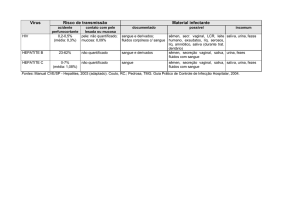
COMPARAÇÃO DOS NIVEIS DE DETECÇÃO DE ANTICORPOS DA CLASSE IgM
ANTI-PGL-l EM AMOSTRAS DE SORO E SALIVA REALIZADA PELO MÉTODO
DE ELISA
André Brandão de Araújo ([email protected]),
Nadia Oliveira Souza ([email protected]),
Francisca Gomes da Silva ([email protected]),
Maria do Perpétuo Socorro Correa Amador ([email protected])
Resumo
O antígeno específico do Mycobacterium leprae, o glicolipídeo-fenólico-1
(PGL-1), tem sido usado por muitos pesquisadores. Os testes sorológicos para
diagnóstico de hanseníase têm aberto algumas possibilidades de estudo do
comportamento epidemiológico desta doença. Este estudo teve por objetivo
comparar os níveis de detecção de anticorpos da classe IgM na saliva e no soro,
verificando assim, se a saliva apresenta uma sensibilidade mais elevada que o soro.
Foram selecionadas convencionalmente 61 amostras de soro e saliva e divididas em
4 grupos que constam de pacientes multibacilares, paucibacilares, contatos cosanguíneo e contato não co-sanguíneo. Títulos positivos de anticorpos anti-PGL-1
de classe IgM na saliva foi equivalente a 21,31% (13/61), enquanto o soro foi de
19,67% (12/61), observou-se também que 52,46% (32/61) da saliva se apresentou
em nível mais elevado que o soro, o qual foi de 44,26% (27/61). Considerando a
média dos níveis de detecção das densidades ópticas por grupo, a saliva apresenta
melhor sensibilidade que o soro, porém os testes estatísticos não demontram
correlação entre soro e saliva. Entretanto sugerimos a avaliação dessa correlação
em estudo com maior espaço amostral.
Palavras-chave: antígeno, teste sorológico, hanseníase, soro e saliva,
anticorpos IgM.
Abstract
The specific antigen of Mycobacterium leprae, phenolic glycolipid-1 (PGL-1),
has been used by many researchers. Serological tests for diagnosis of leprosy have
opened some possibilities for studying the epidemiological behavior of this disease.
This study aimed to compare the levels of detection of IgM antibodies in saliva and
compare them to serum, thereby determining if saliva has a higher sensitivity than
the serum. We selected 61 samples of conventionally serum and saliva and debts,
for comparison, in four groups that consist of multibacillary patients, paucibacillary,
contacts and co-blood contact is not co-blood. Positive titers for anti-PGL-1 IgM in
saliva was equivalent to 21,31% (13/61), whereas serum was 19,67% (12/61), also
observed that 52,46% (32/61) of saliva is presented in the highest serum 44,26%
(27/61). Considering the average levels of detection of the optical densities for each
group, the saliva has greater sensitivity than the serum but not thwarting the
statistical correlation between serum and saliva. However we suggest to evaluate
this correlation in a study with larger sample space.
Keywords: antigen, serologic test, leprosy, serum and saliva, IgM antibodies.
INTRODUÇÃO
A hanseníase, uma das mais antigas doenças humanas a qual acreditavam
ser uma punição divina, a doença da alma, o castigo do pecado, em 1973 foi
associada ao microorganismo
Mycobacterium leprae, o primeiro patógeno
bacteriano a ser identificado como causa de uma doença infecciosa a partir de
biópsia de lesão cutânea há mais de 130 anos 1, 2, é única bactéria conhecida por
invadir o sistema nervoso periférico1. Esse microorganismo tem como característica
exclusiva o tropismo por células de scwhann, que representa a base grave das
neuropatias que podem levar a perda sensomotora, responsável pela maioria das
deformidades e incapacidades físicas associadas a hanseníase3.
Conhecida como moléstia que caminha lentamente, a hanseníase só teve a
conclusão da sequência completa do seu genoma, publicada por Cole et al, em
20014. Durante muito tempo o M. leprae permaneceu como um enigma,
principalmente devido a impossibilidade de ser cultivado in vitro desafiando assim
conceito e convicções sobre tratamento, diagnóstico e propagação2.
A hanseníase é predominantemente uma doença de pele, mucosas e nervos
periféricos. A infecção ativa pelo M. leprae é caracterizada por uma grande
diversificação no curso clínico da infecção, variando de uma doença paucibacilar na
qual poucos bacilos estão presentes, a uma doença multibacilar, na qual uma
grande carga bacilar está presente nas lesões2.
O M. leprae é uma bactéria obrigatoriamente intracelular, álcool-ácido
resistente, sofre replicação lenta, com tempo de duplicação de 13 dias,
preferencialmente em temperaturas inferior a 37 °C, è considerada uma bactéria
com alta infectividade e baixa patogenicidade5, 6, possui em sua cápsula o PGL-1 um
antígeno de parede espécie-específico conhecido como Glicolipídeo fenólico -1, que
contém um grupo fenólico glicosilado com um trissacarídeo7.
As formas clínicas da hanseníase são classificadas por pólos estáveis,
tuberculóide (T) e wirchorviano (V), e por grupos instáveis, indeterminado e dimorfo,
sendo que o grupo dimorfo pode ser: dimorfas tuberculóide (DT), dimorfa-dimorfa
(DD), e dimorfa wirchorviana (DV)3 de acordo com a classificação de Ridley-Jopling
em 1966. A forma V apresenta um alto título de anticorpos específicos 8, 9, porém
possuem uma fraca imunidade mediada por células, acontecendo o oposto aos
pacientes T que possuem um baixo nível de anticorpos específicos, porém uma forte
imunidade mediada por células10.
Foi comprovado anteriormente que anticorpos de classe IgM específicos
contra o antígeno PGL-1 são mais detectados em paciente MB, com cerca de 90 a
100% destes, e 15 a 40% nos pacientes PB11.
O tratamento da hanseníase compreende: quimioterapia específica,
supressão dos surtos reacionais, prevenção de incapacidades físicas, reabilitação
física e psicossocial. Este conjunto de medidas deve ser desenvolvido em serviços
de saúde da rede pública ou particular, mediante notificação de casos à autoridade
sanitária competente. As ações de controle são realizadas em níveis progressivos
de complexidade, dispondo-se de centros de referência locais, regionais e nacionais
para o apoio da rede básica. O Ministério da Saúde (MS) regulamenta o assunto
através da portaria de número 1073/GM publicada em 28/09/2000 no Diário Oficial
da União, disponível no site www.saude.gov.br12.
Na indicação do esquema terapêutico deve-se levar em conta toda a história
clínica do paciente, com especial atenção para alergias a medicamentos, interação
de drogas, e doenças associadas. A definição do esquema depende da classificação
final do caso. O Ministério da Saúde sugere classificação operacional com os
seguintes critérios: paucibacilares (PB) - casos com até cinco lesões de pele e/ou
apenas um tronco nervoso comprometido e multibacilares (MB) - casos com mais de
cinco lesões de pele e/ou mais de um tronco nervoso acometido. A baciloscopia
positiva classifica o caso como multibacilar, independentemente do número de
lesões12.
As drogas usadas nos esquemas padronizados pela OMS e MS são a
rifampicina (única bactericida dos esquemas padrão), dapsona e clofazimina. Os
esquemas poliquimioterápicos têm como princípio a associação de drogas. O
fornecimento da medicação é gratuito em todo o país. Os casos multibacilares
avançados, com infiltração exuberante da pele e que apresentem pouca melhora
com as 12 doses, deverão receber 24 doses em até 36 meses12.
Existem tratamentos alternativos, disponíveis nos centros de referência, para
pacientes com impossibilidade de usar os esquemas padronizados, incluindo o
esquema ROM (rifampicina, ofloxacina e minociclina) para tratamento de lesão única
de pele em pacientes paucibacilares12.
Este trabalho teve como objetivo comparar os níveis de detecção de
anticorpos da classe IgM anti-PGL-l em amostras sorológicas e salivares.
MATERIAIS E MÉTODOS
Metodologia
Para realização deste estudo, dividimos os 61 pacientes em 4 grupos que
facilitaria a comparação das amostras (soro e saliva), dos quais temos:
Doentes multibacilares ou MB: é constituído de pessoas que não apresentam
resistência ao bacilo, este se multiplica no seu organismo passando a ser eliminado
para o meio exterior, podendo infectar outras pessoas6.
Doentes paucibacilares ou PB: dentre as pessoas que adoecem, algumas
apresentam resistência ao bacilo, constituindo os casos paucibacilares (PB), que
abrigam um pequeno número de bactérias no organismo, insuficiente para infectar
outras pessoas6.
Contato co-sanguíneo ou CCOS: sabe-se que a forma de transmissão da
hanseníase ocorre pelas vias aéreas superiores de pessoas que possuem grande
quantidade de bacilos. Consideramos então os contatos co-sanguíneo, aquelas
pessoas que residem dentro do mesmo domicílio há mais ou menos 5 anos com
doentes hansênicos pertencentes a família ou que já morou em com algum doente6.
Contato não co-sanguíneo ou CNCOS: são consideradas neste grupo, pessoas
que não tiveram contato com doentes dentro do ambiente familiar.
Os grupos contatos co-sanguíneo e contato não co-sanguíneo serviram
como controles do teste, visto que, são grupos que apresentam pacientes sadios.
Casuística
Foram selecionados 61 pacientes com faixa etária de 6 a 78 anos que já
tiveram a doença, estão doentes, já entraram em contato ou estão em regiões
hiperendêmicas, mas não possuem histórico de doentes na família, examinados a
partir de 2004. As amostras selecionadas de forma convencional constam de soro e
saliva de cada paciente para estudo piloto comparativo.
Amostras
Um volume de 5 ml de sangue venoso foi coletado dos participantes em
tubos contendo gel separador. As amostras foram centrifugadas a 1500 rpm por 5
minutos e o soro obtido foi armazenado a -20°C até o período de realização do teste.
As amostras de saliva foram coletadas aproximadamente de 1 mL a 1,5mL, sem
estímulo e mantidas a -20ºC até o momento da dosagem. As amostras cedidas pela
Dra. Socorro Amador - Enfermeira e pesquisadora do Instituto Evandro Chagas,
responsável pelo laboratório de Hanseníase -, foram escolhidas por conveniência,
ou seja, que tinham disponibilidade de soro e saliva de cada paciente.
ELISA para dosagem de anticorpos séricos e salivares anti-PGL-1
Os testes imunoenzimáticos, tipo captura ou sanduíche, foram realizados no
laboratório de Hanseníase/IEC. Para o teste, foram utilizadas placas sensibilizadas
com antígeno NT-P-BSA (PGL-1), adicionando-se 50 l do mesmo em cada poço
nas linhas A, C, E e G e nas linhas B, D, F e H foi adicionado apenas o soro
albumina bovina (BSA) as quais foram acondicionadas de 4 a 8°C por 24 h, em
overnight.
Após sensibilização, as placas foram lavadas por 4 vezes com PBST (solução
de lavagem), sendo que a primeira das 4 lavagens, ficou por um período de 5
minutos e as subseqüentes com intervalo de 1 minuto cada uma. Após lavagem, as
placas foram “batidas” em cima de guardanapo de papel, para retirar bem o líquido.
Adicionando-se 100 l, por poço, de solução bloqueadora, PBST a 1% de BSA (soro
albumina bovina) em toda a placa seguida de incubação a 37º C por 1 hora.
Após o período de incubação, retirou-se a solução bloqueadora virando a
placa e colocando a mesma emborcada em papel absorvente até uso. Foi
adicionado 50 l de soro em análise diluído (1:300) (ex: 5l em 1,5ml) em PBST a
10% de NGS (soro normal de cabrito) e distribuídos conforme a disposição do
diagrama de teste (ex: amostra X, foi posta nos poços da coluna 7 de A a D) e
incubado por 1 hora a 37°C. Em seguida foram realizadas 4 lavagens de 1 minuto
cada e adicionado 50 l do conjugado IgM ligado a peroxidase em diluição de
1:2000 (ex: 5l em 5ml)
em PBST a 10% de NGS (soro normal de cabrito) e
incubado por 1 hora. Ao final deste tempo as placas foram lavadas e esvaziadas até
que ficassem secas. Então foi adicionado 50l do substrato TMB Sigma (3,3’, 5’5Tetramethylbenzidine) - T 8665 e esperado o tempo de 5 a 15 minutos para reação.
Posteriormente a reação foi paralisada com 50l ácido sulfúrico e analisada no leitor
de ELISA a uma absorbância de 450 nm.
Para dosagem de IgM salivar anti-PGL-1, as placas foram adsorvidas com o
antígeno, conforme procedimento acima. Lavou-se por 3 vezes, com 1 minuto entre
cada lavagem, com 200l de PBST, a seguir, bloqueadas com 100l de PSBT a 3%
de BSA e incubadas por 1h e 30min. Após esse tempo, foram adicionadas 30l das
amostras em cada poço e posta em overnight por 24h a 4oC. As placas foram
lavadas 3 vezes com solução PBST e adicionado o conjugado ou anti-IgM marcados
com peroxidase diluído na concentração de 1:3000 em PBST a 1% de BSA. Após
incubação por 2h a temperatura ambiente, novas lavagens foram realizadas, a
seguir, foi adicionado 50l do substrato TMB, após tempo de 15 min, a reação foi
parada com 50l de ácido sulfúrico e lida a 450 nm. Foram considerados como
resultados positivos, valores equivalentes ou acima de 0,2 de absorbância, o mesmo
do soro, por ainda não termos um cut-off para saliva.
Análise estatística
O presente trabalho é um estudo seccional. Utilizou-se o teste t, para
compararmos as amostras de soro e saliva dos respectivos grupos e o teste do crivo
para sabermos a sensibilidade e especificidade do teste de ELISA. Análise
estatística foi realizada por meio do Programa computacional BioEstat 5.013 e pelo
Microsoft Office Excel 2010 da Plataforma Windows. O nível de significância
considerado foi de 0,05 ou 5%.
RESULTADOS
Segundo a tabela 2, as amostras foram divididas em 4 grupos, no qual ficou
apresentado em 26 amostras de pacientes multibacilares (26/61 – 42,62%); 7
paucibacilares (7/61 – 11,47%); 16 contatos co-sanguíneos (16/61 - 26,23%) e 12
contatos não co-sanguíneos (12/61-19,67%).
Do grupo multibacilar, 11 indivíduos (11/26 – 42,31%) apresentaram
densidades ópticas mais elevadas na saliva do que o soro (gráfico 1), enquanto 15
(15/26 - 57,69%) apresentaram densidades do soro mais elevada que a saliva
(t=1,3214; p=0,0994).
Comparação dos níveis de anticorpos em amostras de soro e saliva para o grupo mutibacilar (MB). Obs:o gráfico não consta
todas 26 amostras do grupo MB.
Do grupo paucibacilar, 4 indivíduos (4/7 – 57,14%), apresentaram níveis de
anticorpos anti-PGL-I na saliva mais elevados que no soro e no soro apenas 3 (3/7 –
42,86%) se mostrou mais elevado que a saliva (gráfico 2) (t=-0,6305;p=0,2758; IC
95% = -0,0941 a 0,0556).
Comparação das densidades ópticas das amostras de soro e saliva em doentes paucibacilar (PB)
No grupo contato co-sanguíneo, obtivemos 16 amostras, das quais 9 (9/16 –
56,25%) apresentaram saliva com densidades superiores ao soro e 7 (7/16 –
43,75%) apresentaram o soro com maior nível de anticorpo que a saliva (gráfico 3)
(t=-1,0259; p=0,1606; IC 95% = -1,039 a 0,0364).
Comparação das densidades ópticas das amostras de soro e saliva em contato co-sanguíneo (CCOS).
Do grupo contato não co-sanguíneo, obtiveram-se 12 amostras, nas quais se
observou que 7 delas (7/12 - 58,33%) mostraram níveis de anticorpos na saliva mais
elevados que no soro, enquanto 5 (5/12 – 41,67%) mostraram que o soro tem níveis
maiores que a saliva (gráfico 4) (t=0,8549;p=0,2054; IC 95%= -0,0514 a 0,1168).
Comparação das densidades ópticas das amostras de soro e saliva em contato não co-sanguíneo ( CNCOS).
O limite de detecção de positividade para o soro, segundo BÜHRER et al14
1998, é de densidade óptica igual ou superior a 0,200, neste caso das 61 amostras,
12 foram positivas no soro e 13 positivas na saliva.
Foi realizada comparação das médias das densidades do soro e saliva
(gráfico 5) por grupo, relatados abaixo na tabela 1.
Tabela 1: Comparação das médias dos grupos
Grupos/tipo de amostra
Soro
Saliva
MB
PB
0,192
0,030
0,126
0,050
CCOS
CNCOS
0,078
0,058
0,123
0,060
Analise das médias das densidades dos Grupos de amostras de soro e saliva, observa-se que a média da saliva foi mais
elevada que soro. MB= Multibacilar; PB=Paucibacilar; CCOS=Contato co-sanguíneo; CNCOS=Contato não co-sanguíneo.
Embora
não
tenha sido verificada
uma
diferença
estatisticamente
significante, observa-se que as médias para as densidades de ambos os grupos
avaliados, encontravam-se tendencialmente mais elevadas na saliva do que o soro.
Comparação das médias das densidades por grupo. MB=Multibacilar; PB=Paucibacilar; CCOS=Contato co-sanguíneo;
CNCOS=Contato não co-sanguíneo.
Foi analisado também a sensibilidade e especificidade da Técnica do Elisa e
obtivemos os seguintes valores (gráfico 6):
Sensibilidade para o soro de 28,13% e para a saliva de 25% - Proporção de
indivíduos doentes cujo teste é positivo.
Especificidade para o soro 89,29% para a saliva de 82,14% - Proporção de
indivíduos sem a doença cujo teste é negativo.
Falso positivo (erro do tipo I) para o soro 10,71% para a saliva 17,86% -
Proporção de indivíduos não-doentes cujo teste é positivo.
Falso negativo (erro tipo II) para o soro 71,88% e para a saliva 75,00% -
Proporção de indivíduos doentes cujo teste é negativo.
VTPpos (Valor preditivo do teste positivo) para o soro 10,55% e para a saliva
5,92% - Probabilidade de o indivíduo ter a doença quando o for positivo.
VTPneg (Valor preditivo do teste negativo) para o soro 96,51% e para a saliva
96,06% (Probabilidade de o individuo NÃO ter a doença quando o teste for negativo)
+ LR (Likelihood ratio positive) para o soro foi de 98,5% para a saliva 98,5% -
Chance de doença quando o teste for positivo.
- LR (Likelihood ratio negative) para o soro foi de 0,00% para a saliva 0,00%
(Chance de doença quando o teste for negativo)
Acurácia para o soro 100% para a saliva 100% (É a medida de exatidão do teste)
Comparação feita entre saliva e soro pelo teste do crivo e teste da sensibilidade e especificidade. VTPpos - Valor preditivo do
teste positivo; VTPneg Valor preditivo do teste negativo; +LR - Likelihood ratio positive; -LR - Likelihood ratio negative.
DISCUSSÃO
No Brasil, apesar da redução drástica no número de casos, de 19 para 4,68
doentes em cada 10.000 habitantes, no período compreendido entre 1985 a 2000 a
hanseníase ainda se constitui em um problema de saúde pública que exige uma
vigilância resolutiva6.
Um dos grandes desafios da atualidade é que, embora a poliquimioterapia
tenha reduzido a prevalência da hanseníase, o número de casos novos detectados
não decresceu. Isto significa dizer que, ao longo dos últimos anos, o nível de
contaminação entre os indivíduos permaneceu elevado, acrescido ao fato de que a
demora no diagnóstico clínico faz com que o indivíduo com alta carga bacilar
persista como uma potencial fonte de transmissão bacilar15.
A procura de um diagnóstico eficaz para a hanseníase levou os vários
pesquisadores de áreas endêmicas e não-endêmicas a desenvolverem técnicas
para o diagnóstico precoce e a identificar marcadores moleculares para entender de
maneira clara a epidemiologia e transmissão da doença com objetivo final de se ter
intervenções para prevenir a hanseníase4.
A presença de anticorpo da classe IgM, específico da parede do M. leprae16,
poderia caracterizar o estado de infecção na ausência de lesões neurocutâneas17,
por esse motivo, foi feito neste estudo pesquisa de anticorpos em amostras de soro
e saliva.
Futuramente a pesquisa de anticorpos na saliva pode se tornar uma
potencial metodologia de diagnóstico auxiliar para a hanseníase, entretanto,
necessita-se de que fatores como coleta, armazenamento e processamento sejam
feitos de maneira adequada, isso à potencializará com instrumento fundamental não
só para o diagnóstico inicial, mas também para o monitoramento do paciente.
Os resultados desta pesquisa apontaram que em cada grupo de estudo, há
uma aparente sensibilidade da saliva, para detecção de anticorpos, mais elevada
que o soro, o que estatisticamente não possui correlação, como também descrito
pelo trabalho de Bonfitto et al18.
No grupo dos multibacilares, de acordo com os resultados obtidos, o soro
apresentou ser mais sensível para detecção de anticorpos do que a saliva, no
entanto, vale ressaltar que as salivas foram armazenadas por muito tempo, o que
não é ideal, visto que, o proposto pela pesquisadora do Instituto Evandro Chagas,
Dra. Socorro Amador, é que a saliva seja processada imediatamente após a coleta
e, além disso, fazem parte desse grupo, pacientes que já estavam em tratamento,
pacientes que já haviam terminado o tratamento e pacientes em estado reacional.
Os números de doentes casos novos obtidos foram de apenas 16 (16/26 – 61,63%),
então a análise estatística dos níveis de anticorpos apenas desses pacientes
resultou no p valor de 0,0722, mostrando que a saliva se comporta de maneira
diferente em relação ao soro. O fato de haver níveis de anticorpos mais elevados no
soro do que saliva, não era o resultado esperado, pois sabe-se que doentes
multibacilares, pelo fato de possuir uma carga bacilar elevada16, tivesse que
apresentar uma positividade (80-100%) dos casos MB no soro e consequentemente
na saliva, visto que, as mucosas da nasofaringe e orofaringe são as primeiras a
entrarem em contato com o M. leprae19, sendo também as primeiras a iniciarem uma
resposta imunológica20, 21. Porem, não se pode afirmar tal hipótese, pois, para isso
seria necessário uma amostragem de no mínimo 50 pacientes virgens de
tratamento.
Tabela 2: Densidades ópticas dos grupos de estudo
MB
PB
CCOS
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
µ
DP
CNCOS
Soro
Saliva
Soro
Saliva
Soro
Saliva
Soro
Saliva
0,203
0,529
0,008
0,154
0,07
0,033
0,006
0,027
0,262
0,282
0,27
0,204
0,022
0,01
0,277
0,049
0,004
0,008
0,083
0,061
0,105
0,031
0,003
0,005
0,048
0,016
0,025
0,032
0,036
0,004
0,244
0,262
0,01
0,111
0,001
0,037
0,206
0,001
0,005
0,113
0,011
0,007
0,161
0,007
0,26
0,247
0,204
0,042
0,014
0,036
0,027
0,024
0,344
0,01
0,004
0,006
0,266
0,017
0,01
0,015
0,019
0,22
0,019
0,36
0,023
0,042
0,033
0,026
0,104
0,14
0,122
0,03
0,11
0,24
0,03
0,143
0,08
0,007
0,102
0,006
0,012
0,392
0,014
0,014
0,006
0,066
0,052
0,021
0,009
0,009
0,238
0,615
0,151
1,32
0,001
0,019
0,011
0,512
0,031
0,104
0,072
0,082
0,027
0,069
0,004
0,057
0,329
0,017
0,013
0,015
0,02
0,01
0,008
0,095
0,112
0,063
0,079
0,061
0,242
0,007
0,038
0,017
0,1925
0,2729
0,1261
0,1523
0,0598
0,0833
0,0936
0,1234
0,0756
0,1092
0,0429
0,0592
0,0306
0,0308
0,0499
0,0572
Densidades ópticas dos respectivos Grupos; analise das médias das densidades dos Grupos de amostras de soro e saliva e
o desvio padrão. MB=Multibacilar; PB=Paucibacilar; CCOS=Contato co-sanguíneo;CNCOS=Contato não co-sanguíneo.
No grupo dos paucibacilares, os resultados foram diferentes em comparação
com os multibacilares, observou-se que a saliva apresenta uma melhor sensibilidade
que o soro para detecção dos anticorpos anti-PGL-1, entretanto, não se pode
considerar válidos esses resultados, pois, o numero amostral é pouco para se
chegar a uma conclusão.
Nos grupos dos contatos – co-sanguineo e não co-sanguineos-, os
resultados se mostraram positivos, pois observou-se que a saliva é mais sensível
que soro, isso leva a entender que seria preciso um acompanhamento médico nos
contatos de área endêmica para evitar o adoecimento.
As amostras de saliva apresentaram por grupo, de acordo com a média,
uma sensibilidade maior do que no soro, por esse ponto de vista sugere-se que o
teste anti-PGL-I nas amostras de saliva é mais sensível que nas amostras de soro,
para detecção de anticorpos da classe IgM.
De acordo com estudo feito por Nagao-Dias et al15 os anticorpos só podem
ser detectados na saliva quando há uma carga bacteriana elevada na mucosa, o que
levaria a conclusão de que a possibilidade de detecção de IgM salivar para PGL-1
pode indicar infecção recente ou re-infecção.
Com este estudo piloto, chegou-se à conclusão de que não se pode afirmar
que a saliva apresenta sensibilidade melhor que o soro, como aparentemente se
nota comparando as densidades ópticas. Precisa-se realizar análises com amostras
mais atuais e em maior espaço amostral, para poder afirmar essa hipótese, mas
pelos resultados obtidos nos contatos, pode-se sugerir, considerando os níveis de
anticorpos detectados, que deve-se haver um acompanhamento nesses pacientes
para evitar que venham adquirir a doença.
AGRADECIMENTOS
Agradecemos a Deus pelas nossas vidas, a nossa família pela força que nos
tem dado, ao Laboratório de Hanseníase do Instituto Evandro Chagas pelos insumos
e equipamentos utilizados, a Dra. Socorro Amador pelo apoio na realização deste
trabalho e por ter nos cedido às amostras necessárias para estudo.
REFERÊNCIAS BIBLIOGRÁFICAS
1-
Ducati RG, Basso L.A, Santos DS. Micobactérias. In: Trabulsi, Luis Rachid,
Alterthum, Flavio. Microbiologia 4 ed. São Paulo: Editora Atheneu, 2004.
2Goulart IMB, Penna GO, Cunha G. Imunopatologia da hanseníase: a
complexidade dos mecanismos da resposta imune do hospedeiro ao Mycobacterium
leprae.Revista da
2002;35(4):365-375.
Sociedade
Brasileira
de
Medicina
Tropical,
jul./ago.
3Ridley DS, Jopling WH. Classification of leprosy according to imunity: afive
group system. International Journal of Leprosy. 1996; 34: 255-273.
4Stefani MMA. Desafios na era pós genômica para o desenvolvimento de
testes laboratoriais para o diagnóstico da hanseníase. Rev. Soc. Brás. Méd. Trop.
2008;41(Suplemento II):89-94.
5Araujo MG. Hanseníase no Brasil. Revista da Sociedade Brasileira de
Medicina Tropical. mai./jun. 2003;36(3):373-382.
6Brasil. Ministério da Saúde. Secretaria de Políticas de Saúde. Departamento
de Atenção Básica. Guia para o Controle da hanseníase. Brasília: Ministério da
Saúde, 2002.
7Amador MPSC. Soroprevalência para Hanseníase em Àreas Endêmicas do
Estado do Pará. Dissertação de Mestrado. 2004:126.
8Ananias MTP, Araujo MG, Gontijo ED, Guedes ACM. Estudo do anti-PGL-1
em pacientes hansenianos utilizando a técnica de ultramicroelisa. Anais Brasileiros
de Dermatologia. jul./ago. 2002;77(4):425-433.
9Cho S, Cellona RV, Villahermosa LG, et al Detection of PhenolicoGlycolipid I
of Mycobacterium leprae in Sera from Leprosy Patients before and after Start of
Multidrug Therapy. Clinical and Diagnostic Laboratory Immunology, jan.
2001;8(1):138-142.
10Maeda SM, Rotta O, Michalany NS. Comparison between anti-PGL1 serology
and
Mitsuda
reaction:
clinical
reading,
microscopic
findings
and
immunohistochemical analysis. Leprosy Review, mai. 2003;74 :263-274.
11Calado KLS, Vieira AG, Durães S. Positividade sorológica anti-PGL-I em
contatos domiciliares e peridomiciliares de hanseníase em área urbana. Anais
Brasileiros de Dermatologia. 2005;80(3):301-306.
12Ministério da saúde. Portaria Nº 1073/GM de 26 de setembro de 2000.
Publicada no D.O.U. - 188-E -pg 18 -Seção 1 - 28 de setembro, 2000.
13Ayres M, Ayres MJr, Ayres DL. BioEstat 5.0. Aplicações Estatísticas nas
Áreas das Ciências Bio-médicas. 2007; 364.
14Bührer S, Smits HL, Gussenhovem GC ,et al. A simple dipstick assay for the
detection of antibodies to phenolic glycolipid-1 of Mycobacterium leprae. Am. J. Trop.
Med.1998; 58:133-136.
15Cabral PB, Alves AR, Medeiros KBA, et al. Emprego de marcadores séricos e
salivares anti-PGL-1 como parâmetros de exposição ocupacional ao Mycobacterium
leprae. Rev. Panam. Infectol. 2009; 11(1):21-26.
16Oliveira MLW, Cavaliére FAM, Maceira JMP, et al. Uso da sorologia como
ferramenta adicional no apoio ao diagnóstico de casos difíceis de hanseníase
multibacilar: lições de uma unidade de referência. Rev. Soc. Brás. Méd. Trop. 2008.
41(Suplemento II): 89-94.
17Brasil MTLRF, Oliveira LR, Rímoli NS, et al. Sorologia Anti PGL-1 e risco de
ocorrência de hanseníase em área de alta endemicidade do Estado de São Paulo:
quatro anos de seguimento. Rev. Bras. Epidemiol. 2003; 6 (3): 262-271.
18Bonfitto NLB, Motta ACF, Komesu MCK et al. Dosagem de Anti-PGL-1 de
pacientes
com
hanseníase.
Disponível
em:
http:/www.usp.br/siicusp/Resumos/16Siicusp/1496.pdf
19Santos APT, Almeida GG, Martinez CJ, Rezende C. Imunopatologia da
hanseníase: aspectos clínicos e laboratoriais. News Lab. 2005. Ed. 73.
20Nagao-Dias, A.T, Almeida TLP, Santos RC, et al. Salivary anti-PGL IgM and
IgA titers and serum antibody IgG titers and avidities in leprosy patients and their
correlation with time of infection and antigen exposure. Braz J Infect Dis. 2007;
11(2).
21Santos, R.C, Souza EY, Araújo RP, et al. Avaliação imune humoral no soro e
saliva anti-pgl-1 de pacientes portadores de hanseníase. C. Ciências Biológicas 9. Imunologia - 1. Imunologia Aplicada. Trabalho de Iniciação Científica. Disponível
em:
http://www.sbpcnet.org.br/livro/57ra/programas/senior/RESUMOS/resumo.
1112.html.