MINISTÉRIO DA EDUCAÇÃO
SECRETARIA DE EDUCAÇÃO PROFICIONAL E TECNOLÓGICA
INSTITUTO FEDERAL SUL RIO GRANDENSE
DIRETORIA DE ENSINO
COORDENADORIA DE SUPERVISÃO PEDAGÓGICA
PLANO DE ENSINO
I – DADOS DE IDENTIFICAÇÃO
1.1 - Instituição: Instituto Federal Sul-Rio-Grandense - Campus Pelotas
1.2 - Área Profissional:
ELETROTÉCNICA
1.3 - Curso: Técnico de Nível Médio em Eletrônica
1.4 – Professor
PesquisadorFormador: Éder Coutinho
1.5 - Disciplina: Química Orgânica
1.6 - Período letivo: Sexto Semestre
1.8 - Carga horária semanal da disciplina: 02h-aulas
1.9 - Carga horária total: 30h-aulas
1.10 - Código da Disciplina: TEC.057
1.12 – Turma: TEC 6V G.A..
II – EMENTA
Introdução a química do carbono e estudo das diferentes funções orgânicas bem como
um breve entendimento dos compostos bioquímicos
III – OBJETIVOS DA DISCIPLINA
Compreender os conceitos básicos de química, os diferentes elementos químicos
e suas combinações, a nomenclatura e a diferenciação das funções, além das reações
químicas e sua influência no meio ambiente;
Relacionar conteúdos da química geral e inorgânica com os da química orgânica;
Utilizar as habilidades e atitudes desenvolvidas para proporcionar uma melhoria
da qualidade de vida;
Compreender e utilizar conceitos químicos dentro de uma visão macroscópica
potencializando o reconhecimento demateriais do uso cotidiano.
III – CONTEÚDOS
CONTEÚDO
UNIDADE 1
H/A
METODOLOGIA
03
Exposição do conteúdo de maneira
contextualizada, estimulando a participação
dos alunos em aula.
Exercícios de fixação do conteúdo.
Trabalhos individuais e em grupo.
07
Exposição do conteúdo de maneira
contextualizada, estimulando a participação
dos alunos em aula.
Exercícios de fixação do conteúdo.
Unidade I – INTRODUÇÃO À
QUÍMICA DO CARBONO
UNIDADE 2
Unidade
II
HIDROCARBONETOS
–
UNIDADE 3
Unidade III
ORGÂNICAS
–
10
Exposição do conteúdo de maneira
contextualizada, estimulando a participação
dos alunos em aula.
Exercícios de fixação do conteúdo.
10
Exposição do conteúdo de necessidades de
energia dos organismos de maneira
contextualizada; Exercícios de fixação do
conteúdo
de
proteínas,
enzimas,
carbohidratos, graxas, azeites e ácidos
nucleicos; Trabalhos em grupo.
FUNÇÕES
UNIDADE 4
Unidade IV –NOÇÕES
BIOQUÍMICA
DE
IV – ESTRATÉGIAS DE INTERDISCIPLINARIDADE
RELAÇÃO DA DISCIPLINA COM AS DEMAIS:
Biologia – nutrição animal
História – evolução da Química e da ciência com um todo, guerras (armas químicas)
Geografia – meio ambiente (efeito estufa, chuva ácida)
Matemática – logaritmos, unidades de medidas
Física – Cinemática e termologia
Filosofia – Valorização da vida
V – CRONOGRAMA DE ATIVIDADES
Semana_data
1ª.
2ª.
3ª.
4ª.
5ª.
6ª.
7ª.
8ª.
9ª.
10ª.
11ª.
12ª.
13out
20out
27out
03nov
10nov
17nov
24nov
01dez
08dez
15dez
22dez
26jan
11ª.
12ª.
13ª.
14ª.
15ª.
02fev
09fev
16fev
23fev
01mar
Conteúdo previsto
Revisão da 1ª etapa.
Dia não letivo
Dia não letivo
Observações
Atualização de dados para
comunicação via Qacadêmico
16ª.
17ª.
18ª.
19a.
20a.
08mar
15mar
22mar
29mar
05abr
VI – METODOLOGIA
Aula expositivo-dialogada: Exposição do conteúdo de maneira contextualizada,
estimulando a participação dos alunos em aula.
Exercícios de fixação do conteúdo.
Trabalhos em grupo: Resolução de exercícios
Uso de TICs (Tecnologia de Informação Computacional, pelo menos, via
qacadêmico)
VII – AVALIAÇÃO
1a Etapa: Serão realizadas duas provas escritas valendo 5,0 pontos cada.
2a Etapa: Serão realizadas duas provas escritas valendo 5,0 pontos cada.
... REAVALIAÇÃO:
Ao final do semestre letivo será propiciada uma nova e última oportunidade como
reavaliação final que consistirá numa prova escrita de peso 10,00 para cada etapa letiva
em que o aluno não tenha alcançado aprovação.
* Recuperação dos conteúdos:
O resgate dos conteúdos será feito no horário de atendimento do professor.
VIII – REFERÊNCIAS
PERUZZO, F.; CANTO, E. Química na abordagem do cotidiano.3.ed.
São Paulo: Moderna, 2003.
REIS, Martha. Completamente Química. São Paulo: FTD, 2001. Química
Orgânica.
SARDELLA, Antônio. Curso de Química. 18 ed. São Paulo: Ática, 1998. Química
Orgânica.
USBERCO, João; SALVADOR, Edgard. Química. 11 ed. São Paulo: Saraiva, 2005.
V.3, Química Orgânica.
::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::
::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::
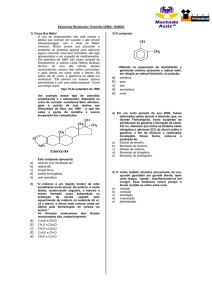
E X E R C Í C I O S:
→ INTRODUÇÃO À QUÍMICA DO CARBONO:
* Química Orgânica é a parte da Química que estuda os compostos do carbono. A
química é uma ciência experimental e se ocupa especialmente, das
transformações das substâncias, de sua composição e das relações entre
estrutura e composição.
Os princípios fundamentais em que a Química se apoia são baseados em fatos
experimentais, portanto as experiências deverão ser executadas com cuidado
para que suas conclusões sejam realmente consideradas exatas.
A capacidade de observação, a imaginação, o cuidado na montagem dos
aparelhos e outros fatores, desempenham um papel muito importante para o
bom desenvolvimento de seus trabalhos experimentais.
1)
a)
b)
c)
d)
No conceito atual, Química Orgânica estuda os compostos:
Extraídos de organismos vivos;
Obtidos em laboratórios;
De carbono
Extraídos de animais e vegetais que contenham o carbono.
2)
A Teoria da Força Vital foi arduamente defendida pelos químicos do início
do século passado. Seu autor foi:
a) Lavoisier; b) Wöhler; c) Gmelin; d) Bergmann; e) Berzelius.
a)
b)
c)
d)
e)
3)
A síntese de Wöhler, feita em 1828, que derrubou a Teoria da Força Vital,
consistiu em:
Reagir carbono e hidrogênio para obter o metano;
Aquecimento do cianato de amônio para obter aminoácido;
Obtenção da ureia a partir do cianato de amônio;
Obter ureia a partir do cianeto de sódio;
Obtenção do vinho a partir do suco de uva.
4)
A representação espacial do átomo de carbono é feita por uma figura
geométrica regular denominada:
a) Triedro;b) tetraedro;c) hexaedro;d) pentaedro;e) octaedro.
5)
No composto C5H12
CH3
H3C
HC
(isopentano),
existem:
3 carbonos primários, 1 secundário e 1 terciário;
3 carbonos primários e 2 secundários;
2 carbonos primários e 2 secundários;
2 carbonos primários e 3 secundários;
Apenas carbonos secundários.
CH2
a)
b)
c)
d)
e)
CH3
6)
O composto de fórmula:
CH3
CH3
H3C
HC
H3C
a)
b)
c)
d)
e)
CH3
possui:
3 carbonos primários, 2 secundários, 2 terciários e 1 quaternário;
5 carbonos primários, 1 secundário, 1 terciário e 1 quaternário;
5 carbonos primários, 1 secundário, 1 terciário e métrico;
4 carbonos primários, 1 secundário, 2 terciários e 1 quaternário;
5 carbonos primários, 2 secundários e 1 terciário.
7)
Escreva 1 cadeia acíclica, insaturada, contendo ao todo 7 átomos de C e que
tenha 1 átomo de C quaternário e nenhum átomo de C 2 ário.
8)
Represente 1 cadeia acíclica heterogênea, de 8 átomos de C que tenha 1
átomo de C 2ário e 2 C 3ários.
9)
Represente 1 cadeia acíclica homogênea saturada, contendo ao todo 10
átomos de C e que tenha 6 átomos de C 1ários.
10) Usando 6 átomos de C, construir: (a) 1 cadeia carbônica em que não haja C
1ário; (b) 1 cadeia que apresenta o maior nº possível de C 1 ários.
11) Quais as possíveis fórmulas estruturais para os compostos que apresentam
fórmula molecular C3H8O?
12) Um composto possui fórmula C4H8O. Qual sua possível fórmula estrutural,
sabendo-se que apresenta cadeia acíclica, insaturada, ramificada e homogênea?
13) Um composto X tem fórmula C4H11N. Representar a fórmula estrutural de
X admitindo que:
(a) o átomo de N é 1 heteroátomo
(b) o átomo de N não é 1 heteroátomo
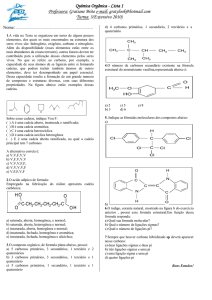
→ UNIDADE 2
- FUNÇÕES ORGÂNICAS
14. Enumere as cadeias principais:
a) ..........................................................................................................................................................................
H3C CH
CH3
H3C C
C
H2
CH2
H2
C
C
H2 H2
C C CH3
H2
C
H2
C
H2 H2
C C CH3
H3C C CH3
H3C CH2
H
b) ..........................................................................................................................................................................
CH3
CH2
CH3
C
H
H2
H3C C
CH
C
CH
H2 H2
C C CH3
CH3
CH3
CH2
CH2
H2C
H3C
c) ..........................................................................................................................................................................
CH3
H2C
CH3
H2
H3C
C
C
C
CH3
H3C
CH3
CH
CH3
d) ..........................................................................................................................................................................
CH3
H3C
H2
C
H
C
CH
H2
C
H
C
CH3
CH2
CH2
CH3
CH3
e) ..........................................................................................................................................................................
f) ..........................................................................................................................................................................
g) ..........................................................................................................................................................................
h) ..........................................................................................................................................................................
i) ..........................................................................................................................................................................
j) ..........................................................................................................................................................................
k) .........................................................................................................................................................................
l) ..........................................................................................................................................................................
m) ..........................................................................................................................................................................
n) ..........................................................................................................................................................................
o)
p)
15.
16.
17.
18.
1.3
1.4
1.5
1.6
1.7
1.8 .
b)
c)
Os hidrocarbonetos são compostos formados exclusivamente por átomos de Carbono e
Hidrogênio (C e H). Na nomenclatura de um hidrocarboneto é utilizado o sufixo O, o
prefixo varia de acordo com o número de carbonos da molécula e o infixo varia pelo tipo
de ligação entre os átomos de carbono. São divididos em Alcanos, Alcenos e Alcinos.
Alcanos
São hidrocarbonetos alifáticos saturados, ou seja, de cadeia aberta e só possuem ligações
simples (sigma) em suas moléculas. O nome parafinas vem do latim parum (pequena) +
affinis (afinidade), e quer dizer pouco reativas, principal característica deste tipo de
hidrocarboneto. A nomenclatura é feita utilizando o prefixo apropriado, o infixo AN e o
sufixo O. Acompanhe abaixo :
4 carbonos + ANO 7 carbonos + ANO 1 carbono +
ANO
Butano
Heptano
Metano
C4H10
C7H16
CH4
Fórmula geral dos alcanos: CnH2n+2 onde n é o número de carbonos do alcano.
Alcenos, Alquenos ou Olefinas
São hidrocarbonetos insaturados etênicos abertos, ou seja, apresentam uma dupla
ligação em sua cadeia. O nome olefinas vem de olleum (óleo) + affinis (afinidade) devido
a facilidade de gerar compostos oleosos. Sua nomenclatura usa o infixo EN.
Quando um alceno tiver quatro ou mais átomos de carbono, sua ligação dupla pode
ocupar diferentes posições na cadeia, originando compostos diferentes. Nestes casos, é
necessário indicar a localização da dupla ligação através de um número, que é obtido
numerando-se a cadeia a partir da extremidade mais próxima da insaturação. O número
que indica a dupla ligação deve ser o menor possível e deve ser colocado antes do nome
do composto.
Apenas para ajudar o aprendizado, os compostos vêm com duas numerações. A
numeração correta está representada na parte superior. Observe com atenção !
Ligação dupla Ligação dupla no 3 carbonos
no carbono 2 + carbono 1 + 6
+ ENO
5 carbonos + carbonos + ENO
ENO
2-penteno
1-hexeno
Propeno
A fórmula geral dos alcenos é CnH2n, onde n é o número de carbonos do composto.
Alcinos ou Alquinos
São hidrocarbonetos insaturados etínicos de cadeia aberta e apresentam fórmula geral
CnH2n-2. Para dar nome a um alcino, usa-se o prefixo de numeração e o sufixo IN, sendo
que com alcinos de 4 ou mais carbonos também necessário indicar a posição da ligação
tripla, através de numeração, usando as mesmas regras dos alcenos.
2 Carbonos + INO
Etino
Ligação tripla no
Ligação tripla no carbono 2 + 6
carbono 1+ 4 carbonos +
carbonos + INO
INO
1-Butino
2-Hexino
Alcadienos
São, na verdade, alcenos formados por duas ligações duplas, por isso o sufixo -dieno.(di
= dois). Podem também existir alcatrienos (alcenos com 3 ligações duplas), alcadiinos
(alcinos com duas ligações duplas) e muitos outros. Seus sufixos são formados pelo
número de ligações que possuem e seu tipo (por exemplo, alcatriino é um alcino com três
ligações triplas, e seu sufixo é -triin). É necessário numerar, indicando as posições de
suas ligações, separando entre vírgulas os números, seguidos de hífen e o nome do
composto
2 Ligações duplas nos
carbonos 1 e 2 + 5
carbonos + DIENO
1,2-Pentadieno
2 Ligações duplas nos
carbonos 1 e 4 + 5
carbonos + DIENO
1,4-Pentadieno
2 Ligações triplas nos
carbonos 2 e 4 + 7
carbonos + DIINO
2,4-Heptadiino