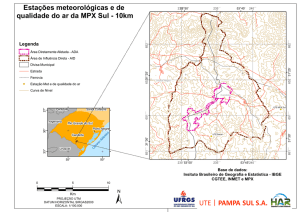
RELATÓRIO FINAL
17 de dezembro de 2009
AVALIAÇÃO TESTE DE 13 PRODUTOS ACERCA DE SUAS
PROPRIEDADES ANTIVIRAIS EM DOIS TEMPOS DE EXPOSIÇÃO
UTILIZANDO MÉTODO IN VITRO
Resumo executivo
RELATÓRIO FINAL:
090903-402
PATROCINADOR:
GOJO INDUSTRIES, INC.
One GOJO Plaza , Suite 500
Akron, Ohio 44311
LOCAL DO TESTE:
BIOSCIENCE LABORATORIES, INC.
300 N Willson Avenue
Bozeman, Montana 59715
DATA DE INÍCIO DO ESTUDO:
22/09/2009
DATA DE TÉRMINO DO ESTUDO:
17/12/2009
MÉTODO
Um teste de Suspensão Viral (método in-vitro eliminação/tempo) foi utilizado para
avaliar as propriedades virucidas de 13 produtos quando confrontados com o um tipo de
vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009 (CDC ID 2009712047). O
percentual e log10 das reduções a partir da população inicial foram determinados após a
exposição a cada um dos produtos testados a cada 15 e 30 segundos.
CONCLUSÃO DOS RESULTADOS:
O Produto de Teste 1, PURELL Instant Hand Sanitizer (62% de etanol, Lote
Q806298), reduziu a população do vírus da Gripe H1N1, influenza A
(A/Califórnia/04/2009) (CDC ID 2009712047) em 4,25 log10 (>99,99% de redução)
após 15 e 30 segundos de exposição.
O Produto de Teste 3, PURELL Instant Hand Sanitizer Skin Nourishing Foam
(70% de etanol, Lote 319602) reduziu a população do vírus da Gripe H1N1,
influenza A (A/Califórnia/04/2009) (CDC ID 2009712047) em 4,25 log10 (>99,99%
de redução) após 15 e 30 segundos de exposição.
O Produto de Teste 4, PURELL 70 Gel Sanitizer (70% de etanol, Lote 1028-69)
reduziu a população do vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009)
(CDC ID 2009712047) em 4,25 log10 (>99,99% de redução) após 15 e 30 segundos
de exposição.
O Produto de Teste 5, PURELL VF481 Hand Sanitizing Gel (70% de etanol, Lote
319152) reduziu a população do vírus da Gripe H1N1, influenza A
(A/Califórnia/04/2009) (CDC ID 2009712047) em 4,25 log10 (>99,99% de redução)
após 15 e 30 segundos de exposição.
O Produto de Teste 7, PURELL Alcohol Canister Wipes (62% de etanol, Lote
LMPQ806733A) reduziu a população do vírus da Gripe H1N1, influenza A
(A/Califórnia/04/2009) (CDC ID 2009712047) em 4,25 log10 (>99,99% de redução)
após 15 e 30 segundos de exposição.
O Produto de Teste 8, ANTIBACTERIAL FOAM SOAP (Triclosan 0,3%) reduziu a
população do vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009) (CDC ID
2009712047) em 4,25 log10 (>99,99% de redução) após 15 e 30 segundos de
exposição.
O Produto de Teste 9...............
O Produto de Teste 9...............
O Produto de Teste 9...............
O Produto de Teste 9...............
RELATÓRIO FINAL 090903-402
1.0 TÍTULO:
AVALIAÇÃO
SOBRE
DE
13
SUAS
PRODUTOS
PROPRIEDADES
ANTIVIRAIS EM DOIS TEMPOS DE
EXPOSIÇÃO
MÉTODO
UTILIZANDO
IN
UM
VITRO
DE
ELIMINAÇÃO/TEMPO
2.0 PATROCINADOR:
GOJO INDUSTRIES, INC.
One GOJO Plaza, Suite 500
Akron, Ohio 44311
3.0 LOCAL DO TESTE:
BIOSCIENCE LABORATORIES, INC.
300 N Willson Avenue
Bozeman, Montana 59715
4.0 DIRETOR DO ESTUDO:
Volha Dzyakanava, Ph.D
5.0 PROPÓSITO DO ESTUDO:
Este estudo foi projetado para avaliar as propriedades antivirais de 13 produtos quando
confrontados com um tipo de vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009
(CDC ID 2009712047) utilizando-se um Teste de Suspensão virucida (método in-vitro
de eliminação/tempo). Os produtos testados foram individualmente avaliados a uma
concentração de 90% (v/v). Todos os testes foram realizados de acordo com as Boas
Práticas Laboratoriais, como especificado no CFR Parte 58, com a exceção de que a
caracterização da identidade, força, pureza, composição, estabilidade, e solubilidade dos
materiais testados permaneceram como responsabilidade do Patrocinador e não foram
realizadas (GLP 58.105).
6.0 ESCOPO:
Uma Suspensão Virucida de Teste (método in vitro eliminação/tempo) foi utilizada para
avaliar as propriedades antivirais de 13 produtos quando confrontados com um tipo de
vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009 (CDC ID 2009712047). Os
percentuais e log10 das reduções foram determinados após a exposição a cada um dos
produtos testados a 15 e 30 segundos. O Protocolo de Estudo incluído como Adendo I
ao Relatório Final apresenta a metodologia de estudo em detalhes, assim como os
Formulários de Dados Gerais “General Data Gathering Forms” (Formulário Número
91-L-002) no Adendo V deste Relatório Final. O Protocolo de Estudo recebeu uma
emenda uma vez a fim de adicionar os testes de 2 produtos extras , para um total de 13
(Referência ao formulário de Emenda [Formulário Número 94-G-006] no Adendo I
deste relatório). Um desvio da metodologia descrito do Protocolo de Estudo ocorreu
(referência a Seção 15 deste relatório) e como está detalhado no Protocolo e/ou
Formulário de Desvio SOP “SOP Deviation Recording Form” (Formulário número 99QA-004 no Adendo I deste relatório, não teve nenhum efeito adverso sobre o resultado
do estudo. Não houve desvios aplicáveis aos Procedimentos Operacionais Padrões do
Bioscience Laboratories, Inc. durante o curso desta avaliação.
7.0 DATAS DO ESTUDO:
DATA DE INÍCIO DO ESTUDO:
22/09/2009
DATA DE INÍCIO EXPERIMENTAL:
16/10/2009
DATA DO TÉRMINO EXPERIMENTAL: 19/11/2009
DATA DE COMPLEIÇÃO DO ESTUDO: 17/12/2009
8.0 MATERIAIS DE TESTE:
9.0 DESAFIO COM O VÍRUS:
O desafio com o tipo de vírus (Tipo de Vírus da Cultura Americana [ATCC] avaliado
foi: Um tipo de vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009 (CDC ID
2009712047).
10.0 EQUIPAMENTO E MATERIAIS:
O equipamento e materiais utilizados neste estudo são descritos no Protocolo de Estudo
no Adendo I deste relatório. Detalhes adicionais estão registrados no Formulário
“Virology Equipment and Supplies Tracking Form (Formulário número 07-L-011 no
Adendo VI deste relatório.
11.0 MEIO:
Os meios de crescimento e fluídos utilizados neste estudo estão descritos no Protocolo
de Estudo no Adendo I deste relatório. Detalhes adicionais estão registrados no
Formulário “Virology Equipment and Supplies Tracking Forms” (Formulário número
07-L-011) no Adendo VI deste Relatório.
.....................
16.0 RESULTADOS A PARTIR DAS TABELAS I A XIII:
A Tabela I apresenta o Controle de citotoxicidade, o Controle de Neutralização, e os
dados de Controle da Célula, assim como a Infectividade de Controle do Vírus
(TCID50), a infectividade após a exposição (TCID50) e as reduções de percentual e log10
observadas após a exposição do tipo de vírus da Gripe H1N1, influenza A
(A/Califórnia/04/2009 (CDC ID 2009712047) ao Produto de Teste 1, PURELL
Instant Hand Sanitizer (lote número Q806298).
A Tabela III apresenta o Controle de citotocixidade, o Controle de Neutralização, e os
dados de Controle da Célula, assim como a Infectividade de Controle do Vírus
(TCID50), a infectividade após a exposição (TCID50) e as reduções de percentual e log10
observadas após a exposição do tipo de vírus da Gripe H1N1, influenza A
(A/Califórnia/04/2009 (CDC ID 2009712047) ao Produto de Teste 3, PURELL
Instant Hand Sanitizer Skin Nourishing Foam (Lote número 319602).
A Tabela IV apresenta o Controle de citotocixidade, o Controle de Neutralização, e os
dados de Controle da Célula, assim como a Infectividade de Controle do Vírus
(TCID50), a infectividade após a exposição (TCID50) e as reduções de percentual e log10
observadas após a exposição do tipo de vírus da Gripe H1N1, influenza A
(A/Califórnia/04/2009 (CDC ID 2009712047) ao Produto de Teste 4, PURELL 70
Gel Sanitizer (Lote número 1028-69).
A Tabela V apresenta o Controle de citotoxicidade, o Controle de Neutralização, e os
dados de Controle da Célula, assim como a Infectividade de Controle do Vírus
(TCID50), a infectividade após a exposição (TCID50) e as reduções de percentual e log10
observadas após a exposição do tipo de vírus da Gripe H1N1, influenza A
(A/Califórnia/04/2009 (CDC ID 2009712047) ao Produto de Teste 5, PURELL
VF841 Hand Sanitizing Gel (Lote número 319152).
A Tabela VII apresenta o Controle de citotoxicidade, o Controle de Neutralização, e os
dados de Controle da Célula, assim como a Infectividade de Controle do Vírus
(TCID50), a infectividade após a exposição (TCID50) e as reduções de percentual e log10
observadas após a exposição do tipo de vírus da Gripe H1N1, influenza A
(A/Califórnia/04/2009 (CDC ID 2009712047) ao Produto de Teste 7, PURELL
Alcohol Canister Wipes (Lote número LMPQ805143).
A Tabela VIII apresenta o Controle de citotoxicidade, o Controle de Neutralização, e os
dados de Controle da Célula, assim como a Infectividade de Controle do Vírus
(TCID50), a infectividade após a exposição (TCID50) e as reduções de percentual e log10
observadas após a exposição do tipo de vírus da Gripe H1N1, influenza A
(A/Califórnia/04/2009
(CDC
ID
2009712047)
ao
Produto
de
Teste
ANTIBACTERIAL FOAM SOAP (Triclosan 0,3%) (Lote número 1029-15).
8,
Tabela I
Produto de Teste 1: PURELL Instant Hand Sanitizer (a 62% de etanol, Lote
número Q806298)
Vírus: tipo de vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009 (CDC ID
2009712047)
Linha da Célula hospedeira: MDCK (ATCC #CCL-34)
Volume por recipiente: 1.0 mL
DILUIÇ
CONTRO TEMPO
ÃO
LE
(-log10)
VÍRUS
DE C0NTROLE
CONTROLE
CONTRO
DE
DE
LE
AO TESTE
CITOTOXID
NEUTRALIZA
CÉLULA
15 seg
ADE
ÇÃO
(CONTR
DO EXPOSIÇÃO
30 seg
DA
OLE
NEGATI
VO)
0000
-3
NT
0000
0000
0000
NT
-4
++++
0000
0000
0000
++++
-5
++++
0000
0000
NT
++++
-6
++++
0000
0000
NT
+++0
-7
+000
0000
0000
NT
+000
-8
0000
NT
NT
NT
0000
TCID50
6,75 log10
2,5
2,5
NA
6,5 log10
log10
log10
4,25
4,25
log10
log10
Redução
NA
em log10
Percentu
al
NA
de
>99,99 >99,99
%
%
Redução
+
CPE (efeito citopático/citotóxico) presente
0
CPE (efeito citopático/citotóxico) não detectado
NT
Não testado
NA
Não aplicável
Tabela III
Produto de Teste 3: PURELL Instant Hand Sanitizer Skin Nourishing Foam (Lote
número 319602)
Vírus: tipo de vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009 (CDC ID
2009712047)
Linha da Célula hospedeira: MDCK (ATCC #CCL-34)
Volume por recipiente: 1.0mL
DILUIÇ
CONTRO TEMPO
ÃO
LE
(-log10)
VÍRUS
DE C0NTROLE
CONTROLE
CONTRO
DE
DE
LE
AO TESTE
CITOTOXID
NEUTRALIZA
CÉLULA
15 seg
ADE
ÇÃO
(CONTR
DO EXPOSIÇÃO
30 seg
DA
OLE
NEGATI
VO)
0000
-3
NT
0000
0000
0000
NT
-4
++++
0000
0000
0000
++++
-5
++++
0000
0000
NT
++++
-6
++++
0000
0000
NT
0+++
-7
+000
0000
0000
NT
0000
-8
0000
NT
NT
NT
0000
TCID50
6,75 log10
2,5
2,5
NA
6,25 log10
log10
log10
4,25
4,25
log10
log10
Redução
NA
em log10
Percentu
al
NA
de
>99,99 >99,99
%
%
Redução
+
CPE (efeito citopático/citotóxico) presente
0
CPE (efeito citopático/citotóxico) não detectado
NT
Não testado
NA
Não aplicável
Tabela IV
Produto de Teste 4: PURELL 70 Gel Sanitizer (a 70% de etanol,Lote número
1028-69)
Vírus: tipo de vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009 (CDC ID
2009712047)
Linha da Célula hospedeira: MDCK (ATCC #CCL-34)
Volume por recipiente: 1.0 mL
DILUIÇ
CONTRO TEMPO
ÃO
LE
(-log10)
VÍRUS
DE C0NTROLE
CONTROLE
CONTRO
DE
DE
LE
AO TESTE
CITOTOXID
NEUTRALIZA
CÉLULA
15 seg
ADE
ÇÃO
(CONTR
DO EXPOSIÇÃO
30 seg
DA
OLE
NEGATI
VO)
0000
-3
NT
0000
0000
0000
NT
-4
++++
0000
0000
0000
++++
-5
++++
0000
0000
NT
++++
-6
++++
0000
0000
NT
++00
-7
+000
0000
0000
NT
+000
-8
0000
NT
NT
NT
0000
TCID50
6,75 log10
2,5
2,5
NA
6,25 log10
log10
log10
4,25
4,25
log10
log10
Redução
NA
em log10
Percentu
al
NA
de
>99,99 >99,99
%
%
Redução
+
CPE (efeito citopático/citotóxico) presente
0
CPE (efeito citopático/citotóxico) não detectado
NT
Não testado
NA
Não aplicável
Tabela V
Produto de Teste 5: PURELL VF841 Hand Sanitizing Gel (Lote número 319152).
Vírus: tipo de vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009 (CDC ID
2009712047)
Linha da Célula hospedeira: MDCK (ATCC #CCL-34)
Volume por recipiente: 1.0 mL
DILUIÇ
CONTRO TEMPO
ÃO
LE
(-log10)
VÍRUS
DE C0NTROLE
CONTROLE
CONTRO
DE
DE
LE
AO TESTE
CITOTOXID
NEUTRALIZA
CÉLULA
15 seg
ADE
ÇÃO
(CONTR
DO EXPOSIÇÃO
30 seg
DA
OLE
NEGATI
VO)
0000
-3
NT
0000
0000
0000
NT
-4
++++
0000
0000
0000
++++
-5
++++
0000
0000
NT
++++
-6
++++
0000
0000
NT
+++0
-7
+000
0000
0000
NT
+000
-8
0000
NT
NT
NT
0000
TCID50
6,75 log10
2,5
2,5
NA
6,5 log10
log10
log10
4,25
4,25
log10
log10
Redução
NA
em log10
Percentu
al
NA
de
>99,99 >99,99
%
%
Redução
+
CPE (efeito citopático/citotóxico) presente
0
CPE (efeito citopático/citotóxico) não detectado
NT
Não testado
NA
Não aplicável
Tabela VII
Produto de Teste 7: PURELL Alcohol Canister Wipes
(Lote número
LMPQ805143)
Vírus: tipo de vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009 (CDC ID
2009712047)
Linha da Célula hospedeira: MDCK (ATCC #CCL-34)
Volume por recipiente: 1.0 mL
DILUIÇ
CONTRO TEMPO
ÃO
LE
(-log10)
VÍRUS
DE C0NTROLE
CONTROLE
CONTRO
DE
DE
LE
AO TESTE
CITOTOXID
NEUTRALIZA
CÉLULA
15 seg
ADE
ÇÃO
(CONTR
DO EXPOSIÇÃO
30 seg
DA
OLE
NEGATI
VO)
0000
-3
NT
0000
0000
0000
NT
-4
++++
0000
0000
0000
++++
-5
++++
0000
0000
NT
++++
-6
++++
0000
0000
NT
++++
-7
+000
0000
0000
NT
+000
-8
0000
NT
NT
NT
0000
TCID50
6,75 log10
2,5
2,5
NA
6,75 log10
log10
log10
4,25
4,25
log10
log10
Redução
NA
em log10
Percentu
al
NA
de
>99,99 >99,99
%
%
Redução
+
CPE (efeito citopático/citotóxico) presente
0
CPE (efeito citopático/citotóxico) não detectado
NT
Não testado
NA
Não aplicável
Tabela VIII
Produto de Teste 8: Antibacterial Foam Soap (a 0,3% de Triclosan - Lote número
1029-15)
Vírus: tipo de vírus da Gripe H1N1, influenza A (A/Califórnia/04/2009 (CDC ID
2009712047)
Linha da Célula hospedeira: MDCK (ATCC #CCL-34)
Volume por recipiente: 1.0mL
DILUIÇ
CONTRO TEMPO
ÃO
LE
(-log10)
VÍRUS
DE C0NTROLE
CONTROLE
CONTRO
DE
DE
LE
AO TESTE
CITOTOXID
NEUTRALIZA
CÉLULA
15 seg
ADE
ÇÃO
(CONTR
DO EXPOSIÇÃO
30 seg
DA
OLE
NEGATI
VO)
0000
-3
NT
0000
0000
0000
NT
-4
++++
0000
0000
0000
++++
-5
++++
0000
0000
NT
++++
-6
++++
0000
0000
NT
0+++
-7
+000
0000
0000
NT
0000
-8
0000
NT
NT
NT
0000
TCID50
6,75 log10
2,5
2,5
NA
6,50 log10
log10
log10
4,25
4,25
log10
log10
Redução
NA
em log10
Percentu
al
NA
de
>99,99 >99,99
%
%
Redução
+
CPE (efeito citopático/citotóxico) presente
0
CPE (efeito citopático/citotóxico) não detectado
NT
Não testado
NA
Não aplicável
17.0 CRITÉRIOS DE ACEITAÇÃO DO TESTE:
Um teste válido requer que: 1) pelo menos 4 log10 de TCID50 sejam recuperados do
Controle do Vírus; 2) células nos recipientes de controle negativo estejam viáveis e
anexadas no fundo dos recipientes; 3) o meio esteja livre de contaminação em todos as
placas; 4) quando a citotoxicidade por evidente, seja demonstrado pelo menos 3 log10 de
redução além do nível de citotoxicidade no título, e 5) o produto de teste seja totalmente
neutralizado
imediatamente após o tempo de exposição de tal maneira que a
infectividade do vírus não seja afetada.
18.0 ANÁLISE ESTATÍSTICA:
Não foi realizada uma análise estatística sobre os dados derivados deste estudo.
19.0 AUDITORIA PARA GARANTIA DA QUALIDADE:
A Unidade de Garantia de Segurança (QAU) conduziu auditorias nas diversas fases do
estudo dos procedimentos de teste críticos e advertiu o Diretor de Estudo dos resultados
destas. Após a compleição dos testes, o QAU realizou uma auditoria dos dados do
Relatório Final em sua totalidade. Ocorreu um desvio do protocolo de estudo durante o
curso desta avaliação e foi apropriadamente documentado. Não ocorreram desvios dos
Procedimentos De Operação Padrões do Bioscience Laboratories Inc. durante o curso
desta avaliação.