Conceitos Preliminares
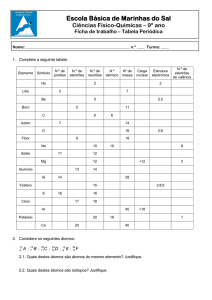
Matéria
Revisão aulas 01 e 02
Conceitos Preliminares
Fenômenos
Substâncias
Elemento Químico
Fenômeno Químico
Fenômeno Físico
Fenômeno Químico
Reação Química
Substâncias
Matéria
Força – Jackson Zanetti
Elemento Ferro
Símbolo: Fe
Z = 26
Constituição Isotópica:
4 isótopos
O mais estável possui A= 56
O elemento químico ferro é um metal chamado de
transição, isto é: metais que possuem seus íons
com configuração eletrônica com o sub nível d
incompleto e isto confere a estes metais
proriedades características como: metais duros de
alto ponto de fusão e ebulição, conduzindo bem o
calor e a eletricidade; formam ligas entre si;
apresentam estados de oxidação muito variados;
seus sais complexos são muito coloridos como nos
sais de cromo, cobalto e níquel.
Objeto
Substância
Conjunto de moléculas que
Podem ou não estar ligadas
entre si.
Moléculas
Conjunto de átomos
ligados entre si através
de ligações químicas
Átomos
Aquamotion - John S. Robinson
Corpo
Conjunto das menores
partículas que constituem
a matéria
Elemento Ferro
É um dos elementos de maior quantidade
no universo estando presente em diversos
asteródes e meteoritos que chegam a
superfície da Terra.
O núcleo da Terra possui Fe em uma
elevadíssima temperatura formando uma
região chamda de NiFe.
Na natureza é encontrado em minérios
como o sulfeto de ferro (pirita ou ouro dos
tolos), a hematita entre outros.
Elemento Ferro
Elemento Ferro
Importância para o ser Humano
É praticamente encontrado em
todos os seres vivos e cumpre
numerosas
e
variadas
funções.
Diferentes proteínas que contêm
o grupo heme, que consiste
na ligação da porfirina com um
átomo de ferro.
A hemoglobina e a mioglobina
que são proteínas associadas
ao ferro. A primeira transporta
O2, e a segunda o armazena.
A hemoglobina localiza-se no
sangue e, pelo fato de ter
átomos de ferro, a cor do
sangue é vermelha.
Elemento Ferro
Onde é encontrado
Elemento Ferro
Utilização
• O ferro é o metal mais
usado, com 95% em
peso
da
produção
mundial de metal.
• Automóveis, barcos e
componentes estruturais
de edifícios
Idade do Ferro
A Idade do Ferro se refere ao período em que
ocorreu a metalurgia do ferro.
Este metal é superior ao bronze em relação à
dureza e abundância de jazidas.
A Idade do Ferro vem caracterizada pela
utilização do ferro como metal, utilização
importada do Oriente através da emigração de
tribos indoeuropéias (celtas), que a partir de 1.200
a.C começaram a chegar a Europa Ocidental, e o
seu período alcança até a época romana e na
Escandinávia até a época dos vikings (em torno
do ano 1.000 d.C).
Idade do Ferro - Utensílios
Aço
Outras Utilizações
Metalurgia - Siderurgia
A metalurgia é o conjunto de técnicas que o
homem desenvolveu com o decorrer do tempo que
lhe permitiu extrair e manipular metais e gerar ligas
metálicas.
Siderurgia é o ramo da metalurgia que se dedica
à fabricação e tratamento do aço.
Minério
Minério (do latim minera, mina) é um
mineral que é economicamente autosustentável para a sua prospecção e
exploração industrial (mineração).
Aço
é
uma
liga
metálica
formada
essencialmente
por
ferro e carbono, com
percentagens
deste
último variáveis entre
0,008 e 2,11%.
Distingue-se do ferro
fundido, que também é
uma liga de ferro e
carbono, mas com teor
de
carbono
entre
2,11% e 6,67%.
Mineral
É um corpo natural sólido e
cristalino
formado
em
resultado da interação de
processos físico-químicos
em ambientes geológicos.
Cada mineral é classificado
e denominado não apenas
com
base
na
sua
composição química, mas
também
na
estrutura
cristalina dos materiais que
o compõem.
Principais Minérios do Brasil
Al2O3 - para a extração
de alumínio - bauxita
ZnS - para a extração
de zinco – blenda
Cu2S - para a extração
de cobre - calcocite
SnO2 - para a extração
de
estanho
–
cassiteriata
PbS - para a extração
de chumbo – galena
Fe2O3 – para extração
do ferro – hematita
MnO2 - para a extração
de
manganês
–
pirolusita
Au - associado ao
quartzo e à pirita –
ouro in natura ou
óxido auroso
Degradação Ambiental
Bauxita
Pirolusita
Cassiterita
Pepitas de Ouro
Minamata - Japão
Desastre de Minamata é a
denominação
dada
ao
envenenamento
de
centenas de pessoas por
mercúrio ocorrido na baia de
Minamata, no Japão.
A Doença de Minamata é
uma síndrome neurológica
causada
por
severos
sintomas
de
envenenamento
por
mercúrio.
Os
sintomas
incluem
distúrbios
sensoriais nas mãos e pés,
danos à visão e audição,
fraqueza e, em casos
extremos, paralisia e morte.
Ligação Covalente
É a ligação caracterizada pelo
compartilhamento de pares eletrônicos.
Lembrando que os átomos se unem para
baixar seu conteúdo global de energia e
para explicar estas ligações existem
diversas teorias entre elas: teoria do
octeto, teoria dos orbitais, teoria da
hibridação, etc.
Aula 03
Ligações:
Covalentes – Polarização –
Inter atômicas – Metálicas – Ligas
Propriedades dos compostos
Fórmulas químicas
Ligação Covalente
H → 1s1
H → 1s1
O orbita “s” pode ser representado
por um único ↑ e dentro dele
um elétron
H→
↑
↑
←H
Perceba que cada orbital necessita um elétron.
Lembre: em cada orbital cabem no máximo
2 elétrons.
Ligação Covalente
Ocorre uma atração entre os orbitais
semi-preenchido e após a
interpenetração dos orbitais constituindo
o Orbital Atômico (OM).
H→
↑
H→
↑
↑↓
←H
Ocorrência
HxH
H x não metal
H x semi metal
Não metal x não metal
Não metal x semi metal
Diferença de eletronegatividade
igual ou inferior a 1,7.
←H
Polarização
É a tendência que os átomos possuem em
atrair para si pares de elétrons nas
ligações covalentes.
A determinação da polaridade de uma
ligação covalente se faz através da
diferença de eletronegatividade entre os
átomos participantes da ligação:
Polarização
dε = ε maior - ε menor
Através da polaridade da ligação pode-se
prever a polaridade de um composto.
A polaridade de um composto é importante
para a determinação da solubilidade de
substâncias, assim:
Compostos Polares:
água, álcool, sabões, detergentes...
Compostos apolares:
Hidrocarbonetos, plásticos, alguns gases...
Polarização
Polarização
Regra de solubilidade:
Semelhante dissolve Semelhante
Polar dissolve Polar
Apolar dissolve Apolar
Esta regra é válida também em função do
tipo de interação existente entre as
diferentes substâncias.
Tipos de Interações
(Ligações Inter moleculares)
São ligações químicas que ocorrem entre as
moléculas que constituem as substâncias
químicas.
Forças de Van der Waals: compostos
apolares; são fracas; gás de cozinha;
Dipólo-permanente: compostos pouco
polares; mais fortes; acetona;
Pontes de Hidrogênio: compostos muito
polares; muito fortes; água.
Ligação Metálica
Propriedades Físicas
Ponto de Fusão e Ponto de Ebulição
• Quanto maior o mol maiores propriedades físicas,
• Quando mais intensa a força da atração
molecular maiores propriedades físicas.
Assim, em resumo, temos:
Iônica
>
Pontes de
Hidrogênio
>
Dipólo
Permanente
>
Van der
Walls
Ligação Metálica
É o tipo de ligação química que ocorre quando
átomos de elementos químicos metálicos ligamse entre si.
Brilho característico; Condutividade térmica;
Condutividade elétrica;
Altos pontos de fusão e ebulição;
Resistência a tensão(tenacidade);
Maleabilidade ( os metais podem ser
transformados em lâminas e chapas
bastante finas );
Ductibilidade ( os metais podem ser
reduzidos a fios, é a trefilaçao);
Dureza
Ligas Metálicas
Ligas Metálicas
São materiais com propriedades metálicas
que contêm dois ou mais elementos
químicos.
Ligas metálicas mais comuns no cotidiano:
Aço — constituído por Fe e C.
Aço inoxidável — constituído por Fe, C, Cr e Ni.
Ouro de Jóias — constituído por Au (75 %), Ag
e/ou Cobre (25 %) para o ouro 18K. O ouro 24K
é ouro puro.
Amálgama dental (utilizada em obturação) —
constituída por Hg, Ag e Sn.
Bronze — constituído por Cu e Sn.
Latão (utilizado em armas e torneiras) —
constituído por Cu e Zn.
Fórmulas Químicas
É a forma pela qual podemos representar
uma substância pura.
Na fórmula química existem as proporções
definidas de cada um dos elementos que
constitui a substância.
Tipos de Fórmulas Químicas
Fórmula Molecular
Expressa a menor proporção de agrupamentos de
átomos que constitui uma substância. (H2O)
Fórmula Estrutural
Expressa a ligação que ocorre entre os elementos
que constitui a fórmula molecular.
O
H
H
Tipos de Fórmulas Químicas
Tipos de Fórmulas Químicas
Fórmula Porcentual
Sabendo-se que o mol de uma substância é
180 e que em sua composição existe C em
40%, H em 6,67% e O em 53,33%, qual a
fórmula molecular e a fórmula mínima do
composto?
(dados: H=1, C=12, O=16)
Expressa a menor porcentagem em quantidade de
matéria que cada elemento possui na
constituição da substância.
Fórmula Mínima
Expressa a menor proporção em números inteiros
de mols dos átomos dos elementos que
constituem uma substância.
Iônico – Molecular - Metálico
Propriedade dos compostos
Iônico – Molecular – Metálico
Ácido – Base – Sal – Óxido
Alguns compostos e suas
Utilizações
Iônico
Sólidos cristalinos, cristais duros e quebradiços,
Altos PF e PE, condução de eletricidade em
solução ou derretidos, solúveis em água.
Molecular
Sólidos, líquidos ou gasosos, baixos PF e PE,
insolúveis em água, não conduzem
Metais
Sólidos,
brilho
característico,
conduzem na fase sólida.
insolúveis,
Ácidos – Bases – Sais - Óxidos
Ácidos
Moleculares, sabor azedo, conduzem em solução
Bases
Iônicos, sabor caustico, conduzem em solução
Sais
Iônicos, reação de ácido e base, conduzem em
solução ou derretidos
Alguns Ácidos
Água boricada - ácido bórico ( H3BO3 )
Ácido Nítrico – (HNO3),
Água de bateria - ácido sulfúrico ( H2SO4 ),
Vinagre - ácido acético ( CH3COOH ),
Refrigerantes - ácido carbônico ( H2CO3 )
Óxidos
Iônicos ou moleculares, em geral poluentes,
podem ser minérios.
Chuva Ácida
Alguns Ácidos
Ocorrem quando alguns óxidos de
nitrogênio, carbono e enxofre entram em
contato com o vapor de água e o oxigênio
da atmosfera, formando assim, ácido
nítrico, ácido sulfúrico e carbônico.
Essas chuvas causam grande destruição ao
caírem sobre florestas pois queimam as
folhas das árvores e expõem o solo à
erosão.
Algumas Bases
Soda Cáustica – hidróxido de sódio (NaOH)
Potassa – hidróxido de potássio (KOH),
Cal extinta – hidróxido de cálcio (Ca(OH)2)
Magnésia – hidróxido de magnésio
(Mg(OH)2)
Pepsamar – hidróxido de alumínio (Al(OH)3)
Amoníaco – hidróxido de amônia (NH4OH)
Algumas Bases
Alguns Sais
Alguns Sais
Sal de cozinha – cloreto de sódio (NaCl)
K-boa – hipoclorito de sódio (NaClO)
Calcário – carbonato de cálcio (CaCO3)
Sais minerais – Ca, P, Fe, Mg, Zn, K, Cl, F
Fertilizantes
Alguns Óxidos
Gás carbônico – dióxido de carbono (CO2)
Gás sulfuroso – trióxido de enxofre (SO3)
Gás nítrico-nitroso – pentóxido de
dinitrogeno (N2O5)
Gás hilariante – monóxido de dinitrogeno
(N2O)
Bauxita, cassiterita, pirolusita, hematita,
caolim (Al2O3.SiO2)
Alguns Óxidos