Enviado por
common.user9850
Introdução Química Geral

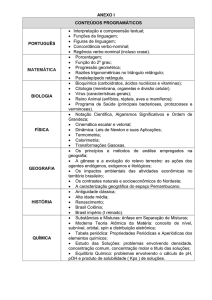
Química Geral INTRODUÇÃO Prof. Dr. Darlan Marum INTRODUÇÃO O QUE É QUÍMICA? A química é a ciência que estuda a natureza, as propriedades, a composição e as transformações da matéria. O campo de interesse e aplicação da química é tão amplo que envolve quase todas as outras ciências; por isso, muitas disciplinas estão interligadas com a química INTRODUÇÃO As primeiras tentativas de entender os fenômenos naturais, desvinculadas da religião ou de forças sobrenaturais, surgiram no século V a.C., na Grécia. Foi Empédocles, um filósofo grego, quem lançou a ideia para explicar a constituição da matéria. Para ele, ela seria formada por quatro elementos primários – o fogo, o ar, a água e a terra. Esses elementos seriam indestrutíveis, mas estariam sofrendo constantes transformações. INTRODUÇÃO Mais tarde, Aristóteles introduziu a ideia de que esses quatro elementos podiam ser diferenciados por suas propriedades: • • • • O fogo: seria quente e seco; O ar: seria quente e úmido; A água: seria fria e úmida; A terra: seria fria e seca; INTRODUÇÃO Boyle fundamentou sua teoria na realização de experimentos e na interpretação dos resultados obtidos, processo que hoje se denomina método científico. QUÍMICA: TRÊS NÍVEIS A partir de vários estudos puderam então, dividir a química em três níveis. • O primeiro, trata-se da matéria e suas transformações (nível macroscópico) • O segundo, trata-se de fenômenos em termos de rearranjos dos átomos (nível microscópico) • O terceiro, trata-se das descrições dos fenômenos químicos por meio de símbolos e equações matemáticas (nível simbólico). POR QUE ESTUDAR A QUÍMICA? A química é central para garantir uma compreensão básica dos princípios dominantes dos campos relacionados à ciência. MATÉRIA E ENERGIA Matéria: tudo que possui massa e que ocupa lugar no espaço A matéria nem sempre é visível. O ar é um exemplo disso. Podemos, através de experimentos simples, constatar que o ar ocupa lugar no espaço. ENERGIA Pode-se afirmar que o conceito de energia está diretamente relacionado à realização de trabalho, ao fato de provocar modificações na matéria e de ser interconversível em suas várias formas. ESTADOS FÍSICOS DA MATÉRIA Toda matéria é constituída de pequenas partículas e, dependendo do maior ou menor grau de agregação entre elas, pode ser encontrada em três estados físicos: sólido, líquido e gasoso. Sólido: é uma forma da matéria que retém sua forma e não flui; Líquido: é uma forma da matéria, que tem superfície bem definida e que toma forma do recipiente que o contém; Gasoso: é uma forma fluída da matéria que ocupa todo o recipiente que o contém e sofre compressão. ESTADOS FÍSICOS DA MATÉRIA Partículas com empacotamento compacto, mas continuam a oscilar. Partículas com menor organização, menor força de atração. Partículas movem-se quase completamente livres e estão em movimento aleatório. Mudanças de temperatura ou pressão podem levar a transformaçã o da matéria. ESTADOS FÍSICOS DA MATÉRIA SUBLIMAÇÃO FUSÃO VAPORIZAÇÃO SOLIDIFICAÇÃO LIQUEFAÇÃO Aumento de Temperatura Diminuição de Temperatura CLASSIFICAÇÃO DA MATÉRIA Um conjunto de átomos com as mesmas propriedades químicas constitui um elemento químico, e cada substância é caracterizada por uma proporção constante desses elementos. Substância pura Tipo de matéria formada por unidades químicas iguais, sejam átomos, sejam moléculas, e por esse motivo apresentando propriedades químicas e físicas próprias. As substâncias puras podem ser classificadas como simples ou compostas. CLASSIFICAÇÃO DA MATÉRIA Substâncias simples A substância formada por um ou mais átomos de um mesmo elemento químico é classificada como substância simples. Substâncias compostas Quando as moléculas de determinada substância são formadas por dois ou mais elementos químicos, ela é classificada como substância composta. CLASSIFICAÇÃO DA MATÉRIA Compostos A maior parte dos elementos químicos podem interagir com outros elementos afim de formar os compostos. Comparação entre água, hidrogênio e oxigênio Água Hidrogênio Oxigênio Estado Físico Líquido Gás Gás Temperatura E 100°C -253°C -183°C Densidade 1,0g/L 0,084g/L 1,33g/L Inflamável Não Sim Não Molécula de água H2O CLASSIFICAÇÃO DA MATÉRIA Misturas As misturas são combinações de duas ou mais substâncias em que cada substância mantém a sua identidade química. CLASSIFICAÇÃO DA MATÉRIA Solução: é formada por duas ou mais substâncias, cada uma delas sendo denominada componente. Solução homogênea Toda solução que apresenta uma única fase. Solução heterogênea Toda solução que apresenta pelo menos duas fases. TRANSFORMAÇÕES DA MATÉRIA Qualquer modificação que ocorra com a matéria é considerada um fenômeno: água em ebulição, massa do pão "crescendo", explosão de uma bomba etc. Fenômenos físicos: não alteram a natureza da matéria, isto é, a sua composição. Fenômenos químicos: alteram a natureza da matéria, ou seja, a sua composição. TRANSFORMAÇÕES DA MATÉRIA A formação de uma nova substância está associada à: 1. Mudança de cor. Exemplos: queima de papel; cândida ou água de lavadeira em tecido colorido; queima de fogos de artifício. 2. Liberação de um gás (efervescência). Exemplos: antiácido estomacal em água; bicarbonato de sódio (fermento de bolo) em vinagre. 3. Formação de um sólido. Exemplos: líquido de bateria de automóvel + cal de pedreiro dissolvida em água; água de cal + ar expirado pelo pulmão (gás carbônico). 4. Aparecimento de chama ou luminosidade. Exemplos: álcool queimando, luz emitida pelos vaga-lumes. DIAGRAMA DE MUDANÇA DE ESTADO FÍSICO Ao aquecermos uma amostra de substância pura, como, por exemplo, a água no estado sólido (gelo) e anotarmos as temperaturas nas quais ocorrem as mudanças de estado, ao nível do mar, obteremos o seguinte gráfico: TE TF DIAGRAMA DE MUDANÇA DE ESTADO FÍSICO Existem algumas misturas com comportamento diferente, as quais apresentam um patamar apenas. Misturas eutéticas Essas misturas comportam-se como uma substância, isto é, apresentam TF constante, e o gráfico apresenta um patamar durante a fusão. Misturas azeotrópicas Essas misturas comportam-se como uma substância, isto é, apresentam TE constante, e o gráfico apresenta um patamar durante a ebulição. DIAGRAMA DE FASE DA ÁGUA 1 – curva de fusão: limita as regiões das fases sólida e líquida 2 – curva de vaporização: limita as regiões das fases líquida e gasosa 3 – curva de sublimação: limita as regiões das fases sólida e gasosa SEPARAÇÃO DE MISTURAS ANÁLISE IMEDIATA O conjunto de processos físicos que não alteram a natureza das substâncias é denominado análise imediata. Para cada tipo de mistura — heterogênea ou homogênea — usamos métodos diferentes. Decantação Processo utilizado para separar dois tipos de misturas heterogêneas. SEPARAÇÃO DE MISTURAS Líquido e sólido A fase sólida (barro), por ser mais densa, sedimenta-se, ou seja, deposita- se no fundo do recipiente, e a fase líquida pode ser transferida para outro frasco. A decantação é usada, por exemplo, nas estações de tratamento de água. SEPARAÇÃO DE MISTURAS Líquido e líquido O líquido mais denso permanece na parte inferior do funil e é escoado controlando-se a abertura da torneira. SEPARAÇÃO DE MISTURAS É utilizada para separar substâncias presentes em misturas heterogêneas envolvendo sólidos e líquidos. SEPARAÇÃO DE MISTURAS Destilação É utilizada para separar cada uma das substâncias presentes em misturas homogêneas envolvendo sólidos dissolvidos em líquidos e líquidos miscíveis entre si. Na destilação simples de sólidos dissolvidos em líquidos, a mistura é aquecida, e os vapores produzidos no balão de destilação passam pelo condensador, onde são resfriados pela passagem de água corrente no tubo externo, se condensam e são recolhidos no erlenmeyer. SEPARAÇÃO DE MISTURAS A parte sólida da mistura, por não ser volátil, não evapora e permanece no balão de destilação. SEPARAÇÃO DE MISTURAS SEPARAÇÃO DE MISTURAS SEPARAÇÃO DE MISTURAS As diferentes capacidades das substâncias para aderir superfícies de sólidos podem também ser usadas na separação de misturas.c Essa capacidade é a base da Cromatografia Cromatografia de coluna UNIDADES DE MEDIDA Em Química, para realizar qualquer experimento, além dos conceitos básicos de matéria e energia, também é necessário conhecer algumas unidades de medida. Os resultados de uma medida, o “valor” de uma quantidade física, são registrados como múltiplos de uma unidade. O Sistema Internacional (SI) é aceito internacionalmente. UNIDADES DE MEDIDA Massa (m): a quantidade de matéria que existe num corpo. No Sistema Internacional (SI), a unidade-padrão de massa é o quilograma (kg). UNIDADES DE MEDIDA Volume (V): é a extensão de espaço ocupado por um corpo. No SI, a unidade-padrão de volume é o metro cúbico (m3). No entanto, a unidade mais usada em Química é o litro (L). UNIDADES DE MEDIDA Temperatura(T): relaciona-se com o estado de agitação das partículas que formam um corpo e com a capacidade desse corpo de transmitir ou receber calor. Existem três escalas centígradas: • Celsius (°C) • Kelvin (K) • Fahrenheit (°F) A escala Kelvin é a recomendada pelo SI e é conhecida como escala absoluta. UNIDADES DE MEDIDA Pressão (P): a relação entre a força exercida na direção perpendicular, sobre uma dada superfície, e a área dessa superfície. A pressão atmosférica varia de acordo com a altitude. Em regiões de grande altitude, há menor quantidade de partículas do ar por unidade de volume, portanto a pressão também é menor. UNIDADES DE MEDIDA Pelo Sistema Internacional (SI), a unidade-padrão é o pascal (Pa), que se relaciona com a unidade atmosfera na seguinte proporção: aproximadamente UNIDADES DE MEDIDA Densidade (d): é a relação (razão) entre a massa de um material e o volume por ele ocupado. Para sólidos e líquidos, a densidade geralmente é expressa em gramas/centímetros cúbicos (g/cm3); para gases, costuma ser expressa em gramas/litro (g/L).




![Roteiro Mensal [3ª série] – Biologia – Química – Empreendedorismo](http://s1.studylibpt.com/store/data/000321355_1-fe20122337e00be7fc133cc291bfacca-300x300.png)