BIOQUÍMICA I 2010/2011
Ensino teórico - 1º ano
Mestrado Integrado em Medicina
14ª aula teórica
Complexo da piruvato desidrogenase (PDH) e ciclo de Krebs.
15/11/2010
Bibliografia
Stryer, Biochemistry, 5ª Ed, 2006, Capítulo 17
1
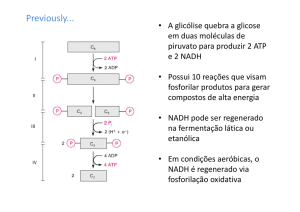
As vias metabólicas do Piruvato
Transaminase glutâmico-pirúvica
Glucose
↓
↓ Glicólise
↓
Piruvato
Transaminação
Alanina
Carboxilação
Piruvato carboxilase
Oxaloacetato
Redução Lactato desidrogenase
Lactato
Descarboxilação
oxidativa Piruvato desidrogenase
Acetil-CoA
TCA
Objectivos
1. Analisar a PDH sob o ponto de vista estrutural e funcional
2. Explicar a importância do acetil-coenzima-A como molécula
chave do metabolismo
3. Descrever o mecanismo de regulação da PDH
4. Analisar o ciclo de Krebs
5. Descrever os mecanismos de regulação do ciclo de Krebs
2
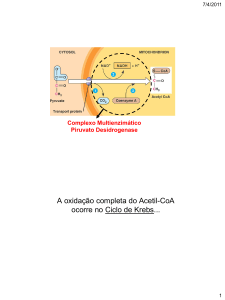
Transporte de piruvato
(membrana mitocondrial interna, MMI)
Espaço
Intermembranar
Matriz
Piruvato
OH-
MEM
MIM
(permeável a pequenas
moléculas e iões)
(impermeável a pequenas
moléculas e iões, incluindo H+)
Acção da piruvato desidrogenase
- um complexo enzimático (E1, E2, E3) -
(irreversível)
E1 - piruvato desidrogenase
E2 - dihidrolipoil transcetilase
E3 - dihidrolipoil desidrogenase
P
Activa na forma
desfosforilada!
3
As gorduras não são convertidas
em hidratos de carbono
Porquê?
Porque conversão Acetil-CoA → Piruvato
Complexo da Piruvato Desidrogenase (PDH)
(matriz mitocondrial)
Complexo enzimático E1, E2, E3
utiliza 5 cofactores e 4 vitaminas:
• Tiamina pirofosfato (TPP)
• Coenzima A
• Ácido lipóico
• NAD
• FAD
Tiamina (vit B1) TPP
Riboflavina (vit B2) FAD
Niacina (vit B3 = ác. nicotínico) NAD
Ácido pantoténico (vit B5) CoA
4
Tiamina pirofosfato (TPP)
cofactor de várias enzimas:
Piruvato desidrogenase (articula Glicólise C. Krebs)
α-Cetoglutarato desidrogenase (C. Krebs)
Transcetolase (Via das Pentoses)
Deficiência em vit B1 TPP
causa Beriberi
Complexo da Piruvato Desidrogenase
(PDH)
Enzima
Cofactor
Reacção catalizada
Piruvato
E1
desidrogenase
TPP
Descarboxilação
oxidativa do piruvato
Di-hidro-lipoil
transacetilase
Lipoamida
CoA-SH
Transferência de um
grupo acetil para CoA
FAD
NAD+
Regeneração da forma
oxidada da lipoamida
E2
Di-hidro-lipoil E3
desidrogenase
5
E3
FAD
E1
E2
Regulação da actividade do
Complexo da Piruvato Desidrogenase
1. Inibição pelo produto: Acetil-CoA e NADH
Acetil-CoA Trans-acetilase
NADH Di-hidro-lipoil desidrogenase
CoA e NAD+ revertem a inibição
↑ Piruvato activa a PDH
2. Regulação por nucleótidos: GTP (inactiva) e AMP (activa)
A actividade de PDH decresce quando a célula possui carga energética ↑
6
3. Regulação por fosforilação reversível:
- Inactivação por fosforilação num resíduo de Serina
(PDH desfosforilada)
Activadores:
Mg2+, Ca2+
PDH activa
PDH fosfatase
Inactivadores PDH
↑ ATP/ADP
↑ Acetil-CoA/CoA
↑ NADH/NAD+
Fosforilação
Activadores:
↑Acetil-CoA/CoA
↑ NADH/NAD+
PDH cinase
Inibidores:
Piruvato, ADP
PDH inactiva
(PDH fosforilada)
O acetil-CoA é um metabolito convergente
7
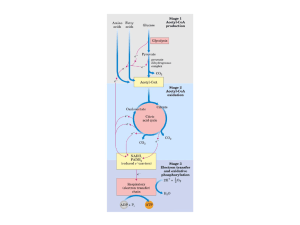
Ciclo de Krebs (TCA)
Produz equivalentes redutores (NADH e
FADH2) para o processo da fosforilação
oxidativa (síntese ATP), que ocorre na MIM
Ocorre na matriz mitocondrial.
Oxidação do Acetil
CoA pelo TCA e
transferência de epara NAD+ e FAD
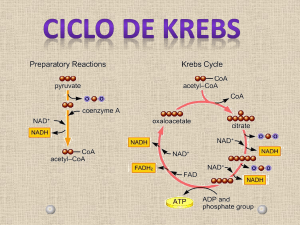
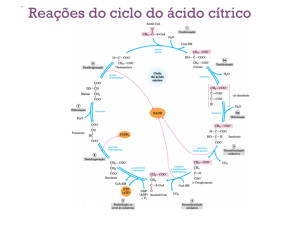
TCA (ciclo de Krebs)
Citrato sintetase
⇓
1
NADH + H+ e FADH2
(6C)
⇓
2
Oxidados na CRM
Aconitase
(4C)
⇓
ATP
3
8
Isocitrato
desidrogenase
Malato
desidrogenase
7
alfa–Cetoglutarato
desidrogenase
Fumarase
4
6
5
1ª Etapa – 1
2ª etapa – 2-5
3ª Etapa – 6-8
Succinato desidrogenase
Succinil-CoA sintetase
(4C)
8
TCA
3 NADH
1 FADH2
1 GTP (ATP)
2 CO2
3 NADH 9 ATP
(7,5)
(1,5)
1 FADH2 2 ATP
11 ATP
(9)
+
1 ATP (GTP) (1)
1 NADH 3 ATP (PDH) (2,5)
15 ATP
(12,5)
O ciclo só opera em aerobiose, apesar do O2 molecular
não participar directamente no ciclo.
A regeneração de NAD+ e FAD requer a
transferência de e- até ao O2 molecular (CRM)
α–Cetoglutarato desidrogenase
- α-Cetoglutarato desidrogenase (TPP)
- Di-hidrolipoil transuccinilase (ácido lipoico)
- Di-hidrolipoil desidrogenase (FAD)
9
Regulação
Enzimática
do TCA
pyruvate
carboxylase
- Citrato sintetase
- Isocitrato desidrogenase
- α-Cetoglutarato
desidrogenase
ATP
Fora do ciclo:
- Piruvato desidrogenase
- Piruvato carboxilase
⊗ inibição
activação
Gluconeogénese
ATP é um inibidor alostérico de
várias enzimas do Ciclo de Krebs
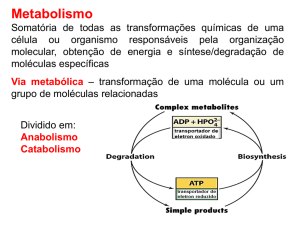
O TCA fornece
precursores para a
Biossíntese
10
O ciclo de Krebs é anfibólico –
opera quer nos processos
catabólicos quer anabólicos
Interacção do TCA com o metabolismo
dos ácidos gordos e aminoácidos
11
As reacções anapleróticas servem para repor
intermediários do TCA utilizados na
biossíntese de outros compostos
(a mais importante é catalizada pela piruvato carboxilase)
(Biotina)
Défice de enzimas do TCA
Défice da Fumarase
(Bourgeron et al., J. Clin. Investigation, 1994)
Rötig et al., 1997
Mutação no gene que codifica fumarase:
- Encefalopatia progressiva
- Intermediários do TCA na urina:
- fumarato
- succinato
- alfa-KG
- citrato
- malato
Ataxia de Friedreich (FRDA): é uma doença degenerativa, autossómica recessiva, caracterizada por
ataxia cerebelosa progressiva, disartria, ausência de reflexos tendinosos, fraqueza proximal dos
membros inferiores e cardiomiopatia hipertrófica (Durr et al., 1996), causada principalmente pela
expressão de uma sequência repetitiva GAA, no primeiro intrão do gene frataxina, localizado no
cromossoma 9q13 (Chamberlain et al., 1989; Campuzano et al., 1996). O gene mutado provoca
alterações na actividade das enzimas mitocondriais (complexos I, II e III) e da aconitase, associadas a
(Fe-S), no coração (e possivelmente no cérebro) em doentes com FRDA. O défice nas enzimas
dependente de Fe-S em FRDA deve estar relacionada com o aumento do conteúdo de ferro
mitocondrial no coração dos doentes, visto que as proteínas Fe-S são muito sensíveis aos radicais livres
de oxigénio. A FRDA deverá, portanto, estar associada a uma alteração do metabolismo energético
mitocondrial, codificado pelo núcleo (Rötig et al., 1997).
M Grazina (Tese de Doutoramento, 2006)
12