JUSTIFICATIVA
Brasília, 24 de janeiro de 2017
Processo nº: 25351.754517/2011-56
Consulta Pública nº 309/2017
Agenda Regulatória 2015-2016: Subtema nº 33.1
Assunto: Proposta de Resolução da Diretoria Colegiada (RDC) que dispõe sobre o registro de soros hiperimunes e dá
outras providências
Diretor Relator: José Carlos Magalhães da Silva Moutinho
Área responsável: Gerência-Geral de Medicamentos e Produtos Biológicos – GGMED
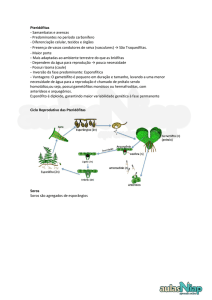
Os soros hiperimunes são preparações contendo imunoglobulinas purificadas, de origem animal, que
neutralizam especificamente toxinas bacterianas, bactérias, vírus, componentes tóxicos diversos ou componentes
tóxicos do veneno de uma ou mais espécies de animais peçonhentos. Os animais que fornecem as imunoglobulinas
específicas são previamente imunizados com antígenos específicos que, ao serem administrados no animal, são capazes
de induzir a produção de plasma hiperimune contendo a imunoglobulina específica de interesse. Esses antígenos são,
geralmente, substâncias tóxicas originadas de animais, microrganismos, vírus ou antígenos específicos.
Os soros hiperimunes são classificados como produtos biológicos e, portanto, para obter registro na Anvisa,
sempre precisaram atender às normativas vigentes relacionadas ao registro de produtos biológicos (RDC 80/2002, RDC
315/2005 e RDC 55/2010). Apesar de estar vigente a Portaria 174/1996, a mesma trata das normas técnicas de
produção e controle de qualidade dos soros antiofídicos antitóxicos e anti-rábico e, portanto, não traz os requisitos
necessários para registro sanitário destes produtos. As RDCs 80/2002 e 315/2005 estabeleciam os requisitos para
registro de produtos biológicos de uma forma mais geral e, portanto, podiam ser aplicadas ao registro dos soros
hiperimunes.
No entanto, no momento da elaboração da RDC 55/2010, norma vigente para registro de produtos biológicos no
Brasil, identificou-se que alguns itens desta legislação não se aplicam aos soros hiperimunes, em virtude das
especificidades destes produtos. A RDC 55/2010 requer a condução de estudos clínicos de fase III comparativos em
relação ao produto biológico novo, o que, em muitos casos, pode inviabilizar o registro de soros hiperimunes pela
ausência de comparadores adequados a serem utilizados nos estudos clínicos. Adicionalmente, a referida norma não
requer a apresentação de documentos essenciais relacionados à produção e controle de qualidade dos soros
hiperimunes, principalmente no que se refere à rastreabilidade, controle dos animais imunizados e dos venenos a
serem utilizados para imunização.
Dessa forma, foi necessária a consulta a referências bibliográficas e guias internacionais, objetivando-se a
elaboração de uma Resolução específica, que atendesse às necessidades dos fabricantes e, também, à missão da Anvisa
de promover a saúde da população por meio do registro de produtos comprovadamente eficazes, seguros e produzidos
com a qualidade necessária.
Importante destacar que a presente proposta foi elaborada de acordo com o guia da Organização Mundial de
Saúde (OMS) “WHO Guidelines for the Production, Control and Regulation of Snake Antivenom Immunoglobulins”, o
qual data de 2008 e engloba todas as etapas relacionadas com a produção, controle e regulação de venenos e
1
antivenenos de cobras. Este documento, ao abranger integralmente aspectos de fabricação, avaliação pré-clínica e
clínica destes produtos, deve servir de guia às autoridades reguladoras nacionais no apoio à disponibilização desses
medicamentos essenciais, garantindo-se qualidade, segurança e eficácia adequadas.
Diante de todo o exposto, a normativa proposta visa regular de maneira adequada o registro de soros
hiperimunes no Brasil, considerando as especificidades de sua fabricação, a necessidade de se garantir o fornecimento
contínuo, além da qualidade, segurança e eficácia necessárias.
Considerando os aspectos mencionados acima e as informações complementares que instruíram o Processo, a
Diretoria Colegiada da Agência Nacional de Vigilância Sanitária (Anvisa), em reunião realizada no dia 24 de janeiro de
2017, aprovou a realização da presente Consulta Pública acerca da proposta de regulamentação sobre o registro de
soros hiperimunes, a fim de submeter o assunto a comentários e sugestões do público em geral.
O prazo previsto para envio das contribuições é de 45 dias, a partir do dia 20/02/2017, após o qual o processo
seguirá novamente para análise técnica e apresentação de proposta final a ser apreciada pela Diretoria Colegiada.
Com o intuito de facilitar e agilizar as atividades de compilação, análise e resposta às contribuições da Consulta
Pública, bem como possibilitar a visualização, em tempo real, das sugestões e críticas recebidas, a Anvisa adotou o uso
do formulário eletrônico do DATASUS (FormSUS). Para esta consulta, durante o período previsto para o envio das
contribuições,
o
formulário
estará
disponível
no
endereço
eletrônico
http://formsus.datasus.gov.br/site/formulario.php?id_aplicacao=29987. Não será necessário o encaminhamento de
contribuições por email ou por protocolo físico.
O aprimoramento das rotinas e dos procedimentos de Consulta Pública é um dos instrumentos do Programa de
Melhoria do Processo de Regulamentação da Anvisa (PMR), também conhecido como Programa de Boas Práticas
Regulatórias. O Programa, instituído em abril de 2008, tem o propósito de aprimorar e modernizar a atuação regulatória
da Agência, na perspectiva de promover maior previsibilidade, transparência e estabilidade ao processo regulatório.
Dessa forma, espera-se que o uso da nova ferramenta de contribuição eletrônica responda aos anseios da
sociedade para garantir maior transparência das sugestões recebidas e estimular a participação social. A submissão de
propostas de atos normativos à Consulta Pública visa colher subsídios para qualificar as decisões regulatórias da Anvisa
e assim assegurar que comentários, pareceres e sugestões sobre esses atos possam ser conhecidos pela Agência e
levados em consideração na definição do conteúdo da norma.
2