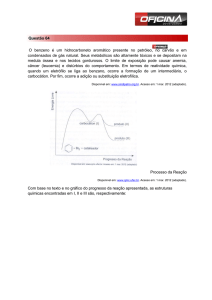
Universidade Federal Rural do Semi­Árido – UFERSA 1. Reações de Substituição Eletrofílica Anteriormente foi discutido que compostos que apresentam insaturação sofrem reações de adição eletrofílica. No entanto, reações de substituição eletrofílica são reações características de benzenos e/ou arenos que ocorrem quando estes reagem com reagentes eletrofílicos. Reações genéricas de substituição eletrofílica estão descritas a seguir: Ar
H
+
E
Ar
A
E
+
H
A
+
H
ou
H
+
E
E
A
A
O benzeno é suscetível ao ataque eletrofílico principalmente devido à exposição de seus elétrons π. Desse modo, o benzeno se parece com um alceno, porque na reação de um alceno com um eletrófilo, o sítio de ataque é a ligação π exposta. O benzeno difere de um alceno de uma maneira muito significativa. A camada fechada dos seis elétrons π confere a ele uma estabilidade especial. Assim, embora o benzeno suscetível ao ataque eletrofílico, sofre reações de substituição em vez de reações de adição. Reações de substituição permitem aos seis elétrons π do aromático serem regenerados após o ataque eletrofílico. Podemos ver como isso ocorre, se examinamos o mecanismo geral para substituição aromática eletrófílica. A primeira etapa ocorre pelo ataque dos elétrons π da insaturação no eletrófilo. Esta etapa é a etapa lenta, pois ocorre a formação do carbocátion, e como Prof. Ms. Zilvam Melo – Química Orgânica 1 Universidade Federal Rural do Semi­Árido – UFERSA conseqüência, determina a velocidade da reação. Esta etapa é bastante favorecida devido existir três estruturas de ressonância para o íon arênio formado. Como visto em aulas anteriores, quanto maior o número de estruturas de ressonância um composto apresentar mais estável ele é. Na segunda etapa, a parte negativa do reagente irá remover um hidrogênio do carbono, no qual o eletrófilo se ligou. A segunda etapa é a etapa rápida. 1.1 Reações halogenação de benzenos O benzeno não reage com bromo ou cloro a menos que um ácido de Lewis (FeCl3 ou FeBr3) esteja presente na mistura. Quando ácidos de Lewis estão presentes, o benzeno reage prontamente com bromo ou cloro. Estas reações fornecem bromobenzeno ou clorobenzeno, respectivamente, com bons rendimentos. 1.2 Reações de Nitração do Benzeno O benzendo reage lentamente com o ácido nítrico concentrado a quente para fornecer nitrobenzeno. A adição de H2SO4 é geralmente usado para acelerar a reação Prof. Ms. Zilvam Melo – Química Orgânica 2 Universidade Federal Rural do Semi­Árido – UFERSA 1.3 Reações de Sulfonação do Benzeno O benzeno reage com ácido sulfúrico fumegante à temperatura ambiente para produzir o ácido benzenossulfônico. O ácido sulfúrico fumegante é ácido sulfúrico que contém trióxido de enxofre extra (SO3). A sulfonação também ocorre também ocorre em ácido sulfúrico concentrado sozinho, porém mais lentamente. Em ambos os casos, o eletrófilo é o trióxido de enxofre. Em ácido sulfúrico concentrado, o trióxido de enxofre é produzido em um equilíbrio onde H2SO4. 1.4 Reações de Alquilação de Friedel­Crafts de Benzenos As reações de alquilações são reações que inserem um grupo alquila (uma cadeia carbônica) ao benzeno. Este tipo de reações ficaram conhecidas como reações de Friedel‐Crafts por causa de seus descobridores. 2. O Efeito dos substituintes Sobre Reatividade e Orientação Quando benzenos substituídos sofrem ataque eletrofílico, os grupos já presentes no anel afetam tanto a reatividade (velocidade) quanto a orientação (sítio de ataque eletrofílico). Podemos dividir os dois grupos substituintes em duas classes de acordo com sua influência sobre a reatividade do anel. Aqueles que tornam o anel mais reativo são chamados de grupos ativadores e orientam o ataque na posição orto e para. Grupos ativadores são grupos que “jogam” elétrons para dentro do benzeno por efeito indutivo. Aqueles que tornam o anel menos reativo, são 3 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA chamados grupos desativadores e orientam o ataque na posição meta. Grupos desativadores são grupos que “retiram” elétrons de dentro do anel aromático por efeito indutivo. 2.1 Grupos Ativadores: Orientadores Orto­Para O grupo metila é um grupo ativador e um orientador orto­para. O tolueno reage consideravelmente mais rápido do que o benzeno em todas as reações de substituições eletrofílicas. 2.2 Grupos Desativadores: Orientadores Meta O grupo nitro é um grupo desativador muito forte e, consequentemente, é um orientador meta. Prof. Ms. Zilvam Melo – Química Orgânica 4 Universidade Federal Rural do Semi­Árido – UFERSA Abaixo, temos uma tabela com vários grupos ativadores e desativadores. 3. Referências 1. SOLOMONS, T. W.; GRAHAM; CRAIG FRYHLE. Química Orgânica. 8. ed. Rio de Janeiro: LTC, 2005. 1 e 2 v. 2. BRUICE, P. Y. Química Orgânica. 4. ed. São Paulo: Pearson, 2006 3. ALLINGER, N. L. Química Orgânica. 2. ed. Rio de Janeiro: Guanabara, 1978. Prof. Ms. Zilvam Melo – Química Orgânica 5