Capítulo 8 – Primeira Lei da Termodinâmica
Até o final do século XVIII haviam 2 correntes dominantes: os que acreditavam
que o calor que se transferia de um corpo mais quente para outro mais frio se
fazia através de uma substância chamada calórico (Lavoisier era um deles) e os
que acreditavam que o calor era oriundo das vibrações das moléculas (Newton,
Joule).
Verificou-se que, se existisse o calórico, ele não poderia ter massa, pois dois
corpos quaisquer que trocassem calor não alteravam suas respectivas massas.
Pior ainda, o calórico deveria ser inesgotável, pois o calor à vontade podia ser
gerado por atrito. Em meados do século XIX a ideia do calórico foi abandonada.
Definição: 1 caloria é a quantidade de calor necessária para elevar de
para
um grama de água.
Ainda hoje muitos alimentos e popularmente se comete o erro de classificar
alimentos em calorias quando, na verdade, a unidade desta classificação é
quilocaloria.
Capacidade Térmica C
É a quantidade de calor
corpo qualquer
necessária para aumentar de
a temperatura de um
Vemos que a capacidade térmica é uma grandeza que depende do tamanho do
corpo. Assim se injetarmos, digamos 2000 cal, em 1 kg de água inicialmente a
, elevaremos sua temperatura para
, ao passo que se a massa de água
for de 2 kg sua temperatura elevará para
. Para se evitar dependência com a
massa, define-se o Calor Específico c
Em geral, o calor específico é função da temperatura
. Às vezes, num
certo intervalo de temperatura, podemos considerar o calor especifico constante e
independente da temperatura.
Tanto a capacidade térmica quanto o calor específico dependem de como se
transfere calor para mudar a temperatura de um corpo: a pressão ou volume
constante. Temos então
1
Calorímetro
É um recipiente termicamente isolado que nos permite determinar o calor
específico de uma substância. Seja
e a massa e o calor específico dessa
substância e
sua temperatura. Se colocarmos essa substância dentro de um
calorímetro cuja capacidade térmica seja e esteja cheio de um fluido de massa
, calor específico
e temperatura inicial de equilíbrio . A troca de calor
dentro do calorímetro fornece (
) a temperatura final
Capacidade Térmica Molar
Para um sólido existe a Lei de Dulong-Petit que afirma que todos os sólidos têm
. Esta lei é correta somente para altas temperaturas (por
exemplo, temperatura ambiente
.
Reservatório Térmico
Chamamos de reservatório térmico um sistema tão grande que ao receber ou
perder uma quantidade de calor
sua temperatura permanece inalterada. A
atmosfera é um ótimo exemplo de reservatório térmico.
Transmissão de Calor
1) Por Convecção
O calor flui junto com sistema. Exemplo: corrente ascendente de ar quente
(menos denso) na atmosfera. Na verdade, toda a dificuldade de previsão
do tempo da metereologia se deve ao fato de que grandes correntes de
convecção estão sempre presentes na atmosfera.
2) Por Radiação
Toda radiação eletromagnética transfere calor (mesmo no vácuo, para
sorte da vida no nosso planeta). A absorção da radiação eletromagnética
(que, dependendo do corpo, pode ser maior ou menor em determinadas
frequências de radiação) faz com que as moléculas vibrem e,
consequentemente, aumentem a temperatura do corpo.
2
3) Por Condução
Quando dois sistemas estão em contacto através de uma parede
diatérmica, haverá transmissão de calor por condução. A corrente térmica
será dada pela equação de condução de calor
onde
é condutividade térmica do material (em
,
,
quando usamos um cobertor, o baixo valor de do ar auxilia muito na
manutenção do calor); é área da secção transversal e
o gradiente da
temperatura na direção x.
Exemplo: se supusermos uma barra homogênea de secção A,
comprimento l entre 2 reservatórios térmicos
teremos no regime
estacionário
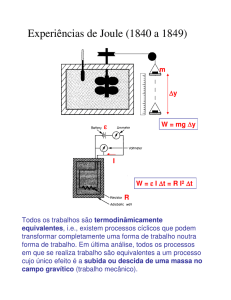
O Equivalente Mecânico da Caloria
1 cal = ? Joules...
Joule realizou a experiência mostrada abaixo e obteve
3
A Primeira Lei da Termodinâmica
Todo e qualquer sistema tem uma função de estado chamada Energia Interna .
Ela é composta por todas as energias de interação entre os componentes do
sistema (sejam eles átomos, moléculas, etc) e todas as suas respectivas energias
cinéticas. Ser uma função de estado significa que se o sistema sai de um estado A
para um estado B, sua energia interna sairá de
para . A determinação de um
estado do sistema é macroscópica, isto é, ela é função de P, V, T, etc.
A primeira Lei da Termodinâmica se expressa pela equação
onde
é a variação infinitesimal da Energia Interna U que variará então
infinitesimalmente entre 2 estados próximos (não depende do caminho);
éa
quantidade de calor infinitesimal – o sinal positivo (negativo) significa que calor
entra (sai) do sistema aumentando (diminuindo) a sua energia interna, a barra
colocada acima do diferencial significa que essa quantidade de calor depende do
caminho que liga os estados inicial e final;
é a quantidade infinitesimal de
trabalho realizado pelo (e não sobre) o sistema – o sinal negativo significa que o
trabalho realizado pelo sistema joga (retira) energia desse sistema diminuindo a
sua energia interna, a barra colocada acima do diferencial significa que essa
quantidade de trabalho depende do caminho que liga os estados inicial e final.
De um ponto de vista puramente matemático,
é um diferencial exato
enquanto que
e
são diferenciais não exatos. É deveras surpreendente que
a diferença de 2 diferenciais não exatos resulte num diferencial exato !
No termo diferencial de trabalho,
, está embutido diferentes formas de
trabalho: mecânico, elétrico, magnético, químico, etc.
A Primeira Lei da Termodinâmica se refere, portanto, a energia – ela se
expressa como um caixa, computando entradas e saídas de diferentes formas de
energia que alteram o valor da sua energia interna.
4
Na figura acima vemos o significado de depender ou não do caminho. Vemos 2
caminhos: 1)
e 2)
. Por qualquer um desses caminhos o valor da
variação da energia interna é exatamente o mesmo:
, mas, como veremos
adiante o trabalho e o calor trocado através dos caminhos 1) e 2) não é o mesmo.
Processos Reversíveis
Um processo reversível é um processo quase-estático no qual todo ponto é um
ponto de equilíbrio termodinâmico. Duas condições são necessárias: 1) o
processo se realiza muito lentamente e 2) o atrito é desprezível
Trabalho mecânico reversível
O trabalho mecânico (reversível) realizado por um gás para deslocar um pistão
de secção transversal A é
Da figura acima no diagrama P x V vemos que o trabalho é a área debaixo da
curva !
Na figura abaixo vemos 2 recipientes: um contenco gás e outro vazio (vácuo). Ao
abrirmos a válvula o gás passará para o recipiente com vácuo e ocupará,
uniformemente, ambos os recipientes.
O trabalho aqui não é reversível e
5
Troca reversível de calor
Um sistema para realizar uma troca reversível de calor deve ser colocado em
contacto com reservatórios que estejam em temperaturas infinititesimalmente
próximas :
.
Em outras palavras, o processo deve ser isotérmico!
Quando temos uma transição de fase, o sistema transiciona com temperatura
constante. Por exemplo, se temos
kg de água a 100 e continuamos a injetar
calor, esse calor será usado para evaporar a água – a temperatura só subirá acima
de 100 depois que toda a água evaporou. Definimos então o Calor Latente de
Vaporização L
para a água
De maneira geral, se um processo termodinâmico é reversível ele será
representado por uma trajetória (curva) em diagramas P x V, P x T, etc. já que
cada ponto do processo é um ponto de equlíbrio, com P, V e T bem definidos.
A 1ª. Lei pode ser escrita
onde o índice
corresponde à forma de troca de calor.
Obs: mesmo quando um sistema evolui de um ponto de equilíbrio A para outro
B, nós podemos fazer cálculos simplesmente conectando os pontos A e B por
qualquer processo reversível.
Exemplos de Processos Termodinâmicos
1) Ciclo
Num processo cíclico o sistema sai de um estado inicial A e chega no mesmo
estado final A, logo
2) Isobárico
Num processo isobárico a pressão permanece constante de modo que se o
volume varia de para
com pressão constante , o trabalho mecânico será
6
3) Adiabático
4) Expansão Livre de um gás
7