54
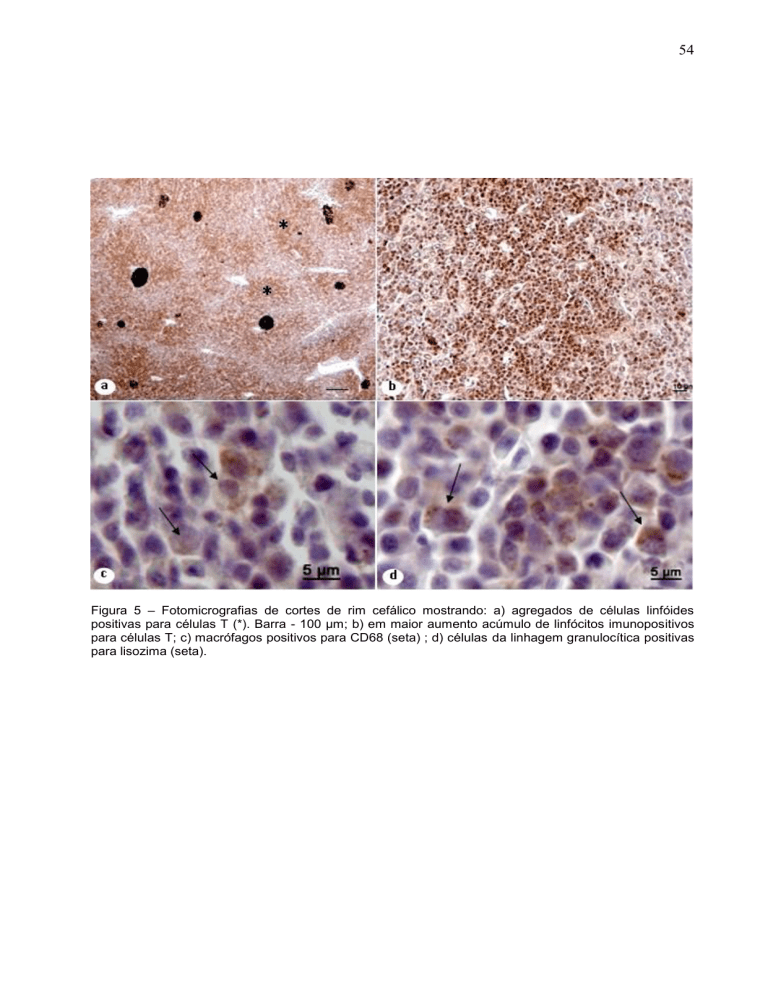
Figura 5 – Fotomicrografias de cortes de rim cefálico mostrando: a) agregados de células linfóides
positivas para células T (*). Barra - 100 µm; b) em maior aumento acúmulo de linfócitos imunopositivos
para células T; c) macrófagos positivos para CD68 (seta) ; d) células da linhagem granulocítica positivas
para lisozima (seta).
55
Figura 6 - Fotomicrografias de decalques de rim cefálico mostrando: a) proeritroblasto
(Pe), eritroblasto basófilo (EB) e eritroblasto policromático (EP); b) eritroblasto
ortocromático (EO) e eritrócitos maduros (Er); c) quatro reticulócitos mostrando precipitado
de cor azul no citoplasma; d) Progranulócito (Gb); e) metagranulócito neutrófilo (MN) e
neutrófilo (Nt); f) prolinfócito (PL) e neutrófilo (Nt); g) linfoblasto (Lb), linfócitos (Lf) e dois
eritrócitos; h) monoblasto (Mb); i) monócito com núcleo reniforme; j) monócito circundado
por sete linfócitos; l,m) tromboblasto (Tb); n) trombócito (Tr). Rosenfeld.
56
Figura 7 – Fotomicrografias de decalques de rim cefálico mostrando: Granulócitos jovens (GJ) e maduros
(GM) positivos para: a) PAS, b) Sudan Black B, c) Mieloperoxidase; d) Fosfatase Ácida positiva em
células das linhagens granulocítica (N), monocítica (M), linfocítca (L) e trombocítica (T); e) Esterase
positiva em células das linhagens granulocítica (N), monocítica (M) e linfocítca (L), f) trombócito (T)
positivo para esterase com fluoreto.
57
Figura 8 – Eletromicrografias de rim cefálico mostrando: a) processos de células mesoteliais (seta);
tecido conjuntivo ({) contendo parte do citoplasma de mastócito (M) repleto de grânulos elétron-densos
(g), fibras nervosas amielínicas (FN); células reticulares do tipo fibroblasto (CRF) e processos celulares
(*) na região subcapsular; b) axônio em maior aumento repleto de neurofilamentos (Nf) e microtúbulos
(Mt); c) parte de uma célula mesotelial evidenciando projeções citoplasmáticas (seta), pinocitose
(cabeça de seta cheia), vesículas pinocíticas (v), grânulos elétron-densos (seta vazia), retículo
endoplasmático rugoso (REG), mitocôndria (m).
58
m
v
CRM
n
Lf
N
*
v
v
a
Figura 9 – Eletromicrografia do rim cefálco mostrando célula reticular do tipo macrófago (CRM)
apresentando núcleo eucromático (N), nucléolo (n) evidente, mitocôndrias (m), vesículas (ponta de
seta), vacúolos (v) e grânulos (seta), linfócito (Lf) apoiado em uma célula reticular do tipo macrófago.
59
Lf
Lf
Lf
Lf
Figura 10 – Eletromicrografias de rim cefálico mostrando: a) cinco linfócitos (Lf) apoiados em um
macrófago (M); b) macrófago (M) com núcleo (N) chanfrado, citoplasma contendo lisossomos (seta) de
tamanhos e densidades variadas, fagolisossomos (*); c) centro melano-macrofágico revestido por uma
cápsula citofibrilar ({), melano-macrófagos com grânulos esféricos compactados no citoplasma, elétrondensos e de tamanhos diferentes.
60
Figura 11 – Eletromicrografias de rim cefálico mostrando: a) proeritroblasto; b) eritroblasto basófilo; c)
eritroblasto policromatófilo; d) eritrobalsto ortocromático; e) eritrócito jovem; f) eritrócito maduro; g)
microtúbulos marginais (seta) de eritrócito maduro.
61
Figura 12 – Eletromicrografias de rim cefálico mostrando: a) três metagranulócito neutrófilo (MN e seta)
contendo grânulos elétron-densos (G); b) neutrófilo contendo grânulos elétron-densos grandes (G) e
pequenos (seta); c) linfócitos com variação morfológica do núcleo e presença de grânulo (seta).
62
Figura 13 – Eletromicrografia de rim cefálico mostrando um plasmócito típico.
63
V
a
Figura 14 – Eletromicrografias de rim cefálico mostrando: a) monoblasto contendo grânulos elétrondensos (seta); b) monócito com núcleo de chanfrado acentuada e citoplasma vacuolizado (V).
V
V
Figura 15 – Eletromicrografias de rim cefálico mostrando: a) tromboblasto evidenciando um vacúolo (V)
desenvolvido e SCCS (seta); b) trombócito mostrando vacúolo (V) e SCCS (seta).
,m
64
4.1.5 Discussão
Estudos recentes mostram considerável interesse em pesquisar os diferentes
aspectos do RC em peixes teleósteos, especialmente aqueles relacionados com a
estrutura e os aspectos morfo-citoquímicos, histoquímicos, imunohistoquímicos e ultraestruturais de seus componentes estromais e celulares (Romano et al. 2002; PetrieHanson & Peterman, 2005; Fischer & Koellner 2007). Apesar disso, os estudos
disponíveis na literatura que abordam estes aspectos ainda são incompletos (Smith et
al. 1970; Zapata, 1983; Tatner & Manning, 1985; Zuasti & Ferrer, 1989; Meseguer et al.
1995; Fijan, 2002; Romano et al. 2002; Petrie-Hanson & Peterman, 2005; Fischer &
Koellner 2007). Os nossos resultados permitem caracterizar a estrutura anatômica, os
constituintes citofibrilares do estroma, as células das séries eritrocítica, granulocítica,
linfocítica, monocítica e trombocítica e a distribuição topográfica dos leucócitos no RC
em C. parallelus.
A localização anatômica do RC em C. parallelus é semelhante àquela observada
em todas as demais espécies de peixes teleósteos (Romano et al. 1997, Press & Even
1999). No entanto, a estrutura anatômica do RC com divisão em duas porções, isto é,
bilateral observado em C. parallelus, bem como na maioria dos peixes, difere daquela
dos salmonídeos, que apresentam o rim como um único órgão (Press & Evensen
1999).
Histologicamente, o RC de C. parallelus apresenta uma delgada cápsula de
tecido conjuntivo constituído por fibras de colágeno I e III coradas pelos métodos de
Tricrômio de N.M.C e Gomori respectivamente (Castro & Camargo, 1951; Gomori,
1936). Estes métodos seletivos para colágeno demonstram também que o estroma
deste órgão é constituído por uma fina trama de fibras reticulares onde um elevado
número de células do parênquima é sustentado, formando um verdadeiro tecido
hematopoiético. Esta trama fibrilar parece ser comum no RC de todos os teleósteos e
presente também em outros tipos de órgãos com função hematopoiética encontrados
em condrictes (Sailendri & Muthukkaryppan 1975; Sorensen et al 1997; Pacheco et al.
2002).
Já em relação ao aspecto estrutural do parênquima do RC de C. parallelus, foi
possível evidenciar agregados de células linfóides pequenas, concentrados ao redor
dos vasos sangüíneos e dos CMMs, também observado em outras espécies de peixes
65
(Agius, 1980; Press et al. 1994; Romano et al. 1997). No entanto, informações sobre a
identificação e caracterização de sub populações desses linfócitos nestes agregados,
especialmente para linfócitos T ainda são limitadas (Press et al. 1994; Romano et al.
1997; Fournier-Betz et al. 2000; Romano et al. 2007). Os nossos resultados
imunohistoquímicos permitem identificar populações de linfócitos T imunopositivos para
o antígeno CDRO45 nos agregados linfóides, em disposição nodular. Além do mais
foram observados populações de linfócitos imunonegativos, indicando possivelmente a
presença também de linfócitos B. Entre as células que constituem esses agregados e
que circundam os mesmos, foram observados macrófagos, monócitos e seus
precursores com forte imunopositividade para CD68 e células da linhagem
granulocítica em diversas fases de maturação, positivas para lisozima e PAS. O arranjo
estrutural entre o sistema vascular e os CMMs, rodeados por agregados linfóides com
presença de células monócitos/macrófagos e granulócitos, reforça o significado
imunológico deste órgão, relacionado à resposta imune inata, apresentação de
antígenos, memória imunológica e produção de anticorpos (Lamers & Haas 1985;
Imagawa et al. 1990; Press et al. 1996; Kollner et al. 2001). Por outro lado, estes
anticorpos monoclonais poderão ser utilizados em pesquisas relacionadas a questões
básicas que permanecem ainda sem respostas tais como ao local de origem das
linhagens dos monócitos, granulócitos e linfócitos (cells B e T) e o período em que
estas células se tornam imunocompetentes.
Acredita-se que o RC em peixe teleósteo é equivalente a medula óssea de
mamíferos (Sailendri & Muthukkaruppan, 1975; Fanger, 1982; Mesenguer et al. 1995;
Petrie-Hanson e Ainswortho 2000) e os nossos resultados morfo-citoquímicos obtidos
na análise de decalques confirmam este fato ao demonstrar a presença de células das
séries eritrocítica, granulocítica, monocítica, linfocítica e trombocítica neste órgão. Os
critérios utilizados neste estudo para caracterizar as fases de maturação celular foram
baseados nos aspectos morfológicos e nas propriedades tintoriais e citoquímicas,
conforme descritos por Fijan (2002). De modo geral os estágios de maturação das
linhagens celulares observados neste estudo correspondem àqueles descritos em
várias espécies de peixes (Mahajan & Dheer 1980; Maiti et al. 2000; Fijan, 2002). No
entanto, vale ressaltar que os resultados morfo-citoquímicos revelam que em relação à
série granulocítica foi observado fases de diferenciação de apenas um único tipo de
granulócito no RC de C. parallelus, correspondente ao neutrófilo.
66
Ao MET, o RC de C. parallelus, mostrou-se constituído por tecidos
hematopoiético, linfóide e endócrino, semelhante àqueles observados por Roberts,
1989; Imagawa et al. 1996. A ausência de túbulos renais no RC em C parallelus, assim
com em outros teleósteos (Weinreb, 1963; Cannon et al. 1980; Zuasti & Ferrer, 1988),
reflete a origem pronéfrica do RC, no qual se formam os primeiros túbulos durante a
ontogenia e regridem quando o rim médio e caudal assume a função de órgão excretor
(Zapata, 1979; Imagawa, 1994).
O presente estudo descreve pela primeira vez em peixe teleósteo, as
características ultra-estruturais da cápsula e sua inter-relação com as células
reticulares subcapsulares do RC em peixe. Assim, a cápsula mostra-se constituída por
uma delgada camada de tecido conjuntivo revestido por uma camada de células
mesotelias. As características ultra-estruturais das células mesoteliais sugerem um
processo ativo de transcitose associado com alta permeabilidade para solutos.
A rede citofibrilar estromal do RC de C. parallelus é composta por células
endoteliais, células reticulares (do tipo fibroblasto e do tipo macrófago), macrófagos,
MMs e fibras reticulares. As células endoteliais e uma camada externa de células
reticulares, formam assim um limite entre o tecido hematopoiético e o sangue, além do
mais existem extensas áreas de contato entre as células endoteliais ou reticulares com
as células hematopoiéticas, semelhante àquela descrita em outros teleósteos
(Meseguer et al. 1991; Imagawa et al. 1994) e àquela do padrão do estroma
hematopoiético de mamíferos (Weiss & Sakai 1984). Os dois tipos de células
reticulares encontradas neste estudo apresentam características ultra-estruturais
semelhantes àquelas observadas em outros peixes (Meseguer et al. 1995) e mamíferos
(Bainton, 1985). Na região subcapular, observa-se uma camada de células reticulares
do tipo fibroblasto. A partir desta região as mesmas se distribuem em toda extensão do
tecido hematopoiético, associadas as células reticulares do tipo macrófago, formando
uma rede de sustentação mecânica das células hemtopoiéticas. Além do mais, as
células reticulares do tipo fibroblasto apresentam características ultra-estruturais típicas
de células que sintetizam colágeno. Já as células reticulares do tipo macrófago
apresentam características que lhes permitem exercer função associada a remoção de
partículas e células senescentes, conforme descrito previamente por Zapata 1983,
Mesenguer et al. 1995. Diante destas observações é possível admitir que ambas as
células reticulares possam contribuir decisivamente na formação de um microambiente
hematopoiético adequado no RC de C. parallelus.
67
O RC em peixes teleósteos parece ser a principal fonte de produção de
macrófagos (Braun-Nesje et al. 1981). No RC de C. parallelus foram identificados tanto
monócitos quanto macrófagos ao redor dos CMMs. A presença destes fagócitos ao
redor destes centros e sua atividade de fagocitose de partículas também foram
descritas por Press & Evensen 1999; Romano et al. 2002. Além do mais, foi observada
a presença de vários linfócitos ao redor de CMMs e também intimamente associados a
um único macrófago. Esta relação célula-célula reforça novamente a hipótese de que
realmente tanto os macrófagos quanto os CMMs participam como células
apresentadoras de antígenos (Lamaers & Haas 1985, Press & Evensen 1999).
As
observações
realizadas
ao
microscópio
eletrônico
do
parênquima
hematopoiético do RC de C. parallelus permitiram caracterizar diversos estágios de
maturação em todas as linhagens celulares: eritropoiese, granulopoiese, linfopoiese,
monopoiese e trombopoiese, fases também observadas ao microscópio de luz. Este
tipo de estudo que integra os aspectos morfo-citoquímicos e ultra-estruturais, permite
caracterizar de forma inequívoca as linhagens celulares do tecido hematopoiético, de
difícil diferenciação especialmente entre as linhagens dos linfócitos e trombócitos
(Rowley et al. 1988) e dos neutrófilos e monócitos (Weinreb 1963; Cannon et al., 1980).
As mudanças ultra-estruturais básicas observadas durante a maturação das
células da série eritropoiética em C parallelus foram descritas também em outras
espécies de peixes (Yammamoto & Iuchi 1975; Zapata, 1980; Fanger, 1986; Zuasti et
al. 1989). No entanto, a presença de bandas de microtúbulos marginais identicadas no
citoplasma de eritrócitos em C parallelus não foram observadas em Sparus auratus
(Zuasti et al. 1989).
Quanto à granulopoiese, foi possível identificar no RC de C parallelus apenas as
fases de maturação do neutrófilo. A presença de uma única série de células
granulocíticas no RC não é uma característica comum em peixes teleósteos, com
exceção de alguns peixes que apresentam uma ou duas séries de células
granulocíticas (Cannon et al. 1980; Savage, 1983; Hightower et al., 1984) a grande
maioria dos teleósteos apresentam três séries (Fey, 1966; Zapata, 1979; Fanger, 1986;
Zuasti et al. 1988; Messeguer et al. 1990; Romano et al. 2002).
Existe uma grande controvérsia em relação a existência de um ou dois tipos de
grânulos no citoplasma dos granulócitos em teleósteo, especialmente do granulócito
neutrófilo (Fey, 1966; Cannon et al. 1980; Zuasti & Ferrer, 1988; Messeguer et al.
1990). No presente estudo foram observados dois tipos de grânulos citoplasmáticos
68
identificados em momentos diferentes nas fases de maturação celular, ou seja, o
grânulo de aspecto esférico, elétron-denso com a região central elétron-lúcida foi
observado primeiro na fase progranulócito, enquanto que o grânulo de aspecto
esférico, pequeno, comparativamente dezenas de vezes menor foi observado somente
nas fases de metagranulócito neutrófilo e neutrófilo maduro. Estas observações são
compatíveis com as descrições realizadas em outros peixes teleósteos (Cannon et al.
1980; Savage, 1983). Por outro lado, Zuasti & Ferrer, 1988 observaram apenas um
único tipo de grânulo em heterófilo de Sparus auratus. Bielek (1981) relata que um tipo
de
grânulo
citoplasmático
morfologicamente
homogêneo
pode
apresentar
características citoquímicas diferentes.
Em relação às células da série linfóide em C parallelus, foram identificadas apenas
duas fases de maturação celular, semelhantes àquelas observadas em outras espécies
de peixes (Savege, 1983; Zuasti & Ferrer 1989). Além do mais, alguns linfócitos
observados no RC de C. parallelus apresentam grânulos citoplasmáticos, enquanto
aqueles observados em Sparus auratos, Pleuronectes platessa, Fundulus heteroclitus
não apresentaram grânulos (Ferfuson, 1976; Hightonwer et al., 1984; Zuasti & Ferrer,
1989). Observou-se ainda a presença de plasmócitos no RC de C. parallelus com
características estruturais semelhantes àquelas de plasmócitos de vertebrados
ectotérmicos (Campbell, 1970; Zapata & Solas 1979; Zapata, 1980; Kilarsky & Plytycz
1981;). A dilatação acentuada da cisterna do reticulo endoplasmático rugoso é uma das
características mais importante desta célula. A presença desta célula no RC de C.
parallelus reforça a idéia de que o RC em teleósteos representa um sítio de
proliferação de linfócitos B (Romano et al., 1997) e de produção de imunoglobulina
(Chiller et al., 1969; Smith et al. 1970).
A literatura consultada apresenta relatos incompletos sobre os aspectos ultraestruturais da série monocítica no RC de peixes teleósteos (Zuasti & Ferrer 1989;
Messeguer et al. 1991; Romano et al. 2002). Estes estudos descrevem unicamente a
presença de monócitos no RC deste animal, sem relatar a presença de monoblastos.
No entanto, no presente estudo foi possível identificar tanto monoblastos quanto
monócitos no RC de C. parallelus.
Quanto à trombopoiese em C. parallelus verificou-se que durante a maturação
celular ocorre um aumento da condensação nuclear e do desenvolvimento do SCCS,
semelhante as observações realizadas por Zapata, 1980; Esteban et al. 1989 e Zuasti
et al. 1989.
69
4.1.6 Conclusão
Os resultados obtidos no presente estudo demonstram que o RC de C.
parallelus é um órgão fundamentalmente hematopoiético (eritropoiese, granulopoiese,
linfopoiese, monocitopoiese e trombopoiese), com características morfo-citoquímicas e
ultra-estruturais semelhantes àquelas observadas na medula óssea de mamíferos; as
reações imunohistoquímicas podem ser utilizadas para identificar e caracterizar a
distribuição topográfica das células das linhagens granulocítica, monocítica e de
linfócitos em tecidos linfóides e hematopoiéticos em peixes teleósteos.
4.1.7 Agradecimentos
Esta pesquisa foi financiada pelo Conselho Nacional de Desenvolvimento
Científico e Tecnológico (CNPq) do Ministério da Educação, Ciência e Cultura, Brasil.
4.1.8 Referências Bibliográficas
Ackerman, G. A. (1962). Substituted naftol AS phosphate derivatives for the localization of
leukocyte alkaline phosphatase activity. Laboratory Investigation 11 (7), 563-567.
Abelli, L, Picchietti, S., Romano, N., Mastrolia, L. & Scapigliati, G. (1996).
Immunocytochemical detection of thymocyte antigenic determinants in developing
lymphoid organs of sea bass Dicentrarchus labrax (L.). Fish Shellfish Immunology 6, 493–
505.
Agius, C. (1980) Phylogenetic development of melano-macrophage centres in fish. Journal
of Zoology, London 191, 11-31.
Bainton, D. F. (1985). Bone marrow stromal cells, fibroblasts and macrophages. In: (ed. by)
Van Furth R.: Mononuclear phagocytes. Characteristics, Physiology and function. Martinus
Nijhoff, Dordretch, p 125-13.
Barber, D. L. & Westermann, J. E. M. (1981). The blood cells of the Antarctic icefish
Chaenocephalus aceratus Lonnberg: light and electron microscopic observations. Journal
of Fish Biology 19, 11-28.
70
Barka, T. & Anderson, T. J. (1962). Histochemical methods for acid phosphatase using
hexazonium parararosanilin as couple. Journal of Histochemistry and Cytochemistry 10,
741.
Bayne, C. J. (1986). Pronephric leucocytes of Cyprinus carpio: isolation, separation and
characterization. Veterinary Immunology and Immunopathology 12, 141-151.
Bielek, E. (1981). Developmental stages and localization of peroxidatic activity in the
leukocytes of three teleost species (Cyprinus carpio L., Tinca tinca L., Salmo gairdneri
Richardson). Cell and Tissue Research 220, 163-180.
Botham, J.W. & Manning, M. J. (1981). The histogenesis of the lymphoid organs in the carp
Cyprinus carpio L. and ontogenetic development of allograft reactivy. Journal of Fish
Biology 19, 403-414.
Braun-Nesje, R., Bertheussen, K., Kaplan, G. & Seljelid, R. (1981). Salmonid
macrophages: separation, “in vitro” culture and characterization. Journal of Fish Diseases
4, 141-151.
Cannon, M. S., Mollenhauer, H. H., Eurell, T.E,, Lewis, D. H., Cannon, A. M. & Tompkins,
C. (1980). An ultrastructural study of the leucocytes of the channel catfish, Ictalurus
punctatus. Journal of Morphology 164, 1-24.
Castro, N. M. & Camargo, J. S. (1951). Coloração policrômica de cortes histológicos. Anais
da Faculdade de Farmácia e Odontologia da Universidade de São Paulo 9, 211-215.
Chiller, J. M., Hodgins, H. O. & Weiser, R. S. (1969). Antibody response in rainbow trout
(Salmo gairdneri) II. Studies on the kinetics of development of antibody-producing cells and
on complement and natural hemolysin. Journal of Immunology 102 (5), 1202-1207.
Daimon T., Mizuhira. V., Takahashi, I. & Uchida, K. (1979). The surface connected
canalicular system of carp (Cyprinus carpio) thrombocytes: its fine structure and three
dimensional architecture. Cell and Tissue Research 203, 355-365.
Esteban, M. A., Meseguer, J., Garcia, A. A. & Agulleiro, B. (1989). Erythropoiesis and
Thrombopoiesis in the Head-Kidney of the sea bass (Dicentrarchus labrax L.): An
Ultrastructural Study. Archives of Histology Cytology 52, 407-419.
Fanger, R. (1982). A comparative study of lymphomieloid tissue in fish. Developmental of
Comparative Immunology 2, 23-33.
Fanger, R. & Nilsson, S. (1985). The fish spleen: structure and function. Experientia 41,
152-158.
Ferguson, H.W. (1976). The ultrastructure of plaice (Pleuronectes platessa) leucocytes.
Journal of Fish Biology 8, 139-142.
71
Fijan, N. (2002). Morfphogenesis of blood cell lineages in channel catfish. Journal of Fish
Biology 60, 999-1014.
Fischer, U. & Koellner, B. (2007). Cross-reactivity of human leukocyte differentiation
antigen monoclonal antibodies on carp and rainbow trout cells. Veterinary Immunology and
Immunopathology 119, 142–155.
Fischer, U., Utke, K., Somamoto, T., Köllner, B., Ototake, M. & Nakanishi, T. (2006).
Cytotoxic activities of fish leucocytes. Fish and Shellfish Immunology 20, 209–226.
Gomori, G. (1936). Microtechnical demonstration of iron. American Journal of Pathology
12, 655-663.
Hattori, A. J., Tokinaga, T., Fujita, T. & Natsuoka, M. (1969). Scanning electron microscopic
observations on human blood platelets and their alterations induced by trhrombin. Archives
of Histology and Cytology 31, 37-54.
Hightower, J. A., Mccumber, L. .J, Welsh, M. G., Whatley, D. S., Hartvigsen, R.E. & Sigel,
M. M. (1984). Blood cells of Fundulus heteroclitus (L.). Journal of Fish Biology 24, 587-598.
Imagawa, T., Kitagawa, H. & Uehara, M. (1994). Ultrastructure of blood vessels in the head
kidney of the carp, Cyprinus carpio. Journal of Anatomy 185, 521-528.
Imagawa, T., Kitagawa, H. & Uehara, M. (1996). The innervation of the chromaffin cells in
the head kidney of the carp, Cyprinus carpio, regional differences of the connections
between nerve endings and chromaffin cells. Journal of Anatomy 188, 149-156.
Karnovsky, M. J. (1965). A formaldehyde glutaraldehyde fixative of high osmolabilidade for
use in electron microscopy. Journal of Cell Biology 27, 137-8.
Köllner, B., Blohm, U., Kotterba, G. & Fischer, U, (2001). A monoclonal antibody
recognising a surface marker on rainbow trout (Oncorhynchus mykiss) monocytes. Fish
and Shellfish Immunology 11, 127–142.
Köllner, B., Fischer, U., Rombout, J. H. W. M., Taverne-Thiele, J. J. & Hansen, J. D. (2004).
Potential involvement of rainbow trout thrombocytes in immune functions: a study using a
panel of monoclonal antibodies and RT-PCR. Developmental of Comparative Immunology
28, 1049–1062.
Kuroda, A., Okamoto, N. & Fukuda, H. (2000). Characterization of monoclonal antibodies
against antigens shared with neutrophils and macrophages rainbow trout Oncorhynchus
mykiss. Fish Pathology 35, 205–213.
Lamers, C. H. J. & Haas, M. J. H. (1985). Antingen localization in the lymphoid organs of
carp (Cyprinus carpio). Cell and Tissue Research 242, 491-498.
72
Lison, L. (1960). Lipides et lipoproteines. In: LISON, L. Histochimie et cytochimie animales.
Principes et méthodes. Paris, Gauthier- Villares V. 2, p. 449-530.
Mahajan, C. L. & Dheer, J. M. S. (1980). An autoradiographic and cytochemical study of
erytropoiesis in a fresh water fish, Channa punctatus Bloch. Journal of Fish Biology 17,
641-648.
Maiti, M., Saha, S. K., Homechaudhuri, S. & Banerjee, S. (2000). Characterization of
erythropoietic cells in Oreochromis nilloticus (L) and Cirrhinus mrigala (Ham). Journal of
Aquatic Tropical 15 (1), 81-90.
McCumber, L. J. M. C., Sigel, M. M., Trauger, R. J. & Cuchens, M. A. (1982). RES
structure and function of the fish. In: The reticulo-endothelial system, phylogeny and
ontogeny, Cambrigde: Cambridge University Press, p. 293-422.
McManus, J. F. A. (1946). Histological demonstration of mucin after periodic acid. Nature,
158, 202.
Meseguer, J., Esteban, M.A. & Agulleiro, B. (1991). Stromal cells, macrophages and
lymphoid cells in the head-kidney of sea bass (Dicentrarchus labrax L.). An Ultrastructural
study. Archives Histology and Cytology 54, 299-309.
Meseguer, J., Lopez-Ruiz, A. & AYala-Garcia, A. (1995). Reticulo-endothelial stroma of the
head-kidney form the seawater teleost gilthead seabream (Sparus aurata L.): An
ultrastructural and cytochemical study. Anatomical Record 241, 303-309.
Meseguer, J. M. A., Esteban, A., Garcia, A. A., Lopez, R. & Agulleiro, B. (1990).
Granulopoiesis in the head-kidney of the sea bass (Dicentrarchus labrax L.): An
ultrastructural study. Archives Histology and Cytology 53, 287- 296.
Miller, N. W., Bly, J.E., van Ginkel, F., Ellsaesser, C.F. & Clem, L.W. (1987). Phylogeny of
lymphocyte
heterogeneity:
identification
and
separation
of
functionally
distinct
subpopulations of channel catfish lymphocytes with monoclonal antibodies. Developmental
of Comparative Immunology 11, 739–747.
Mohammad, M.G., Chilmonczyk, S., Birch, D., Aladaileh, S., Raftos, D. & Joss, J. (2007).
Anatomy and cytology of the thymus in juvenile Australian lungfish, Neoceratodus forsteri.
Journal of Anatomy 211, 784-797.
Pacheco, F. J., Pacheco, S. O. S., Segreto, H. R C, Segreto ,R. A., Silva, M. R. R. (2002).
Development of granulocytes in haematopoietic tissues of Rhizoprionodon lalandii. Journal
of Fish Biology 61, 888-898.
Patrona, L. D. (1984). Contribution à la biologie du robalo Centropomus parallelus (Pisces,
Centropomidae) du su estude Brésil: possibilités aquacoles. Tese (Doutorado em
73
“Sciences et Techniques en Production Animale”) - L’ Institut National Polythechnique,
Tolouse.
Pearse, A. G. E. (1968). Histochemistry: Theoretical and applied. Churchill-Livingstone,
Edinburgh London.
Petrie-Hanson, L & Ainsworth, A. J. (2000). Differencial cytochemical staing characteristics
of channel catfish leucocytes identify cell population in lymphoid organs. Veterinary and
Immunology Immunopathology 73, 129-144.
Petrie-Hanson, L. & Peterman, A. E. (2006). American paddlefish leuckocytes demonstrate
mammalian-like cytochemical staining characteristics in lymphoid tissues. Journal of Fish
Biology 66, 1101-1115.
Press, C. M. L. & Evensen, O. (1999). The morphology of the immune system in teleost
fish. Fish and Shellfish Immunology 9, 309-318.
Press, C. M., Dannevig, B.H. & Landsverk, T. (1994). Immune and enzyme histochemical
phenotypes of lymphoid and nonlymphoid cells within the spleen and head kidney of
Atlantic salmon (Salmo salar L). Fish and Shellfish Immunology 4, 79-93.
Press, C. M., Evensen, O., Reitan, L. J. & Landsverk ,T. (1996). Retention of furunculosis
vaccine components in Atlantic salmon Salmo salar L., following different routes of
administration. Journal of Fish Diseases 19, 215-224.
Razquin, B. E., Castillo, A., Lópes-Fierro, P., Alvarez, F., Zapata, A. & Villena, A. J. (1990).
Ontogeny of IgM-producing cells in the lymphoid organs of rainbow trout, Salmo gairdneri
Richardson: an immuno- and enzyme-histochemical study. Journal of Fish Biology 36
(2), 159-173.
Reynolds, E. S. (1963). Use of lead citrate at hight pH as an electron-opaque stain in
electron microscopy. Journal of Cell Biology 17, 208-13.
Rivas, L. R. (1986). Systematic review of the perciform fishes of the genus Centropomus.
Copeia, Lawrence 3, pp. 579-61
Roberts, R. J. (1989). The anatomy and physiology of teleost. In Fish Pathology, 2nd edn,
pp. 13-55. London: Bailliere Tindall.
Romano, N., Baldassini, M. R., Terribili, F. R., Abelli, L., Mastrolia, L. & Mazzini, M, (1997),
Histological observations on lymphoid organs of the Antarctic fish Trematomus bernacchii
(Teleostei: Nototheniidae). Polar Biology 18, 358–362.
Romano, N., Ceccariglia, S., Mastrolia, L. & Mazzini, M, (2002). Cytology of lymphomyeloid
head kidney of Antarctic fishes Trematomus bernacchii (Nototheniidae) and Chionodraco
hamatus (Channicthyidae). Tissue and Cell 34 (2), 63-72.
74
Romano, N., Rossi, F., Abelli, L., Caccia , L. & Piergentili, R. (2007) Majority of TcRβ+ Tlymphocytes located in thymus and midgut of the bony fish, Dicentrarchus labrax (L.). Cell
and Tissue Research 329:479–489.
Rowley, A. F., Hunt, T. C., Page, M. & Mainwaring, G. (1988). Fish In: (ed. by) Rowley, A.
F. & Ratcliffe, N. A.: Vertebrate blood cells. Cambridge University Press, Cambridge, p. 19127.
Sailendri, K. & Muthukkaruppan, V. R. (1975). Morphology of lymphoid organs in a cichlid
teleost, Tilapia mossambica (Peters). Journal of Morphology 147, 109-122.
Sayed, N. K. & Safer, A. M. (1992). Renal haemopoietic tissue of the mudaskipper
Periophthalmus koelreuteri (Pallas). Journal of Morphology 213, 173-178.
Smith, A. M., Wivel, N. A. & Potter, M. (1970). Plasmacytopoiesis in the pronephros of the
carp (Cyprinus carpio L.). Anatomical Record 167, 351-370.
Sorensen, K. K., Sveinbjornsson, B., Dalmo, R. A., Smedsrod, B. & Bertheussen, K.
(1997). Isolation, cultivation and characterization of head kidney macrophages from Atlantic
cod, Gadus morhua L. Journal of Fish Diseases 20, 93-107.
Tatner, M. F. & Manning, M. J. (1985). The ontogenetic development of the reticuloendothelial system in the rainbow trout, Salmo gairdneri Richardson. Journal of Fish
Diseases 8, 35-41.
Weinreb, E. L. (1963) .Studies on the fine structure of teleost blood cells. I. Peripheral
blood. Anatomical Record 147, 219-238.
Weiss, L,. & Sakai, H. (1984). The hematopoietic stroma. American Journal of Anatomy
170, 447-463.
Yamamoto, M. & Iuchi, I. (1976). Electron microscopic study of erythrocytes in developing
rainbow, Salmo gairdneri irideus, with particular reference to changes in the cell line.
Journal of Experimental Zoology 191, 407-426.
Zapata, A. (1980). Splenic erytropoiesis and thrombopoiesis in elasmobranchs: an
ultrastructural study. Acta Zoology 61, 59-60.
Zapata, A. (1981). Lymphoid organs of teleost fish. II. Ultrastructure of renal lymphoid
tissue of Rutilus rutilus and Gobio gobio. Developmental of Comparative Immunology 5,
685-690.
Zapata, A. (1983). Phylogeny of the fish immune system. Bulletin de I’Institut Pasteur 81,
165-186.
Zuasti, A. & Ferrer, C, (1988), Granulopoiesis in the head kidney of Sparus auratus.
Archives of Histology and Cytology 51, 425-531.
75
Zuasti, A. & Ferrer, C. (1989). Haematopoiesis in the head kidney of Sparus auratus.
Archives of Histology and Cytology 52, 249-255.
76
4.2 Versão Original do Artigo “Parâmetros hematológicos e atividade fagocítica
em robalo (Centropomus parallelus): variação sazonal, sexo e maturação
gonadal” Aceito pela revista “Aquaculture” (vide anexo 3)
Hematological parameters and phagocytic activity in fat snook (Centropomus
parallelus): seasonal variation, sex and gonadal maturation
Antenor Aguiar Santosa,*,**, Maria José T. Ranzani-Paivac, Yara Julianod, Mizue I.
Egamib*
a
UNIFESP/EPM, SP, Brazil; Morphology Department and Laboratory of Environmental
Impact and Histopathology –Adventist University Center of São Paulo – UNASP, Brazil
b
Morphology Department – Histology Division and Comparative Hematology Laboratory
- UNIFESP-EPM, SP, Brazil
c
Fishery Institute, Av. Francisco Matarazzo, 455 CEP 05001-900, São Paulo, SP, Brazil
d
*
School of Medicine of Sto Amaro – UNISA.
Federal University of São Paulo – Paulista School of Medicine, Brazil – mail code:
04023-4000
**Author to whom correspondence should be addressed. Tel.: +55-11-58165630; fax:
+55-11-55764268; e-mail: [email protected]
77
4.2.1 Resumo
O objetivo deste trabalho foi estabelecer os valores hematológicos e avaliar a
capacidade fagocítica de macrófagos peritoneais do robalo relacionando sexo, estádio
de maturação gonadal e ciclo sazonal. Os resultados hematológicos não mostraram
diferenças significantes entre machos e fêmeas. Quanto ao estádio de maturação
gonadal, verificou-se que somente os valores de eritrócitos (Er), em fêmeas, se
mostraram significantemente elevados no estádio III (em maturação) e diminuídos no
estádio V (esgotado). A análise dos resultados da série eritrocítica, leucocítica,
trombócitos e atividade fagocítica relacionada ao sexo e ao ciclo sazonal mostrou
diferenças
estatisticamente
significantes:
a)
em
machos
hematócrito
(Ht)
e
hemoblobina (Hb) elevados na primavera e baixos no inverno; b) em ambos os sexos o
volume corpuscular médio (VCM) altos na primavera e verão e baixos no outono; c) em
fêmeas, trombócitos elevados no outono e baixos nas demais estações; d) em ambos
os sexos capacidade fagocítica (CF) e índice fagocítico (IF) elevados no verão e baixos
no inverno. Os resultados mostraram que a primavera e verão correspondem às
estações do ano de melhor resposta hematológica e fagocítica para a sobrevivência do
robalo em seu habitat natural. Os parâmetros estudados poderão ser utilizados, para a
manutenção e controle desta espécie na criação em cativeiro.
78
4.2.2 Introdução
Dentre as inúmeras espécies de peixes marinhos nativas do Brasil uma das que
se destaca é a do robalo Centropomus parallelus, pelo seu grande interesse comercial
e elevado consumo como fonte alimentar. Além do mais, essa espécie apresenta
muitos aspectos biológicos favoráveis à aqüicultura: é um peixe euriahalino, estuarinodependente, tem hábitos gregários, é tolerante a altas densidades, resistente a água
eutrofizada, crescimento rápido, eficiente na conversão alimentar em biomassa e
resistente a doenças (Tucker, 1998; Cerqueira and Tsuzuki 2009).
C parallelus
pertence à família Centropomidae, sendo encontrada desde a Flórida até a Argentina,
nas Américas Tropical e Subtropical, incluindo o Leste da América Central, ou seja,
Caribe, Cuba e Porto Rico (Patrona, 1984; Rivas, 1986; Muhlia-Melo, 1995). Estudos
relacionados aos hábitos alimentares, à biologia reprodutiva e ao desenvolvimento ou
cultivo desse animal, vem sendo conduzido em várias regiões tropicais e subtropicais
(Temple et al., 2004; Alves et al., 2006; Tsuzuki et al., 2007). Apesar dessa espécie
apresentar grande potencial que permite a criação em cativeiro, ainda faltam dados que
aportem os conhecimentos biológicos básicos necessários ao seu cultivo ideal. Por
exemplo, não foram encontrados estudos relacionados aos aspectos hematológicos,
aos mecanismos de resistência natural bem como do sistema imune, particularmente
quando relacionados às variações sazonais.
Sabe-se que em peixes as variações sazonais desafiam os mecanismos
próprios de sobrevivência ou de aclimatação principalmente no inverno, quando a
resposta imune específica destes animais sofre supressão e como conseqüência esses
animais se tornam amplamente susceptíveis a patógenos oportunistas (Mann and
Huang 2000). Por exemplo, o pargo, Sparus aurata, quando criado ao longo da costa
do Mediterrâneo, foi acometido por uma condição patológica conhecida como “doença
do inverno” ou “síndrome do inverno”, caracterizada por provocar lesão significante
durante as estações frias (Tort et al., 1998). Os Centropomidae, quando expostos a
temperaturas inferiores a 14oC deixam de se alimentar, perdem o equilíbrio e morrem
(Hawells nd SansKi 1990). Nesse sentido o conhecimento das respostas hematológicas
e imunológicas ao longo das estações sazonais poderia contribuir na avaliação da
resistência contra doenças infecciosas, principalmente em épocas frias e com isso
possibilitar, provavelmente, o aumento da taxa de sobrevivência e diminuir o período e
o custo necessário para o cultivo (Hart and Purser, 1996; Le Morvan, Troutaud and