CIÊNCIAS – QUÍMICA
Nome ___________________________________________________________ No ______ 9o Ano _____
LISTA – RECUPERAÇÃO – QUÍMICA
1. Preencha as lacunas da seguinte tabela:
2. O átomo de telúrio (Te) possui 52 elétrons e 75 nêutrons. Determine:
a) seu número atômico;
b) número de massa;
c) número de elétrons da camada de valência;
d) a representação do íon formado para o elemento adquirir estabilidade.
30
30
30
30
29
3. (ITA-SP) Dados os elementos 15I , 18II , 13III , 15IV , 18V
que:
a) I e IV são isótopos; II e V são isóbaros; III e IV são isótonos.
b) IV e VI são isótopos; I, II e III são isóbaros; V e VI são isótonos.
c) I, II e III são isótopos; III e V são isóbaros; IV e VI são isótonos.
d) II e VI são isótopos; I e IV são isóbaros; III e VI são isótonos.
e) II e V são isótopos; III e IV são isóbaros; III e VI são isótonos.
,
31
14VI ,
podemos afirmar
4. Alguns elementos apresentam, no seu estado fundamental e no seu nível mais energético, a
x
distribuição eletrônica np . Dentre os elementos abaixo, o que apresenta o maior valor de “x”
é:
a) 13Al.
b) 14Si.
c) 34Se
d) 15P.
e) 35Br.
5. Complete a frase:
Na atual tabela periódica, os elementos estão dispostos em ORDEM CRESCENTE de
.........................................; cada fila VERTICAL recebe o nome de .................................... e
cada fila HORIZONTAL é denominada de .......................................
1
6. Observando a tabela periódica, classifique os seguintes elementos: Ar, Hg, He, Br, N, Sb, Ga,
P, As, Zn e Th.
a) METAIS:.............................................................
b) NÃO METAIS:.....................................................
c) GASES NOBRES...............................................
7. (CESGRANRIO) Indique, entre as alternativas abaixo, aquela onde são feitas exclusivamente
afirmações corretas sobre os elementos cujas configurações eletrônicas são dadas a seguir:
a) O elemento 3 é um gás nobre e o elemento 2 um halogênio.
b) Os elementos 2 e 4 situam-se, respectivamente, no segundo e terceiro períodos da
classificação periódica.
c) O elemento 4 situa-se no terceiro período da classificação periódica e é um metal alcalino
terroso.
d) O elemento 3 é um elemento de transição e o elemento 4 é um metal alcalino.
e) O elemento 1 é um metal alcalino terroso e o elemento 2 situa-se no mesmo grupo do
nitrogênio na classificação periódica.
8. Escreva as fórmulas dos compostos formados entre os íons abaixo e nomeie-os:
a) Na+ e Cℓb) Aℓ3+ e SO42c) Mg2+ e Fd) K+ e S2e) Ca2+ e PO43f) NH4+ e NO3-
9. O elemento X pertence ao grupo 1 e Y pertence ao grupo 16 da tabela periódica. A fórmula
correta do composto formado entre esses dois elementos é:
a) X2Y3
b) XY
c) XY2
d) X3Y2
e) X2Y
10. Os elementos X e Y têm, respectivamente, 2 e 6 elétrons em sua camada de valência.
Quando X e Y reagem, forma-se um composto:
a) covalente, de forma XY;
b) covalente, de forma XY2;
c) covalente, de forma X2Y3;
d) iônico, de forma XY;
e) iônico, de forma X2Y.
2
11. Considere os elementos sódio, magnésio, enxofre e cloro; escreva as fórmulas e o nome dos
compostos iônicos que podem ser formados entre eles.
12. O fosfogênio (COCℓ2), um gás incolor, tóxico, de cheiro penetrante, utilizado na Primeira
Guerra Mundial como gás asfixiante. Construa a fórmula estrutural plana do fosfogênio.
13. Dê as fórmulas das substâncias:
a) hidróxido de lítio .....................................................
b) hidróxido de magnésio ...........................................
c) hidróxido de níquel III .............................................
d) hidróxido de prata ...................................................
e) ácido clórico ............................................................
f) ácido fosforoso .........................................................
g) ácido nítrico .............................................................
h) ácido sulfuroso ........................................................
14. Esquematize a reação de neutralização da base do item b com o ácido do item e.
15. Esquematize a neutralização do ácido do item g pelo bicarbonato de sódio.
16. Classifique as equações abaixo como síntese, dupla troca, simples troca ou análise.
I- Zn + Pb(NO3)2 Zn(NO3)2 + Pb
II- FeS + 2HCl FeCl2 + H2S
III- 2NaNO3 2NaNO2 + O2
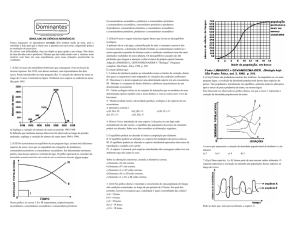
17. Faça o balanceamento das seguintes equações químicas:
A)
C2H6O +
B)
Na2CO3 +
C)
C6H12O6
→
CO2 +
HCl →
NaCl
→
C2H6O +
D)
C4H10 +
O2
E)
FeCl3 +
Na2CO3
F)
NH4Cl +
Ba(OH)2
O2
→
H2O
+
CO2
CO2
CO2 +
→
→
H2O +
H2O
Fe2(CO3)3 +
BaCl2 +
3
NaCl
NH3 +
H2O