Aula: 18
Temática: Equilíbrio de Fases
Veremos alguns conceitos para, então, introduzirmos a regra de fases.
Iniciaremos o estudo dos diagramas de equilíbrio para sistemas com dois
componentes.
A fase identifica um estado uniforme da matéria referente à composição
química e ao estado físico. Simbolizaremos o número de fases de um sistema
pela letra P.
Vejamos alguns exemplos:
•
P = 1 (uma fase) uma mistura gasosa, dois líquidos miscíveis, um
cristal, o gelo.
•
P = 2 (duas fases) uma mistura de gelo e água, uma liga de metais
imiscíveis.
Uma solução de dois sólidos é uma mistura homogênea uniforme em escala
microscópica. Uma dispersão é uniforme em escala macroscópica, sendo que
uma amostra pequena pode não representar o todo.
Quaisquer espécies químicas presente no sistema, chamamos de um
constituinte do sistema, podendo ser uma molécula ou íon. Já um
componente é um constituinte quimicamente independente do sistema. O
número mínimo de espécies que definem a composição de todas as fases de
um sistema é o número de componentes, C. Por exemplo, uma solução de
água e etanol é um sistema que contém o mesmo número de constituintes e
compostos, 2. Em outro exemplo, a reação de decomposição de CaCO3(s) em
CaO(s) e CO2(g), na qual existem 3 fases, possui 3 constituintes, mas só 2
componentes, já que o sistema pode ter sua composição definida somente com
as espécies CaO e CO2.
FÍSICO-QUÍMICA
A variância, V, indica o número de variáveis intensivas que podem ser
alteradas sem mudar o número de fases do sistema. Um sistema com um
componente e uma fase (monofásico) pode ter a pressão e a temperatura
alteradas que continuará com uma fase, sendo, portanto, um sistema bivariante
ou que possui dois graus de liberdade (V = 2). Vejamos agora um sistema de
um componente com duas fases em equilíbrio, como um líquido e seu vapor, a
modificação na pressão causa alteração na temperatura para que o sistema
permaneça no equilíbrio, e vice-versa, então V = 1 (univariante). Não temos
valores negativos para V.
Gibbs deduziu a regra das fases, como uma relação entre a variância, o
número de componentes e o número de fases, para qualquer composição:
V =C−P+2
Foram apresentados acima, nos exemplos usados para variância, os sistemas
com um componente (C = 1), formados por uma ou duas fases. Para mostrar
o uso da regra das fases, para um componente V = 3 − P, temos para uma fase
V = 3 − 1, logo V = 2 como visto no exemplo. Se aplicarmos a regra para o
sistema de duas fases (P = 2), esta resultará em V = 1. Ainda podemos ter o
sistema com três fases (P = 3), resultando em V = 0, ou seja, o sistema é
invariante. O equilíbrio entre três fases é definido por p e T característicos de
cada substância e é representado no diagrama de fases pelo ponto triplo.
Para sistemas de dois componentes (C = 2), V = 4 − P. No caso da
temperatura ser constante, a variância cai para 3 − P, ficando com o valor
máximo de dois. Estes dois graus de liberdade remanescente são a pressão e
a composição (fração molar). Então, o diagrama de fases pode ter a forma de
um gráfico das pressões e composições, a temperatura constante, em que
cada fase é estável. Também se pode fazer um diagrama da temperatura pela
composição, mantendo a pressão constante.
Para a utilização dos diagramas de pressão de vapor, devemos verificar
certas relações. As pressões parciais do vapor dos componentes de uma
FÍSICO-QUÍMICA
solução ideal de dois líquidos voláteis estão relacionadas com a composição da
solução líquida pela lei de Raoult:
p A = x A p ∗A
p B = xB p B∗
A pressão total do vapor da solução, p = pA + pB, é
p = x A p ∗A + x B p B∗ = p B∗ + ( p ∗A − p B∗ )x A
Mostrando que, a T constante, a pressão de vapor varia linearmente com a
composição. Podemos também relacionar a pressão total do vapor com a
composição do vapor. Para tanto, precisamos de uma relação entre a
composição do líquido e a do vapor que pode ser obtida por substituição na lei
de Dalton para as frações molares no vapor, yA e yB (yA = pA/p e yB = pB/p, com
yB = 1 − yA):
yA =
E ficamos com
p B∗
x A p ∗A
+ ( p ∗A − p B∗ )x A
p ∗A p B∗
p= ∗
p A + ( p B∗ − p ∗A )y A
O vapor, em geral, é mais rico no componente mais volátil. Se um componente
não é volátil, não terá contribuição ao vapor.
Através de um ponto na região de duas fases do diagrama de pressão de vapor
observa-se o equilíbrio líquido-vapor, além de ser possível o cálculo do número
de mols das duas fases, α e β, em equilíbrio. A regra da alavanca relaciona nα
e nβ com as distâncias (l) medidas sobre a linha de amarração:
nα lα = nβ l β .
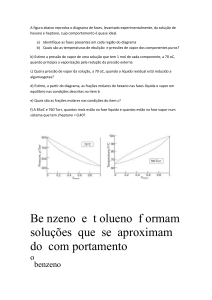
Os diagramas de temperatura-composição são muito usados na discussão
da destilação. Caracterizam-se por diagramas de fases em que as curvas
mostram as composições das fases em equilíbrio (líquido e vapor), em função
da temperatura, a uma pressão fixa. Embora muitas soluções binárias tenham
FÍSICO-QUÍMICA
diagrama de fase em termos de temperatura e composição semelhantes à
versão ideal, em muitos casos os afastamentos são notáveis. Pode aparecer
um máximo no diagrama de fases, quando a interação favorável entre as
moléculas dos componentes, A e B, reduz a pressão de vapor da solução a um
valor inferior ao ideal. Os diagramas também podem exibir um mínimo, quando
as soluções estão desestabilizadas em relação às soluções ideais, pois as
interações A-B são desfavoráveis. Quando estes extremos aparecem as
conseqüências para a destilação são grandes. Se o processo chegar a um
ponto em que a evaporação de A for suficiente para a composição da solução
líquida chegar ao equilíbrio com o vapor, o vapor formado na ebulição terá a
mesma composição que o líquido. A evaporação se dá sem alteração da
composição e dizemos que a solução é um azeótropo. Quando a composição
azeotrópica é atingida, a destilação não contribui mais para a separação dos
dois líquidos.
Nesta aula aprendemos a determinar os graus de liberdade de um
sistema, a partir da regra de fases de Gibbs. Os graus de liberdade mostram a
possibilidade de variação dos parâmetros termodinâmicos preservando o
equilíbrio entre as fases. Analisamos também alguns tipos de diagramas de
fases para sistemas com dois componentes e continuaremos esta análise na
próxima aula.
FÍSICO-QUÍMICA