Quebra-cabeças termoquímico
Experimento cadastrado por João Marcelo Peito Alves em
09/08/2010
Classificação
•••••
(baseado em 2 avaliações)
Total de exibições: 2295 (até 28/06/2011)
Palavras-chave: Água, ácido sulfúrico, quebra-cabeças,
química, gelo.
Onde encontrar o material?
em laboratórios e lojas especializadas
Quanto custa o material?
até 10 reais
Tempo de apresentação
até 10 minutos
Dificuldade
intermediário
Segurança
requer cuidados especiais
Introdução
Vamos ver o que acontece quando adiciona-se ácido à água em diferentes estados físicos.
Materiais necessários
100 g de gelo a 0°C
100 g de água a 0°C
2 termômetros
1 béquer de 500 mL
200 mL de ácido sulfúrico com concentração 9 mol/L
2 copos de isopor grandes
Passo 1
Para obter a solução de ácido sulfúrico coloque no béquer 100 mL de água. Coloque o béquer em um recipiente
com água fria ou gelo para dissipar o calor produzido na dissolução do ácido. Lentamente e sob agitação,complete
com ácido sulfúrico até o volume de 200 mL. Deixe em repouso até que a solução atinja a temperatura ambiente.
Esta etapa deve ser feita cuidadosamente, pois o ácido sulfúrico concentrado é corrosivo e pode causar
queimaduras.
© 2011 pontociência / www.pontociencia.org.br
1
Quebra-cabeças termoquímico
Passo 2
Coloque o gelo dentro de um copo de isopor e a água no outro copo. Confira as temperaturas utilizando os
termômetros.
Passo 3
Despeje 100 mL da solução de ácido sulfúrico no copo com gelo e os outros 100 mL no copo com água.
© 2011 pontociência / www.pontociencia.org.br
2
Quebra-cabeças termoquímico
Passo 4
Observe a variação da temperatura.
© 2011 pontociência / www.pontociencia.org.br
3
Quebra-cabeças termoquímico
Clique para assistir ao vídeo
http://www.youtube.com/watch?v=SKDVMwJjRms
Passo 5
O que acontece?
© 2011 pontociência / www.pontociencia.org.br
4
Quebra-cabeças termoquímico
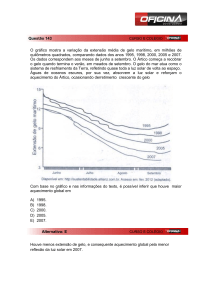
Quando a solução de ácido sulfúrico entra em contato com a água no estado líquido ocorre elevação da
temperatura devido à grande energia liberada na solvatação dos íons H+ e HSO4?. Essa energia é muito superior
à energia necessária para a ionização do ácido e, portanto, a sua dissolução em água é exotérmica.
No entanto, no caso do gelo, a presença dos íons H+ e HSO4? propicia a queda no ponto de fusão da água e com
isso a temperatura do sistema diminui. Todo calor gerado pela hidratação do ácido é absorvido na fusão do gelo.
H2SO4(?) + H2O → H3O+(aq) + HSO4-(aq) + calor
H2O(s) + calor → H2O(?)
Passo 6
Para saber mais
O efeito envolvido no experimento é chamado crioscopia. Crioscopia é o abaixamento da temperatura de fusão de
um solvente pela adição de um soluto não volátil. A mesma situação acontece quando se adiciona ao gelo um
pouco de sal de cozinha.
Passo 7
Veja também
L. R. Summerlin, C. L. Borgford, and J. B. Ealy (1988) Chemical Demonstrations: A Source book for Teachers,
Vol. 2, Second Edition.
© 2011 pontociência / www.pontociencia.org.br
Powered by TCPDF (www.tcpdf.org)
5