UNIVERSIDADE DO ESTADO DO AMAZONAS
FUNDAÇÃO DE MEDICINA TROPICAL DR. HEITOR VIEIRA DOURADO
PROGRAMA DE PÓS-GRADUAÇÃO EM MEDICINA TROPICAL
MESTRADO EM DOENÇAS TROPICAIS E INFECCIOSAS
PREVALÊNCIA DE FEBRE POR ALFAVÍRUS ARTRITOGÊNICO
(CHIKUNGUNYA), ENTRE PACIENTES SUBMETIDOS À ABORDAGEM
SINDRÔMICA DE DOENÇAS FEBRIS, EM UM SERVIÇO DE REFERÊNCIA PARA
DOENÇAS INFECCIOSAS NO ESTADO DO AMAZONAS
MARIA CYNTIA KERLE CALADO LIMA
MANAUS
2016
i
MARIA CYNTIA KERLE CALADO LIMA
PREVALÊNCIA DE FEBRE POR ALFAVÍRUS ARTRITOGÊNICO (CHIKUNGUNYA),
ENTRE PACIENTES SUBMETIDOS À ABORDAGEM SINDRÔMICA DE DOENÇAS
FEBRIS, EM UM SERVIÇO DE REFERÊNCIA PARA DOENÇAS INFECCIOSAS NO
ESTADO DO AMAZONAS
Dissertação Apresentado ao Programa de Pós
Graduação
em
Medicina
Tropical
da
Universidade do Estado do Amazonas em
convênio com a Fundação de Medicina Tropical
Dr. Heitor Vieira Dourado, para obtenção grau
de Mestre em Doenças Tropicais e Infecciosas.
Orientador (a): Prof Dr. Maurício Lacerda Nogueira
Co-Orientador (a): Profª. Dra. Maria Paula Gomes Mourão
MANAUS
2016
ii
Ficha Catalográfica
L732p
Lima, Maria Cyntia Kerle Calado.
Prevalência de febre por Alfavírus artritogênico (chikungunya), entre
pacientes submetidos à abordagem sindrômica de doenças febris, em um
serviço de referência para doenças infecciosas no estado do Amazonas ./Maria
Cyntia Kerle Calado Lima. -- Manaus : Universidade do Estado do Amazonas,
Fundação de Medicina Tropical, 2016.
xviii, 78 f. : il.
Dissertação (Mestrado) apresentada ao Programa de Pós- Graduação em
Medicina Tropical da Universidade do Estado do Amazonas – UEA/FMT, 2016.
Orientador: Prof. Dr. Maurício Lacerda Nogueira
1.Arbovíroses 2 Vigilância . 3.Chikungunya I.Título Título.
CDU: 616.9(811.3)(043)
iii
PREVALÊNCIA DE FEBRE POR ALFAVÍRUS ARTRITOGÊNICO
(CHIKUNGUNYA), ENTRE PACIENTES SUBMETIDOS À ABORDAGEM
SINDRÔMICA DE DOENÇAS FEBRIS, EM UM SERVIÇO DE
REFERÊNCIA PARA DOENÇAS INFECCIOSAS NO ESTADO DO
AMAZONAS
MARIA CYNTIA KERLE CALADO LIMA
“Esta Dissertação foi julgada adequada para obtenção do Título de Mestre
em Doenças Tropicais e Infecciosas, aprovada em sua forma final pelo
Programa de Pós-Graduação em Medicina Tropical da Universidade do
Estado do Amazonas em convênio com a Fundação de Medicina Tropical
Dr. Heitor Vieira Dourado”.
Banca Julgadora:
______________________________________
Presidente
______________________________________
Membro
______________________________________
Membro
iv
DEDICATÓRIA
A minha mãe, Maria Celeste Calado Lima, por todo esforço e dedicação, a fim de
me proporcionar condições necessárias de estudar, diante de suas possibilidades,
desde a infância até a minha graduação.
Ao meu filho, Felipe que desde que soube de sua concepção, aprendi que o
amor é a forma mais sublime da existência humana. Agradeço a Deus por ter me
presenteado esta criança, que transborda alegria e que deu um sentido especial a
minha vida.
v
AGRADECIMENTOS
Agradeço primeiramente a Deus, pelo dom da vida, da perseverança e pela força concedida
para que eu pudesse avançar passo a passo e superar cada obstáculo vivenciado nesta pósgraduação.
Ao meu filho Felipe, meu porto seguro e minha fortaleza.
Ao meu esposo Fabio, pelo amigo e companheiro durante toda nossa caminhada juntos, e que
vivenciou e suportou comigo as alegrias e aflições em cada etapa desse mestrado.
Aos meus pais, a minha irmã Cynara e ao meu irmão Edvaldo Júnior, por serem minha base, e
por estarem sempre me apoiando em todos os momentos da minha vida.
A Universidade do Estado do Amazonas e em especial a Fundação de Medicina Tropical Dr.
Heitor Vieira Dourado, pela oportunidade de realizar o mestrado nesta instituição.
A meu orientador, Dr. Maurício Nogueira pela oportunidade de tê-lo à frente desse estudo
desde a concepção, pelas contribuições científicas e pessoais relevantes para o meu
crescimento profissional.
A minha amiga e companheira de turma, doutoranda Bárbara Chaves. Agradeço por todas as
horas que a mim foram disponibilizadas, pelas enriquecedoras sugestões e observações
pertinentes contribuindo para o desenvolvimento desse trabalho, e sobretudo, pelo apoio
emocional, o carinho e amizade construída durante o período acadêmico.
A todos os amigos de turma conquistados durante o período de mestrado, pelos conhecimentos
construídos, pelas mútuas trocas de saberes, pelas dificuldades enfrentadas, pelos momentos
de descontração, por todo companheirismo, incentivo e ajuda. Todos eles foram essenciais
para a solidez da nossa amizade e para seguir firme na caminhada acadêmica.
A todos os professores que passaram pela minha vida desde a infância, pelos valiosos
ensinamentos que graças a eles venho trilhando um caminho de conquistas.
Aos colegas que compõem a equipe do Laboratório de Pesquisa em Virologia da FAMERP, que
disponibilizaram um pouco do seu tempo, para ajudar-me na parte técnica laboratorial desse
estudo.
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), pela bolsa
concedida durante o mestrado.
Aos membros da banca pelo interesse e disponibilidade em estar presente nesta apresentação
de defesa, a fim de fazerem suas colocações e possíveis contribuições.
vi
DECLARAÇÃO DAS AGÊNCIAS FINANCIADORAS
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e
Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), por financiar a
pesquisa na instituição e PPGMT, possibilitando o desenvolvimento científico e
tecnológico local.
vii
“Paz não é aquilo que encontramos em um lugar sem ruídos, sem
problemas, sem trabalho duro, mas o que permite manter a calma em
nosso coração, mesmo no meio das situações mais adversas. Este é o seu
verdadeiro e único significado”.
Paulo Freire
viii
RESUMO
As arboviroses são doenças transmitidas por artrópodes, que acomete grande
parte da populaçao mundial. O vírus Chikungunya é transmitido por mosquitos do
genêro Aedes e é emergente no Brasil, onde teve seu primeiro registro em Setembro de
2014. Além disso, essa arbovirose apresenta manifestações clínicas semelhantes a
outras doenças, principalmente o estado febril do paciente, o que dificulta o diagnóstico
etiológico e a definição da conduta mais adequada. A Fundação de Medicina Tropical
Dr. Heitor Vieira Dourado (FMT-HVD) implementou em 1998, o sistema de
monitoramento de doenças febris agudas, a fim de identificar os agentes etiológicos
causadores de febre aguda sem causa definida. Dessa forma o objetivo do presente
estudo foi estimar a prevalência de infecção por CHIKV em pacientes apresentando
doença febril assistidos em uma unidade de referência no atendimento de doenças
infecciosas no estado do Amazonas. Para isso foram feitos testes moleculares em
amostras de soros de 171 pacientes febris, negativos para Malária e Dengue, atendidos
na referida unidade de saúde entre 2014 e 2015. Os sintomas que mais se destacaram
entre os pacientes febris foram: cefaleia (100%), mialgia (100%), calafrios (100%),
artralgia (98%), dor retro ocular (97,9%) e dor nas costas (96,5%). Seis amostras
apresentaram-se positivas para CHIKV, sendo mais frequente em homens (60%) com
média de idade de 24 anos, e dos seis, 4 (66,7%) não residiam em Manaus. A partir do
resultado positivo para CHIKV em nossas amostras, pudemos observar a prevalência
de 3,5%, referente a nossa população de pacientes febris, apontando para uma
subnotificação desse agravo. O presente trabalho também mostra a circulação do
CHIKV no Amazonas desde Março de 2014, antes dos principais órgãos de saúde no
Brasil, notificarem os primeiros casos da infecção, ou seja, contrariando a cronologia da
introdução do vírus no país e no estado do amazonense. Portanto, esse trabalho
contribuiu para a vigilância epidemiológica e rastreamento de infecções por esse vírus
no estado e a forma como se manifestou clinicamente, caracterizando um perfil de
comportamento da infecção na população amazonense. Devido ao risco de emergência
do CHIKV no Amazonas, a grande extensão territorial do estado e as vias de acesso
predominante fluviais podem estar dificultando o diagnóstico nas regiões mais
afastadas. A circulação nessa região de um grande contingente de turistas nacionais e
internacionais, também indica a necessidade de vigilância já que facilita a propagação
das infecções em território amazonense, assim como a exportação do vírus para outras
regiões do mundo.
Palavras chaves: Arboviroses, prevalência, vigilância, chikungunya, Amazônia.
ix
ABSTRACT
Arboviruses are diseases transmitted by arthropods, which affects a large part of the
world population. The Chikungunya virus is transmitted by mosquitoes of the genus
Aedes and is emerging in Brazil, where it had its first registry in September 2014. In
addition, this arbovirose presents clinical manifestations similar to other diseases, mainly
the febrile state of the patient, which makes difficult the Etiological diagnosis and the
definition of the most appropriate conduct. In 1998, the Dr. Heitor Vieira Dourado
Tropical Medicine Foundation (FMT-HVD) implemented the monitoring system for acute
febrile diseases in order to identify the causative agents of acute fever without definite
cause. Thus, the objective of the present study was to estimate the prevalence of CHIKV
infection in patients with febrile disease treated in a reference unit in the treatment of
infectious diseases in the state of Amazonas. Molecular tests were performed on
samples of 171 malaria and Dengue negative febrile patients attended at the
aforementioned health unit between 2014 and 2015. The most prominent symptoms
among febrile patients were headache (100%), Myalgia (100%), chills (100%), arthralgia
(98%), retro eye pain (97.9%) and back pain (96.5%). Six samples were positive for
CHIKV, being more frequent in men (60%) with a mean age of 24 years, and of the six,
4 (66.7%) did not live in Manaus. From the positive result for CHIKV in our samples, we
could observe the prevalence of 3.5%, referring to our population of febrile patients,
pointing to an underreporting of this disease. The present work also shows the
circulation of CHIKV in Amazonas from March 2014, before the main health agencies in
Brazil, to notify the first cases of the infection, that is, contrary to the chronology of the
introduction of the virus in the country and in the state of Amazonas. Therefore, this
work contributed to the epidemiological surveillance and tracking of infections by this
virus in the state and the way it manifested clinically, characterizing a profile of infection
behavior in the Amazonian population. Due to the CHIKV emergency risk in Amazonas,
the large territorial extension of the state and the predominant fluvial access roads may
be making diagnosis in the most remote regions difficult. The circulation in this region of
a large contingent of national and international tourists also indicates the need for
surveillance since it facilitates the spread of the infections in Amazonian territory, as well
as the export of the virus to other regions of the world.
Keywords: Arboviroses, prevalence, surveillance, chikungunya, Amazon.
x
RESUMO LEIGO
O Chikungunya é uma doença transmitida por mosquitos Aedes, popularmente
conhecido como “mosquito da dengue” e os primeiros casos da doença em território
brasileiro, foram registrados em Setembro de 2014. Além disso, essa infecção
apresenta sintomas muito parecidos com outras doenças como a Dengue,
principalmente a febre inicial do paciente, dificultando a identificação e o tratamento da
doença pelos profissionais de saúde. Foi realizado um estudo em 171 pacientes febris,
a fim de identificar a presença de infecção por CHIKV. Esses mesmos pacientes já
haviam sido testados previamente para Malária e para Dengue e tiveram diagnóstico
negativo. Assim foi possível observar os principais sintomas apresentados por estes
pacientes: cefaleia (100%), mialgia (100%), calafrios (100%), artralgia (98%), dor retro
ocular (97,9%) e dor nas costas (96,5%). Dentre os 171 pacientes, seis amostras
apresentaram-se positivas para CHIKV, sendo que mais homens foram atingidos (60%)
com média de idade de 24 anos, e 4 (66,7%) não residiam em Manaus. O presente
trabalho também mostra que através dos registros de atendimento dos pacientes que o
CHIKV já estava no Amazonas desde Março de 2014, antes dos principais órgãos de
saúde no Brasil, identificarem os primeiros casos dessa infecção. Portanto, esse
trabalho contribuiu para identificar os primeiros casos da infecção no estado e a forma
como a doença se apresentou clinicamente, caracterizando um perfil de comportamento
da infecção na população amazonense. Atualmente como o diagnóstico laboratorial do
CHIKV no estado somente é realizado na FMT-HVD, em Manaus, as regiões mais
afastadas da capital ficam praticamente inviabilizadas de confirmar a doença, uma vez
que as vias de acesso são predominantemente fluviais, dificultando o diagnóstico nas
regiões mais afastadas e apontando para um sub-registro dessa doença. Devido ao
risco de acontecer surtos do CHIKV no Amazonas, os profissionais de saúde e a
população, devem permanecer em alerta para os sinais dessa doença principalmente
pela grande circulação de turistas nacionais e internacionais nessa região, já que os
mesmos podem facilitar a distribuição dessa infecção em território amazonense, assim
como, para outras regiões do mundo.
xi
LISTA DE FIGURAS
FIGURA 1: Ilustração do RNA viral e suas três proteínas estruturais (C, E1, E2) e
quatro proteínas não estruturais (nsP1, nsP2, nsP3, nsP4).............................................2
FIGURA 2: Reconstrução filogenética das CHIKV incluindo genomas brasileiros...........4
FIGURA 3: Ciclos de transmissão do CHIKV...................................................................6
FIGURA 4: Introdução e distribuição dos genótipos Asiático e o ECSA do CHIKV nas
Américas............................................................................................................................9
FIGURA 5: Casos notificados e confirmados de febre de chikungunya por município de
notificação, até a Semana Epidemiológica 27, Brasil, 2016............................................10
FIGURA 6: Fluxo e triagem das amostras dos pacientes febris da FMT-HVD entre 20142015, e diagnóstico molecular em 171 amostras realizado na Faculdade de Medicina de
São José do Rio Preto FAMERP.....................................................................................19
FIGURA 7: Curvas de amplificação qRT/PCR para detecção do vírus Chikungunya ...23
xii
LISTA DE TABELAS
Tabela 1: Primers que foram utilizados na detecção de CHIKV RT-PCR...................15
Tabela 2: Principais sintomas apresentados pelos pacientes febris..........................21
Tabela 3: Relação das variáveis entre pacientes CHIKV negativos e CHIKV
positivos...........................................................................................................................21
Tabela 4: Parâmetros laboratoriais entre pacientes CHIKV negativos e CHIKV
positivos...........................................................................................................................22
xiii
LISTA DE ABREVIATURAS, SÍMBOLOS E UNIDADES DE MEDIDA
CHIKV- Vírus Chikungunya
MAYV- Vírus Mayaro
ECSA- genótipo Suldeste-Centro-Sul africano do vírus Chikungunya
Ae- Aedes
RT- PCR- Transcriptase reversa seguida de reação em cadeia da polimerase
ELISA- Sorologia por testes imunoenzimáticos
IgG- Imunoglogulina G
IgM- Imunoglobulina M
SE- Semana Epidemiológica
FC- Febre por Chikungunya
FMT- HVD- Fundação de Medicina Tropical Dr. Heitor Vieira Dourado
AM-Amazonas
IDoctor- Prontuário eletrônico
LVP- Laboratório de Pesquisa em Virologia
FAMERP- Faculdade de Medicina de São José do Rio Preto
PA- Pronto Atendimento
AM- Amazonas
µl- Microlitros
ml- mililitros
xiv
º C- Graus Celsius
AVE- solução tampão de eluição (200 mM Tris-HCl, pH 8,4, 500 mM KCl)
RT- Transcriptase Reversa
CHIK F- oligonucleotídeo específico F
CHIK R- oligonucleotídeo específico R
PCR- Reação em Cadeia da Polimerase
CXR- corante fluóforo utilizado na marcação de sondas
EUA- Estados Unidos da América
nM- nanômetros
HCl- ácido clorídrico
NaCl- Cloreto de Sódio
MgCl2- Cloreto de Magnésio
DTT- Dithiothreitol
dNTP- Deoxynucleoside Triphosphate
CHIKV WEA R- primer
CHIKV WEA F- primer
RNase OUT-Invitrogen- enzima inibidora de ribonuclease
USA- United States of America
U/mL- Unidade por mililitro
M- MLV RT- enzima transcriptase reversa
RT- Trancriptase Reversa
KCl- Cloreto de Potássio
Taq DNA- Enzima da polimerase
xv
%- sinal de porcentagem
pb- pares de base
TCLE- Termo de Consentimento Livre e Esclarecido
n- número
DENV- vírus da Dengue
ZIKV- Vírus da Zika
CDC- Centro de Controle e Prevenção de Doenças
µL- Microlitro
U- Unidade
µM- Micromicrometro
mM- milimol
UNAV- Una vírus
xvi
SUMÁRIO
1.
1.1.
INTRODUÇÃO .................................................................................................................... 1
Histórico e epidemiologia ................................................................................................. 1
1.2. Vírus Chikungunya ............................................................................................................... 2
1.3. Aspectos clínicos ................................................................................................................ 5
1.4. Transmissão ........................................................................................................................ 6
1.5. Diagnóstico e tratamento ..................................................................................................... 7
1.6. Dispersão do CHIKV ............................................................................................................ 8
2. OBJETIVOS ......................................................................................................................... 13
2.1 Objetivo geral...................................................................................................................... 13
2.2 Objetivos específicos .......................................................................................................... 13
3. MATERIAIS E MÉTODOS .................................................................................................... 14
3.1. Modelo de estudo .............................................................................................................. 14
3.2. Local e população de estudo ............................................................................................. 14
3.3. Procedimentos ................................................................................................................... 14
3.3.1. Coleta de amostras ............................................................................................................... 14
3.3.2 Extração de RNA .................................................................................................................... 15
3.3.2.1Primers utilizados qRT-PCR .......................................................................................... 15
3.3.3. qRT-PCR ....................................................................................................................... 16
3.3.3.1Primers utilizados na RT-PCR........................................................................................ 16
3.3.4 RT-PCR para detecção de CHIKV............................................................................................. 16
3.3.5 Eletroforese em gel de agarose.............................................................................................. 17
3.4. Aspectos éticos .................................................................................................................. 17
3.5. Análise de dados ............................................................................................................... 18
4. RESULTADOS.........................................................................................................................19
5. DISCUSÃO..............................................................................................................................24
6. CONCLUSÃO..........................................................................................................................34
7. REFERÊNCIAS........................................................................................................................35
8. ANEXOS..................................................................................................................................43
ANEXO I.......................................................................................................................................43
ANEXO II .................................................................................................................................. 46
ANEXO III ................................................................................................................................. 47
ANEXO IV ................................................................................................................................ 48
ANEXO V ................................................................................................................................. 50
xvii
ANEXO VI....................................................................................................................................51
ANEXO VII...................................................................................................................................52
ANEXOVIII...................................................................................................................................53
ANEXO IX....................................................................................................................................54
ANEXO X.....................................................................................................................................56
ANEXO XI....................................................................................................................................58
1
1. INTRODUÇÃO
1.1. Histórico e epidemiologia
O nome Chikungunya é derivado de uma palavra na língua Makondes (falada por
uma população que vive na região de Moçambique), que significa: “tornar-se
contorcido” ou “aqueles que se dobram”, e é usada para descrever tanto o vírus como a
doença1. Esta descrição refere-se a postura curvada que se desenvolve como um
resultado dos sintomas artríticos desta doença2. Entre 1952 e 1953, no leste do
continente africano, aconteceu o primeiro registro dessa doença na província de
Tanganyika, na Tanzânia1. Em 1955, o primeiro relatório a notificar a maioria dos casos
de infecção por CHIKV, descrevia a África e a Índia como foco primário da infecção no
mundo. A partir de então, nos últimos 60 anos, vários países da África, na região do
Oceano Índico, Sudeste Asiático e Índia, tem-se relatados casos isolados ou surtos
epidêmicos da infecção3.
Em 2004, uma grande epidemia de CHIKV, começou na costa do Quênia, seguido
em 2005 por sequenciais surtos em Comoros, Ilha da Reunião, e outros ilhas no
sudoeste do Oceano Índico. As Ilhas da Reunião foram massivamente afetadas com
cerca de 266 000 casos da infecção4, 5,6. Nos anos seguintes, uma epidemia devastou o
subcontinente indiano, entre 2005- 2006, causando mais de um milhão e meio de
casos7. Em meados dos anos 2000, casos da doença foram registrados em países da
Europa, demonstrando que essa região também é suceptível as arboviroses8, 9. A
infecção foi confirmada nas Américas em 2013, chegando ao Brasil no ano seguinte, e
desde então, 45 países ou territórios já apresentaram transmissão local na América do
Norte, Central, Sul e Caribe10.
2
1.2. Vírus Chikungunya
O Chinkungunya vírus pertence à família Togaviridae e ao gênero Alphavirus,
apresenta-se na forma esférica envelopada, com 60 a 70 nm de diâmetro11, 12,13. Tem
envelope fosfolipídico e é sensível a dessecação e a temperaturas acima de 58⁰C7.
Como
todos
os
Alphavirus,
CHIKV
apresenta
um
genoma constituído por uma molécula de RNA de cadeia simples linear e sentido
positivo, que codifica quatro proteínas não estruturais (ns1-4), e três proteínas
estruturais14,13 (C,E1,E2) necessárias para as replicações virais (Figura 1). As proteínas
E2 e E1 apresentam-se como heterodímeros em pH neutro. A proteína E1 encontra-se
abaixo de E2 e tem a função de unir o vírus com a membrana celular durante sua
entrada na célula. Já a proteína E2 forma picos na superfície do vírus para interagir
com receptores celulares14, 16.
Figura1: Ilustração do RNA viral e suas três proteínas estruturais (C, E1, E2) e quatro proteínas
15
não estruturais (nsP1, nsP2, nsP3, nsP4). Adaptada de Khan A H et al. J Gen Virol 2002 .
Os Alphavirus apresentam uma variedade de espécies de vírus, que se subdividem
em quatro complexos de acordo com a proximidade de suas características genéticas.
O Chikungunya é membro do subgrupo Semliki Forest complexo, juntamente com,
Mayaro vírus (MAYV), Semliki Forest, O'nyong-nyong e Ross River vírus12,
13
. São
amplamente distribuídos por todo o mundo, podendo ser encontrados em todos os
continentes, exceto na região da Antártida. As distribuições geográficas das espécies
3
individuais são restritas por causa de condições ecológicas, hospedeiro-reservatório e
restrições vetoriais17, 18.
Além da proximidade genética entre o MAYV e CHIKV, o que também os tornam
intimamente relacionados é a semelhança na apresentação clínica dos sintomas,
porém19, enquanto o Chikungunya é amplamente distribuído no mundo, o MAYV está
limitado geograficamente a América Central e a América do Sul10, 20.
O CHIKV teve sua origem da África, onde circula em complexos ciclos silvestres
envolvendo artrópodes como vetores e primatas não humanos. A adaptação do vírus
RNA em uma nova espécie hospedeira ou vetor resulta muitas vezes no surgimento de
novas linhagens virais. As cepas do CHIKV estão agrupadas em três genótipos
distintos: África Ocidental, Leste - Central – Sul da África (ECSA) e Asiático21.
Depois do isolamento do CHIKV na Tanzânia, em 1952, a primeira emergência
registrada do CHIKV ocorreu com sua introdução no sudeste asiático e na Índia,
instalando-se em um ciclo de transmissão urbano que continua até hoje, onde o Ae.
aegypti é o principal vetor22. A segunda emergência do CHIKV ocorreu em 2004, no
Quênia que se disseminou pelos anos seguintes por diversas ilhas do Oceano Índico,
atingindo a Índia e sudeste asiático. Em 2006, nas Ilhas da Reunião, aconteceu a
terceira emergência relacionada ao CHIKV, onde mutações virais no genótipo ECSA
levaram a uma transmissibilidade mais eficaz pelo mosquito Ae. albopictus durante uma
grande epidemia16
Os genótipos susceptíveis indicam evolução independente do vírus em áreas
isoladas historicamente. Diferenças fenotípicas foram descritas entre genótipos e entre
as cepas individuais, mais notavelmente uma mutação na região E1 entre algumas
linhagens ECSA, parece facilitar a replicação do vírus no vetor Aedes albopictus16.
Um recente estudo verificou que o CHIKV detectado na ilha Caribenha de St. Martin
em 2013, corresponde ao genótipo asiático, pois está intimamente relacionado com
cepas isoladas na China e nas Filipinas. Esta descoberta apóia a idéia de que uma
4
única cepa CHIKV, a do genótipo asiático, recentemente introduzido no Caribe é a que
atualmente está sendo disseminada em toda a região caribenha23.
No Brasil, com a introdução do CHIKVem 2014, uma análise de sequênciamento
genético demonstrou que duas linhagens distintas foram identificadas. Na Bahia (Feira
de Santana), o genótipo ECSA foi identificado em Junho de 2014, já a cepa Asiática foi
observada no Amapá(Oiapoque) em Setembro do mesmo ano(Figura 4) e tem
similaridade com as mesmas linhagens asiáticas circunlantes no Caribe24(Figura 2).
Figura 2: Reconstrução filogenética das CHIKV incluindo genomas brasileiros. As linhagens
envolvidos na transmissão autóctone do Brasil em Oiapoque e Feira de Santana são destacadas
24
em azul (A) e vermelho (B), respectivamente. Adaptado de Nunes MR et al, BMC Med 2015 .
5
1.3. Aspectos clínicos
Após a picada do mosquito, o CHIKV apresenta um período de incubação que varia
de 2 a 12 dias, porém na maioria dos casos o vírus permanece em incubação por 3 a 7
dias, quando aparecem os primeiros sinais e sintomas da doença25. Clinicamente a
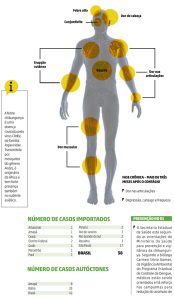
doença apresenta uma fase aguda caracterizada por febre alta (acima de 38,9 ° C),
com início súbito e duração de vários dias, que pode vir acompanhada de dor de
cabeça, dor nas costas, calafrios, mialgia, náuseas e vômitos1. A artralgia é uma
característica da doença que juntamente com as manifestações clínicas, permite o
diagnóstico diferencial com outras infecções por Alphavirus26. Passada a fase aguda, a
maioria dos sintomas desaparecerem, mas alguns pacientes costumam apresentar dor
nas articulações, que podem perdurar e ser tão grave a ponto dos mesmos adotarem
uma postura curvada por anos1. Raramente a doença evolui para um quadro grave
apresentando como principais complicações meningoencefalite e morte. A transmissão
vertical foi documentada durante a grande epidemia nas Ilhas da Reunião, entre 2005 e
2006, em mulheres grávidas infectadas próximo ao parto27. A infecção pelo CHIKV
pode apresentar-se
também na forma assintomática que pode contribuir para
propagação da doença na presença do vetor25.
A clínica de pacientes febris, em regiões onde há a co-circulação da tríplice
epidemia por CHIKV, DENV e ZIKV como no Brasil, têm sido um desafio para os
profissionais,
devido
à
similaridade
sintomatológica
apresentados
por
essas
arboviroses28. O mesmo também pode ser observado entre os sinais e sintomas
causados por MAYV a algumas arboviroses, e principalmente ao CHIKV, por serem
filogeneticamente semelhantes e fazerem parte do mesmo subgrupo, Semliki forest
complexo dos Alphavirus19. Em áreas endêmicas de MAYV, o diagnóstico sorológico
não é o mais recomendado. Portanto, o diagnóstico com foco no agente etiológico
(biologia molecular e o isolamento viral) é o método de escolha para diferenciar estas
infecções28, 19.
6
1.4. Transmissão
O mosquito do gênero Aedes, é o principal vetor do CHIKV, sendo o mais comum o
Aedes aegypti, largamente conhecido pela transmissão de dengue. O Ae. albopictus é a
outra espécie de mosquito de grande importância na disseminação de CHIKV, ele pode
ser encontrado em ambientes, rurais e periurbanos, agravando a transmissão da
doença3. No Brasil, a presença e disseminação dos mosquitos vetores são intensas por
todo território nacional já que, são comumente encontrados em regiões tropicais e
subtropicais29.
A transmissão do vírus acontece pela picada de fêmeas de mosquitos infectadas,
obedecendo a um ciclo humano-mosquito-humano30 (Figura 2). Essas fêmeas possuem
o hábito de
fazer repasto sanguíneo durante todo o dia, embora seus picos de
atividades sejam pela manhã e no final da tarde21.
31
Figura 3: Ciclos de transmissão do CHIKV. Adaptada de Petersen L., 2010 .
Um ciclo enzoótico de CHIKV pode se estabelecer com esporádicas epidemias
humanas. Este padrão tem sido observado na África32 e, no sudeste da Ásia33, onde há
alguma evidência de um ciclo de transmissão CHIKV silvestre, envolvendo primatas não
7
humanos e mosquitos que habitam a floresta, semelhante ao observado para o vírus da
febre amarela silvestre34.
1.5. Diagnóstico e tratamento
O diagnóstico para CHIKV é baseado na sintomatologia, epidemiologia e testes
laboratoriais. No entanto, a confirmação laboratorial é crucial, a fim de se descartar
doenças que apresentam sintomatologia semelhantes35, 36.
Dessa forma, o diagnóstico laboratorial específico pode ser realizado basicamente
de três formas: o isolamento viral, teste molecular por transcriptase reversa seguida de
reação em cadeia
da
polimerase
(RT-PCR),
e
por sorologia
pelos testes
imunoenzimáticos (ELISA). O isolamento viral pode ser realizado a partir do soro de
pacientes ou de insetos
infectados usando células de mamíferos. A técnica de
isolamento viral é de difícil realização pois mostra-se efetiva apenas no período de
viremia, quando as amostras ainda são negativas para anticorpos36.
Já os ensaios moleculares, como a RT-PCR são usados por serem métodos
sensíveis e rápidos para detectar alfaviroses. Essta técnica amplifica os genes nsP1,
nsP2 e E1, pois utilizam primers genéricos de Alphavirus ou primers específicos do
vírus37. O método de diagnóstico molecular, assim como o isolamento viral, é
dependente do período de viremia. Para o CHIKV essa técnica é eficaz durante a fase
inicial de 1 a 8 dias da doença, antes de uma resposta imunológica efetiva38,39.
Em contra partida, os ensaios sorológicos são amplamente realizados, pois não
dependem do período de viremia, já que identificam anticorpos contra o vírus e detecta
tanto uma infecção recente, dosagem de imunoglobulina IgM como uma infecção
ocorrida no passado, dosagem de IgG. Na infecção por CHIKV a IgM torna-se positiva
de 5-7 dias após o início da infecção, persistindo por vários meses11,
25,7
. Entretanto,
não se recomenda fazer unicamente a sorologia como diagnóstico , quando se quer
identificar um vírus específico, pois pode ocorrer reação cruzada entre os anticorpos
8
produzidos por infecções por CHIKV e MAYV (Semliki forest complexo), que podem
circular cocomitantemente numa mesma região21.
Atualmente a terapia para infecção por CHIKV, é administrada apenas para tratar
os sintomas, pois ainda não há um tratamento antiviral específico disponível. Para os
primeiros sinais primários, característicos da infecção, que incluem febre e dores nas
articulações, são utilizados analgésicos, antitérmicos e anti-inflamatórios
40
. Nos casos
de artrite crônica que geralmente se instala após a fase aguda na infecção por CHIKV,
é utilizado fosfato de Cloroquina que demostrou-se eficiênte ao proporcionar alívio da
dor nos doentes que não obtiveram uma boa resposta aos fármacos anti-inflamatórios
não hormonais. Além dessas drogas, ações como repouso e ingestão de líquidos são
recomendadas41. Uma resposta imunitária vigorosa limita a doença produzida por
CHIKV e confere proteção contra uma re-infecção42.Embora ainda estejam sendo
estudadas, a vacina para CHIKV podem ser uma opção preventiva e terapêutica para o
futuro43.
1.6. Dispersão do CHIKV
Nas regiões onde a doença é endêmica, pacientes em estágio inicial da infecção,
que se deslocam para áreas onde não há circulação viral, podem carrear o vírus e
serem responsáveis por disseminar o CHIKV em locais onde há a presença do vetor8,44.
Em 2007, o CHIKV foi encontrado em transmissão autóctone (humano-paramosquito-para-humano) no norte da Itália após ter sido introduzido por um viajante
infectado pelo vírus, advindo da Índia (caso importado)45. Na França 808 casos
importados foram registrados entre 2005 e 2006, assim como relato de casos na
Alemanha e Noruega9 e nos seguintes países: Albânia (1979)46, Itália (1990)47, França
(1999)48, Suíça (2003)49, Grécia (2003)50, Espanha (2004)51, Bélgica (2004)52. Com a
identificação do Ae. albopictus, demostrou-se, a grande vulnerabilidade da Europa às
arboviroses9, 53,54. A partir de então, a preocupação com a propagação do vírus atingiu
seu pico em todo o mundo. Casos importados também foram identificados no ano de
2010 em Taiwan, na França, nos Estados Unidos e no Brasil, trazidos por viajantes
advindos da Ásia45.
9
No Brasil, registrou-se o primeiro caso importado da doença na cidade do Rio de
Janeiro em Agosto de 2010, por um paciente do sexo masculino que havia viajado para
Sumatra, na Indonésia55.
O primeiro surto documentado de Chikungunya com transmissão autóctone nas
Américas, aconteceu em dezembro de 2013, onde foram registrados casos autóctones
da doença, em países mais próximos do Brasil, como os do Caribe, como pode ser visto
na Figura 4. Na parte francesa da ilha caribenha de St Martin, foram confirmados
laboratorialmente dois casos de CHIKV. Desde então, a transmissão local foi
confirmada na parte holandesa da ilha (St Maarten)57.
Figura 4: Introdução e distribuição dos genótipos asiáticos e o ECSA do CHIKV nas Américas.
56.
Adaptada de PAHO-WHO, 2015
Em 12 de Setembro de 2014 o Brasil registrou o primeiro caso de Chikungunya por
transmissão autóctone no estado do Amapá , e na semana seguinte, uma segunda
10
introdução do vírus também foi registrada na Bahia (Figura 4). Ainda em 2014, desde a
introdução do vírus, na semana epidemiológica (SE) 37 até a SE 53, foram registrados
3655 casos suspeitos de Febre por Chikungunya (FC) no Brasil, sendo 140 confirmados
por critério laboratorial; 2.628 por critério clínico-epidemiológico; 479 continuavam sob
investigação e 408 foram descartados. Já em 2016, foram notificados 169.656 casos
prováveis de Chikungunya no país (até a SE 27) e cerca de 63.000 casos foram
confirmados. No cenário atual, todos os estados da Federação já apresentaram casos
confirmados da doença, totalizando cerca de 2.154 municípios acometidos (Figura 5). O
Nordeste tem apresentado a maior taxa de incidência entre as demais regiões do país
(267,8 casos por 100 mil habitantes), seguida pela região Norte (27,5), em que o estado
do Amazonas registra uma taxa de incidência de 14,4 casos por 100 mil habitantes. Em
geral, foram confirmados laboratorialmente 38 óbitos, e a média de idade entre eles foi
de aproximadamente 71 anos: Pernambuco (25); Paraíba (2); Rio de Janeiro (2); Rio
Grande do Norte (5); Ceará (2); Maranhão (1) e Alagoas (1)58.
Figura 5: Casos notificados e confirmados de febre de chikungunya por município de notificação,
58.
até a Semana Epidemiológica 27, Brasil, 2016
11
No Brasil, o MAYV é considerado endêmico e responsável por surtos esporádicos
na região Amazônica e afeta principalmente pessoas que habitem e trabalhem em
ambiente rural, em contato com a floresta59. Com a introdução do CHIKV nesta região,
tornou-se mais um fator de confusão para o diagnóstico diferencial, já que as
apresentações clínicas do MAYV e CHIKV se sobrepõem, pois ambas se caracterizam
por febre alta com comprometimento articular. Além disso, a reatividade cruzada entre o
MAYV e CHIKV tem sido relatada, devido a suas relações antigênicas, mas não se
sabe se a exposição prévia ao MAYV fornece proteção contra CHIKV60, 61.
Outro fator preocupante para a saúde pública é a distribuição geográfica dos
Alphavirus que tem se expandido acompanhado do aumento das viagens em todo o
mundo62, 8.
Nos últimos anos o crescente processo de globalização tem favorecido a alta
mobilidade de pessoas entre as diversas regiões do mundo. Concomitante a isso,
mudanças climáticas e a alta infestação por Ae. Aegypti e Ae. Albopictus em áreas
urbanas e periurbanas, favorecem a propagação e amplia o risco de transmissão de
doenças. Dessa forma, o interesse em estudar a prevalência do CHIKV, foi despertado
pelo risco de emergência de epidemias desse vírus no Brasil e no estado do Amazonas.
O clima é favorável, há a presença dos vetores competentes, além do seu estratégico
posicionamento geográfico, atrelados a grande circulação de turistas que podem ser
possíveis carreadores ou disseminadores dessas infecções, potencializando o risco de
ocorrência de surtos de infecções por esse vírus.
A semelhança do quadro clínico entre algumas arboviroses, principalmente o estado
febril apresentado pelo paciente, dificulta fazer a diferenciação dos agravos e direcionar
para o correto diagnóstico e para a conduta mais adequada. Dessa forma fazem-se
necessárias ações de vigilância em saúde com direcionamento na abordagem
sindrômica, para distinguir as infecções febris, com foco principal nos vírus CHIKV.
12
Portanto a vigilância epidemiológica para Chikungunya, conduzida pela abordagem
sindrômica das doenças febris aguda, pode ser um método eficiente para monitorar
uma possível epidemia dessas infecções e observar o comportamento clínico da
mesma, na população no período de estudo.
13
2. OBJETIVOS
2.1 Objetivo geral
Estimar a prevalência de infecção por CHIKV em pacientes apresentando
síndrome febril assistidos na Fundação de Medicina Tropical- Heitor Vieira
Dourado/AM (FMT- HVD).
2.2 Objetivos específicos
Avaliar a positividade para CHIKV em amostras de pacientes febris oriundos de
abordagem sindrômica com diagnóstico negativo para dengue e malária.
Descrever as características demográficas, clínicas e laboratoriais da infecção
por Chikungunya na população estudada.
14
3. MATERIAIS E MÉTODOS
3.1. Modelo de estudo
O desenho de estudo proposto é do tipo exploratório descritivo de delineamento
transversal, baseado em dados oriundos dos resultados dos exames laboratoriais de
testes moleculares para CHIKV da análise de dados provenientes dos prontuários dos
participantes da pesquisa, através do sistema de prontuário eletrônico IDoctor,
atualmente em funcionamento na FMT-HVD.
3.2. Local e população de estudo
Esse projeto foi desenvolvido na Fundação de Medicina Tropical Dr. Heitor Vieira
Dourado (FMT-HVD) na cidade de Manaus-AM, e os ensaios moleculares para análises
das amostras foram realizados no Laboratório de Pesquisa em Virologia (LPV) da
Faculdade de Medicina de São José do Rio Preto (FAMERP).
A população do estudo foi constituída por pacientes que apresentarem até cinco
dias de doença febril aguda sem causa definida, que deram entrada no ambulatório de
doenças febris e no Pronto Atendimento (PA) da FMT-HVD entre 2014 e 2015, que
tiveram no seu diagnóstico resultados negativos para Dengue e Malária e que
aceitaram participar do presente estudo.
3.3. Procedimentos
3.3.1. Coleta de amostras
A coleta do material biológico foi realizada por técnicos em laboratório, onde
foram coletados 5 mL de sangue em tubo sem anticoagulante para o diagnóstico de
15
malária e dengue (Anexos VIII, IX, X). Nos casos negativos para tais infecções, a partir
da referida amostra foi retirada alíquotas de 500 - 1000µL em microtubos de 1,5 mL.
Tais microtubos foram armazenados na soroteca do laboratório de virologia da FMTHVD/AM a -80º C.
Ao fim do período estabelecido para a coleta, todas as amostras foram
preparadas e enviadas ao laboratório onde foram analisadas, sendo, portanto,
armazenadas em suportes e embaladas em plásticos, colocadas em isopor contendo
gelo seco para manter temperatura de -80º C, seguindo o protocolo da empresa de
transporte aéreo e encaminhado ao Laboratório de Pesquisa em virologia da FAMERP,
local onde foram realizados os testes moleculares para o diagnóstico dos vírus
Chikungunya.
3.3.2 Extração de RNA
A extração de RNA de 171 amostras de soro negativas para dengue, o RNA viral
foi extraído a partir de 140 µl de soro, utilizando o Qiamp Viral RNA Kit (Qiagen®), de
acordo com as recomendações do fabricante. O RNA foi eluído em 60µl de tampão
AVE e conservado a – 80º C até o momento do uso.
3.3.2.1Primers utilizados qRT-PCR
Os primers específicos que foram utilizados na detecção de CHIKV se ligam a
região do gene do capsídeo (Tabela 1).
Tabela 1. Primers que foram utilizados na detecção de CHIKV63
Primers
CHIKV 874
CHIKV 961
CHIKV 899
FAM
Posição no
genoma
874-894
961-942
899-923
Sequência (5’ - 3')
AAAGGGCAAACTCAGCTTCAC
GCCTGGGCTCATCGTTATTC
Referência
Lanciotti et
CGCTGTGATACAGTGGTTTCGTGTG al., 2008
16
3.3.3. qRT-PCR
A qRT-PCR segundo a metodologia descrita por Lanciotti et al., 200863.
3.3.3.1Primers utilizados na RT-PCR
Os primers específicos que foram utilizados na detecção de CHIKV se ligam a
regiões do gene do capsídeo (Tabela 2).
Tabela 2. Primers que foram utilizados na detecção de CHIKV64
Primers
CHIKV
WEA R
CHIKV
WEA F
Sequência (5'-3')
Amplicon
(pb*)
Referência
500
Plante et al.,
2011
TGGCCTTTAAGCGGTC
TATGGTCTTGTGGCTTTATAGAC
* pb: pares de base.
3.3.4 RT-PCR para detecção de CHIKV
A reação de PCR para a detecção de CHIKV, em que foi realizada uma etapa de
Transcriptase Reversa utilizando oligonucleotídeos específicos CHKF e CHKR, bem
como sondas específicas marcadas com corante de fluoróforo CXR64 (Plante K, et al.,
2011).
A reação de transcrição reversa (RT) foi realizada pela adição de 8 µl de RNA
em uma mistura contendo 4 µl de solução tampão (Quiagen) cinco vezes concentrada
(20 mM Tris-HCl, pH 7,5, 100 mM NaCl, 15 mM MgCl2), 1,0 mM de DTT (Dithiothreitol),
1,0 µl da mistura contendo 10 mM de dNTP (Deoxynucleoside Triphosphate), 1 µl do
primer CHIKV WEA R (15 µM), 1 µl do primer CHIKV WEA F (15 µM), 1,0 µL (40 U/ µL)
do inibidor de ribonuclease (RNaseOUT-Invitrogen, USA), 1 µl (200 U/µl) de enzima
17
transcriptase reversa (M-MLV RT-Invitrogen, USA) e água suficiente para completar 20
µl. A reação ocorreu seguindo as recomendações do fabricante.
A reação em cadeia da polimerase (PCR) consiste em 8 µl do produto da RT, 5
µl da solução tampão (qiagen) 10 vezes concentrada (200 mM Tris-HCl, pH 8,4, 500
mM KCl), 4 µl de MgCl2 a 25 Mm, 1 µl da mistura contendo 10 mM de dNTP, 1µl do
primer WEA R (15 µM), 1 µl do primer CHIKV WEA F (15 µM), 1 U da enzima
polimerase (Taq DNA polymerase recombinant-Invitrogen, USA) e água suficiente para
completar 50 µl. A mistura foi submetida a um passo de desnaturação inicial a 95ºC por
1 minuto, seguida por 35 ciclos de 95ºC por 1 minuto, 50ºC por 1 minuto e 72ºC por 2
minutos, finalizando com um ciclo de 72ºC por 5 minutos. As reações de RT-PCR foram
realizadas em termociclador Veriti Thermal Cycler (Applied Biosystem, USA).
3.3.5 Eletroforese em gel de agarose
Em todas as amostras foi realizada a eletroforese em gel de agarose a 1,5%
(peso/volume) com coloração de brometo de etídio, para se observar os amplicons à luz
ultravioleta. Precauções para se evitar contaminações foram seguidas, e controles
positivos e negativos foram utilizados em todas as reações.
3.4. Aspectos éticos
Toda pesquisa na ciência humana é uma interferência direta ou individual na vida
humana, por isso, independente da sua metodologia e objetivo, precisamos estar
atentos e críticos para avaliar os danos que elas podem causar à vida, nas suas
diferentes dimensões.
As amostras biológicas selecionadas para este estudo compõem um banco de
amostras (biorrepositório) da Gerência de Virologia, formado a partir de um projeto
guarda-chuva intitulado “DOENÇAS FEBRIS AGUDAS EM UMA UNIDADE TERCIÁRIA
DE
SAÚDE
DA
AMAZÔNIA
OCIDENTAL
BRASILEIRA:
ESTUDOS
DE
18
EPIDEMIOLOGIA, CARACTERIZAÇÃO CLÍNICA E DIAGNÓSTICA”, aprovado pelo
CEP local (Aprovação N° 2015/2010 - Processo N° 2337/2010), para o qual os
participantes consentiram em participar por meio da assinatura de um TCLE.
Nos casos de confirmação de diagnóstico para CHIKV, foi realizada a busca ativa
dos participantes e seguimento ambulatorial integral, conforme necessidade, além da
notificação dos casos à Vigilância Epidemiológica da FMT-HVD e para as instâncias
municipais de saúde dos casos confirmados.
3.5. Análise de dados
As informações clínicas e laboratoriais dos pacientes resgatadas no IDoctor, assim
como os dados referentes aos testes moleculares, foram armazenadas no Microsoft
Office Excel 2007 e após sua consolidação a análise foi realizada no Software Stata
13.0.
A prevalência da infecção por CHIKV foi estimada e a relação com dados sócioepidemiológicos, foi feita aplicando o teste Qui-quadrado (Teste Exato de Fisher’s). Na
análise das variáveis contínuas (ou numéricas), foi realizado um teste de normalidade
(Shapiro wilk) e para dados paramétricos foi aplicado o teste t Student e dados não
paramétrico o teste Mann-Whitney. Para os testes acima citados, a significância
estatística foi considerada quando p<0.05.
19
4. RESULTADOS
Foram analisadas por qRT-PCR 171 amostras de soro de pacientes febris, sendo
que seis amostras apresentaram-se positivas para CHIKV (Figura 5).
Laboratório de Virologia FMT-HVD/AM
2014-2015 (n=1079)
2014
2015
Malária(+)
Dengue(+)
Malária(+)
Dengue(+)
2018
156
725
62
Malária(-) e Dengue(-)
961
* P(+)Positivos
* N(-) Negativos
até 5 dias de febre
IgM MAYV
171
N=128
Mayaro (-)
171
Prevalência
3,5%
FAMERP qRT-PCR
CHIKV (+)
6
Figura 6: Fluxo e triagem das amostras dos pacientes febris da FMT-HVD entre 2014-2015, e
aplicação de diagnóstico molecular em 171 amostras realizado na FAMERP.
20
Dentre os pacientes que foram atendidos na FMT-HVD, que apresentaram
síndrome febril e que eram considerados casos suspeitos de infecção por CHIKV, no
período entre Janeiro de 2014 a Junho de 2015, aproximadamente 55% dos mesmos
eram do gênero feminino. Porém, ao analisar a prevalência por sexo entre os pacientes
com diagnóstico positivo, a maioria pertencia ao sexo masculino (60%).
No instante da primeira consulta, realizada no ambulatório de doenças febris ou
no PA da instituição, que é a porta de entrada para esses pacientes, além de relatarem
febre (n=158) como sintomatologia mais frequente, também foram mencionados pelos
mesmos, vários outros sintomas que estavam associados ao estado febril. Entretanto,
alguns desses sintomas, destacaram-se por estarem em maior evidência de acordo
com a ordem de prevalência, respectivamente: cefaleia (100%), mialgia (100%),
calafrios (100%), artralgia (98%), dor retro ocular (97,9%) e dor nas costas (96,5%)
(Tabela 1).
Para o referido estudo foram selecionados os pacientes que estavam com até 5
dias de febre. Sendo assim, foi analisada a frequência em dias, em que o paciente
apresentando febre, chegou ao seu primeiro atendimento na FMT-HVD. Dessa forma,
foi observada uma maior intensidade na procura pelo atendimento por esses pacientes,
entre o terceiro e o quinto dia no curso do seu estado febril (Tabela 1).
Na realização da triagem após o procedimento de biologia molecular, dentre os 6
pacientes positivos para CHIKV (Figura 7), em apenas 5 possuíam informações
pessoais dos prontuários no sistema IDoctor. Dessa forma, foi constatado que a média
de idade entre os pacientes CHIKV positivos era de 24 anos, a média das idades não
apresentaram diferença estatística quando comparamos o grupo de pacientes positivos
e os negativos (p value 0,1950) (Tabela 2).
Ainda analisando a positividade de CHIKV em 6 pacientes das nossas amostras,
foi possível observar a prevalência, objetivo do nosso estudo. Assim, contatamos que a
mesma foi de 3,5%, numa população de 171pacientes febris com até 5 dias de febre.
21
Tabela 2: Frequência dos principais sintomas apresentados pelos pacientes febris (N=171) da
FMT-HVD entre 2014-2015.
Principais Sintomas
Febre (n=158)
1oDia
2oDia
3oDia
4oDia
5oDia
Artralgia (n=50)
Cefaleia (n=110)
Mialgia (n=97)
Dor nas costas (n=29)
Prurido (n=25)
Calafrios (n=55)
Náuseas (n=16)
Vômito (n=21)
Diarreia (n=17)
Dor retrocular (n=47)
Dor abdominal (n=29)
Frequência (%)
5,7
12,7
27,2
25,31
29,1
98
100
100
96,5
96,2
100
93,7
95,2
94,1
97,9
96,5
Em relação as variáveis demográficas, ao observarmos a média de idade entre
os pacientes CHIKV negativos comparada aos pacientes CHIKV positivos, podemos
inferir que não houve diferença estatística entre esses dois grupos, pois o p value foi
0,1950.
A proporção na variável relacionada ao sexo entre CHIKV positivo e CHIKV
negativo, também não se constatou significância estatística entre os mesmos, visto que
o p value foi 0,520.
Quando avaliada a variável que corresponde aos pacientes que residem na
capital do estado do Amazonas, evidenciou-se que uma diferença estatisticamente
significativa (p value 0.0019). Isso por que 95,2% dos pacientes CHIKV negativos
residiam em Manaus, já entre os CHIKV positivos, 40% residiam também na capital,
Manaus.
22
Tabela 3: Associação das variáveis demográficas entre pacientes CHIKV negativos e CHIKV
positivos
CHIKV negativos (n=165)
CHIKV positivos p
(n=5)
Idade - média (DP)
34,2 anos (18,0)
24,3 anos (16,1)
0,1950*
Sexo masculino - nº (%)
75 (45,5)
3 (60,0)
0,5200**
Sexo feminino - nº (%)
90 (54,5)
2 (40,0)
Residente em Manaus - nº (%)
157(95,2)
2 (40,0)
Residentes outras localidades - nº (%)
8 (4,8)
3 (60,0)
Variáveis
* Teste t
0,0019**
** Teste exato de Fisher DP = Desvio padrão
Obs.: houve mais um caso positivo em que não havia registro das características demográficas
Quanto aos parâmetros laboratoriais, não foi observada diferenças estatísticas
das variáveis hematológicas analisadas, entre pacientes CHIKV positivos e os CHIKV
negativos (Tabela3).
Tabela 4: Associação dos parâmetros laboratoriais entre pacientes CHIKV negativos e CHIKV
positivos
Parâmetros
Laboratoriais
Hematócrito (%)
Leucócitos (mm³)
Linfócitos (mm³)
Trombócitos (mm³)
*Teste T
* Teste Mann-Whitney
CHIKV negativos (n=145)
CHIKV positivos (n=6)
Média
Desvio Padrão(SD)
Média
Desvio Padrão(SD)
40,6
04,5
41,2
06,5
6544,9
3247,5
7756
3202,4
2202,7
1280,7
2370.4
1294,6
243137,9
104961,7
221400
49792,6
p value
0,5780*
0,3250**
0,4936**
0,6715**
23
Figura 7: Curvas de amplificação qRT/PCR para detecção do vírus Chikungunya em amostras
clínicas de pacientes febris do Ambulatório de Síndrome Febril da FMT-HVD, em Manaus/AM
segundo a metodologia de Lanciotti et al., 2008.
24
5. DISCUSSÃO
Entre os anos de 2014 e 2015, 171 amostras sorológicas de indivíduos febris
com suspeita clínica para CHIKV e MAYV foram coletadas pelo Laboratório de Virologia
da FMT-HVD.
Antes de serem encaminhadas para São José do Rio Preto- SP a fim de se
realizar diagnóstico molecular, cerca de 75% (n=128) das amostras foram previamente
testadas IgM para MAYV (ANEXO XI). Embora não seja o método mais indicado para
detecção do agente etiológico, uma vez que pode acontecer reação cruzada com outros
vírus do complexo Semliki forest sorogroup19, principalmente Una vírus (UNAV), que é
um subtipo de MAYV65, nenhuma das amostras apresentou resultado MAYV positivo.
A avaliação realizada nos prontuários dos participantes da pesquisa, através do
sistema de prontuário eletrônico, IDoctor, utilizado na FMT-HVD, foi insuficiente para
traçar um perfil (quadro clínico, laboratorial e epidemiológico) mais detalhado,
principalmente dos pacientes CHIKV positivos, devido a dados incompletos ou
inexistentes.
Ao tentarmos traçar um perfil geral dos sintomas referidos pelos pacientes febris
durante a primeira consulta, constatamos que, a média da idade entre estes foi 34 anos
e prevalência do sexo feminino. Quanto à sintomatologia, além da febre, cefaleia,
mialgia, calafrios, artralgia e dor retro ocular, foram os que mais se destacaram por sua
frequência. Esses mesmos sintomas, também foram característicos do quadro clínico
de Chikungunya descrito pela OMS (2014), em que febre, artralgia e cefaleia, se
destacam como alguns dos sintomas mais comuns característicos desta arbovirose66.
Entre os positivos para CHIKV, o sexo masculino foi mais acometido e a faixa etária
média entre foi de 24 anos. Dentre os pacientes acometidos, nenhuma criança foi
diagnosticada para essa infecção.
Um estudo realizado no Siri Lanka em 2007 caracterizou a infecção em
pacientes com doença febril indiferenciada. Foi possível observar que dentre os
pacientes febris avaliados, mais homens foram acometidos, contrastando com os
25
pacientes do nosso estudo. Já a faixa etária média entre estes mesmos pacientes foi
aproximadamente
31
anos,
apresentando
características
semelhantes
a
que
encontramos. Ainda no Siri Lanka, pacientes positivos para CHIKV eram predominante
masculinos, dados estes que reforçam a concordância com nosso estudo67.
Em outro trabalho, Chakravarti et al. encontrou características diferentes. Diante
do estudo realizado na região norte da Índia- Delhi em 2010, utilizando testes
sorológicos em 324 pacientes febris, mulheres diagnosticadas com resultado positivo,
foram mais afetadas comparadas aos homens (1: 1.34). Quando analisado o grupo de
idade mais comum, foram mais acometidos os que tinham entre 31-41 anos. Já as
crianças foi o grupo menos afetado, 3,3%68.
Quanto a variável relacionada ao gênero, o mesmo aconteceu no estudo feito em
Kerala 2007. Foram diagnosticados clinicamente 354 casos de CHIKV positivos, sendo,
portanto, maiores de 35 anos e o gênero feminino os mais atingidos69.
Ao observar os estudos descritos anteriormente, Não há consenso sobre o
gênero mais acometido pelo CHIKV. Porém, ao avaliarmos a infecção entre as idades,
os adultos parecem ser mais afetados quando comparados às crianças e a população
acima de 60 anos.
Quando analisarmos os sintomas que se destacam na apresentação deste
agravo, um estudo que compara DENV e CHIKV entre viajantes, mostra as proporções
em que sintomas como cefaléia, mialgia, prurido e características do exantema foram
semelhantes em ambos os grupos, enquanto que artralgias foram significativamente
mais frequentes no grupo CHIKV70.
Nas Ilhas da Reunião, quando observado os sintomas mais frequentes em um
surto de CHIKV, a artralgia e a febre foram os dois principais sintomas, respectivamente
que mais se destacaram54.
Em Kerala 2007, segundo um estudo realizado por Kannan et al., ao observar os
sintomas que frequentemente caracterizavam pacientes positivos para CHIKV, além da
febre (100%), a artralgia (99,4%), mialgia (99,4%) e dor de cabeça (97,5%) foram os
que tiveram uma maior frequência69.
26
No estudo direcionado por Reller et al., quando observados os sintomas do
grupo CHIKV positivo, dor muscular e articular se sobrepõem quando comparadas ao
DENV e os dois grupos são igualmente propensos para cefaléia67.
Apresentações sintomatológicas atípicas têm sido relatadas em casos de
pacientes CHIKV positivos portadores de doenças subjacentes, como descritos no
estudo realizado nas Antilhas francesas, no Caribe em 2014. Foi possível observar que
além da febre e artralgia, síndrome de Guillain–Barré, encefalite e sepse severa
pareciam ter uma maior associação com doenças autoimunes que com hipertensão
arterial71. Características atípicas também foram encontradas em pacientes CHIKV
positivos registradas por Economopoulou et al. O estudo desenvolvido nas Ilhas da
Reunião observou em pacientes portadores de comorbidades, características clínicas
que nunca tinham sido associadas à FC, como dermatose bolhosa, pneumonia e
diabetes mellitus72. Os dados encontrados nos estudos citados acima, não apresentam
concordância com o nosso estudo, pois não identificamos quaisquer manifestações
clínicas indiferentes nos pacientes CHIKV positivos no Amazonas.
Embora os sintomas mais comuns sejam frequentemente mencionados pelos
pacientes acometidos por CHIKV, a apresentação clínica desta doença, pode ser
confundida
com
consistentemente
uma
variedade
encontrados
de
podem
doenças
ser
infecciosas.
considerados
Poucos
sintomas
exclusivamente
para
Chikungunya. No entanto, a existência de dor articular incapacitante, parece ser
específica de CHIKV7.
No nosso estudo, também avaliamos a contagem dos elementos sanguíneos.
No entanto, não foram observadas alterações hematológicas em pacientes CHIKV
negativos e positivos, o que difere de achados de um grande surto de CHIKV nas Ilhas
da Reunião que aconteceu entre 2005 e 2006, e que registraram a linfopenia seguida
de trombocitopenia moderada como a anormalidade mais comum em pacientes
positivos para CHIKV54. Essa mesma característica também é descrita pelo Centers for
desease Control and Prevention (CDC)73.
27
O contrário foi observado em pacientes de um concomitante surto de DENV e
CHIKV ocorrido no Gabão em 2010. Os dados biológicos dos pacientes em estudo
foram quantificados e a contagem de seus linfócitos mostrou-se inferior em pacientes
com DENV. Hochedez et al., observou as características hematologicas entre viajantes
apresentando CHIKV e DENV. Sendo assim, foram significativamente mais frequentes
quando comparados com pacientes positivos para CHIKV74, 70.
Estudos como esses mostram que embora o linfopenia pode ou não estar
presente em pacientes CHIKV positivos, e dessa forma não pode ser considerada
especifica do CHIKV, principalmente quando outras infecções de manifestações clínicas
semelhantes se fazem presentes numa mesma região. Portanto exames laboratoriais
não definem o diagnóstico dessas doenças, sendo apenas auxiliares neste processo.
Embora alguns sinais e sintomas de indivíduos podem sugererir CHIKV ou
DENV, não existe características clínicas exclusivas para diferenciar estas duas
doenças. Portanto, alguns sintomas assim como algumas características laboratoriais,
podem estar mais evidenciados em uma infecção que em outra. O problema do
diagnóstico diferencial pode ser agravado durante surtos concomitantes de CHIKV e
DENV em uma área endêmica de malária, como no Amazonas. As alterações
hematológicas dessas infecções, também são semelhantes às observadas em outras
viroses. Nesses casos, uma característica laboratorial importante dos pacientes com FC
é a linfopenia, que em muitos casos, encontra-se mais acentuada que em outras
infecções. Essas características podem ser observadas na tabela do CDC em que
compara dados clínicos e hematológicos entre CHIKV e DENV73.
No advento da imersão de novos vírus em território brasileiro, como tem
acontecido nos últimos anos, o diagnóstico diferencial da FC deve ser realizado com o
DENV e ZIKV, por apresentar similaridade entre as manifestações clínicas tornando-as,
em muitos dos casos, praticamente indistinguíveis e podem ser confundidas
particularmente em áreas onde elas circulam simultaneamente75, 76,7. Assim, podemosse dizer que essas doenças por serem clinicamente e laboratorialmente semelhantes,
há a necessidade de confirmação laboratorial com foco no agente etiológico para a sua
identificação.
28
Desde 1779, epidemias por CHIKV têm sido registradas, mas foram
equivocadamente documentadas como surtos de DENV74. Um ponto a se ressaltar no
nosso estudo, é que dentre todos os pacientes com febre (os dados febris foram
relatados por 158 pacientes), nenhum deles teve em seus registros hipótese
diagnóstica para CHIKV, sendo, portanto, DENV, a suspeita diagnóstica mais comum.
O mesmo aconteceu em Sri Lanka em 2007, quando o diagnóstico presuntivo inicial,
abordava outras doenças febris, discordando da infecção em questão67.
O CHIKV chegou as Américas em 2013 e este fato causou uma grande
expectativa da introdução do vírus no Brasil. Desde então, o sinal de alerta foi
acionado, uma vez que se observa um cenário amplamente infestado pelo Ae. aegypti,
que está presente em todas as regiões brasileiras. Já o Ae. albopictus é mais
restritamente encontrado, porém altamente competente para a transmissão do genótipo
ECSA, uma vez que mutações o tornaram possivelmente mais virulento e o mesmo já
se encontra em circulação no país16, 24,77.
Os primeiros casos autóctones de CHIKV no Brasil foram confirmados no
Oiapoque, Estado do Amapá, em 13 de Setembro de 2014. Sete dias depois, casos
autóctones foram também confirmados em Feira de Santana, Bahia78, 24.
Análises epidemiológicas e filogenéticas foram realizadas a fim de possibilitar a
identificação da introdução do genótipo ECSA, que teve sua origem de Angola para
Feira de Santana, em Junho de 2014. Usando os mesmos métodos, casos autóctones
do genótipo asiático, na região do Oiapoque, no Amapá, foram identificados em
Setembro de 2014 e parece que o mesmo, foi introduzido múltiplas vezes, provenientes
de áreas epidêmicas na América do Sul e no Caribe. O genótipo asiático que circula no
Amapá foi importado da Guiana Francesa24.
No Amazonas, em junho de 2014 foi registrado o primeiro caso de CHIKV
importado de Porto Príncipe/Haiti no estado, neste ano foram notificados 31 casos
suspeitos sendo confirmados 9 (nove), todos importados. Os quatro primeiros casos
autóctones registrados da infecção na capital do estado, aconteceram em Julho de
2015. Em 2016, foram notificados 165 casos, sendo confirmados 12 casos, destes 07
eram importados e 05 da capital do estado79.
29
Ao contrário do que se sabia sobre o histórico de infecção pelo CHIKV no
Amazonas, o presente trabalho mostra a circulação do CHIKV desde Março de 2014,
antes dos principais órgãos de saúde no Brasil, notificarem os primeiros casos da
infecção.
Ao analisar os casos positivos quanto à periodicidade e a localidade em que
aconteceram as infecções por CHIKV, nosso estudo identificou casos da doença na
capital do Amazonas, Manaus (3), e em outros três municípios do interior do estado:
Urucurituba (1), Iranduba (1) e Eirunepé (1). O que chama atenção é o registro nos
prontuários dos pacientes, referindo o período em que deram entrada para a primeira
consulta apresentando sintomas da infecção.
Seguindo a ordem cronológica em que aconteceram os casos da doença no
Amazonas, o primeiro registro do paciente de 48 anos, sexo masculino, na FMT-HVD,
aconteceu em 10/03/2014. O mesmo era residente no distrito de Augusto Montenegro,
no município de Urucurituba, no interior do estado, não era militar, assim como também,
não esteve em outras regiões fora do estado do Amazonas. O segundo paciente, cujos
dados da infecção podem ser considerados os mais remotos (25/03/2014), tinha 2
anos, sexo feminino e residente em Manaus, porém o bairro não estava descrito no
prontuário.
A partir da confirmação laboratorial da doença, pudemos analisar a prevalência
de CHIKV em nossas amostras de 171 pacientes até o quinto dia de febre. Assim
pudemos constatar uma prevalência de 3,5%. Quando comparamos com um estudo
realizado na Tanzânia entre 2013-2014, que também avaliou a mesma taxa em
pacientes agudos para CHIKV, pudemos observar uma prevalência de 4,2%. Dessa
forma podemos inferir que a prevalência em pacientes agudos na Tanzânia foi superior,
porém não tão divergente quando comparada com a mesma taxa de prevalência do
nosso estudo80.
Também analisamos a taxa de incidência de CHIKV no Amazonas (0,15
casos/100.000 habitantes), a partir do resultado das nossas amostras, relacionando
com a mesma variável no estado da Bahia (22,6 casos/100.000 habitantes)58 durante o
mesmo período do nosso estudo (Jan-2014 a Junho 2015), e podemos observar que a
30
taxa no Amazonas é bastante inferior. Porém, aspectos geográficos e ecológicos estão
relacionados aos quadros epidemiológicos na região Amazônica brasileira. A extensão
territorial do estado e as vias de acesso predominantemente fluviais, assim como
também a distribuição geográfica populacional, dificultam o acesso das populações
mais distantes da capital, do centro de referência para diagnóstico de doenças febris,
FMT-HVD, que se encontra em Manaus. Assim podemos inferir que há uma
subnotificação do agravo de interesse e por isso, há a necessidade de descentralizar e
hierarquizar a rede de serviços de saúde.
Manaus tem 1.802.014 habitantes, está situada à margem do rio Solimões e
recebe um grande contingente de pessoas do Brasil e do mundo. Urucurituba está a
192 km da capital e encontra-se localizado na mesorregião central do Amazonas e
microrregião de Itacoatiara. Tem um total de 21.140 habitantes e faz limite com o
município de Parintins, próximo de região de fronteira com os estados do Pará e
Roraima81.
Assim como as demais cidades que se localizam na região amazônica, Manaus
e Urucurituba apresentam grande umidade, altos índices pluviométricos, elevadas
temperaturas, caracterizando o clima tropical71. A grande susceptibilidade da população
a essa infecção e a alta infestação de mosquitos do gênero Aedes sp, que também
podem ser comumente encontrados, favorecem a disseminação rápida do vírus82,
83
.
Dessa forma, essas cidades, assim como o estado do Amazonas, são de potencial risco
para epidemias por CHIKV.
Outra característica que tem apontado para o risco dessa infecção no estado, é
que o Amazonas tem recebido um constante fluxo de pessoas de todas as partes do
mundo. O processo de globalização, que tem facilitado o grande fluxo de pessoas entre
países e continentes, é o reflexo de estilo de vida moderno que pode ser o
intermediador na introdução de novos agentes infecciosos, assim também como
exportador de doenças para outras regiões do mundo, proporcionando a disseminação
e amplificando a propagação de agravos, causadores de grandes epidemias.
31
Por ser o maior centro financeiro da Região Norte, a cidade de Manaus também
é um dos maiores centros industriais do país. Empresas de grande porte estão situadas
no polo industrial da cidade e isso favorece para que empreendedores do Brasil e do
mundo desembarquem por lá. Outro fator importante que atrai turistas de diversos
países e de outras regiões do país é a Floresta Amazônica brasileira, que concentra
uma vasta biodiversidade natural e o grandioso festival folclórico na cidade de Parintins,
que e é conhecido mundialmente.
O fluxo contínuo entre pessoas para diferentes regiões e países, também pode
ser observado em outras ocasiões no Amazonas. Desde 2004, tropas do exército
brasileiro, inclusive militares amazonenses, são enviadas semestralmente em missão
para o Haiti, a fim de restaurar a ordem e a paz no país84, 85. Logo após acontecer o
terremoto em Porto Príncipe no Haiti em 2010, que devastou boa parte do país, a
capital amazonense tem recebido um grande número de refugiados haitianos. Uma
importante característica que favoreceu o acesso dos refugiados à capital amazonense,
foi o posicionamento geográfico do estado do Amazonas em relação às ilhas
Caribenhas. Também nos últimos anos, Manaus recebeu um grande contingente de
turistas nacionais e internacionais, por ter sediado grandes eventos esportivos como a
Copa do Mundo em 2014 e os Jogos Olímpicos 2016, colocando essas pessoas e a
população local em risco para novos agravos86, 87.
No entanto, as aglomerações que normalmente acontecem nesses eventos e em
outras situações acima mencionadas, são de grande risco para a introdução de novos
agentes etiológicos. Por isso, doenças transmitidas por vetor, como as arboviroses, tem
sido um grande problema para a saúde pública, pois ainda parecem ser negligenciadas
pelas autoridades de saúde e tem colocado em risco a vida de milhares de pessoas que
participam de eventos em massa, principalmente em países tropicais86, 87,88.
O CHIKV está circulando no Caribe desde 2013, e embora não se saiba a
procedência deste arbovírus no Amazonas, não podemos descartar a possibilidade de
o vírus ter emergido diretamente no estado proveniente dessa região. É importante
destacar também que o estado faz fronteira com países como a Colômbia e a
32
Venezuela onde CHIKV é endêmica desde 201456 e que frequentemente recebem a
visita dos amazonenses, seja por turismo ou por relações comerciais e esse fluxo pode
ter facilitado a entrada da infecção por CHIKV nesta região.
O CHIKV foi introduzido imperceptivelmente no estado, e as manifestações
brandas da doença apresentadas pelos pacientes CHIKV positivos, somadas a
sobreposição de outras infecções na região, confundindo o CHIKV com outros agravos,
podem ter intimidado os profissionais em arriscar fazer os primeiros diagnósticos da
infecção na região (hipótese diagnóstica), favorecendo a propagação da doença no
Amazonas.
Todas as situações e eventos mencionados anteriormente são de fundamental
relevância para a saúde pública do país e especialmente do estado do Amazonas. A
susceptibilidade da população relacionada aos elevados índices de infestação de
vetores, atrelado a grande circulação de turistas internacionais, assim como de
brasileiros que visitam regiões endêmicas de doenças ainda inexistentes no Brasil,
concentram elementos que potencializam a vulnerabilidade para introdução de novos
agravos e a disseminação de doenças transmitidas por mosquitos67. Não menos
importante, doenças endêmicas na região amazônica como o MAYV e a Malária,
também podem ser exportadas para outras regiões, sendo possíveis causadores de
grandes epidemias89, 90,91.
No Brasil, analisando o cenário epidemiológico atual, o que enxergamos são
grandes epidemias por CHIKV. Uma vez que fatores importantes como a circulação do
vírus, clima favorável, vetor competente e população imunologicamente virgem para a
infecção, favorecem estabelecimento do CHIKV no país24. Dessa forma, faz-se
necessário implementar mecanismos de ações de vigilância de doenças emergentes,
como o principal objetivo de controle a futuras epidemias. Sabemos que será sempre
um desafio manter uma vigilância efetiva, principalmente pela extensão territorial do
país, e também do estado do Amazonas, que dificulta realizar adequadamente este
processo.
A efetividade da vigilância do CHIKV depende do diagnóstico rápido. Devido aos
elevados custos no investimento de RT-PCR para toda população, disponibilizar testes
33
de diagnósticos rápidos, poderia ser um método eficiente, favorecendo o diagnóstico
preciso e adequada abordagem terapêutica, principalmente para regiões isoladas e de
difícil acesso, como no interior do Amazonas.
Diante de todo o contexto, podemos inferir que o nosso estudo é relevante para a
saúde pública, pois contribuiu para a vigilância epidemiológica e rastreamento de
infecções por esse vírus, principalmente para o entendimento da introdução do CHIKV
no estado do Amazonas e no Brasil. Uma vez que o CHIKV já se encontrava circulando
em cidades do interior e da capital do Amazonas, contrariando outros estudos quanto à
cronologia da introdução do vírus no Brasil. Sendo assim, observando os dados da
infecção no paciente proveniente de Urucurituba, é possível que o mesmo possa ser o
primeiro caso registrado da doença no Amazonas e no país, visto que, não foram
relatados previamente outros casos com essas características.
Dessa forma, ressaltamos a necessidade de intensificar as ações de vigilância
entomoepidemiológicas para se evitar surtos explosivos na região e analisar as
características filogenéticas do CHIKV no estado, comparando-as com os genótipos
encontrados nas regiões de fronteira com o Amazonas, assim como também de outros
estados e países, a fim de se compreender a origem e a procedência do CHIKV que
circula nesta região.
34
6. Conclusão
As análises realizadas durante o estudo demonstram que o CHIKV estava em
circulação no Amazonas e até mesmo no Brasil, antes do que se conhecia pelos órgãos
de saúde brasileiros.
O estudo permitiu observar o momento em que o vírus estava em circulação no
estado e a forma como se manifestou clinica e epidemiologicamente, caracterizando um
perfil de comportamento da infecção na população amazonense.
A prevalência do CHIKV foi baixa, possivelmente vinculada a questões de
acesso a serviços de saúde. A grande extensão territorial do estado e as vias de
acesso predominantemente fluviais tem dificultando o diagnóstico nas regiões mais
afastadas, sugerindo a possibilidade de sub-notificação e disseminação desse agravo
no Amazonas. Por isso, há a necessidade de hierarquizar e descentralizar a rede de
serviços de saúde.
A partir deste estudo será possível realizar outros trabalhos que ajudarão a
identificar o(s) genótipo(s) que circula(m) na região através de análises filogenéticas, e
compreender se a linhagem que circula no estado tem relações com outros isolados no
Brasil ou de outras regiões, inclusive as que fazem fronteira com o estado do
Amazonas.
Além disso, as informações geradas pelo nosso trabalho serão encaminhadas
para os gestores municipais em que foram confirmados casos da doença, assim como
para a instância estadual e Ministério da Saúde, a fim de atualizarem o histórico da
doença em suas áreas de abrangência, além de ser um retorno positivo, pois são úteis
para que seus gestores e a população continuem atentos em viabilizar as ações de
prevenção da Chikungunya.
35
7. REFERÊNCIAS
1. Robinson MC. An epidemic of virus disease in Southern Province, Tanganyika
Territory, in 1952-53—1: Clinical features. Trans R Soc Trop Med Hyg 1955; 49: 28.
2. Cavrini F, Gaibani P., Pierro A., Rossini G., Landini M., Sambri V. Chikungunya: an
emerging and spreading arthropod-borne viral disease. J Infect Dev C tries 2009 Dec
15; 3(10):744-52.
3. Sambri V, Cavrini F, Rossini G, Pierro A, Landini MP. The 2007 epidemic outbreak of
Chikungunya virus infection in the Romagna region of Italy: a new perspective for the
possible diffusion of tropical diseases in temperate areas? New Microbiol 2008 Jul; 31:
303-304.
4. Ligon BL. Reemergence of an unusual disease: the chikungunya epidemic. Semin
Pediatr Infect Dis 2006 April; 17: 99-104.
5. Chastel C. Chikungunya virus: its recent spread to the southern Indian Ocean and
Reunion Island (2005-2006). Bull Acad Natl Med 2005 Nov; 189: 1827-1835.
6. Paganin F, Borgherini G, Staikowsky F, Arvin-Berod C, Poubeau P. Chikungunya on
Reunion Island: chronicle of an epidemic foretold. Presse Med 2006 Apr; 35: 641-646.
7. Pialoux G, Gaüzere BA, Jaureguiberry S, Strobel M. Chikungunya, an epidemic
arbovirosis. Lancet Infect Dis 2007May; 7:319-327.
8. Rezza G, Nicoletti L, Angelini R, Romi R, Finarelli AC, Panning M. Infection with
chikungunya virus in Italy: an outbreak in a temperate region. Lancet. 2007; 370:1840-6.
9. Organização Mundial de Saúde. Outbreak and spread of chikungunya. Wkly
Epidemiol Rec. 2007 Nov;82(47):409-15.
10. Centers for Disease Control and Prevent. Chikungunya vírus geographic
Distribution. Acesso em 05 de Setembro de 2016. Disponível em:
http://www.cdc.gov/chikungunya/geo/index.html
11. Swaroop A, Jain A, Kumhar M, Parihar N, Jain S. Chikungunya fever. Journal, Indian
Academy of Clinical Medicine 2007; 8:164-168.
12. Porterfield JH. Antigenic characteristics and classification of the Togaviridae. In:
Schlesinger R, editor. The Togaviruses. New York: Academic Press 1980. pp. 13–46.
13. Strauss J.H., Strauss E. The alphaviruses: gene expression, replication and
evolution. Microbiol Rev. 1994 Dec; 58, 491-562.
36
14. Powers AM, Logue CH. Changing patterns of chikungunya virus:re-emergence of a
zoonotic arbovirus. J Gen Virol.2007Sep; 88: 2363-77.
15. Khan AH, Morita K, Parquet Md Mdel C, Hasebe F, Mathenge EG, Igarashi A.
Complete nucleotide sequence of chikungunya virus and evidence for an internal
polyadenylation site. J. Gen. Virol. 2002 Dec;83 (Pt. 12):3075–3084.
16. Tsetsarkin KA, Vanlandingham DL, McGee CE, Higgs S. A single mutation in
chikungunya virus affects vector specificity and epidemic potential. PLoS Pathog. 2007
Dec; 3(12): e 201.
17. Johnston R E, Peters C J. Alphaviruses. In: Fields B N, Knipe D M, Howley P M,
editors. Fields virology. Philadelphia, Pa: Lippincott-Raven; 1996. 3rd ed.pp. 843–898.
18.Weaver SC., Dalgarno L., Frey TK., Huang HV., Kinney RM.,Rice CM., Roehrig JT.,
Shope RE., Strauss EG. FamilyTogaviridae.In:vanRegenmortel MHV., Fauquet CM., Bis
hop DHL., Carstens EB.,EstesMK., Lemon SM., Maniloff J., Mayo MA., McGeogh DJ., P
ringle CR.,Wickner RB (eds). Virus taxonomy. Classification and nomenclature of
viruses. Academic Press, San Diego. 2000 pp 879–889.
19. Figueiredo Mario Luis Garcia de, Figueiredo Luiz Tadeu Moraes. Emerging
alphaviruses in the Americas: Chikungunya and Mayaro. Rev. Soc. Bras. Med. Trop.
2014 Dec; 47( 6 ): 677-683.
20. Napoleão-Pego P, Gomes LP, Provance-Jr DW, De-Simone SG. Mayaro Virus
Disease. J Hum Virol Retrovirol. 2014; 1 (3):00018
21. Caglioti C, Lalle E, Castilletti C, Carletti F, Capobianchi MR, Bordi L. Chikungunya
virus infection: an overview. New Microbiol. 2013; 36: 211–27.
22. Nasci RS. Movement of Chikungunya virus into the Western Hemisphere. Emerg
Infect Dis. 2014; 20:1394-5.
23. Leparc-Goffart I, Nougairede A, Cassadou S, Prat C, de Lamballerie X.
Chikungunya in the Americas. Lancet. 2014 Feb; 383(9916):514.
24. Nunes MR, Faria NR, de Vasconcelos JM, Golding N, Kraemer MU, de Oliveira LF,
et al. Emergence and potential for spread of Chikungunya virus in Brazil. BMC Med.
2015 Apr 30;13:102.
25. Staples JE, Breiman RF, Powers AM. Chikungunya Fever: an epidemiological
review of a re-emerging infectious disease. Clin Infect Dis. 2009; 49:942-948.
26. Parola P, F Simon, Oliver M. Tenossinovite e desordens vasculares associadas com
reumatismo relacionados ao vírus Chikungunya. Clin Infect Dis. 2007 May; 45:801802.
37
27.Gérardin P, Barau G, Michault A, Bintner M, Randrianaivo H, Choker G, et
al. Multidisciplinary prospective study of mother-to-child chikungunya virus infections on
the island of La Réunion. PLoS Med. 2008 Mar; 5:e60.
28. Cabral-Castro MJ, Cavalcanti MG, Peralta RH, Peralta JM. Molecular and
serological techniques to detect co-circulation of DENV, ZIKV and CHIKV in suspected
dengue-like syndrome patients. J Clin Virol. 2016 Sep; 82:108-11.
29. Simon F, Savini H, Parola P. Chikungunya: A Paradigm of Emergence and
Globalization of Vector-Borne Disease, Medical Clinics of North America. 2008 Nov. 92,
n.6, p.1323-1343.
30. Organização Mundial de Saúde. Chikungunya-transmission.. Acesso em 6 Ago
2014. Disponível em http://www.who.int/mediacentre/factsheets/fs327/en/
31. Petersen L. “Chikungunya virus: Possible Impact on Transfusion Medicine.” Transfus
Med Rev. 2010Jan; 24 (1): 15-21.
32. Volk SM, Chen R, Tsetsarkin KA, Adams AP, Garcia TI, Sall AA, et al. Genomescale phylogenetic analyses of chikungunya virus reveal independent emergences of
recent epidemics and various evolutionary rates. J Virol. 2010; 84:6497–504
33. Apandi Y, Nazni WA, Noor Azleen ZA, Vythilingam I, Noorazian MY, Azahari AH, et
al. The first isolation of Chikungunya virus from non-human primates in Malaysia. J Gen
Molec Virol. 2009; 1:35–9
34. Taylor RM, FdC J, et al. An epidemiological study of jungle yellow fever in an
endemic area in Brazil; epidemiology of human infections; investigation of vertebrate
hosts and arthropod vectors. AmJTrop Med Hyg. 1946; 26:69.
35. Burt FJ. Rolph MS, Rulli NE, Mahaligam S, Heise MT. Chikungunya: a re-emerging
virus, Lancet. 2012 Feb; 379, p. 662-71.
36. Panning M., Grywna k., Van Esbroeck M., Emmerich P., Drosten c. Chikungunya
fever in travelers returning to Europe from the Indian Ocean region, 2006. Emerg.
Infect. Dis. 2008 Mar; 14, 416-422.
37. Bronzoni RVM, Moreli ML, Cruz ACR, Figueiredo LTM. Multiplex-nested-PCR for
Brazilian Alphavirus diagnosis. Trans R Soc Trop Med Hyg. 2004 Aug; 98:456-461.
38. Hasebe F., Parquetm C., Pandey BD., Mathenge EG., Morita K., Balasubramaniam
V., et al. Combined detection and genotyping of Chikungunya virus by a specific reverse
transcription-polymerase chain reaction. J. Med. Virol. 2002 Jul; 67, 370-4.
38
39. Pfeffer M., Linssen B., Parke M.D., Kinney R.M. Specific detection of Chikungunya
virus using a RT-PCR/nested PCR combination. J. Vet. Med. B. Infect. Dis. Vet. Public
Health. 2002 Feb; 49, 49-54.
40. Tesh RB. Arthritides caused by mosquito-borne viruses. Annu Rev Med. 1982;
33:31-40.
41. Brighton SW. Chloroquine phosphate treatment of chronic Chikungunya arthritis. An
open pilot study. S Afr Med J. 1984 Aug 11; 66(6):217-8.
42. Kam YW, Lee WW, Simarmata D, Harjanto S, Teng TS, Tolou H. et al. Longitudinal
analysis of the human antibody response to chikungunya virus infection: Implications for
serodiagnosis and vaccine development. J Virol 2012 Dec; 86:13005–13015.
43. Dessain SK, Adekar SP, Berry JD. Exploring the native human antibody repertoire to
create antiviral therapeutics. Curr Top Microbiol Immunol 2008; 317:155-183.
44. Organização Mundial de Saúde. Alerta Epidemiológica. Fiebre por Chikungunya. 9
de
diciembre
2013.
Acesso
em:
10
Ago
2014.
Disponível
em:
www.paho.org/hq/index.php?option=com_docman&task=doc_view&gid=23808+&Itemid
=999999&lang=es.
45. Organização Pan-Americana da Saúde. Preparativo para o vírus de Chikungunya
nas
Américas.
Acesso
em:
6
Ago
2014.
Disponível
em:
http://www.paho.org/hq/index.php?option=com_topics&view=article&id=343&Itemid=409
31.
46. Adhami J, Reiter P. Introduction and establishment of Aedes (Stegomyia) albopictus
skuse (Diptera: Culicidae) in Albania. J Am Mosq Control Assoc. 1998 Sep;14(3):340-3.
47. Sabatini A, Raineri V, Trovato G, Coluzzi M. Aedes albopictus in Italy and possible
diffusion of the species into the Mediterranean area. Parassitologia. 1990
Dec;32(3):301-4.
48. Schaffner F, Karch S. First report of Aedes albopictus (Skuse, 1984) in metropolitan
France. C R Acaddes sci III. 2000 Apr; 323(4):373-5.
49. Flacio E, Lüthy P, Patocchi N, Guidotti F, al. e. Primo ritrovamento di Aedes
albopictus in Svizzera. Bollettino della Società Ticinese di Scienze Naturli (STSN). 2004;
92:141-2.
50. Benedict MQ, Levine RS, Hawley WA, Lounibos LP. Spread of the tiger: global risk
of invasion by the mosquito Aedes albopictus. Vector Borne Zoonotic Dis. 2007; 7(1):7685.
39
51. Nart P. Aedes albopictus: 1st record from Spain. PROMED Mail. 2004.
52. Schaffner F, Van Bortel W, Coosemans M. First record of Aedes (Stegomyia)
albopictus in Belgium. J Am Mosq Control Assoc. 2004 Jun; 20(2):201-3.
53. Kumar CVMN, Gopal SDVP. Reemergence of Chikungunya Virus in Indian
Subcontinent. Ind J Virol. 2010 Jun;21(1):8-1.
54. Borgherini G, Poubeau P, Staikowsky F, Lory M, Le Moullec N, Becquart JP, et al.
Outbreak of chikungunya on Reunion Island: early clinical and laboratory features in 157
adult patients. Clin Infect Dis. 2007 Jun; 44(11):1401-7.
55. Albuquerque, Isabella Gomes Cavalcanti de et al . Chikungunya virus infection:
report of the first case diagnosed in Rio de Janeiro, Brazil. Rev. Soc. Bras. Med. Trop.
2012 Feb; 45(1):128-9.
56. Organização Mundial de Saúde. Distribuição Geográfica CHIKV. Acesso em 12 de
Disponível
em:
Setembro
2016.
http://www.paho.org/hq/images/stories/AD/HSD/IR/Viral_Diseases/Chikungunya/CHIKVData-Caribbean-2016-EW-36.jpg
57. Centers for Disease Control and Prevent (CDC). Informações para Clínicos. Acesso
em:
5
Ago
2014.
Disponível
em:
http://wwwnc.cdc.gov/travel/notices/watch/chikungunya-saint-martin.
58. Ministério da Saúde (MS). Secretaria de Vigilância em Saúde. Boletim
Epidemiológico
Acesso
em
15
de
Setembro
2016.
Disponível
em:
http://portalsaude.saude.gov.br/images/pdf/2016/agosto/10/2016-026--2-pdf.
59. Mourao MP, Bastos Mde S, de Figueiredo RP, Gimaque JB, Galusso Edos S,
Kramer VM, et al. Mayaro fever in the city of Manaus, Brazil, 2007- 2008. Vector Borne
Zoonotic Dis. 2012 Jan; 12(1): 42-46.
60. Powers AM, Brault AC, Shirako Y, Strauss EG, Kang W, Strauss JH et al.
Evolutionary relationships and systematics of the alphaviruses. J Virol.
2001Nov;75:10118–31
61. Hassing RJ, Leparc-Goffart I, Tolou H, van Doornum G, van Genderen PJ. Crossreactivity of antibodies to viruses belonging to the Semliki forest serocomplex. Euro
surveillance 2010 Jun; 15 (23).
62. Charrel RN, De Lamballerie X, Raoult D. Chikungunya outbreaks–the globalization
of vectorborne diseases. N Engl J Med. 2007 Feb; 356(8): 769-771.
40
63. Lanciotti RS, Kosoy OL, Laven JJ, Panella AJ, Velez JO, Lambert AJ, et al.
Chikungunya Virus in US Travelers Returning from India. Emerging Infectious Diseases,
2007 May;13(5): 764-767.
64. Plante K, Wang E, Partidos CD, Weger J, Gorchakov R, Tsetsarkin K, et al. Novel
Chikungunya Vaccine Candidate with an IRES-Based Attenuation and Host Range
Alteration Mechanism. PLoS Pathogens, 2011Jul; 7(7): 1 a 11.
65. Diaz LA, Spinsanti LI, Almiron WR, Contigiani MS. UNA virus: first report of human
infection in Argentina. Rev. Inst. Med. trop. S. Paulo. 2003 Apr; 45 ( 2 ): 109-110.
66. Organização Mundial de Saúde. Características clinicas da febre de
Chikungunya,2014.
Acesso
em:
20
de
Julho
2016.
file:///C:/Users/Owner/Downloads/POR_CHIK_Aide-memoire_-clinicians.pdf.
67. Reller ME, Akoroda U, Nagahawatte A, Devasiri V, Kodikaarachchi W, Strouse JJ, et
al. Chikungunya as a cause of acute febrile illness in southern Sri Lanka. Coffey LL,
editor. PLoS ONE. 2013 Dec; 8(12).
68. Chakravarti A, Malik S, Tiwari S, Ashraf A. A study of Chikungunya outbreak in
Delhi. J Commun Dis. 2011 Dec; 43 (4):259-63.
69. Kannan M, Rajendran R, Sunish IP, Balasubramaniam R, Arunachalam N,
Paramsivan R, et al. A study on chikungunya outbreak during 2007 in Kerala, south
India. Indian J Med Res. 2009 Mar; 129(3):311-5.
70. Hochedez P, Canestri A, Guihot A, Brichler S, Bricaire F, Caumes E. Management
of travelers with fever and exanthema, notably dengue and chikungunya infections. Am
J Trop Med Hyg 2008 May; 78:710-3.
71. Crosby L, Perreau C, Madeux B, Cossic J, Armand C, Herrmann-Storke C, et al.
Severe manifestations of chikungunya virus in critically ill patients during the 2013–2014
Caribbean outbreak. Int J Infect Dis 2016 Jul; 48: 78–80.
72. A. Economopoulou, M. Dominguez, B. Helynck, D. Sissoko, O. Wichmann, P.
Quenel, P. et al. Atypical Chikungunya virus infections: clinical manifestations, mortality
and risk factors for severe disease during the 2005–2006 outbreak on Réunion.
Epidemiol Infect. 2009 Apr; 137(4):534-41.
73. Centers for Disease Control and Prevent. Clinical and laboratory features of
chikungunya virus infections compared with dengue virus infections.. Acesso em 20 de
Julho 2016. http://www.cdc.gov/chikungunya/pdfs/CHIKV_DengueEndemic.pdf. Revised
May 5, 2014.
74. Nkoghe D, Kassa RFK, Bisvigou U, Caron M, Grard G, Leroy EM. No clinical or
biological difference between Chikungunya and Dengue Fever during the 2010
Gabonese outbreak. Infect Dis Rep. 2012 Jan; 4(1):e5.
41
75. Carey DE. Chikungunya and dengue: a case of mistaken identity. J Hist Med Allied
Sci. 1971JUl; 26(3):243-62.
76. Pessôa R, Patriota JV, de Souza L, Felix AC, Mamede N, Sanabani SS.
Investigation into an outbreak of dengue-like illness in Pernambuco, Brazil, revealed a
cocirculation of zika, chikungunya, and dengue virus type 1. Medicine (Baltimore). 2016
Mar; 95(12):e3201.
77. Vazeille M, Moutailler S, Coudrier D, Rousseaux C, Khun H, Huerre M, et al. Two
Chikungunya isolates from the outbreak of La Réunion (Indian Ocean) exhibit different
patterns of infection in the mosquito, Aedes albopictus. PLoS One. 2007 Nov;
2(11):e1168.
78. Ministério da Saúde. Portal da Saúde. Ministério da Saúde intensifica medidas de
controle
da
febre
Chikungunya.
Acesso
em 24
de
Agosto
2016.
http://portalsaude.saude.gov.br/index.php/cidadao/principal/agencia-saude/14666ministerio-da-saude-intensifica-medidas-de-controle-da-febre-chikungunya
79. Fundação de Vigilância em Saúde do Amazonas (FVS-AM). Situação
epidemiológica atual da febre de chikungunya no Amazonas. Acesso em 25 de Julho
http://www.fvs.am.gov.br/images/pdf/2016/dve-boletim-de-vigilancia-em-saude2016.
01-ano-05-edicao-marco-2016.pdf
80. Kajeguka DC, Kaaya RD, Mwakalinga S, Ndossi R, Ndaro A, Chilongola JO, et al.
Prevalence of dengue and chikungunya virus infections in north-eastern Tanzania: a
cross sectional study among participants presenting with malaria-like symptoms. BMC
Infect Dis. 2016 Apr 26;16:183.
81. Instituto Brasileiro de Geografia e Estatística (IBGE). Características demográficas
dos municípios de Manaus e Urucurituba. Acesso em: 26 de Julho 2016. Disponível em:
http://censo2010.ibge.gov.br.
82. Yaseen HM, Simon F, Deparis X, Marimoutou C. Estimation of lasting impact of a
Chikungunya outbreak in Reunion Island. Epidemiology. 2012 Jan; S2:003.
83. Azevedo R do, S, Oliveira, CS, and Vasconcelos, PF. Chikungunya risk for
Brazil. Rev Saude Publica.2015; 49: 58.
84. Ministério das Relações Exteriores. MINUSTAH united nations stabilization mission
in Haiti. Acesso em 5 de Agosto 2016. Disponível em http://www.itamaraty.gov.br.
85. Ministério da Defesa (MD). O Brasil na Minustah. Acesso em 5 de Agosto 2016.
Disponível em: http://www.defesa.gov.br/relacoes-internacionais/missoes-de-paz/obrasil-na-minustah-haiti.
86. Gautret P., Simon F. Dengue, chikungunya and Zika and mass gatherings: What
happened in Brazil, 2014. Travel Med Infect Dis. 2015 Dec; 14(1):7-8.
42
87. Gallego V, Berberian G, Lloveras S, Verbanaz S, Chaves TS, Orduna T, et al. The
2014 FIFA World Cup: communicable disease risks and advice for visitors to Brazilea
review from the Latin American Society for Travel Medicine (SLAMVI). Travel Med Infect
Dis 2014 May-Jun; 12(3):208 e18.
88. Petersen E., Wilson M.E., Touch S., McCloskey B., Mwaba P., Bates M.,. et al.
Rapid spread of Zika virus in the Americas - Implications for public health preparedness
for mass gatherings at the 2016 Brazil Olympic Games. Int. J. Infect. Dis. 2016
Mar; 44: 11–15
89. Coimbra TLM, Santos CLS, Suzuki A, Petrella 117. SMC, Bisordi I, Nagamori AH, et
al. Vírus Mayaro: casos importados de infecção humana no Estado de São Paulo,
Brasil. Rev Inst Med Trop S. Paulo 2007Jul-Aug; 49:221-4.
90. Receveur MC, Grandadam M, Pistone T, Malvy D. Infection with Mayaro virus in a
French traveller returning from the Amazon region, Brazil. Euro Surveill. 2010 May
15(18)
91. Martens P, Hall L. Malaria on the move: human population movement and malaria
transmission. Emerg infect dis. 2000 Mar-Apr; 6(2):103-9.
43
8. ANEXOS
ANEXO I
Doenças febris agudas em uma unidade terciária de saúde
da Amazônia Ocidental Brasileira: estudos de
epidemiologia, caracterização clínica e diagnóstico
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO PÕS-INFORMAÇÃO
O paciente abaixo assinado ou o seu parente próximo abaixo
identificado, sob a responsabilidade do investigador ou médico que assina este
documento, declara estar ciente após ter lido ou ouvido o presente Termo de
Consentimento que lhe informa o seguinte:
I. Que está participando de um estudo para saber qual a causa do quadro febril
que apresenta, a partir da investigação de várias doenças como: malária,
dengue, mononucleose, febre por Oropouche, febre por Mayaro, leptospirose,
febre tifóide e febre amarela. Além disso, se os testes forem negativos para
essas doenças, novos vírus serão pesquisados, como Saint Louis, Oeste do
Nilo, Ilhéus, Bussuquara e Cacipacoré;
II. Que a participação neste estudo é voluntária, e que a recusa em participar
não provocará qualquer tratamento diferenciado ou perda de benefícios a que o
paciente tenha direito;
III. Que, havendo concordância para a participação no estudo, se procederão
as seguintes condutas:
44
1 - Preenchimento da ficha clínica (constando de dados relativos ao paciente e à
doença);
2 - Coleta de sangue da veia do braço (10mL para adultos e 3mL para crianças),
com uso de agulhas e seringas descartáveis, por profissional qualificado;
IV. Após os primeiros testes de laboratório, se houver necessidade e
consentimento do participante e/ou seu responsável, o paciente poderá ser
contactado para proceder a uma nova coleta de sangue;
V. Que o médico assistente poderá pedir outros exames como sangue, fezes e
urina, dependendo da necessidade e que não terão qualquer relação com a
pesquisa;
VI. Que, participando do estudo, o paciente ou a família não obterão quaisquer
benefícios adicionais além dos já citados (diagnóstico da infecção e/ou
doença), podendo desta forma beneficiar outros indivíduos;
VII. Que a participação nessa pesquisa é voluntária e o indivíduo receberá todos
os cuidados quanto ao diagnóstico e tratamento da sua doença.
I. Que esse estudo incluirá pacientes que buscam espontaneamente a FMTAM para assistência médica e que todos os procedimentos a serem adotados
fazem parte da rotina de investigação dessa instituição.
II.
Que para eventuais danos que forem devidamente comprovados em
decorrência dos procedimentos realizados nesta pesquisa, a Fundação de
Medicina Tropical do Amazonas- FMTAM se propõe a atender, ressarcir e/ou
indenizar os participantes deste estudo.
III. Que o material retirado do paciente se destina apenas à definição da causa da
doença febril.
IV. Que o projeto poderá ser encerrado caso haja discordância por parte do
paciente ou que possam prejudicar o sujeito da pesquisa.
V.
Que a participação neste estudo será confidencial e os registros ou
resultados dos testes relacionados ao estudo serão mostrados apenas aos
participantes e aos representantes da FMT-AM, bem como a autoridades
normativas estaduais ou nacionais, com o objetivo de garantir informações
de pesquisas clínicas ou para fins normativos. A identidade dos participantes
permanecerá sempre em confiabilidade.
45
VI.
Que o participante e seus familiares têm direitos aos esclarecimentos que
julgarem necessários a qualquer período do desenvolvimento deste estudo
e será notificado sobre qualquer nova informação relacionada. O Dr.
Maurício Nogueira Lacerda, médico responsável por esta pesquisa, cujos
números de telefone são (17)3201 5921 ou (17)98811 0550, terá plena
disponibilidade para atender e esclarecer possíveis dúvidas dos participantes;
VII.
Que o participante tem o direito de se retirar deste estudo a qualquer momento,
sem qualquer retaliação, e também o direito de manter em seu poder cópia
assinada deste documento;
VIII. Que, por estar devidamente esclarecido sobre o conteúdo deste termo,
livremente expressa seu consentimento e/ou do seu responsável para inclusão
como participante nesta pesquisa.
Você autoriza que seu sangue seja guardado para outros
estudos com vírus? ( ) Sim (
)
Não
Data: ....../....../.....
..............................................................................
Nome
Assinatura do paciente ou responsável legal: ...........................................................
Nome do entrevistador:
.......................................................................................................
Assinatura do entrevistador:
...............................................................................................
Impressão dactiloscópica
46
ANEXO II
47
ANEXO III
Carta de Anuência
Manaus, .... de .................de 2015.
À
Gerência do Laboratório de Pesquisa em Virologia
Att.: Dr. Maurício Nogueira
Solicitamos autorização institucional para realização da pesquisa intitulada “PREVALÊNCIA DE
FEBRE POR ALFAVÍRUS ARTRITOGÊNICO (CHIKUNGUNYA ) ENTRE PACIENTES SUBMETIDOS À
ABORDAGEM SINDRÔMICA DE DOENÇAS FEBRIS, NUM SERVIÇO DE REFERÊNCIA PARA
DOENÇAS INFECCIOSAS NO ESTADO DO AMAZONAS” a ser realizada no ambulatório da
Fundação Dr. Heitor Vieira Dourado e em parceria com o Laboratório de Pesquisa em
Virologia-FAMERP, pela aluna de pós-graduação da Universidade Estadual do Amazonas,
M aria Cyntia K erle Calado Lima sob orientação do Prof. Dr. Maurício Nogueira
Lacerda .
Ao mesmo tempo, pedimos autorização para que o nome desta instituição possa
constar no relatório final bem como em futuras publicações na forma de artigo
científico.
Ressaltamos que os dados coletados serão mantidos em absoluto sigilo de acordo
com a Resolução do Conselho Nacional de Saúde (CNS/MS) 196/96 que trata da
Pesquisa envolvendo Seres Humanos. Salientamos ainda que tais dados sejam
utilizados tão somente para realização deste estudo.
Na certeza de contarmos com a colaboração e empenho desta Gerência,
agradecemos antecipadamente a atenção, ficando à disposição para quaisquer
esclarecimentos que se fizerem necessários.
________________________________
P rofa. Dra. M aria P aula M ourão
Pesquisador(a) Co-responsável do Projeto
(x ) Concordamos com a
( ) Não concordamos com a solicitação
solicitação
____________________________
Dr. M aurício Nogueira
Gerência do Laboratório de Pesquisa em Virologia- FAM ERP
48
ANEXO IV
Número______________________
Fundação de Medicina Tropical do Amazonas
Universidade do Estado do Amazonas
Questionário- Chikungunya
1. IDENTIFICAÇÃO
Nome:__________________________________________________Prontuário____________
Data da internação_______________Idade___________anos Sexo ( )M ( )F
Município___________________________________________________________
Endereço(bairro)__________________________________________________________
Telefone:______________________________________________________________
Co- Morbidade
( )Gestação______semanas
( )Diabetes ( )Hipertensão ( )Cardiopatia ( )HIV/Aids
( )Insuficiência renal ( )Neoplasia ( )Asma ( )Alcolismo ( )Anemia falciforme
( )Talassemia ( )Convulsão febril ( )doenças reumatológicas
2. História da doença Atual
Febre (dias):
1D( )
Artralgia (dias):
2D( ) 3D( ) 4D( ) 5D( )
1D( ) 2D( ) 3D( ) 4D( )
5D( )
Cefaléia( ) Mialgia( ) Dor nas costas( ) edema( ) Prurido( ) Calafrios( )
(
)Náusea ( )Vômito ( )diarréia
( ) eritema nodoso
( )Dermatite esfoliativa
( )úlceras orais
( )dor retro-ocular ( )conjuntivite ( )dor abdominal
( )neurite ( ) tenossinovite
49
2.1 Principais articulações acometidas:
( )ombros
cotovelos( ) Punho( ) Bacia( )
Falanges( ) joelhos( ) Tornozelos( )
3. Alterações laboratoriais
Hematócrito..............................
Leucócitos.................................
Linfócitos.....................................
Trombócitos..................................
Proteína C-Reativa............................
Velocidade de Hemossedimentação( eritrócito)..........................
Bilirrubina total (mg/dL): .........................Bilirrubina direta(mg/dL): .................................
TGO........................................
TGP..........................................
Creatinina.....................................
Creatinofosfoquinase (CPK)......................................
4. Antecedente de viagens
Tem história de viagem para área endêmica nos últimos 30 dias antes do aparecimento dos
sintomas? ( )Sim ( )Não
5. Alguém do convívio com os mesmos sintomas: SIM ( ) NÃO ( )
* Se a resposta for SIM, qual o ambiente de convivência:
Casa( )
Vizinhança( )
Trabalho( )
5. Hipótese Diagnóstica
................................................................................................................................
50
ANEXO V
Protocolo extração RNA
Extração de RNA – Kit Quiagem
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Ligar termobloco (˂80 ºC)
Colocar AVL no termobloco sob agitação por pouco tempo (1 min) até
descristalizar
560 µL pra cada amostra
Colocar 5,6 µL de Carrier no tubo contendo AVL
Adicionar 140 µL do soro (amostra)- Homogeneizado- no tubo contendo AVL
e Carrier
Misturar o vortex 15s
Deixar a temperatura ambiente por 10 min (lise da partícula viral)
Centrifugar: spin de 13.200 rpm
Adicionar 560µL de Etanol 100% (Merk) e misturar o vortex
Centrifugar: spin de 13.200 rpm
Aplicar 630µL dessa solução na coluna 9Kit Qui Amp Mini Spin Colunm)
Centrifugar: 8000 rpm por 1min
Pegar a porte superior da coluna em um tubo novo (que será a nova parte
inferior). Despreze a parte inferior com o filtrado
Repetir procedimento anterior (Aplicar 630µL...)
Abrir a coluna e adicionar 500µL de Buffer AW1- Homogeneiza-lo antes
Centrifugar: 8000 rpm por 1min
Colocar parte superior da coluna em outro tubo
Adicionar 500µL de Buffer AW2- Homogeneiza-lo antes
Centrifugar: 13.200 rpm por 3,5 min
Colocar parte superior da coluna em outro novo tubo de 1,5 mL
Abrir a coluna e adicionar 60µL de Buffer AVE- Homogeneiza-lo antes
Deixe o AVE em contato com a membrana, trocando de ponteira a cada
amostra
Deixar 1min em temperatura ambiente
Centrifugar: 8000 rpm por 1min
RNA ficará no tubo de 1,5 mL (parte inferior), desprezando a parte superior
Colocar imediatamente no gelo. Caso for fazer a PCR no mesmo dia:
geladeira; se não, estocar no frezer a -80ºC.
51
ANEXO VI
Protocolo para RT-PCR para Vírus Chikungunya
Primer CHK F -TATGGTCTTGTGGCTTTATAGAC
Primer CHK R -TGGCCTTTAAGCGGTC
*F – Forward *R – Reverse
Transcriptase Reversa – RT
Reagente
Buffer 5x
Primer CHK F [10pmol]
Primer CHK R [10pmol]
dNTP [10mM]
DTT
RNaseOUT
SuperScript III
H2O
TOTAL
RNA
μL Termociclagem
4,0 55°C – 1h
1,0 70°C – 15’
1,0 4°C – ∞
1,0
1,0
1,0
1,0
5,0
15,0
5,0
PCR
Reagente
μL Termociclagem
GoTaq qPCR Master Mix 12,5 95º C 2’
Primer CHK F [10mM]
0,5 95º C 15’
40 ciclos
Primer CHK R [10mM]
0,5 62º C 1’
Fluoróforo CXR
0,25
H2O
1,25 Seguido de uma curva de Melt
VOLUME DA REAÇÃO
15 De 60º C a 95º C
cDNA 5,0
Volume final 20µl em uma reação.
Utilizando o equipamento Veriti Thermal Cycler (Applied Biosystem, USA).
52
ANEXO VII
Metodologia CHIKV (reações de PCR)
O RNA foi extraído a partir de 140µl de amostras clínicas, utilizando o Qiamp
Viral RNA Kit (QIAGEN Inc., USA), de acordo com as recomendações do fabricante.
O volume final obtido foi de 60µl. Os RNAs foram submetidos a análise por PCR em
tempo real (qPCR), segundo metodologia descrita por Lanciotti et al., 2007. Para
tanto, foi utilizado primers e sonda que se ligam a região do gene da proteína NsP1
do CHIKV. Dessa forma, 5 µl do RNA extraído foi adicionado à reação de GoTaq
Probe 1-step RT-qPCR system (Promega). Um total de 15 µL da reação contendo
0,3 µL de GoScript™ RT Mix for 1-Step RT-qPCR (50X), 0,5 µL de cada primer
CHIKV
874
(5'-
AAAGGGCAAACTCAGCTTCAC-3')
e
CHIKV
961
(5'-
GCCTGGGCTCATCGTTATTC-3') a 10µM cada, 0,15 µL da sonda CHIKV 899FAM§ (5’ – CGCTGTGATACAGTGGTTTCGTGTG – 3’) a 10µM, 6,5 µL da mistura
GoTaq® Probe qPCR Master Mix (2X), 0,125 µL de CXR Reference Dye para uma
concentração final de 500 nM e água suficiente para completar 15 µl. A reação foi
submetida a 45oC por 15 min e 95oC por 2 min, seguida de 40 ciclos: 95ºC por 15
seg, 60ºC por 1 min,. Os dados gerados foram plotados e analisados pelo programa
StepOne Software v2.3 (Applied Biosystems).
As reações foram realizadas em StepOne Tempo Real PCR System (Applied
Biosystem) utilizando MicroAmp Fast Optical 48-Well Reaction Plate (Applied
Biosystem).
53
ANEXO VIII
Protocolo Gota Espessa - MALÁRIA
Furar a ponta do dedo anelar esquerdo com uma lanceta,remover do dedo a
primeira gota de sangue com gaze ou algodão secos.
Comprimir suavemente o dedo para obter outra gota de sangue esférica.
Segurar a lâmina firmemente pelas bordas e levá-la ao encontro com o dedo do
paciente até tocar a gota de sangue evitando que toque a pele do dedo, depositar
outra gota ao lado da primeira.
Colocar a lâmina em cima de uma bancada,espalhar o sangue de modo a formar um
retângulo aproximadamente 1,2cm.
Secar a lâmina em temperatura ambiente ou em ar morno.
Coloração da Gota espessa.
Primeira fase: Desemoglobinização.
Aplicar a solução de azul de metileno fosfatado sobre a gota espessa por dois
segundos.Enxaguar a lâmina com agua tamponada (sem jato forte).
segunda fase: coloração pelo Giemsa.
Aplicar uma solução de Giemsa sobre a lâmina, deixar corar por 10 minutos.
Enxaguar com agua tamponada(sem jato forte).
Secar em calor suave ou sob ventilação.
Aplicar uma solução de Giemsa sobre a lâmina, deixar corar por 20 a 30 minutos.
Enxaguar com agua tamponada(sem jato forte).
Secar em calor suave ou sob ventilação.
54
ANEXO IX
FUNDAÇÃO DE MEDICINA TROPICAL/INSTITUTO DE MEDICINA
TROPICAL DO AMAZONAS
DEPECEN/ARBOVIROLOGIA
TESTES DE ELISA -IgM- DENGUE
Sensibilização da microplaca com “goat anti human IgM”
Data
/
/
Diluição: 1/500
Quantidade por poço 100
Incubar a 4ºC, em câmara úmida durante pelo menos 24 horas.
TESTE No / 2016
Data do Teste:
RESULTADO
Diluição dos soros: 1:40 Realizado:
1
2
3
4
5
6
/ 2016
7
8
9
10
11
A
B
C
D
E
F
G
H
•
•
•
Preparação da placa: lavar a placa 5x com PBS pH7.4 e batê-la suavemente
ate que seque.
Sensibilização: cobrir cada well com 100µl de anti IgM humana diluída em
tampão de carbonato pH9.6.
Incubar overnight a 4ºC.
Câmara úmida.
Lavar a placa 5x. Secar.
Bloqueio: colocar 150µl de PBS+BSA 4% em cada well.
Incubar 30 min. Em temperatura ambiente (TA).
Câmara úmida.
Lavar a placa 5x. Secar.
•
Soros e controles: distribuir 50µl dos soros a testar e controles na diluição
de 1:40 em PBS+BSA 0.5%.
12
55
Incubar 1 hora a 37ºC.
Câmara úmida.
Lavar a placa 5x. Secar.
•
Antígeno: colocar 50µl do antígeno diluído em PBS+SHN 20%.
Incubar overnight a 4ºC. D1 = 1 / 10 F.A= 1/30
Câmara úmida.
D2 = 1 / 20
Lavar a placa 5x. Secar. D3 = 1/ 25
•
Conjugado: colocar 25µl de HRP conjugated 6B6C-1 monoclonal
antibody/Jackson imuno research diluído em PBS+SHN 20%.
Incubar 1 hora a 37ºC. 1/6000
Câmara úmida.
Lavar a placa 7x. Secar.
•
Substrato: colocar 100µl de substrato ABTS (solução A+solução B a 50%).
Incubar 1 hora a 37ºC.
• Leitura: ler a placa em espectrofotômetro (multiskan) com filtro 405nm.
Obs. A anti-IgM humana, o antígeno e o conjugado são previamente titulados para
determinar diluição ótima a ser utilizada no teste.
56
ANEXO X
Metodologia DENV (reações de PCR)
Extração de RNA
O RNA viral foi extraído a partir de 140 µl de soro, utilizando o Qiamp Viral RNA Kit
(Qiagen®), de acordo com as recomendações do fabricante.
Primers
Os primers que foram utilizados na detecção de dengue se ligam a regiões do gene da
proteína NS5 (Tabela 1).
Tabela 1. Primers que foram utilizados na detecção dos Flavivirus (NS5).
Primers
FG1 (+)
FG2 (-)
Sequência (5'-3')
Amplicon (pb)
Primers gênero-específicos para Flavivirus
TCAAGGAACTCCACACATGAGATGTACT
GTGTCCCATCCTGCTGTGTCATCAGCATACA
1000
Primers espécie-específicos
NDEN1 (-)
CGTTTTGCTCTTGTGTGCGC
472
NDEN2 (-)
GAACCAGTTTGGTTDRTTTCATCGCTGCC
316
NDEN3 (-)
TTCCTCGTCCTCAACAGCAGCTCTCGCACT
659
NDEN4 (-)
GCAATCGCTGAAGCCTTCTCCC
222
*Com o primer FG1. (+): sentido positivo. (-): sentido negativo. pb: pares de base.
Referência
Bronzoni
et al 2005
Bronzoni
et al 2005
RT-PCR para detecção de DENV
De acordo com o protocolo descrito por Bronzoni et al (2005), a reação de
transcrição reversa (RT) foi realizada pela adição de 8 µl de RNA em uma mistura contendo 4
µl de solução tampão cinco vezes concentrada (250 mM Tris-HCl, pH 8,3, 375 mM KCl, 15
mM MgCl2), 1,4 µl de DTT (Dithiothreitol) a 0,1 M, 1,6 µl da mistura contendo 2,5 mM de
dNTP (Deoxynucleoside Triphosphate), 1 µl do primer FG2 (15 µM), 0,5 µL (40 U/ µL) do
inibidor de ribonuclease (RNaseOUT-Invitrogen, USA), 1 µl (200 U/µl) de enzima
transcriptase reversa (Superscript II-Invitrogen, USA) e água suficiente para completar 20 µl.
A mistura foi incubada a 42ºC por 50 minutos e a 70ºC por 15 minutos.
57
A reação em cadeia da polimerase (PCR) consiste em 8 µl do produto da RT, 5 µl da
solução tampão 10 vezes concentrada (200 mM Tris-HCl, pH 8,4, 500 mM KCl), 2 µl de MgCl2
a 50 Mm, 4 µl da mistura contendo 2,5 mM de dNTP, 1µl do primer FG1 (15 µM), 1 U da
enzima polimerase (Taq DNA polymerase recombinant-Invitrogen, USA) e água suficiente
para completar 50 µl. A mistura foi submetida a um passo de desnaturação inicial a 94ºC por
1 minuto, seguida por 30 ciclos de 94ºC por 1 minuto, 53ºC por 1 minuto e 72ºC por 2
minutos, finalizando com um ciclo de 72ºC por 5 minutos. As reações de RT-PCR foram
realizadas em termociclador Veriti Thermal Cycler (Applied Biosystem, USA).
Multiplex-Nested-PCR para identificação de DENV
Segundo o estudo realizado por Bronzoni et al. (2005) foram utilizados os primers
NDEN-1 (-), NDEN-2 (-), NDEN-3 (-), NDEN-4 (-), FG1 (+) (1 µl de cada primer a 15 µM). O ciclo
de amplificação consiste em um passo de desnaturação inicial a 94ºC por 1 minuto, seguido
por 25 ciclos de 94ºC por 1 minuto, 53ºC por 1 minuto e 72ºC por 2 minutos, finalizando com
um ciclo de 72ºC por 5 minutos.
Eletroforese em gel de agarose
Em todas as amostras foi realizada a eletroforese em gel de agarose a 1,5%
(peso/volume) com coloração de brometo de etídio, para se observar os amplicons à luz
ultravioleta. Precauções para se evitar contaminações foram seguidas, e controles positivos
e negativos foram utilizados em todas as reações.
58
ANEXO XI
FUNDAÇÃO DE MEDICINA TROPICAL DR.HEITOR VIEIRA DOURADO
TESTES IMUNOENZIMÁTICO COM CELULAS INFECTADAS (EIA-ICC
MICROPLACAS INFECTADAS COM MAYARO/OROPOUCHE PARA PESQUISA IgM e IgG
TESTE No.
/
Data do resultado:
Diluição dos soros: 1:500
C2
/
/
Realizado:
C-
C1
Data do Teste:
C-
C-
C3
4
5
6
7
8
9
10
11
A
B
C
D
E
F
G
H
•
Inicio do teste EIA-ICC
•
Bloqueio: adicionar 200µl de PBS+LPD a 5% em cada poço.
Incubar 2 hora a 37ºC.
Lavar a placa 3x com PBS+Tween-20 a 0,05% e secar.
•
Amostras: distribuir 100 µl das amostras diluídas 1:500 em solução PBST+LPD 5% nos
poços pares e impares.
Incubar 1 hora a 37ºC.
Lavar a placa 4x em PBS+Tween-20 a 0,05%
•
Conjugado: colocar 100µl de imunoglobulina caprina (anti-IgG ou IgM) humana conjugada
com peroxidase na diluição 1:2000 PBST+LPD 5%
Lavar a placa 5x em PBS+Tween-20 a 0,05%
•
Substrato: colocar 100µl de substrato ABTS (solução A+solução B a 50%) em cada orifício.
Incubar 15 a 20 min. a 37˚C, fazer a leitura.
•
Leitura: ler a placa em espectrofotômetro (multiskan) com filtro 405
12
59