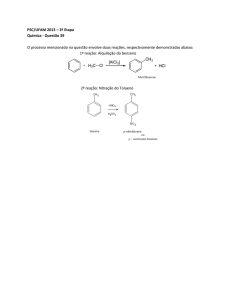
177
Benzeno e Aromaticidade
O anel aromático (benzeno) é formado pela conexão de seis carbonos
sp . No interior do anel aromático, existem seis elétrons pi, ocupando seis
orbitais p, e formando três ligações duplas alternadas por uma simples. Os seis
elétrons tornam o anel aromático por obedecer a Lei de Huckel, que considera
aromático todos os anéis monocíclicos que contenham 4n + 2elétrons π, onde
n pode assumir valores de zero até o infinito. Anéis monocíclicos que
contenham 2, 6, 10.......... elétrons pi, estão em acordo com a lei de Huckel, e
são considerados aromáticos.
2
A substituíção eletrofílica aromática (SEA), utiliza como substrato o anel
benzênico, e tem como finalidade formar derivados do benzeno. Dependendo
do eletrófilo, utilizado na substituição do hidrogênio do anel, é formado um
derivado benzênico diferente. Os elétrofilos utilizados na substituição
eletrofílica aromática são: o NO2+, Cl+, ou Br+, R+ (R= representa um
carbocátion alquila), SO3 e R-+C=O, esses eletrófilos formam respectivamente,
o nitrobenzeno, cloro ou bromobenzeno, alquilbenzeno, ácido benzeno
sulfônico e alquil fenil cetona.
Química Orgânica I / Ana Júlia Silveira / UEAP SET 2014
178
Benzeno e Aromaticidade
12.1.3.1 Alquilação de Friedel-Crafts
O mecanismo apresenta três etapas. Na primeira etapa o catalisador
ajuda na preparação do eletrófilo. A segunda etapa mostra a interação entre o
substrato benzeno e o eletrófilo, esta é a etapa lenta do mecanismo e se forma
o intermediário, finalmente na terceira etapa é recuperada a aromaticidade do
anel benzênico. No mecanismo de alquilação, um halogeneto de alquila é
utilizado para alquilar o anel benzênico. A primeira etapa do mecanismo mostra
o halogeneto de alquila (cloreto de metila) sendo transformado no eletrófilo
carbocátion metila, pela ação do catalisador, em uma reação ácido-base. Nesta
reação o halogeneto de alquila é uma base de Lewis e o catalisador, cloreto de
alumínio é um ácido de Lewis.
Visualização no modelo molecular
Química Orgânica I / Ana Júlia Silveira / UEAP SET 2014
179
Benzeno e Aromaticidade
A segunda etapa, é a etapa determinante da velocidade da reação,
etapa lenta do mecanismo. Nesta etapa um par de elétrons pi do anel, faz a
conexão com o eletrófilo CH3+, esta formação de ligação entre o anel e o
carbocátion metila, promove a quebra da aromaticidade do anel benznico.
Nesse processo, é formado o intermediário carbocátion arênio, que pode ser
estabilizado por ressonância.
Após a quebra da aromaticidade, o anel passou a conter cinco carbonos
sp e um carbono sp3, onde se encontra conectado o grupo metila. A
ressonância desloca os elétrons pi nos cinco carbonos sp2. O carbono sp3 não
participa do processo de ressonância. A ressonância nos cinco carbonos sp2,
pode ser representada por uma linha pontilhada que tangencia os cinco
carbonos sp2.
Visualização da etapa lenta no modelo molecular.
2
Etapa rápida, no modelo molecular.
Química Orgânica I / Ana Júlia Silveira / UEAP SET 2014
180
Benzeno e Aromaticidade
12.1.3.2 Halogenação do Benzeno
O segundo mecanismo trata da halogenação do anel aromático, as
etapas do mecanismo, são semelhantes as desenvolvidas no mecanismo de
alquilaçaõ de Friedel-Crafts. Na primeira etapa, ocorre a preparação do
eletrófilo com a ajuda do catalisador. Na segunda etapa ocorre a conexão do
eletrófilo no anel provocando a quebra da aromaticidade do anel, e finalmente
na última etapa é mostrada a recuperação da aromaticidade do anel e do
catalisador.
Química Orgânica I / Ana Júlia Silveira / UEAP SET 2014
181
Benzeno e Aromaticidade
12.1.3.3 Acilação de Friedel-Crafts
A reação se processa entre o substrato benzeno e o reagente cloreto de
acila, também conhecido como cloreto de ácido. Este é reagente é facilmente
obtido pela reação entre um acido carboxílico e o cloreto de tionila (SOCl 2) ou
pentacloreto de fósforo (PCl5).
A reação de formação do cloreto de acido, utilizando o cloreto de tionila,
em temperatura de 80oC, produz um rendimento de aproximadamente 90%.
A acilação de Friedel-Crafts tem como objetivo a obtenção de uma cetona
aromática.
No desenvolvimento do mecanismo o catalisador cloreto de alumínio
tem duas funções: na forma de acido de Lewis prepara o eletrófilo e na
forma de base de Lewis recupera a aromaticidade do anel .
Na etapa lenta do mecanismo, o eletrófilo é capturado por um par de
elétrons pi do anel. a conexão do eletrófilo no anel leva a quebra da
aromaticidade do anel, que passa a ser formado por cinco carbonos sp 2 e
Química Orgânica I / Ana Júlia Silveira / UEAP SET 2014
182
Benzeno e Aromaticidade
um carbono sp3. Primeira etapa: preparação do eletrófilo com a ajuda do
catalisador.
Segunda etapa: conexão do eletrófilo cátion acílio no anel. Um par de
elétrons pi do anel captura o eletrófilo cátion acílio. A reação é lenta e ocorre
a quebra da aromaticidade do anel.
O intermediário traz um hidrogênio, conectado em carbono sp 3 vicinal
a um centro catiônico. Este centro eletrofílico (catiônico) é capaz de puxar
para si os elétrons sigma da ligação carbono-hidrogênio, esta ação, deixa o
hidrogênio do carbono sp3 com carga parcial positiva, podendo ser
capturado por uma base de Lewis. Os carbonos catiônicos, puxam elétrons
sigma para si e geram hidrogênio ionizável em seus carbonos vicinais. Na
reação de eliminação unimolecular, o carbocátion ao puxar os elétrons
sigma da ligação, promove a formação de hidrogênios ionizáveis em seus
carbonos vicinais, esta reação será estudada ainda neste capitulo.
Química Orgânica I / Ana Júlia Silveira / UEAP SET 2014
183
Benzeno e Aromaticidade
Terceira etapa: Recuperação da aromaticidade do anel e recuperação do
catalisador. A base de Lewis (complexo aniônico) captura o hidrogênio
ionizável do anel. Este hidrogênio ao sair deixa o par de elétrons que é
devolvido ao anel, desta forma a aromaticidade é recuperada.
12.1.3.4 Nitração do Benzeno
Reação do processo.
Reação do processo no modelo molecular.
Preparação do eletróforo e do complexo aniônico (base de Lewis).
Química Orgânica I / Ana Júlia Silveira / UEAP SET 2014
184
Benzeno e Aromaticidade
Conexão do eletrófilo íon nitrônio no anel aromático.
Recuperação da aromaticidade do anel.No meio reacional existem duas
bases para recuperar a aromaticidade do anel, o ânion hidrogenosulfato e a
água. A base mais forte é a água e será utilizada para recuperar a
aromaticidade do anel.
12.1.3.5 Sulfonação do Benzeno
Preparação do eletrófilo.
As duas moléculas de ácido sulfúrico através de um processo de
autoionização fornecem o eletrófilo SO3, que possui um centro eletrofílico no
átomo de enxofre.
Química Orgânica I / Ana Júlia Silveira / UEAP SET 2014
185
Benzeno e Aromaticidade
Conexão do eletrófilo no anel.
Recuperação da aromaticidade do anel. Será realizada pela base ânion
hidrogenosulfato.
O ânion benzenosulfonato através de uma reação ácido-base recebe um
próton e forma o ácido benzenosulfônico.
Química Orgânica I / Ana Júlia Silveira / UEAP SET 2014
186
Benzeno e Aromaticidade
Sugestão de Leitura
SOLOMONS, Graham; FRYHLE, Craig. Química Orgánica. Tradução da 10
a
edição
americana, vols 1 e 2. Rio de Janeiro: Livros Técnicos e Científicos Editora S. A., 2012. 815p.
BRUICE, Paula. Química Orgânica. Tradução da quarta edição. São Paulo: Pearson Prentice
Hall, 2006. 547p.
Química Orgânica I / Ana Júlia Silveira / UEAP SET 2014