COLÉGIO ESTADUAL NEWTON FELIPE ALBACH- EFM
PLANO DE TRABALHO DOCENTE ANUAL - 2011
PROFESSORA: Angélica de Sousa Hrysyk
DISCIPLINA: Química
TURMA: 1ªA
CARGA HORÁRIA: 2 h/a semanais
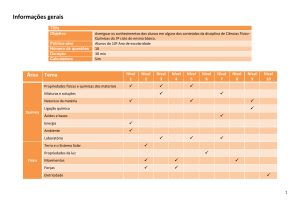
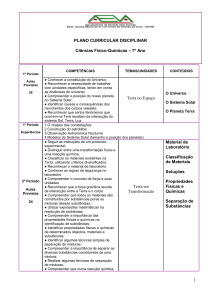
1. CONTEÚDOS
1.1 CONTEÚDOS ESTRUTURANTES
- Matéria e sua natureza
- Biogeoquímica
- Química sintética
1.2 CONTEÚDOS BÁSICOS
- Matéria;
- Solução;
- Ligação química;
- Reações químicas;
- Funções químicas.
1.3 CONTEÚDOS ESPECÍFICOS
1º Bimestre
- A Química como Ciência;
- Classificação da matéria: estados físicos e propriedades;
- Substâncias puras e misturas;
- Fenômenos físicos e químicos;
- Fracionamento de misturas homogêneas e heterogêneas;
- Partículas fundamentais;
- Elementos químicos, íons e moléculas;
- Modelos atômicos.
2º Bimestre
- Tabela periódica – propriedades periódicas e aperiódicas;
- Números Quânticos
- Ligações químicas: iônica, molecular e metálica;
- Polaridade e geometria molecular;
- Forças intermoleculares.
3º Bimestre
- Funções inorgânicas: ácidos, bases, sais e óxidos.
- Soluções eletrolíticas;
- Dissociação e ionização;
- Reações químicas.
4º Bimestre
- Número de oxidação;
- Acerto de coeficientes das reações químicas pelo método da
oxirredução e das tentativas;
- Cálculo estequiométrico.
- Estudo dos gases.
2. OBJETIVOS
2.1 OBJETIVOS GERAIS
- Verificar a importância da Química;
- Conhecer seu desenvolvimento;
- Adquirir noções da estrutura atômica.
- Relacionar os tipos de ligações e funções químicas (ácido, base).
- Diferenciar as funções químicas (sais e óxidos);
- Compreender e classificar as reações químicas.
- Verificar as reações químicas de oxirredução e estequiometria.
2.2
OBJETIVOS ESPECÍFICOS
-Conhecer o desenvolvimento histórico da Química;
-Estudar as propriedades da matéria;
-Reconhecer substâncias simples, compostas e misturas;
- Reconhecer os principais métodos de separação dos
componentes de misturas homogêneas e heterogêneas;
-Demonstrar as diversas experiências no desenvolvimento da teoria
atômica;
Reconhecer o modelo atômico atual e determinar seus constituintes
fundamentais;
-Reconhecer os níveis e subníveis de energia;
-Identificar o princípio de ordenação dos elementos químicos na
classificação periódica;
-Correlacionar às propriedades dos elementos.
Identificar ligações químicas iônicas e covalentes;
-Classificar compostos quanto a sua função (ácido e base);
-Conceituar os ácidos e hidróxidos segundo Arrhenius, Bronsted e
Lewis;
-Nomear, classificar, escrever as fórmulas e destacar as
propriedades mais características de cada função.
-Classificar compostos quanto a sua função (sais e óxidos);
-Nomear, classificar, escrever as fórmulas e destacar as
propriedades mais características de cada função;
-Classificar as reações químicas mais comuns;
-Determinar número de oxidação com o auxílio de regras práticas.
-Verificar as reações químicas de oxirredução e estequiometria.
3. DESENVOLVIMENTO METODOLÓGICO
-Ativar o potencial do aluno de forma que o estimule a buscar
informações históricas, aplicações práticas, curiosidades e outras
informações que lhe permitam evoluir na sua visão do
conhecimento, através de leituras e seminários referentes a textos e
artigos, pesquisas e aulas práticas relacionadas com o cotidiano.
-Trabalhar evitando atividades mecanizadas, desenvolvendo o
raciocínio na resolução de exercícios.
-Proporcionar atividades que desenvolvam o senso crítico, a
curiosidade e a criatividade do aluno através de aulas práticas
envolvendo o seu dia-a-dia, leituras e pesquisas, debates sobre
temas atuais em que a química está presente promovendo
discussões sobre temas sociais, ambientais, culturais e
econômicos.
-Relacionar as propriedades dos elementos químicos e a
classificação periódica com os materiais que encontramos no lixo e
podem ser reciclados. Este desafio contemporâneo pode ser
trabalhado através de leituras de textos e atividades práticas que
proporcionem a comparação, classificação e descoberta das
propriedades destes materiais, promovendo a valorização da
reciclagem e reutilização de materiais que podem causar impactos
ao meio ambiente.
-Elencar os problemas ambientais provenientes das emissões de
gases causadores da chuva ácida, aquecimento global e efeito
estufa, promovendo pesquisas, debates e trabalhos de
conscientização na comunidade escolar.
4. RECURSOS DIDÁTICOS
- Livro didático e livro didático público;
- Quadro de giz;
- TV multimídia;
- CDs e DVDs;
- Laboratório de informática;
- Laboratório de química;
- Livros da biblioteca do professor.
5. CRITÉRIOS E INSTRUMENTOS DE AVALIAÇÃO
A avaliação é contínua, somatória e diagnóstica.
5.1. CRITÉRIOS
- Verificação da formação, construção e reconstrução de conceitos
científicos;
- Valorização dos conhecimentos prévios do aluno e a sua interação
com os conceitos químicos;
- Contemplar as várias formas de expressão dos alunos: leitura,
interpretação e produção de textos, leitura e interpretação da tabela
periódica, pesquisa bibliográficas, relatórios de aulas em
laboratório, apresentação de seminários.
- Averiguação da apropriação efetiva de conhecimentos que
contribuam para transformar a própria realidade do aluno.
5.2. INSTRUMENTOS
- Provas dissertativas e/ou objetivas;
- Pesquisas;
- Seminários;
- Aulas presenciais e práticas;
- Debates;
- Trabalhos;
- Relatórios;
5.3. RECUPERAÇÃO
Após as avaliações são oportunizadas recuperações de conteúdos
através de atividades que possibilitem uma retomada dos mesmos.
São oferecidas também novas avaliações, os trabalhos podem ser
corrigidos e melhorados a fim de recuperar as notas.
6. REFERÊNCIAS BIBLIOGRÁFICAS
BAIRD,C. Química Ambiental. 2. ed. Porto Alegre: Bookman, 2002.
BRADY, J. ; HUMISTON, G. E. Química geral. v.1, ed.2. Rio de Janeiro: LTC,
1981.
BRASIL. Secretaria de Educação Média e Tecnológica. Parâmetros
curriculares nacionais: ensino médio. Brasília: MEC/SEMTEC, 2002.
BRAVERMAN, H. Trabalho e capital monopolista: a degradação do trabalho no
São Paulo XX. 3.ed. Rio de Janeiro: LTC, 1987.
Diretrizes Curriculares da rede pública de Educação Básica do Estado do
Paraná, 2007.
FELTRE, Ricardo Química Geral, Fisico-química, Química Orgânica Editora
Moderna 6ªEdição São Paulo 2004.
GOLDFARB, A. M. Da alquimia à Química. São Paulo: Landy, 2001.
HALL, Nina. Neoquímica. A química moderna e suas aplicações. Porto Alegre:
2004.
MALDANER, O. A. A formação inicial e continuada de professores de química:
professor/ pesquisador. 2. Ed. Ijuí: Editora Unijuí, 2003. p.120.
MORTIMER, E. F.; MACHAD0, A. H. Química para o ensino médio. São Paulo:
Scipione, 2002.
RUSSEL, J.B. Química geral. São Paulo: McGraw-hill,1981.
SANTOS, W. L. P. MIL, G.S.; Química e sociedade: cálculos, soluções e
estatística.São Paulo: Nova Geração, 2004.
SARDELLA, A.; FALCONE, M. Química: série Brasil. São Paulo: Áica, 2004.
SARDELLA, A.; MATEUS, E. Dicionário escolar de química. 3.ed. São Paulo:
Ática, 1992.