COLÉGIO AFI
2º ANO DO ENSINO MÉDIO
DATA:_____;_____/2009
ALUNO(A):________________________________________________________________________________
PROFESSOR: MARCOS EMÍLIO
DISCIPLINA: FÍSICA
ESTUDO DOS GASES
GÁS:
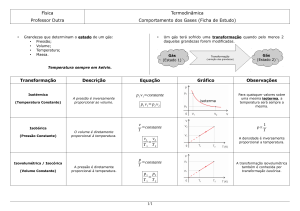
Transformação Isobárica – Gay-Lussac
Possui grande compressibilidade e
expansibilidade;
"Transformação a pressão constante."
Permanece no estado gasoso a
qualquer temperatura e pressão.
Porém, na prática o gás se liquefaz quando submetido a
altas pressões e baixas temperaturas;
Suas moléculas não possuem volume próprio, ocupando
todo o espaço que lhe é fornecido;
O gás ideal serve para prever o comportamento do gás
ideal. O gás ideal tem seu comportamento próximo ao do
gás ideal quando submetido a baixas pressões e altas
temperaturas.
Para uma mesma massa
de um mesmo gás numa
transformação isobárica, o
V1 ; T1
quociente entre o volume e a
V2 ; T2
temperatura
é
uma
constante.
O volume de um gás é diretamente proporcional à
temperatura absoluta do gás.
V1
V
T
onde: T = tc + 273
K
F
F
T1
V2
TRANSFORMAÇÕES GASOSAS
T2
Certa massa de gás tem seu estado definido pelas
grandezas pressão, volume e temperatura.
As grandezas Básicas para o estudo dos Gases são:
Pressão ( P ), Volume ( V ) e Temperatura ( T ).
Essas Grandezas são chamadas de VARIÁVEIS DE
ESTADO de um gás.
Quando uma dessas grandezas varia, ao menos umas
das outras também deve variar. Dizemos que o gás sofreu
uma TRANSFORMAÇÃO. É impossível apenas uma só
variável ser alterada.
O estado de um gás é determinado pelas variáveis:
P = pressão [N/m2 (Pa)]
V = volume (m3)
T = temperatura absoluta (K)
Transformações:
Pressão: 1 atm = 1,0 . 105 Pa = 760 mmHg
Volume: 1litro = 10-3 m3
Temperatura: TK = tC + 273
K
V1
T1
T = temperatura do gás em graus Kelvin
tc = temperatura em graus Celsius
Transformação Isométrica(isocórica ou isovolumétrica)– GayLussac
"Transformação a volume constante."
Para uma mesma massa de
um
mesmo
gás
numa
transformação isocórica, o
quociente entre a pressão e a
temperatura é uma constante.
A pressão que o gás exerce
nas paredes do recipiente é diretamente proporcional à
temperatura absoluta do gás.
P2 ; T2
P1 ; T1
P1
P
T
T1
P2
K
P1
T1
K
TRANSFORMAÇÕES PARTICULARES
T2
Transformação Isotérmica – lei de Boyle
EQUAÇÃO DE CLAYPERON
"Transformação de um gás sob temperatura constante."
F
Para uma mesma massa de
um
mesmo
gás,
numa
transformação isotérmica, o
produto da pressão pelo
volume é uma constante.
F F
P1
; V1
P2 ; V2
A pressão e o volume são inversamente proporcionais.
P
1
V
P1 V1
k
P2 V 2
P = pressão do gás
P1 V1
k
;
V = volume do gás
P2 V2
V2
T2
n = Número de mols.
M = massa molecular do
gás.
m = massa do gás.
R = constante universa
R = 0,082 litros . atm /
mol . kelvin
R = 8,31 joules / mol . kelvin ( S.I )
Obs: 1 mol de qualquer
substância é representa uma
quantidade fixa de 6,02 . 1023
átomos
ou
moléculas
da
mesma. NA = 6,02 . 1023 –
número de Avogadro.
P2
T2
Lei geral dos gases perfeitos
Na expansão, Vfinal > Vinicial
(o gás realiza trabalho)
Considere uma quantidade de gás confinada num
recipiente. Mesmo alterando suas variáveis de estado, n e
R permanecem constantes.
P1 V1
T1
P2 V2
T2
Na compressão, Vfinal < Vinicial
<0
(o gás recebe trabalho do meio exterior)
n R
1 atm . litro = 100 J
n R
Trabalho pela área
Análise gráfica das transformações gasosas
Propriedade:
Transformação isotérmica:
isoterma
P
T2
T1
T1
"O trabalho é numericamente igual a área, num gráfico da
pressão em função da variação do volume."
T2
V
Obs: Quanto mais afastada dos eixos estiver a isoterma,
maior a temperatura absoluta do gás.
Transformação isovolumétrica (isocórica ou isométrica)
Transformações cíclicas
SENTIDO HORÁRIO
O
trabalho
realizado
do
A
A
estado A até o
área1
área 2
estado
B
é
V
V
0
0
numericamente
igual a área 1 e o trabalho realizado de B até A é
numericamente igual a área 2. observe que o trajeto
seguido na ida não é o mesmo da volta, isto significa que os
módulos dos trabalhos são diferente. Como a área 1 é
maior que a área 2, o módulo do trabalho AB é maior que o
P
>0
Transformação isobárica
P
B
módulo do trabalho BA-
B
WAB
WBA
.
O trabalho resultante é a soma algébrica dos trabalhos
parciais:
WAB
WBA .
Do estado A ao estado
B o trabalho é POSITIVO (aumento de volume) e do estado
B ao estado A o trabalho é NEGATIVO (diminuição de
Transformação adiabática
T1
O SISTEMA VARIA
A SUA TEMPERATURA SEM TROCAR
CALOR O
COM
A
VIZINHANÇA.
T2
"A termodinâmica estuda as relações entre o calor
trocado e o trabalho realizado numa transformação de um
sistema."
Trabalho realizado por um gás
V
volume). Como
gás
WAB
WBA
, então o trabalho
resultante é POSITIVO.
SENTIDO ANTI-HORÁRIO
O
trabalho
realizado
do
estado A até o
B
B
área1
área 2
estado
B
é
numericamente
V
V
0
0
igual a área 1 e o
trabalho realizado de B até A é numericamente igual a
área 2. observe que o trajeto seguido na ida não é o mesmo
da volta, isto significa que os módulos dos trabalhos são
diferente. Como a área 1 é maior que a área 2, o módulo do
trabalho AB é maior que o módulo do trabalho BAP
TERMODINÂMICA
= P.
WR
P
A
WAB
WBA
A
.
O trabalho resultante é a soma algébrica dos trabalhos
parciais:
WR WAB WBA . Do estado A ao estado B o
trabalho é NEGATIVO (diminuição de volume) e do estado B
ao estado A o trabalho é POSITIVO (aumento de volume).
(tau)= trabalho realizado pelo gás (J)
P = pressão exercida pelo gás [N/m2 (Pa)]
V = variação do volume (m3), onde:
Como
V = V2 - V1
WAB
NEGATIVO.
WBA
, então o trabalho resultante é
Obs: Juntando as duas curvas (isotermas) de cada sentido
fecha-se o ciclo e o trabalho resultante corresponde á área
interna da figura.
Q (absorvido) > 0
Q ( cedido) < 0
(expansão - realizado pelo gás) > 0
(compressão – realizado sobre o gás) < 0
A energia interna do gás é função exclusiva da
temperatura absoluta do mesmo:
U = Ufinal - Uinicial
* A temperatura aumenta :
U>0
* A temperatura diminui :
U<0
Primeiro princípio da
conservação da energia.
termodinâmica:
Princípio
da
Aplicação da primeira lei nas transformações gasosas
particulares
Energia interna
A soma de todas as formas de energia das moléculas de um
gás é chamada energia interna (U) do gás. De todas elas, a
mais significativa é a energia cinética das moléculas.
Portanto a energia interna de um gás corresponde
praticamente á soma da energia cinética
média das
moléculas.
3
E CM
2
3
2
A temperatura é constante. Como a energia interna é
função exclusiva da temperatura absoluta do gás, se TF = TI
T = 0, então UF = UI
U = 0.
A energia cinética média, ECM, das
moléculas de um gás é proporcional à
sua temperatura absoluta.
k T
Se a amostra gasosa for constituída por N moléculas, a
energia cinética média de agitação molecular, E, ou a energia
térmica dessas N partículas é dada por
E
Transformação isotérmica
K
constante de Boltzmann e seu
valor é 1,38 x 10 -23 J/k.
N k T
U
U
3
2
N k
T
Quando um sistema
recebe calor (Q) da
vizinhança,
parte
dessa energia é usada
para realizar trabalho
( ) e a outra parte é
“armazenada”
na
forma
de
energia
interna ( U ).
Quando o sistema recebe trabalho (
0
Q
W
W
Transformação isovolumétrica, isocórica ou isométrica
O volume é constante. Como o trabalho depende da
variação do volume do gás, se V2 = V1
V 0 , então
o trabalho também é nulo.
U
Q
W
U
Q
(P
U
Q
(P 0 )
U
Q
V)
Numa transformação isovolumétrica todo calor trocado
é convertido em energia interna. Se o gás recebe calor, a
sua temperatura aumenta junto com a energia interna. Se
o gás perde calor, a sua temperatura diminui às custas da
energia interna que também diminui.
Transformação isobárica
A pressão é constante. Nenhuma grandeza é nula.
U
Q
W
Transformação adiabática
O sistema não troca calor com o meio externo
) da vizinhança,
parte deste é convertida em energia interna (
outra parte em calor cedido (Q) para a vizinhança
Observe que a energia total é conservada.
Q = quantidade de calor;
interna;
= trabalho
W
Obs: A primeira lei da termodinâmica permite, ao menos na
teoria, que todo calor trocado seja convertido em trabalho.
A energia interna de um gás é função
exclusiva da temperatura absoluta
(kelvin).
Isso significa que a energia interna varia se a
temperatura também variar. Podemos dizer, então, que a
variação da energia interna é função exclusiva da variação
de temperatura.
Q
Q
Para os gases ideais, em que o modelo cinético considera
suas moléculas como esferas rígidas e pontuais, a energia
interna, U, é a própria energia cinética média de translação,
E, dessas partículas. Temos , então
3
N k T
2
U
U)
e a
U = variação da energia
U
Q
W
U
0
W
U
(Q = 0).
W
Quando o gás realiza trabalho a sua energia interna
diminui e quando recebe trabalho a sua energia interna
aumenta.
Segundo princípio da termodinâmica
No universo há um sentido preferencial para as
transformações de energia. Uma pedra, espontaneamente,
sempre desce uma encosta e nunca sobe, por exemplo. As
moléculas de uma gota de café espontaneamente se
espalham quando mergulhadas num copo de leite. Essas
mesmas moléculas não vão se juntar para formar a gota
original. Essas são chamadas transformações irreversíveis.
De acordo com a segunda lei da Termodinâmica, nas
transformações naturais a energia se “degrada”de uma forma
organizada para uma forma desordenada chamada energia
térmica, como por exemplo, um pêndulo, oscilando, pára ao
fim de algum tempo em virtude dos choques com as
moléculas do ar e outros atritos.
De acordo com essa lei, há um sentido preferencial, também,
para a transferência de calor entre corpos. O calor sempre
passa, espontaneamente, de regiões mais quentes para
regiões mais frias.
Esse fato levou Clausius a enunciar a segunda lei do
seguinte modo:
Rendimento da máquina térmica
O rendimento dessa máquina térmica pode ser expresso
pela razão entre a energia útil (trabalho) e a energia total
representada pelo calor retirado da fonte quente (Q1).
Q1
O calor não passa espontaneamente de um corpo
para outro de temperatura mais alta.
Sendo a calor uma forma de energia inferior (degradada),
não é simples a sua conversão em outra forma de energia,
embora a primeira lei estabeleça essa possibilidade. Sendo
assim, Lord Kelvin e Max Planck (1848-1947) enunciaram a
segunda lei da Termodinâmica da seguinte maneira:
É impossível construir uma máquina, operando
em ciclos, cujo único efeito seja retirar calor de uma
fonte e convertê-lo integralmente em trabalho.
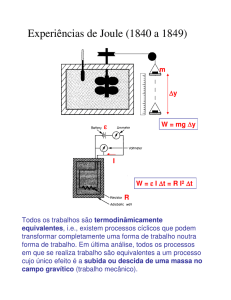
Conversão de calor em trabalho: Máquina térmica
Vimos que, quando um sistema, por exemplo, um gás,
realiza um ciclo em sentido horário no diagrama de trabalho,
há transformação de calor em trabalho. Todavia, e acordo
com a segunda lei, essa ocorrência não é possível, com o
sistema retirando calor de uma fonte e convertendo-o
completamente em trabalho.
As máquinas térmicas, como por exemplo, as máquinas a
vapor, foram inventadas e funcionavam antes que seu
princípio teórico fosse estabelecido.
Estudando essas máquinas, Carnot evidenciou que uma
diferença de temperatura era tão importante para uma
máquina térmica quanto uma diferença de nível d’água para
uma máquina hidráulica. Estabeleceu, então, que:
Para que uma máquina térmica consiga converter
calor em trabalho de modo contínuo, deve operar
em ciclo entre duas fontes térmicas, uma quente e
outra fria: retira calor da fonte quente (Q1),
converte-o parcialmente em trabalho ( ) e o
restante (Q2) rejeita para a fonte fria.
Q1 = quantidade de calor fornecida para a máquina
térmica pela fonte quente.
= trabalho obtido, realizado pela máquina térmica.
Q2 = quantidade de calor perdida para a fonte fria.
(Primeira máquina a vapor)
(Barco a vapor)
Uma máquina térmica bem conhecida é a locomotiva a
vapor ( “Maria Fumaça “). Nesta, a fonte quente é a caldeira
( fornalha ) e a fonte fria é o ar atmosférico. O calor retirado
da caldeira é parcialmente transformado no trabalho motor
que aciona a máquina e a diferença é a rejeitada para a
atmosfera.
Entropia - tendência natural da energia se dispersar e da ordem
evoluir invariavelmente para a desordem. O conceito foi
sistematizado pelo austríaco Ludwig Boltzmann ( 1844-1906) e
explica o desequilíbrio natural entre trabalho e calor.