UNIVERSIDADE DO ESTADO DE SANTA CATARINA - UDESC
CENTRO DE CIÊNCIAS TECNOLÓGICAS – CCT
DEPARTAMENTO DE QUÍMICA – DQMC
Profa. Márcia Margarete Meier
Alunos: Andrei Vailati, Janaina Sehnem
Voltametria Clíclica
A voltametria é uma técnica eletroquímica onde as informações
qualitativas e quantitativas de uma espécie química são obtidas a partir do
registro de curvas corrente-potencial, feitas durante a eletrólise dessa
espécie em uma cela constituída de pelo menos dois eletrodos, sendo um
deles o eletrodo de trabalho e o outro um eletrodo de referência. Um
potencial (E) é aplicado entre os dois eletrodos em forma de varredura, isto
é, variando-o a uma velocidade constante em função do tempo (s). A curva
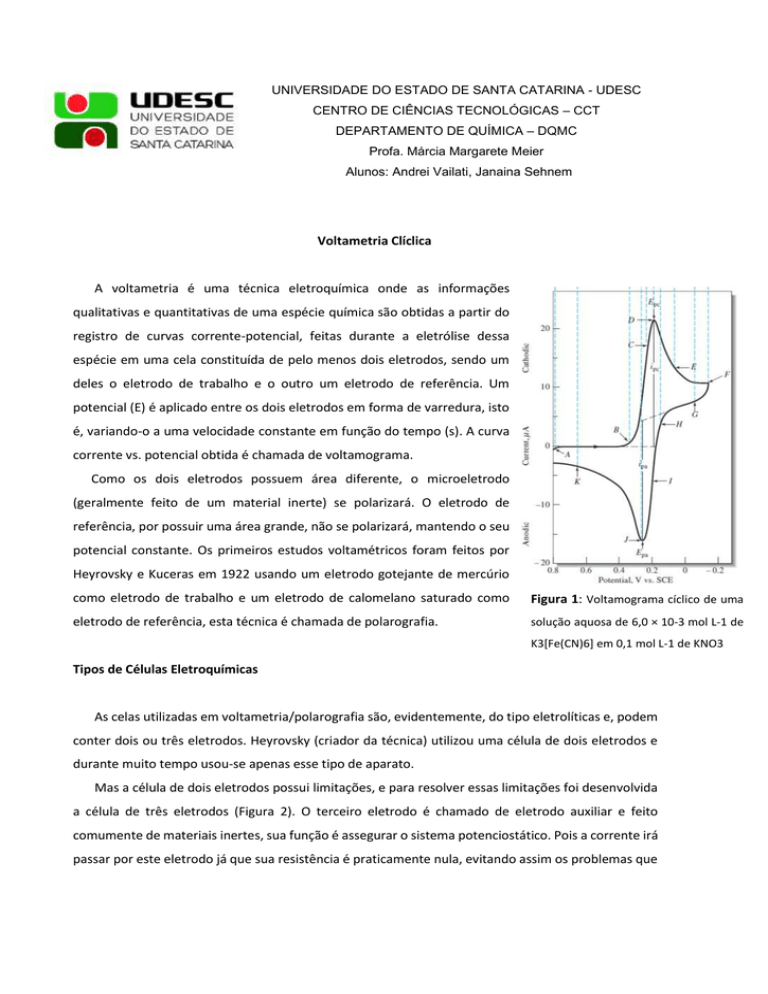
corrente vs. potencial obtida é chamada de voltamograma.
Como os dois eletrodos possuem área diferente, o microeletrodo
(geralmente feito de um material inerte) se polarizará. O eletrodo de
referência, por possuir uma área grande, não se polarizará, mantendo o seu
potencial constante. Os primeiros estudos voltamétricos foram feitos por
Heyrovsky e Kuceras em 1922 usando um eletrodo gotejante de mercúrio
como eletrodo de trabalho e um eletrodo de calomelano saturado como
Figura 1: Voltamograma cíclico de uma
eletrodo de referência, esta técnica é chamada de polarografia.
solução aquosa de 6,0 × 10-3 mol L-1 de
K3[Fe(CN)6] em 0,1 mol L-1 de KNO3
Tipos de Células Eletroquímicas
As celas utilizadas em voltametria/polarografia são, evidentemente, do tipo eletrolíticas e, podem
conter dois ou três eletrodos. Heyrovsky (criador da técnica) utilizou uma célula de dois eletrodos e
durante muito tempo usou-se apenas esse tipo de aparato.
Mas a célula de dois eletrodos possui limitações, e para resolver essas limitações foi desenvolvida
a célula de três eletrodos (Figura 2). O terceiro eletrodo é chamado de eletrodo auxiliar e feito
comumente de materiais inertes, sua função é assegurar o sistema potenciostático. Pois a corrente irá
passar por este eletrodo já que sua resistência é praticamente nula, evitando assim os problemas que
ocorrem na cela com dois eletrodos onde a corrente passa pelo eletrodo de referência, fazendo com
que este não mantenha sempre seu potencial constante.
Figura 2: Esquema de uma célula voltamométrica potenciostática de três eletrodos.
A corrente resultante da varredura de potencial depende além da velocidade de transporte de
massa, da velocidade com que os elétrons são transferidos do eletrodo para a solução ou vice-versa
(chamada velocidade de transferência eletrônica heterogênea). Através disso pode-se verificar a
reversibilidade do processo.
Processos reversíveis: Um processo reversível é um processo no qual a velocidade de transferência
de carga heterogénea é tão elevada que se estabelece um equilíbrio dinâmico à superfície do eletrodo.
Processos quase-reversíveis: são aqueles nos quais a reação depende tanto da velocidade de
transferência de elétrons heterogênea como da velocidade de difusão. Logo, os voltamogramas são
sensíveis a variação na escala de tempo do experimento, ou seja, a velocidade de varredura.
Processos irreversíveis: são aqueles nos quais a etapa limitante é o processo de transferência de
elétrons heterogênea na interface eletrodo/solução. O processo redox ocorre num potencial mais
positivo ou negativo.
Algumas das aplicações de voltametria
Em análise de complexos a voltametria é útil para verificar a quantidade de processos redox do
composto analisado, como também descobrir a quantidade de elétrons envolvidos no processo. Através
dela também pode-se avaliar a força de interação entre o ligante e o metal. Além disso, também pode
ser utilizada para determinar concentrações de analitos cuja os potenciais de oxidação são conhecidos.
Um exemplo é a concentração de ácido ascórbico em suplementos de vitamina.












