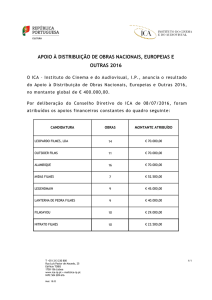
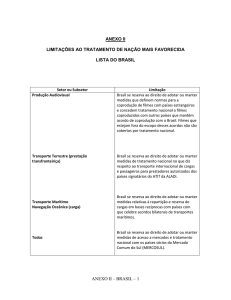
UNESP - UNIVERSIDADE ESTADUAL PAULISTA
CAMPUS DE ARARAQUARA
PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
“Imunossensores à base de filmes nanoestruturados de fibroína da seda - peptídeo antigênico
NS5A-1- vanadato de ítrio:európio para detecção de Hepatite C”
LAIS RONCALHO DE LIMA
Dissertação de Mestrado
2014
LAIS RONCALHO DE LIMA
“Imunossensores à base de filmes nanoestruturados de fibroína da seda - peptídeo antigênico
NS5A-1- vanadato de ítrio:európio para detecção de Hepatite C”
Dissertação de mestrado apresentada ao
Instituto de Química, Universidade Estadual Paulista,
como parte dos requisitos para a obtenção do título de
Mestre em Química.
Orientador: Prof. Dr. Sidney José Lima Ribeiro
Co-orientadora: Profa. Dra. Marli Leite de Moraes
Araraquara
2014
DADOS CURRICULARES
Dados Pessoais
Nome: Lais Roncalho de Lima
Data de nascimento: 09/09/1988
Nacionalidade: Brasileira
Naturalidade: Araraquara-SP
Estado civil: Solteira
Filiação: João Roberto de Lima e Elisete Helena Roncalho
Profissão: Química
Endereço: Rua Dante Giazzi, 1884, Santa Angelina, Araraquara-SP
Formação Acadêmica
Licenciatura em Química – curso concluído em 2011 – Universidade Estadual Paulista “Júlio
de Mesquita Filho” (IQ – UNESP, Araraquara-SP).
Produção Bibliográfica 2012-2013
MORAES, M. L.; LIMA, L. R.; SILVA, R. R.; CAVICCHIOLI, M.; RIBEIRO, S. J. L.
Immunosensor based on immobilization of antigenic peptide NS5A-1 from HCV and silk
fibroin in nanostructured films. Langmuir, v. 29, n. 11, p. 3829-3834, 2013. (doi:
10.1021/la304404v)
FAPESP (Brasil). MORAES, M. L.; RIBEIRO, S. J. L.; LIMA, L. R.; DEFFUNE, E.;
OLIVEIRA, J. C. V.; SOUZA, A. V. G. Processo de produção de um imunossensor, kit
para detecção de um vírus e método de detecção. BR 102013024172-5, 20 set. 2013.
Dedico este trabalho a minha família, meus alicerces,
em especial aos meus pais pelo apoio, amor, carinho,
incentivo e educação. Aos amigos pelas mãos sempre
estendidas e a Deus que sempre me guiou.
AGRADECIMENTOS
Agradeço em primeiro lugar a Deus, pela vida, sabedoria e pelas pessoas maravilhosas
que colocou em meu caminho. A elas são os meus maiores agradecimentos: a minha mãe,
meu maior exemplo de garra e superação, pela educação ímpar que me forneceu, pela
cumplicidade e compreensão em todos os momentos de nossas vidas. A minha avó, que é uma
segunda mãe e me criou com todo amor e carinho. A minha tia Iva pela paciência e dedicação,
também materna, durante toda minha vida. Ao meu pai, pela oportunidade de voltar e trazer a
chance de convivência para criarmos os nossos atuais laços afetivos e de amor. À minha
prima-irmã Maisa que esteve sempre ao meu lado, pela amizade, força e aos ensinamentos
proporcionados.
A todos os amigos conquistados no IQ ou através dele. Ao Douglas, parceiro de toda a
graduação, ao Matão que se tornou especial ainda mais nestes últimos anos, a Tiago e Samira
pela amizade sincera. Ao Paulinho que me ajudou e apoiou principalmente com relação à
realização deste trabalho. Agradeço não menos às amigas Araraquarenses Maiara, Nayara,
Júlia e Japa, que independente das correrias da vida nossa amizade foi sempre a mesma!
Obrigada pelos incentivos e pela confiança de sempre.
Agradeço também e principalmente ao Prof. Sidney, por todo o conhecimento e
orientação deste trabalho, pela oportunidade e confiança, além da compreensão e amizade
oferecidas neste período.
À Marli, pela orientação durante estes dois anos, onde sem dúvida foi peça
fundamental para meu crescimento profissional. Os meus mais que sinceros agradecimentos!
Ao Grupo de Pesquisa do Laboratório de Materiais Fotônicos, à Tâmara pela
cooperação e em especial a Hernane, Maurício, Molíria, Robson, Karina e Denise pela
amizade e colaboração.
Aos funcionários do IQ pelo auxílio nas tarefas desenvolvidas durante o curso e apoio
na revisão desta dissertação.
Ao grupo Polímeros da USP, São Carlos, pelas portas sempre abertas e à Faculdade de
Medicina de Botucatu, em especial à Dra. Elenice pela parceria e colaboração com nosso
trabalho.
À CNPq pela bolsa concedida.
“A ciência nos traz conhecimento; a vida, sabedoria.”
(Will Durant)
“Sábio é quem se contenta com o espetáculo do mundo.”
(Fernando Pessoa)
RESUMO
Neste trabalho foram investigados a fibroína da seda (silk fibroin, SF) com o peptídeo
antigênico da proteína NS5A-1 derivado do vírus da hepatite C (HCV) e nanopartículas de
vanadato de ítrio dopadas com európio em filmes nanoestruturados. Dois foram os tópicos
abordados: i) interação e organização estrutural do peptídeo com a fibroína. ii) imobilização
do peptídeo, da fibroína e nanopartículas em filmes automontados (Layer-by-Layer, LbL),
visando estudar a interação específica peptídeo antigênico-anticorpo e a produção de
protótipos de imunossensores. As interações fibroína-peptídeo foram estudadas em solução e
em filmes LbL pelas técnicas espectroscópicas de dicroísmo circular e luminescência. Os
resultados indicaram que há uma mudança conformacional da fibroína em solução para a
fibroína em filmes, de aleatória para folha-β, respectivamente, e que o filme de fibroína induz
a estrutura secundária do peptídeo que não possui uma conformação bioativa em solução. O
crescimento dos filmes LbL foi monitorado por espectroscopia UV-visível, e pôde-se observar
um crescimento linear a cada deposição realizada. Além do estudo fundamental das interações
a nível molecular, os sistemas foram utilizados para o desenvolvimento de protótipos de
imunossensores. A interação peptídeo antigênico-anticorpo foi estudada por medidas de
detecção eletroquímica, elétrica e óptica. Para a detecção eletroquímica realizou-se medidas
de voltametria cíclica, indicando uma diminuição na corrente quando em presença dos
anticorpos anti-HCV e testes em amostras reais soropositivas para o vírus, que indicaram uma
maior densidade de elétrons nos voltamogramas referentes às amostras infectadas. A detecção
elétrica foi analisada por espectroscopia de impedância elétrica, e observou-se que há um
aumento no sinal da capacitância e das perdas dielétricas de acordo com o aumento da
concentração do anticorpo. Este aumento de sinal é maior para filmes que contêm menor
número de bicamadas e medidas morfológicas de microscopia de força atômica foram
realizadas para o estudo da topografia do filme, indicando que provavelmente as reações
elétricas ocorram na superfície do sistema. Os dados de impedância elétrica foram analisados
por projeções multidimensionais, com a utilização do mapa interativo de documentos
(IDMAP), o que facilitou a visualização dos resultados através de um gráfico bidimensional.
A detecção óptica foi estudada por espectroscopia de luminescência, e os resultados indicaram
um aumento na luminescência característica do íon do európio, quando as medidas foram
realizadas na presença do anticorpo anti-HCV.
Palavras-chave: fibroína da seda, peptídeo, vanadato de ítrio e európio,
imunossensores, hepatite C.
ABSTRACT
The present study investigated the silk fibroin (SF) with the antigenic peptide of the
NS5A-1 protein of the hepatitis C virus (HCV) and nanoparticles of yttrium vanadate doped
with europium immobilized on nanostructured films. Two main topics were explored: i)
interaction and structural organization of the peptide with fibroin. ii) immobilization of the
peptide together with fibroin and nanoparticles in LbL films (Layer- by- Layer), in order to
study the specific interaction peptide antigen-antibody and production of prototype
immunosensors. The fibroin-peptide interactions were studied in solution and in LbL films by
spectroscopic techniques of circular dichroism and luminescence. The results indicate that
there is a conformational change of fibroin in the fibroin solution in film, sheet to random
coil-B, respectively, and that the fibroin film induces the secondary structure of the peptide
does not possess a bioactive conformation in solution. The growth of the LbL films was
monitored by UV-visible spectroscopy, and could observe a linear growth every deposit
made. Besides the fundamental study of interactions at the molecular level, the systems were
used for the development of prototype immunosensors. The peptide antigen-antibody
interaction was studied by electrochemical, electrical and optical detection measures. For
electrochemical detection, were made cyclic voltammetry measurements indicating a decrease
in current when in the presence of anti-HCV antibodies, and were made tests on real samples
seropositive for the virus, which indicated a higher density of electrons in voltammograms
respect to infected samples. The electrical detection was analyzed by electrical impedance
spectroscopy, and it was observed that there is an increase in the signal of capacitance and the
dielectric losses in accordance with the increase in antibody concentration. This increase in
signal is higher for films containing smaller number of bilayers and morphological
measurements of atomic force micrscopy were conducted to study the topography of the film,
indicating that probably the electrical reactions occur on the surface of the system. The
electrical impedance data were analyzed by multidimensional projections, using the
interactive document map (IDMAP), which facilitated the visualization of the results through
a two-dimensional graph. The optical detection was studied by luminescence spectroscopy,
and the results indicated an increase in the luminescence characteristic of the europium ion,
when measurements were performed in the presence of anti-HCV antibodies.
Keywords: silk fibroin, peptide, yttrium vanadate and europium, immunosensors,
hepatitis C.
LISTA DE ILUSTRAÇÕES
Figura 1: Estrutura do vírus HCV. a) Estrutura completa do vírus b) Secção mostrando os
componentes do vírus como as proteínas do envelope, proteínas do capsídeo, lipídeos e ácidos
nucléicos....................................................................................................................................21
Figura 2: Genoma do vírus HCV mostrando as proteínas estruturais e não estruturais que
compõem o vírus.......................................................................................................................22
Figura 3: Processo de infecção da célula hospedeira iniciando com a entrada do vírus através
da membrana plasmática por endocitose, seguido pela liberação do material genético viral no
meio intracelular culminando na tradução das poliproteínas, estruturação do vírus até sua
maturação..................................................................................................................................24
Figura 4: Regiões globais mostrando os níveis de infecção por HCV e os tipo de genótipos
prevalecentes por região............................................................................................................25
Figura 5: Principais aminoácidos da cadeia polimérica da fibroína da seda...........................28
Figura 6: Estrutura da fibroína da seda produzida pelo bicho-da-seda (Bombyx mori)..........29
Figura 7: Representação esquemática do processo de automontagem de uma bicamada do
filme camada-por-camada. a) deposição do filme sobre substrato sólido. Em 1 e 3 há a
adsorção dos polieletrólitos aniônico e catiônico. E em 2 e 4 são as etapas de lavagem. b)
Estrutura idealizada do filme automontado...............................................................................30
Figura 8: Representação esquemática de um biossensor.........................................................32
Figura 9: Esquema do procedimento de preparação dos filmes automontados via técnica LbL
(camada por camada). As soluções 1 e 4 representam, respectivamente, a fibroína da seda e o
peptídeo NS5A-1 e 2 e 4 representam a água Milli-Q utilizada para lavagem e remoção de
moléculas fracamente adsorvidas..............................................................................................39
Figura 10: Representação esquemática dos filmes LbL de (1) fibroína/NS5A-1 com 5
bicamadas depositadas e do (2) filme LbL de fibroína da seda com 5 camadas, montados sobre
eletrodos impressos de carbono................................................................................................40
Figura 11: Representação esquemática do filme LbL de fibroína/NS5A-1 sobre eletrodos de
ouro interdigitados....................................................................................................................40
Figura 12: Espectros UV-vis. do filme de fibroína da seda contendo diferentes números de
camadas e bicamadas. Inserção: aumento na absorção a 280 nm em função do número de
camadas/bicamadas depositadas...............................................................................................45
Figura 13: Espectros UV-vis. do filme de fibroína/NS5A-1, contendo diferentes números de
camadas e bicamadas. Inserção: aumento na absorção a 280 nm em função do número de
camadas/bicamadas depositadas...............................................................................................46
Figura 14: Espectros de Dicroísmo Circular (CD) (a) da fibroína da seda em solução aquosa
(linha sólida) e em filme LbL contendo 10 camadas da proteína (linha tracejada); (b) do
NS5A-1 em solução aquosa (linha sólida) e dos filmes automontados fibroína/NS5A-1 com
10 bicamadas depositadas (linha tracejada). Detalhe: predição de estrutura secundária para o
NS5A-1.....................................................................................................................................47
Figura 15: Espectros de luminescência (a) da fibroína da seda em solução aquosa (linha
sólida) e do filme de fibroína com 10 camadas depositadas (linha tracejada); (b) da fibroína e
da mistura de fibroína/NS5A-1 em solução aquosa e dos filmes automontados de fibroína da
seda (10 camadas depositadas) e de fibroína/NS5A-1 (10 bicamadas depositadas) com
excitação em 280 nm.................................................................................................................49
Figura 16: Voltamogramas Cíclicos dos filmes LbL de (a) fibroína da seda com 5 camadas
depositadas e de (b) fibroína/NS5A-1 com 5 bicamadas automontadas, em tampão PBS na
ausência (curva pontilhada) e presença (curva sólida) de anticorpos antiHCV..........................................................................................................................................51
Figura 17: Curva analítica dos filmes automontados contendo 1 bicamada de fibroína/NS5A1 na presença de diferentes concentrações de anti-HCV:PBS (diluições 1 g mL-1; 0,2 g mL1
; 0,1 g mL-1; 0,02 g mL-1; 0,01 g mL-1, 0 g mL-1)..........................................................52
Figura 18: Voltamogramas Cíclicos dos filmes LbL de fibroína/NS5A-1 com 5 bicamadas
automontadas, na presença de amostras reais soronegativas para HCV (curva padrão
vermelha) e soropositivas para HCV, ou seja, amostras reais que contêm anticorpos anti-HCV
(curvas verde)............................................................................................................................53
Figura 19: representação esquemática do filme LbL de fibroína/NS5A-1 mostrando o
reconhecimento específico dos anticorpos anti-HCV e o não reconhecimento na presença dos
anticorpos anti-HIV...................................................................................................................53
Figura 20: Curvas de Capacitância e Perdas Dielétricas vs frequência dos filmes LbL
contendo 1 bicamada de fibroína/NS5A-1, em ausência e presença de anticorpo anti-HCV em
diferentes concentrações...........................................................................................................54
Figura 21: Curvas de Capacitância e Perdas Dielétricas vs frequência dos filmes LbL
contendo 5 bicamadas de fibroína/NS5A-1, em ausência e presença de anticorpo anti-HCV
em diferentes concentrações.....................................................................................................55
Figura 22: Capacitância a 100 Hz vs concentração de anti-HCV para os filmes contendo 1
(quadrados sólidos) e 5 (círculos) bicamadas de fibroína/NS5A-1.........................................56
Figura 23: Curvas de Capacitância e Perdas Dielétricas vs frequência do filme LbL contendo
5 bicamadas de fibroína/NS5A-1 em ausência (curva preta) e presença (curva vermelha) de
anticorpo anti-p24 (HIV)..........................................................................................................57
Figura 24: Combinação das partes reais e imaginárias dos dados impedância obtidos através
de um eletrodo revestido por um filme LbL contendo 1 bicamada de fibroína/NS5A1.................................................................................................................................................58
Figura 25: Imagens topográficas de AFM dos filmes de (a) fibroína, (b) fibroina/NS5A-1
contendo uma bicamada e (c) o filme de 1 bicamada de fibroína/NS5A-1 na presença de
anticorpos anti-HCV. As inserções em (a) e (b) mostram um zoom de alta resolução de uma
área de 1 x 1 μm2 nas respectivas imagens...............................................................................59
Figura 26: Nanopartículas de YVO4:Eu3+ em solução aquosa vista sob a) luz branca e b) luz
UV.............................................................................................................................................60
Figura 27: representação esquemática do filme LbL de fibroína/NS5A-1+nanopartículas de
YVO4:Eu3+ mostrando o reconhecimento específico quando na presença dos anticorpos antiHCV..........................................................................................................................................60
Figura 28: Espectros de a) emissão e b) excitação das nanopartículas de YVO4:Eu3+ em
solução aquosa..........................................................................................................................61
Figura 29: Espectro de luminescência do filme LbL contendo 5 bicamadas de fibroína/NS5A1+nanopartículas de YVO4:Eu3+. Inserção: Aumento da emissão em 334 nm (característica
da fibroína) e em 619 nm (característica das nanopartículas de YVO4:Eu3+) para o filme em
função do número de camadas depositadas..............................................................................62
Figura 30: Espectro de excitação do filme LbL contendo 5 bicamadas de fibroína/NS5A1+nanopartículas de YVO4:Eu3+...............................................................................................63
Figura 31: Espectros de luminescência dos filmes LbL contendo 5 bicamadas de
fibroína/NS5A-1+nanopartículas de YVO4:Eu3+ na ausência de anticorpos (em PBS, curva
negra) e na presença de anticorpos anti-HCV (curva vermelha)..............................................64
Figura 32: Espectros de luminescência dos filmes LbL contendo 5 bicamadas de
fibroína/NS5A-1+nanopartículas de YVO4:Eu3+ na ausência de anticorpos (em PBS, curva
negra) e na presença de anticorpos anti-HIV (curva vermelha)................................................65
Figura 33: Curva analítica do filme LbL contendo 5 bicamadas de fibroína/NS5A1+nanopartículas de YVO4:Eu3+ na presença de diferentes concentrações de anti-HCV
(concentrações 0; 0,01; 0,02; 0,1; 0,2 e 1 g mL-1)..................................................................66
Figura 34: Espectros de excitação do filme LbL contendo 5 bicamadas de fibroína/NS5A1+nanopartículas de YVO4:Eu3+ na presença de diferentes concentrações de anti-HCV......67
Figura 35: Razão entre as bandas largas de excitação e as linhas finas referentes às transições
ff do európio de acordo com a concentração de anticorpo........................................................68
LISTA DE GRÁFICOS
Gráfico 1: Casos confirmados de Hepatite C, segundo a região de residência. Brasil, 1999 –
2010...........................................................................................................................................16
Gráfico 2: taxa de detecção de Hepatite C (por 100.000 habitantes), segundo a região de
residência, por ano de notificação. Brasil, 1999 a 2010............................................................17
LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS
HCV
Vírus da Hepatite C
SF
Fibroína da Seda
NS5A-1
Peptídeo Antigênico do vírus da hepatite C
LbL
Layer-by-Layer
YVO4:Eu3+
Vanadato de Ítrio dopado com európio
Np
Nanopartículas
PBS
Tampão fosfato salino
HIV
Vírus da imunodeficiência humana
p24
Proteína do vírus da imunodeficiência humana
Tyr
Tirosina
Trp
Triptofano
Phe
Fenilalanina
UV-vis
Ultravioleta-visível
CD
Dicroísmo Circular
VC
Voltametria Cíclica
IE
Impedância Elétrica
AFM
Microscopia de Força Atômica
ABS
Absorção
i
Intensidade final
i0
Intensidade inicial
IDMAP
Mapa Interativo de Documentos
RMS
Rugosidade
AC
Corrente Alternada
SINAN
Sistema de Informação de Agravos de Notificação
SVS
Secretaria de Vigilância em Saúde
IBGE
Instituto Brasileiro de Geografia e Estatística
OMS
Organização Mundial da Saúde
RNA
Ácido Ribonucleico
DCPF
Doença crônica parenquimatosa do fígado
EIE
Ensaios Imunoenzimáticos
ELISA
Enzyme-Linked Immunosorbent Assay
ORF
Open reading frame
E1
Proteína do envelope 1
E2
Proteína do envelope 2
p7
Peptídeo que possui atividade de canal iônico
NS2
Proteína Transmembrana
NS3
Proteases
NS4A
Cofator A
NS4B
Cofator B
NS5A
Proteína de resistência ao interferon
NS5B
RNA polimerase
NTP
Nucleotídeos tri-fosfatados
LCS
Sequencia de baixa complexidade
RE
Retículo endoplasmático
DAA
Antivirais de ação direta
MHC
Complexo Maior de Histocompatibilidade
SRP
Ressonância de plásmon de superfície
HPLC
Cromatografia Líquida de Alta Eficiência
LED
Diodo Emissor de Luz
EDTA
Ácido etilenodiamino tetra-acético
DO
Densidade Óptica
G/
Condutância/Frequência angular
SUMÁRIO
1. APRESENTAÇÃO ......................................................................................................... 16
2. INTRODUÇÃO .............................................................................................................. 21
2.1
Hepatite C .................................................................................................................... 21
2.2
Peptídeos Antigênicos ................................................................................................. 26
2.3
Fibroína da Seda (SF) ................................................................................................ 28
2.4
Filmes automontados Layer-by-Layer (LbL)............................................................. 29
2.5
Biossensores................................................................................................................. 31
2.5.1.
Biossensores Eletroquímicos ................................................................................... 32
2.5.2.
Biossensores Elétricos .............................................................................................. 33
2.5.3
Biossensores Ópticos ................................................................................................. 34
2.6
Nanopartículas de YVO4:Eu3+................................................................................... 35
3. OBJETIVOS ................................................................................................................... 36
4. METODOLOGIA EXPERIMENTAL ......................................................................... 37
4.1
Material e Métodos ..................................................................................................... 37
4.2
Preparação dos filmes sobre substratos de sílica. .................................................... 38
4.3
Preparação dos filmes em eletrodos impressos de carbono .................................... 39
4.4
Preparação dos filmes em eletrodos interdigitados de ouro ................................... 40
4.5
Técnicas experimentais .............................................................................................. 41
4.5.1.
Espectroscopia de absorção no UV-Visível ........................................................... 41
4.5.2
Espectroscopia de Dicroísmo Circular (CD) .......................................................... 41
4.5.3
Espectroscopia de Luminescência ........................................................................... 42
4.5.4
Voltametria Cíclica (VC) ........................................................................................... 43
4.5.5 Impedância Elétrica (IE)............................................................................................ 43
4.5.6 Microscopia de Força Atômica (AFM)....................................................................... 44
5. RESULTADOS E DISCUSSÕES ................................................................................. 45
5.1
Crescimento dos filmes automontados caracterizados por UV-visível .................. 45
5.2
Caracterização dos filmes por Dicroísmo Circular (CD)........................................ 46
5.3
Caracterização dos filmes por Espectroscopia de Luminescência ......................... 48
5.4
Aplicação dos filmes de fibroína/NS5A-1/YVO4:Eu3+ como imunossensores ....... 50
5.4.1.
Detecção Eletroquímica.......................................................................................... 50
5.4.2.
Testes em amostras reais soropositivas do vírus da hepatite C (HCV) ................. 52
5.4.3
Detecção Elétrica ..................................................................................................... 53
5.4.4
Projeções Multidimensionais ................................................................................... 57
5.4.5
Morfologia do Sistema fibroína/NS5A-1 .................................................................. 58
5.4.6 Detecção Óptica .......................................................................................................... 59
6. CONCLUSÕES E PERSPECTIVAS ........................................................................... 69
REFERÊNCIAS ..................................................................................................................... 71
16
1. APRESENTAÇÃO
A infecção pelo HCV é um dos maiores problemas de saúde pública em todo o
mundo.[1] Há evidências de alta prevalência da infecção localizada na África, sobretudo no
Egito e África do Sul, onde a prevalência em determinadas regiões pode alcançar 20% da
população.[1-2] Cerca de 2,7 a 3,9 milhões de pessoas são infectadas apenas nos Estados
Unidos, sendo que o Ministério da Saúde (MS) estima que no Brasil este número seja de 1,5
milhão de pessoas. No período de 1999 a 2011, foram notificados ao MS 82.041 casos confirmados de hepatite C no Brasil, a maioria dos quais nas Regiões Sudeste (67,3%) e Sul
(22,3%) conforme Gráfico abaixo, sendo que somente em 2010 foram notificados 10.321
novos casos.[3]
Gráfico 1: Casos confirmados de Hepatite C, segundo a região de residência. Brasil, 1999 – 2010.
Fonte: Casos de Hepatites virais: SINAN/SVS/MS; população: estimativas populacionais do
Instituto Brasileiro de Geografia e Estatística (IBGE) segundo os Censos (1980, 1991, 2000 e 2010),
contagem da população (1996) e projeções intercensitárias (1981 a 2009).[3]
No entanto, outras publicações apontam que o número de indivíduos infectados pelo
HCV seja em torno de 2% da população brasileira, ou seja, 3 milhões de indivíduos.[4] A
análise das taxas de soroconversão para a hepatite C continuam alertando para a epidemia,
este fato é mais presente no Brasil na região sul, Gráfico 2.[3]
17
Gráfico 2: taxa de detecção de Hepatite C (por 100.000 habitantes), segundo a região de
residência, por ano de notificação. Brasil, 1999 a 2010.
Fonte: Casos de hepatites virais: SINAN/SVS/MS; população: estimativas populacionais do
Instituto Brasileiro de Geografia e Estatística (IBGE) segundo os Censos (1980, 1991, 2000 e 2010),
contagem da população (1996) e projeções intercensitárias (1981 a 2009).[3]
Nos Estados Unidos da América (EUA), são registrados em torno de 8.000 a 10.000
mortes por ano em consequência de doença hepática crônica causada pelo vírus C e ocorre
cerca de 30.000 novas infecções por ano.[5-6] Isso torna a hepatite C a infecção transportada
pelo sangue mais comum, e a responsável por quase a metade de todos os pacientes com
doença hepática crônica nos Estados Unidos.[7] Na França, a soro positividade para anti-HCV
é em torno de 1,1% com 500.000 a 650.000 pessoas afetadas.[5] Dados da Organização
Mundial da Saúde (OMS) estimam que em torno de 3% (aproximadamente 170 milhões) da
população mundial estaria infectada por esse vírus, sendo relevante o número de pessoas que
desconhece o fato de conter o vírus.[2,5-6,8] Ainda referente ao Brasil, dados mostram que a
cidade de São Paulo possui prevalência de 1 a 4% da população com anticorpos anti-HCV
positivos.[6,8]
As altas porcentagens de cronicidade da doença, seu potencial evolutivo para cirrose e
hepatocarcinoma, assim como o fato de ser a mais frequente etiologia diagnosticada em casos
de transplante hepático, fazem com que constitua grave problema de saúde pública.[8]
O HCV é um vírus de ácido ribonucleico (RNA), pertencente à família Flaviviridae e
foi descoberto em 1989 por Choo e colaboradores.[1,5-6,8-9] O genoma desse vírus apresenta
9.400 nucleotídeos que codifica poliproteína simples de aproximadamente 3.010 aminoácidos
em um único quadro de leitura aberta.[7,9] De maneira semelhante a outros vírus de RNA, tem
18
alta capacidade mutagênica, fato que contribui para a manutenção no organismo humano e
desenvolvimento de hepatite crônica.[1] Essa heterogeneidade genética parece resultar da má
fidelidade da RNA polimerase dando origem a diversos genótipos com diferentes subtipos. [7,9]
Dentro de qualquer paciente infectado, o HCV circula como uma população de diferentes
genótipos.[10] Essa variabilidade genômica e instabilidade antigênica dificultam os esforços no
desenvolvimento de uma vacina contra o vírus.[7] A partir do sequenciamento do genoma do
HCV foram realizados estudos filogenéticos que demonstraram a presença de diferentes
variantes, e isso levou a classificação do vírus em 6 tipos ou genótipos (1 - 6), e no mínimo 30
subtipos (a - f).[9] O HCV é uma das principais causas de doença crônica parenquimatosa do
fígado (DCPF) e possui tanto formas clínicas agudas, geralmente assintomáticas, como
formas crônicas, que possuem sintomas brandos, mas podem causar lesões hepáticas mais
severas, como a cirrose e a insuficiência hepática.[11-12]
É uma doença transmitida pelo sangue, ocorrendo com maior frequência através de
transfusões sanguíneas. A contaminação também pode ocorrer através do uso de drogas
injetáveis, acidentes com instrumentos cortantes como agulhas, tesouras, bisturis, lâminas e
alicates de unha, quando não esterilizados corretamente, tatuagens, piercings, bem como em
hemodiálises e por contato sexual.[12]
Os testes para diagnosticar a infecção pelo HCV podem ser divididos em duas
categorias principais: testes sorológicos, que detectam anticorpos anti-HCV e testes
moleculares, que buscam detectar ou quantificar o RNA viral. Exames complementares
também possuem papel fundamental no diagnóstico e avaliação da resposta a esta infecção,
como exemplo, exames de imagem do fígado, testes genotípicos, biópsia hepática, entre
outros. Na prática clínica, costuma-se primeiro utilizar exames para a detecção de anticorpos
anti-HCV e depois realizar os testes que detectam o RNA viral, confirmando, assim, a
infecção pela presença do vírus no sangue.[13]
Os testes mais utilizados para a detecção de anticorpos anti-HCV no sangue de
indivíduos são os ensaios imunoenzimáticos (EIE) ou enzyme-linked immunosorbent assay
(ELISA).[14] O teste ELISA possui algumas vantagens, como facilidade e pouca variabilidade
de resultados, porém é um teste relativamente caro e com um tempo de resposta no mínimo de
30 minutos. Por ser um teste que detecta o anticorpo contra o HCV, faz-se necessário o
emprego de testes comprobatórios para auxiliar os profissionais de saúde na interpretação de
resultados positivos e de possíveis resultados falso-positivos. Tais testes avaliam o RNA do
HCV e podem ser qualitativos ou quantitativos. Os qualitativos apenas informam se existe ou
não material genético viral, já os quantitativos indicam a quantidade de ácido nucléico do
19
vírus presente no material estudado. Esses exames comprobatórios são de fundamental
importância para o tratamento do paciente infectado cronicamente com o HCV.[13-14]
Os métodos tradicionais de detecção do RNA viral da hepatite C, embora bastante
sensíveis, exigem tempo, complexos tratamentos das amostras, equipamentos especiais, além
de, muitas vezes, apresentarem alto custo. Em geral, o objetivo de uma estratégia de detecção
é a simplicidade da metodologia analítica a um nível prático e rotineiro, com uma demanda
mínima de habilidades do operador. Deste modo, métodos de detecção, que apresentam
desempenhos comparáveis aos tradicionais, têm sido desenvolvidos, como imunossensores
amperométricos, quimioluminescentes, calorimétricos, entre outros.[15]
Neste trabalho foi desenvolvido um imunossensor através da imobilização de
biomoléculas, neste caso, a fibroína da seda como matriz e o peptídeo antigênico NS5A-1
derivado do vírus da hepatite C (HCV). A imobilização de peptídeos antigênicos em filmes
nanoestruturados tem sido muito promissor para o desenvolvimento de imunossensores
altamente específicos.[16-17] O reconhecimento molecular entre o peptídeo antigênico e o
anticorpo conduz seletividade dos ensaios baseados em princípios imunológicos, sem a
necessidade de utilizar as moléculas complexas, tais como proteínas ou vírus.[17-18] Desta
forma, o peptídeo de NS5A-1 do vírus da hepatite C (HCV), foi imobilizado via método
camada-por-camada (LbL) juntamente com a fibroína da seda (SF) e nanopartículas
luminescentes de YVO4:Eu3+. Filmes automontados SF/NS5A-1 foram monitorados e
caracterizados por espectroscopia UV-vis, Luminescência, Dicroísmo Circular (CD) e a
interação antígeno-anticorpo foi observada por medidas eletroquímica, elétrica e
luminescência.
Esta dissertação está dividida em 6 sessões. A sessão 1 consta desta apresentação, que
mostra o tema abordado e sua importância na pesquisa, frente aos problemas de hepatite C
registrados no Brasil e no mundo em geral, bem como o resumo dos resultados alcançados
durante o período deste trabalho. A sessão 2 consta de uma introdução que apresenta uma
revisão bibliográfica dos temas envolvidos nesta dissertação, que inicia com a descrição do
vírus da hepatite C (HCV) e dos peptídeos antigênicos, seguida da descrição da fibroína da
seda e da técnica Layer-by-Layer (LbL) para montagem de filmes, e finaliza com a
classificação dos biossensores, frente às técnicas de caracterização utilizadas neste período.
Na sessão 3 estão os objetivos do trabalho, bem como as metas intermediárias para a
elaboração dos biossensores. A sessão 4 consta de toda a metodologia experimental da
pesquisa, desde a preparação dos materiais necessários para o desenvolvimento do trabalho,
bem como a preparação dos filmes biossensores e os detalhes das técnicas utilizadas para
20
caracterização dos mesmos. A sessão 5 apresenta os resultados e as discussões sobre cada
estudo realizado, começando pelo estudo sistemático da imobilização do peptídeo antigênico
NS5A-1 sobre a fibroína e finalizando pela aplicação dos filmes como imunossensores,
através das técnicas para detecção eletroquímica, elétrica e por luminescência. Por fim, a
sessão 6 apresenta as principais conclusões deste estudo e as perspectivas para futuras
pesquisas.
21
2. INTRODUÇÃO
2.1 Hepatite C
O vírus da hepatite C (HCV) foi identificado em 1989 por Choo e colaboradores e
desde então vários trabalhos subsequentes elucidaram a organização e a diversidade do
vírus.[19,20] É classificado como parte da família Flaviviridae e do gênero Hepacivirus, que são
vírus envelopados com aproximadamente 50 nm, Figura 1, cujo genoma corresponde a uma
cadeia simples de RNA linear de polaridade positiva contendo uma única matriz aberta de
leitura (ORF - open reading frame) que codifica uma poliproteína precursora de 3.011
aminoácidos, flanqueada por duas regiões terminais não codificantes.[21] Esta poliproteína é
posteriormente processada por proteases virais e celulares em dez proteínas, estruturais (C,
E1, E2/p7) e não-estruturais (NS2, NS3, NS4A, NS4B, NS5A e NS5B)[22], Figura 2.
a)
b)
Figura 1: Estrutura do HCV. a) Estrutura completa do vírus b) Secção mostrando os componentes do
vírus como as proteínas do envelope, proteínas do capsídeo, lipídeos e ácidos nucléicos. Fonte:
http://utopiasilver.com/testimonials/hepc.htm
22
Figura 2: Genoma do HCV mostrando as proteínas estruturais e não estruturais que compõem o vírus.
Fonte: http://www.roche.com.br/portal/roche-brazil
As proteínas estruturais encontram-se presentes na região amino-terminal da
poliproteína e são os principais constituintes das partículas virais infecciosas.[23] Segundo
Penin et al. (2004), a proteína do capsídeo (C) é uma proteína básica constituída pelos
primeiros 191 aminoácidos sendo a segunda região mais conservada do genoma viral a qual
compõe o núcleo capsídeo viral. Pode estar envolvida na modulação da transcrição de genes,
proliferação celular, apoptose e sinalização celular, podendo interferir no metabolismo de
lipídeos e na supressão da resposta imune.
E1 e E2, denominadas proteínas do envelope, são glicoproteínas transmembranares
associadas ao envelope viral. São consideradas essenciais para a infecção viral sendo que na
E2, foram encontradas duas regiões hipervariáveis (HVR1 e HVR2) envolvidas na subversão
do sistema imune.[24] Acredita-se que a E1 seja responsável por mediar a fusão, enquanto têm
sido demonstrado que a E2 é responsável pela ligação direta aos receptores celulares da célula
hospedeira.[25]
O peptídeo p7, com 63 aminoácidos, possui atividade de canal iônico, similar ao grupo
proteico das viroporinas. A p7, assim como a NS2 é necessária para a montagem do vírion.[23]
A primeira proteína não estrutural é a proteína NS2, apresentando 217 aminoácidos.
Essa proteína aparece associada com a NS3, formando a auto-protease NS2/NS3, e é
responsável pela maturação das outras proteínas NS e pela clivagem da junção NS2/NS3.[22]
A NS3 é uma proteína multifuncional constituída de um domínio N-terminal serinoprotease e um domínio C-terminal RNA helicase/NTPase. A serino-protease forma um
complexo estável com o cofator NS4A e catalisa a clivagem da poliproteína nos sítios NS34A; NS4A-B, NS4B-5A e NS5A-5B.[23] A helicase/NTPase usa a energia da hidrólise de NTP
23
para desenrolar a dupla fita de RNA na direção 3’→ 5’. Esta função do HCV não é bem
conhecida, mas pode estar envolvida na iniciação da síntese de RNA durante a replicação.[22]
O polipeptídeo NS4A funciona como um cofator para a proteína NS3, formando um
complexo NS3/NS4A. Outra função atribuída a esta proteína é a participação na
hiperfosforilação de NS5A.[26] NS4B é uma pequena proteína hidrofóbica, que desempenha
um importante papel no recrutamento de outras proteínas virais. Interage com a proteína
NS4A e indiretamente com a NS3 e NS5A. Estudos de microscopia eletrônica indicaram que
a NS4B induz mudanças morfológicas no retículo endoplasmático formando uma estrutura
denominada rede membranosa, em adição todas as proteínas virais foram encontradas nesse
local, sugerindo um sítio para a formação do complexo replicativo.[27]
A fosfoproteína hidrofílica NS5A contém uma sequência particular de nucleotídeos
que pode determinar a sensibilidade do vírus e, estudos indicam que a mesma está envolvida
na indução da instabilidade cromossômica e consequente desenvolvimento de carcinoma
hepatocelular.[26] A NS5A é uma proteína organizada em três domínios (I; II e III). Entre as
proteínas não estruturais do HCV é a que apresenta maior interação com o hospedeiro[28] e
existem evidências para um papel desta proteína em antagonizar a resposta imune inata do
hospedeiro, interagindo com inúmeras vias de transdução de sinal. Além dessas diversas
influências sobre a célula hospedeira, a NS5A está envolvida na replicação e montagem do
HCV, sendo capaz de interagir independentemente com todas as proteínas não-estruturais do
vírus.[26] A proteína NS5A compreende três domínios ligados por duas sequências de baixa
complexidade, ricas em serina ou em prolina, denominados LCS I e LCS II,
respectivamente.[29] O domínio I (aa 28 a 213) contém um local de ligação de zinco, é
relativamente bem conservado e é essencial para a replicação do RNA. O domínio I é um
dímero e vários estudos têm confirmado a capacidade de se ligar ao RNA. Os domínios II (aa
250 a 342) e III (aa 356 a 447) são bem menos conservados do que domínio I e são
originalmente desdobrados. O domínio II é importante para a replicação do RNA e pode
também contribuir para as propriedades de ligação da proteína ao RNA. O domínio III é
dispensável para replicação de RNA, mas é essencial para a montagem do vírion.[30]
A entrada do vírus na célula hospedeira é mediada por receptores/co-receptores de
superfície celular.[31] Após a entrada do vírus e liberação do material genético, é iniciada a
tradução da poliproteína que segue a produção das proteínas virais. As proteínas estruturais
associam-se ou integram-se com a membrana do retículo endoplasmático (RE) e formam
oligômeros funcionais que promoverão a montagem da nova partícula viral. As proteínas não
estruturais se associam do lado citoplasmático da membrana do RE onde interagem entre si e
24
com as proteínas hospedeiras para formar a maquinaria de replicação viral. Essa maquinaria
usa seu próprio genoma como molde para transcrição de fita complementar negativa de RNA.
Essa fita negativa, por sua vez, serve como uma molécula replicativa intermediária na síntese
de uma nova molécula de RNA de polaridade positiva que pode ser usada para tradução,
replicação ou então ser empacotada para constituir novos vírus.[32] O esquema do ciclo de
vida do HCV está representado na Figura 3.
Figura 3: Processo de infecção da célula hospedeira iniciando com a entrada do vírus através da
membrana plasmática por endocitose, seguido pela liberação do material genético viral no meio
intracelular culminando na tradução das poliproteínas, estruturação do vírus até sua maturação.
Fonte: http://thebileflow.files.wordpress.com/2011/02/life_cycle_hcv1.jpg
A organização mundial da saúde estima que cerca de 130 a 170 milhões de pessoas
são infectadas por HCV em todo o mundo. A distribuição da infecção por HCV é altamente
variável, com a prevalência em países individuais que variam de entre 1% a 10%. A maior
prevalência foi relatada na África (Egito e Camarões > 10%) e no Oriente Médio, com uma
menor prevalência nas Américas, Austrália e Norte e Oeste da Europa.[33]
Em termos de números absolutos, a China (29,8 milhões), Índia (18,2 milhões), Egito
(11,8 milhões), Paquistão (9,4 milhões) e Indonésia (9,4 milhões) têm o maior número de
indivíduos infectados pelo HCV. Apesar de muitos países da Ásia terem uma prevalência
baixa a intermediária, cerca de 50% das pessoas no mundo que estão infectadas com HCV
25
residem nesta região, que é essencialmente um fator agravante das grandes populações dos
países asiáticos.[34]
O HCV possui seis genótipos, sendo que cada um pode ser dividido em vários
subtipos. A distribuição global dos genótipos do HCV é diversificada, o que reflete diferenças
na epidemiologia, inclusive temporais, modos de transmissão e variabilidade étnica.
Genótipos 1, 2 e 3 têm uma perspectiva bastante ampla na distribuição geográfica, enquanto
que genótipos HCV 4, 5 e 6 são geralmente confinadas a regiões geográficas específicas.
Figura 4: Regiões globais mostrando os níveis de infecção por HCV e os tipo de genótipos
prevalecentes por região. Fonte: http://c4da.com/HepC/HepMap.html
Há dois tipos de infecções características: HCV aguda e HCV aguda sintomática. A
doença HCV aguda refere-se aos primeiros 6 meses de infecção e pode ou não incluir sinais
ou sintomas clínicos. HCV aguda sintomática é observada em 15-30% dos pacientes
infectados com o vírus, ocorre dentro de 5-12 semanas de exposição ao HCV e dura 2-12
semanas. HCV sintomática aguda geralmente é moderada, envolvendo sintomas inespecíficos
como letargia e mialgia, podendo ser observada icterícia.[35]
A infecção inicial com o HCV caracteriza-se pela detecção do vírus no sangue dentro
de 2-14 dias de exposição, os aumentos nos níveis de enzimas do fígado no soro (alanina
aminotransferase e aspartato aminotransferase) e o aparecimento gradual de anticorpos
específicos para o HCV dentro 20-150 dias de exposição são pontos específicos para detecção
de infecções icterícias.[35]
26
O rápido desenvolvimento de antivirais de ação direta (DAA) e terapias para a
infecção por HCV resultou em considerável otimismo entre os cientistas que tratam pacientes
com HCV, com a esperança realista de que as intervenções terapêuticas em breve serão mais
eficazes, mais toleradas e com ação mais curta que as terapias atuais. No entanto, como na
maioria das vezes a doença é inicialmente assintomática, testes que sejam capazes de
diagnosticar infecções pelo vírus são de grande importância e objeto de estudo de muitos
grupos de pesquisa.
2.2 Peptídeos Antigênicos
Os peptídeos são biomoléculas que contém de dois a dezenas de resíduos de
aminoácidos unidos entre si através de ligações peptídicas. Se comparados às proteínas, são
quimicamente mais versáteis, pois podem ser semi-cíclicos (geralmente via uma ou mais
ligações dissulfeto intra- ou intercadeias peptídicas) ou cíclicos (via ligação entre os grupos
amino e carboxila dos aminoácidos terminais). Muitos contêm um ácido piroglutâmico como
resíduo N-terminal, outros apresentam D-aminoácidos e outros, ainda, possuem aminoácidos
não usuais.[36]
Os peptídeos antigênicos são fragmentos de proteínas que podem ser utilizados para
induzir anticorpos capazes de reconhecer a proteína nativa a partir da qual a sequência
peptídica foi derivada.[37] Os peptídeos potencialmente antigênicos são denominados epítopos.
Estes epítopos são apresentados a receptores de linfócitos T, desencadeando processos que
resultam em respostas à invasão antigênica por parte do sistema imunitário.[38]
A apresentação de epítopos na superfície de células é feita por glicoproteínas,
codificadas por um conjunto de genes conhecidos como Complexo Maior de
Histocompatibilidade (MHC – Major Histocompatibility Complex).[39]
O MHC é dividido em duas classes, I e II. Em condições fisiológicas o MHC de classe
I apresenta antígenos endógenos processados a partir de proteínas citoplasmáticas. Portanto
peptídeos virais podem, também, ser apresentados através deste caminho endógeno.
Contrariamente o MHC de classe II apresenta peptídeos exógenos, processados a partir de
antígenos fagocitados por macrófagos ou internalizados por anticorpos na superfície externa
de células B. Os peptídeos apresentados através deste caminho exógeno são uma variedade de
moléculas provenientes do meio externo, como por exemplo, proteínas derivadas de bactérias,
do meio plasmático ou de superfícies celulares. O processo de endocitose e a apresentação de
27
antígenos estranhos às células T são os principais eventos de iniciação das respostas
imunológicas.[40]
A região responsável pela apresentação dos antígenos é formada por uma base plana,
ou ligeiramente curva, de fitas antiparalelas, delimitada por duas hélices; o receptáculo
resultante acomoda peptídeos em conformação quase estendida.[41-43] Os peptídeos que se
estendem além das extremidades do receptáculo têm sua conformação apenas parcialmente
ordenada.[44] Ligações de hidrogênio entre regiões conservadas do receptáculo, em especial
resíduos com dupla capacidade de estabelecer ligações de hidrogênio como asparagina e
glutamina, e o esqueleto carbônico do peptídeo, parecem desempenhar um papel universal na
ligação de peptídeos de diferentes sequências,[45-46] de forma que a maioria dos agrupamentos
polares contata a cadeia principal do peptídeo, e a maioria dos agrupamentos hidrofóbicos
contata as cadeias laterais do peptídeo.[44,46]
As composições antigênicas de muitas proteínas do HCV têm sido estudadas através
da utilização de proteínas recombinantes[47] e peptídeos sintéticos.[48-51] Alguns estudos
mostraram que a heterogeneidade de sequência da proteína tem um impacto sobre as
propriedades antigênicas dessas regiões.[47,52] Dou et. al. descreveram a imunoreatividade de
algumas proteínas que contêm a maior região antigênica da NS5A (aa 2212 a 2313),
derivadas de todos os seis genótipos do HCV. Os dados mostraram que a reatividade
antigênica destas proteínas foi significativamente afetada pela heterogeneidade de sequência.
O estudo foi realizado pelo mapeamento de epítopos dentro da região NS5A. Cada proteína
da região foi testada por imunotransferência contra um conjunto de cinco amostras de soro
positivo para HCV. Três proteínas (NS5A-1, NS5A-3, e NS5A-4) foram encontradas como
sendo as mais imunorreativas, dentre todas as proteínas testadas. Este estudo mostrou que a
utilização de peptídeos sintéticos são úteis para ensaios de diagnóstico do HCV. Estudos
anteriores,[47-50] também demonstraram que a proteína NS5, especialmente a proteína de
NS5A, contém vários epítopos antigênicos fortemente relevantes ao diagnóstico do vírus, que
podem ser eficientemente modelados a peptídeos sintéticos ou proteínas recombinantes.
Assim, é concebível que a especificidade de detecção anti-NS5 seja melhorada por essas
regiões antigênicas ativas utilizadas como alvos antigênicos. Quando cuidadosamente
selecionado, o antígeno utilizado pode ser NS5A para detectar atividades anti-HCV com
eficiência a partir de amostras de soro obtidas de pacientes infectados, com diferentes
genótipos do HCV, espalhados em diferentes partes o mundo.[53]
28
2.3 Fibroína da Seda (SF)
A seda é composta por fibras de proteínas que são produzidas na natureza por diversas
espécies de insetos e aranhas. A seda produzida pelo bicho-da-seda (Bombyx mori) é formada
por dois tipos de proteínas: a sericina que envolve as fibras, e a fibroína que é o filamento da
seda composta de regiões altamente organizadas com formas cristalinas folha-β e
semicristalinas.[54-55]
A fibroína é composta basicamente pelos aminoácidos glicina, alanina, serina e, em
menor quantidade, tirosina, triptofano e outros aminoácidos residuais. A glicina e a alanina se
repetem e constituem a maior parte de sua composição, correspondentes a 75% em mol da
proteína, como mostrado na Figura 5. As várias repetições desses aminoácidos em sequência
constitui a região cristalina da fibroína, formando o arranjo conhecido como folha-β. As
propriedades de tensão das fibras da seda dependem principalmente da estrutura cristalina,
enquanto outras propriedades como retenção de umidade e resistência química, dependem do
estado da região amorfa, que contém a maioria dos aminoácidos com uma cadeia lateral
volumosa e polar.[10,56]
OH
O
O
NH
CH3
O
NH
.
CH3
.
NH
NH
NH
NH
n
Gly
Ser
O
O
O
Gly
Ala
Gly
Ala
Figura 5: Estrutura principal da cadeia polimérica da fibroína da seda.
Por ser composta por grande quantidade de Glicina e Alanina, a conformação β de sua
estrutura é favorecida, já que é permitido um alto empacotamento entre suas folhas. A
estrutura global dessa proteína é estabilizada por ligações de hidrogênio entre todas as
ligações peptídicas dos segmentos polipeptídicos de cada cadeia β, otimizando as interações
de Van der Waals entre as cadeias.[57] A Figura 6 representa a estrutura da fibroína da seda,
onde as setas indicam as folhas β antiparalelas.
29
Figura 6: Estrutura da fibroína da seda produzida pelo bicho-da-seda (Bombyx mori).[57]
A fibroína vem sendo largamente estudada no campo de biomateriais, pois apresenta
compatibilidade com diversos tipos de células, alta resistência mecânica e microbiológica,
além da possibilidade de ser obtida sob diversas formas como pós, filmes, esponjas e
hidrogéis.[58]
2.4 Filmes automontados Layer-by-Layer (LbL)
Os filmes automontados são produzidos por materiais que podem formar filmes sobre
um substrato sem a necessidade de intervenção externa, ou seja, seus processos de formação
ocorrem por reações e/ou interações espontâneas.
Dentre os métodos de obtenção de filmes automontados, podemos destacar a técnica
conhecida como camada por camada, ou simplesmente LbL (do inglês: Layer-by-Layer). Esta
técnica de construção de filmes foi inicialmente proposta por Decher em 1997, e baseia-se no
princípio de interações eletrostáticas entre moléculas que se alternam num processo de
adsorção sobre uma superfície de carga oposta.[59]
Em linhas gerais, na técnica de construção de filmes LbL um substrato sólido é tratado
previamente e imerso por um determinado período de tempo em uma solução aquosa
contendo o material a ser depositado. Uma vez que o substrato imerso possui, em sua
superfície, carga elétrica oposta à das espécies em solução, inicia-se um processo espontâneo
de adsorção por atração eletrostática.[59]
O conjunto substrato/filme depositado é então lavado e seco de forma a remover o
excesso das espécies fracamente adsorvidas, e sequencialmente é imerso em outra solução
contendo uma espécie de cargas opostas às do filme já formado sobre o substrato. Ao repetir
este processo sucessivas vezes consegue-se construir filmes de multicamadas catiônicas e
30
aniônicas alternadamente adsorvidas, conforme se deseja.[59-60] A Figura 7 ilustra o
procedimento de formação de um filme via técnica LbL.
Figura 7: Representação esquemática do processo de automontagem de uma bicamada do filme LbL.
a) deposição do filme sobre substrato sólido. Em 1 e 3 há a adsorção dos polieletrólitos aniônico e
catiônico. E em 2 e 4 são as etapas de lavagem. b) Estrutura idealizada do filme automontado. [Figura
extraída de [59]]
A deposição de filmes multicamadas a partir de soluções de policátions e poliânions
pode ser efetuada manualmente, levando à fabricação de filmes automontados por um método
simples e de baixo custo operacional, de modo que os instrumentos necessários para a
produção destes filmes são apenas substratos, béqueres e pinça. A técnica além de simples e
versátil, permite o controle na espessura e composição dos filmes em escalas nanométricas.[61]
A formação do filme automontado pode também ocorrer por outros tipos de interações
além das eletrostáticas, como por ligações de hidrogênio, quimissorção, interações de Van der
Waals, interações hidrofóbicas, reconhecimento bio-específico, dentre outras. Esta
multiplicidade de interações intermoleculares favorece o emprego de diferentes moléculas,
como as biomoléculas, onde o efeito cooperativo de atração por vários pontos exerce papel
fundamental na imobilização. Importante também é que os filmes automontados são
construídos essencialmente com substâncias solúveis em água, favorecendo o emprego de
biomoléculas. De fato, a desnaturação da biomolécula é minimizada devido à adsorção, que
pode ser realizada em condições adequadas de pH e temperatura.[62]
31
Nos últimos anos, houve um aumento significativo de interesse na utilização de
polímeros naturais como a matriz de imobilização para biomoléculas, tais como quitina [63],
quitosana[64-65] e fibroína da seda[66-68]. Filmes LbL têm sido usados para imobilizar fibroína
preservando propriedades mecânicas e a biocompatibilidade. Wang e colaboradores
produziram filmes de fibroína por sucessivas deposições sobre um substrato sólido. Estes
filmes apresentaram estabilidade em condições fisiológicas e boa adesão de células,
possibilitando o uso para funcionalizar superfícies de biomateriais.[67] A fibroína também foi
imobilizada em filmes LbL em junção de filmes de quitosana sobre superfície de titânio. A
superfície modificada com o filme melhorou significativamente a compatibilidade celular,
apresentou boa aderência e bom crescimento de osteoblastos.[69] As propriedades mecânicas
dos filmes de fibroína foram investigadas por Jiang e colaboradores. Os filmes multicamadas
apresentaram alta elasticidade e resistência, sugerindo sua utilização em microescala para a
produção de biodispositivos, implantes biocompatíveis e revestimentos para pele artificial.[70]
2.5 Biossensores
Um biossensor é um dispositivo analítico composto de um elemento de
reconhecimento biológico, denominado biorreceptor, que em contato com um transdutor, irá
converter a concentração de um determinado analito em uma resposta mensurável, ou seja,
em um sinal eletrônico ou óptico proporcional à concentração do composto a ser detectado.[71]
Os biossensores podem ser classificados de acordo com o método de detecção, como
biossensores ópticos, elétricos, eletroquímicos e térmicos ou quanto ao tipo de biorreceptor,
como biossensores enzimáticos, imunossensores ou genossensores.[72] A Figura 8 apresenta o
esquema de um biossensor.
32
Figura 8: Representação esquemática de um biossensor.
Os biossensores são geralmente muito seletivos devido à possibilidade de adequar
interações de alta seletividade com determinados compostos biológicos que são imobilizados
sobre a superfície de um eletrodo ou substrato. Dentre as moléculas de reconhecimento
seletivo utilizadas em biossensores estão as enzimas, os ácidos nucléicos, anticorpos e
antígenos.[73]
2.5.1. Biossensores Eletroquímicos
Um sistema de sensoriamento eletroquímico usualmente contém três eletrodos, um
eletrodo de referência, um contra eletrodo e um eletrodo de trabalho, onde ocorre o processo
biológico. O composto a ser analisado reage na superfície do eletrodo de trabalho, e os
reagentes e/ou produtos da reação geram um sinal.[74] O eletrodo de trabalho pode ser
constituído com diversos materiais, como platina, ouro, carbono grafite, carbono vítreo e
pasta de carbono. Além do sistema convencional, os eletrodos podem ser miniaturizados
como é o caso dos eletrodos impressos (screen-printed). As vantagens são baixo custo, fácil
manuseio, alta sensibilidade e principalmente a pequena quantidade de amostra para as
medidas.[75]
33
Dentre
os
métodos
de
detecção
eletroquímica,
destacam-se
os
sensores
amperométricos e voltamétricos. No sensor amperométrico, um potencial fixo é aplicado,
geralmente o potencial de redução e/ou oxidação das espécies eletroativas geradas na reação
com a biomolécula, e a corrente é medida em função do tempo. No voltamétrico, a faixa de
potencial pode ser determinada de tal modo que seja obtida uma maior seletividade em cada
medida, dado que cada espécie, bem como os seus estados de oxidação apresentam um
potencial característico para oxidação e redução. A maior seletividade neste tipo de sensor
está relacionada com a escolha correta das condições durante as medidas voltamétricas, que
vão desde o material do eletrodo, a modificação da sua superfície e o intervalo do
potencial.[75-76]
2.5.2. Biossensores Elétricos
Biossensores baseados em medidas elétricas podem trazer diferentes informações do
sistema, desde mudanças no filme a mudanças no meio. Medidas de impedância com corrente
alternada (AC) de um material combinam ambas as propriedades capacitiva e resistiva. As
regiões de frequência da AC podem dar informações das propriedades elétricas dos diferentes
eventos do sistema em análise, como as reações biológicas na superfície do eletrodo.[77]
Os biossensores elétricos podem ser construídos a partir da imobilização de elementos
de reconhecimento em camadas ultrafinas sobre eletrodos interdigitados. Quando ocorrem
interações seletivas ou mudanças no meio causadas pela presença do analito as propriedades
dielétricas do sistema sofrem alterações. Essas alterações são geralmente proporcionais à
concentração do analito.[78]
Uma variedade de biomoléculas tem sido usada como biossensores com medidas
elétricas. Em particular, anticorpos e enzimas têm sido imobilizados sobre eletrodos, onde a
detecção é feita através da mudança de capacidade e/ou resistência quando o antígeno liga-se
ao anticorpo ou quando ocorre reação enzima-analito. Há vários trabalhos, incluindo uma
patente, que descreve este modelo de detecção com sensores de filmes poliméricos.[78-79]
Medidas de impedância elétrica foram usadas para detectar ureia, com filme contendo
material polimérico e urease. A produção de íons amônio gerada da reação urease-ureia nas
amostras resultou em mudança no pH, provocando aumento na capacitância.[80] Outro
trabalho realizado por Zucolotto e colaboradores mostra o desenvolvimento de um biossensor
para detecção de catecol utilizando uma enzima específica depositada sobre um eletrodo
interdigitado. A enzima foi imobilizada alternada com um dendrímero através da técnica de
34
automontagem e mudanças na capacitância foram observadas em função da concentração do
catecol. Utilizando o mesmo biossensor, a detecção elétrica foi comparada com detecção
óptica, na qual o limite de detecção obtido foi maior, mostrando que o sensor elétrico
apresentou maior sensibilidade que o sensor óptico.[81]
2.5.3 Biossensores Ópticos
Os métodos que empregam sensores ópticos são baseados nas mudanças das
propriedades ópticas no sistema utilizado, por meio de medidas de absorção, emissão,
reflexão, dispersão, difusão da luz, interferência, refração e difração.[82-83]
Durante as últimas décadas houve um avanço significativo no desenvolvimento de
sensores e biossensores ópticos para determinação de espécies de interesse químico e
biológico. O primeiro sensor com transdução químico-óptico foi baseado na medida de
mudanças no espectro de absorção e foi desenvolvido para determinações de CO2.[84] Desde
então, uma variedade de sistemas de detecção ópticos estão sendo utilizados em sensores e
biossensores, incluindo, entre outros, elipsometria, espectroscopias de luminescência,
fluorescência, fosforescência e Raman, interferometria (de luz branca e interferometria
modal) e a ressonância de plásmon de superfície (SRP).[84-85]
Pontos quânticos (Quantum dots), luminóforos orgânicos e nanopartículas contendo
íons lantanídeos em sua estrutura vêm sendo utilizados como sondas ópticas em materiais
para biossensores. A tendência atual no campo de biossensores ópticos é desenvolver
dispositivos cada vez mais sensíveis baseando-se em nanoestruturas e explorando a
funcionalização de íons lantanídeos (como sondas luminescentes) a sistemas de
reconhecimento molecular.[86]
Soman et al. utilizaram pontos quânticos com diferentes bandas de emissão marcados
em vários anticorpos. A detecção simultânea de antígenos presentes em ratos foi observada
com elevada sensibilidade e seletividade. Outra estratégia para a imunodetecção abordada nos
últimos anos consiste no uso de nanopartículas com morfologia núcleo-casca, formadas por
um núcleo inerte (de sílica ou poliestireno) e uma casca formada por uma espécie
luminescente, como por exemplo complexos de európio (III). Estas nanopartículas
modificadas têm como vantagem a modificação adaptável da superfície das nanopartículas
inertes, o que resulta em biossensores sensíveis para o reconhecimento específico entre um
antígeno marcado por elas e seu respectivo anticorpo.[87]
35
2.6 Nanopartículas de YVO4:Eu3+
Neste trabalho, utilizou-se as nanopartículas de YVO4:Eu3+ como transdutores para a
preparação dos filmes voltados à detecção óptica. Estas nanopartículas que agem como sinal
transdutor, convertem as informações, ou seja, a presença do anticorpo específico, em sinais
ópticos, através do aumento na luminescência do íon lantanídeo.[88]
Propriedades de luminescência das nanopartículas de YVO4:Eu3+ e materiais
relacionados têm sido estudados há mais de três décadas.[89-92] O espectro de absorção do
YVO4 apresenta bandas largas na região do UV. A transição da absorção envolvida é uma
transferência de carga do orbital 2p do oxigênio para os estados 3d do vanádio.
Consideravelmente, um menor deslocamento de Stokes da emissão do vanadato (VO43-) leva
a uma rápida migração de energia ao íon lantanídeo, tornando o YVO4:Eu3+ um material
muito eficiente com emissão no vermelho.[93] Sua alta luminescência deve-se ao seu
rendimento quântico elevado, em torno de 70% para a dopagem com íon európio.[94]
O tamanho e a forma das partículas podem ser controlados e ajustados de forma eficaz
através do controle das condições da reação, tais como o tempo de reação, as fontes de
vanádio, os diferentes aditivos orgânicos e a proporção molar do aditivo orgânico. O citrato
de sódio é um aditivo muito utilizado como estabilizante que ajusta a taxa de crescimento de
diferentes morfologias em determinadas condições experimentais, resultando na formação de
várias geometrias dos produtos finais.[95]
A capacidade de preparar nanoestruturas de YVO4 com diversas formas, com emissão
na região do visível e contendo maior eficiência quântica, oferece uma grande oportunidade
de explorar as suas aplicações em vários campos que estudam a exibição de cores. O európio
dopado à matriz de vanadato de ítrio vem sendo utilizado em televisores a cores, tubos de
raios catódicos, lâmpadas fluorescentes e em muitos aplicativos e dispositivos de exibição
visual. As nanopartículas são também úteis como marcadores biológicos ultrassensíveis,
porque elas são solúveis em água e biocompatíveis. Além disso, em comparação com corantes
orgânicos e pontos quânticos semicondutores, elas possuem linhas espectrais mais estreitas e,
provavelmente, uma fotodegradação mais estável.[95-97]
36
3. OBJETIVOS
O objetivo principal do trabalho concentrou-se na obtenção e caracterização de filmes
automontados, via técnica de deposição camada por camada (Layer-by-Layer, LbL) contendo
a fibroína da seda, o peptídeo antigênico NS5A-1 derivado da proteína NS5A do vírus da
hepatite C e nanopartículas de vandato de ítrio dopadas com európio para obtenção de
protótipos de imunossensores.
Para alcançar este objetivo as metas intermediárias foram:
a) Extração e purificação da fibroína a partir de casulos do bicho-da-seda.
b) Preparação de nanopartículas de vanadato de ítrio e európio
c) Preparação dos filmes automontados camada por camada (LbL), contendo fibroína
como matriz de imobilização, o peptídeo antigênico NS5A-1 do vírus da hepatite C (HCV) e
as nanopartículas luminescentes
d) Monitoramento do crescimento dos filmes pela técnica de Espectroscopia de UVvisível.
e) Análise da organização estrutural da fibroína e do peptídeo pelas técnicas de
Espectroscopia de Dicroísmo Circular (CD) e Espectroscopia de Luminescência.
f) Detecção do anticorpo anti-NS5A (anti-HCV) através de medidas de Voltametria
Cíclica.
g) Detecção do anticorpo anti-NS5A (anti-HCV) através de medidas de Impedância
Elétrica.
h) Detecção do anticorpo anti-NS5A (anti-HCV) através de medidas de
Luminescência.
37
4. METODOLOGIA EXPERIMENTAL
4.1 Material e Métodos
O Peptídeo sintético NS5A-1 (PPLLESWKDPDYVPPWHG) foi adquirido da BioSynthesis Inc. O peptídeo foi purificado e isolada por HPLC com pureza > 90% e a sequência
peptídica foi confirmada por análise de espectroscopia de massa, tal como descrito pela BioSynthesis Inc. As soluções do NS5A-1 foram preparadas com água purificada a partir do
sistema Milli-Q em uma concentração de 0,5 mg mL-1.
Os anticorpos específicos para o peptídeo NS5A-1 (anti-NS5A ou anti-HCV) e para a
proteína p24 do vírus da imunodeficiência humana (anti-p24 ou anti-HIV) foram obtidos da
Santa Cruz Biotechnology Inc. Cada frasco continha 100 g mL-1, os quais foram diluídos em
tampão fosfato salino (PBS), em diferentes concentrações (0, 0,002, 0,01, 0,02, 0,1, 0,2 e 1 g
mL-1).
A fibroína da seda foi extraída de casulos do bicho-da-seda (Bombyx mori) fornecido
pela BRATAC SA, Brasil. Para extração, 10 g de casulos foram fervidos durante 30 minutos
em 2 L de solução de Na2CO3 0,02 mol L-1 a fim de remover a sericina. Para cada 10 g de fio
de seda restantes, 100 mL de solução CaCl2/CH3CH2OH/H2O (1:2:8) foram adicionados e a
mistura foi aquecida a 60-70°C para dissolução. Em seguida, a solução foi dialisada com água
Milli-Q, utilizando membranas de acetato de celulose, à temperatura ambiente durante 48
horas. Após este procedimento, a solução de fibroína foi centrifugada a 20000 rpm durante 30
minutos à temperatura ambiente, para remover impurezas e agregados. A solução foi mantida
a aproximadamente 5°C[98] e a concentração de fibroína em solução foi calculada através da
evaporação da água, restando apenas um filme formado pela fibroína, contendo 4% em peso
(m/m).
As nanopartículas luminescentes de YVO4:Eu3+ foram preparadas em duas etapas
seguindo procedimento descrito na literatura.[99-100] Na primeira etapa, o Na2CO3 foi
misturado com o V2O5 no estado sólido para iniciar a preparação do vanadato de sódio. A
mistura foi levada ao forno até 700ºC a uma taxa de aquecimento de 14ºC/minuto. O meio
reacional foi mantido a 700ºC durante 4 horas e depois resfriado a 200ºC e mantido nessa
temperatura por mais 10 horas.[99] O produto final foi dissolvido em água para utilização na
segunda etapa, que consistiu em misturar sob agitação soluções de Y(NO3)3 e Eu(NO3)3. A
essa mistura foram adicionados 7,5 mL de solução de citrato de sódio (0,1 mol L-1).
Rapidamente foi formado um precipitado branco (citrato de lantanídeo) e ainda, sob agitação
38
em um agitador magnético, foi adicionada a solução de Na3VO4 preparada na etapa anterior.
O meio reacional ficou transparente e foi agitado e aquecido a 60ºC por 45 minutos. Isto
permitiu a formação das nanopartículas de YVO4:Eu3+ estabilizadas pelo citrato. Na
sequência a solução foi resfriada e dialisada contra água Milli-Q por 72 horas.[100]
A concentração final de európio contida nas nanopartículas foi de 12 mmol L-1. Esta
concentração foi calculada em triplicata através da titulação das nanopartículas com solução
de EDTA 0,01 mol L-1, em tampão ácido acético-acetato, utilizando como indicador o
alaranjado de xilenol.
Os eletrodos impressos de carbono utilizados para as medidas eletroquímicas foram
adquiridos da DropSens (Oviedo, Espanha) e os eletrodos interdigitados de ouro, utilizados
nas medidas elétricas, foram preparados no Laboratório de Microfabricação, do Laboratório
Nacional de Luz Sincrotron (LMF/LNLS), Campinas-SP. Estes foram produzidos contendo
50 trilhas de ouro interdigitadas com larguras de 10 m cada, separadas entre elas por mais 10
m sobre um substrato de vidro. Os eletrodos foram previamente tratados com acetona e
álcool isopropílico para a montagem dos filmes de fibroína/NS5A-1 via técnica LbL.
4.2 Preparação dos filmes sobre substratos de sílica.
Filmes de fibroína da seda e de fibroína/NS5A-1 foram montados sobre substratos de
sílica previamente tratados com uma solução 1:1:5 de NH4OH:H2O2:H2O durante 10 minutos
a 70°C, e em seguida com uma solução 1:1:6 de HCl:H2O2:H2O durante 10 minutos a 70°C.
O processo de deposição da fibroína da seda foi realizado por imersão do substrato na
solução de fibroína 0,1%, durante 10 minutos, seguida da secagem com N2.
Para a montagem dos filmes LbL de fibroína/NS5A-1 foi realizada a imersão do
substrato na solução de fibroína 0,1%, durante 10 minutos e em solução de NS5A-1 0,5 mg
mL-1 durante 10 minutos. Após cada deposição, o substrato foi lavado com água Milli-Q para
remover as moléculas fracamente adsorvidas e, em seguida, foi seco suavemente com N2. Este
procedimento foi repetido até alcançar o número de camadas desejadas de fibroína da seda e
de bicamadas de fibroína/NS5A-1. A Figura 9 apresenta um esquema do procedimento de
montagem dos filmes.
39
Figura 9: Esquema do procedimento de preparação dos filmes automontados via técnica LbL (camada
por camada). As soluções 1 e 3 representam, respectivamente, a fibroína da seda e o peptídeo NS5A-1
e 2 e 4 representam a água Milli-Q utilizada para lavagem e remoção de moléculas fracamente
adsorvidas.
O mesmo procedimento foi realizado para o preparo dos filmes LbL de
fibroína/NS5A-1+nanopartículas. As nanopartículas foram misturadas à solução do peptídeo,
formando assim uma única solução 1:1 em volume/volume, com concentração final de 0,1
mmol L-1 para ambos. O tempo de imersão do substrato de sílica na solução de fibroína 0,1%,
foi mantido em 10 minutos e em solução de NS5A-1+nanopartículas de YVO4:Eu3+ também
durante 10 minutos. Após cada deposição, o substrato foi lavado com água Milli-Q para
remover as moléculas fracamente adsorvidas e, em seguida, foi seco suavemente com N2.
Repetiu-se este procedimento até alcançar o número de bicamadas de fibroína/NS5A1+nanopartículas desejadas.
4.3 Preparação dos filmes em eletrodos impressos de carbono
Filmes automontados de fibroína da seda e NS5A-1 foram produzidos sobre eletrodos
de carbono impressos contendo 1 camada, 2, 3, 4 e 5 bicamadas, como mostrado
esquematicamente na Figura 10.
40
ou
Fibroína
NS5A-1
Figura 10: Representação esquemática dos filmes LbL de (1) fibroína/NS5A-1 com 5 bicamadas
depositadas e do (2) filme LbL de fibroína da seda com 5 camadas, montados sobre eletrodos
impressos de carbono.
A deposição da fibroína da seda e do peptídeo sobre o eletrodo foi realizada utilizando
uma célula de fluxo com raio menor que o eletrodo de trabalho, garantindo que as soluções
não atingissem o eletrodo de referência, e o tempo de adsorção de cada camada foi mantido
em 10 minutos para ambas as soluções. A cada camada depositada, o filme foi lavado com
água Milli-Q para remover as moléculas fracamente adsorvidas.
4.4 Preparação dos filmes em eletrodos interdigitados de ouro
Os filmes LbL de fibroína da seda e NS5A-1 foram montados sobre eletrodos
interdigitados de ouro, previamente tratados com acetona e álcool isopropílico. A Figura 11
mostra o esquema de preparo dos filmes.
Conformação aleatória
Eletrodo
interdigitado
- 1 bicamada
fibroína/NS5A-1
-
-
Fibroína
NS5A-1
Folha-
α-hélice
-
Peptídeo (NS5A-1)
Fibroína da seda
Figura 11: Representação esquemática do filme LbL de fibroína/NS5A-1 sobre eletrodos de ouro
interdigitados.
41
O processo de deposição realizado foi exatamente o mesmo descrito para os substratos
de sílica (Figura 9). Neste caso, pela imersão do eletrodo na solução de fibroína 0,1%, durante
10 minutos, seguida da imersão na solução de NS5A-1 0,5 mg mL-1 durante 10 minutos. Após
cada deposição, os eletrodos foram lavados com água Milli-Q, para remoção das moléculas
pouco adsorvidas, e secos suavemente com N2.
4.5 Técnicas experimentais
4.5.1. Espectroscopia de absorção no UV-Visível
A formação das multicamadas foi monitorada a cada deposição por espectroscopia de
UV-vis. As medidas de UV-vis foram realizadas utilizando um espectrofotômetro de UV-Vis
Cary® 50 de Varian, Inc.
4.5.2 Espectroscopia de Dicroísmo Circular (CD)
O Dicroísmo Circular (CD) é uma propriedade observada em cromóforos que
apresentam diferenças na absorção da luz circularmente polarizada à esquerda e à direita. Este
fenômeno é muito observado em proteínas, por elas possuírem diversos centros de assimetria
(carbonos α) distribuídos ao longo da sua cadeia principal. Assim, a espectroscopia de CD
torna possível caracterizar e quantificar diferentes tipos de estrutura secundária destas
macromoléculas tais como: α-hélice, folhas- (paralelas e antiparalelas), vários tipos de voltas
e estruturas randômicas.[101]
Esta técnica é amplamente utilizada em estudos de mudanças conformacionais,
vizinhanças locais, interações de ligantes com proteínas, desnaturação e renaturação de
proteínas, bem como a estimativa do conteúdo das frações de seus componentes de estrutura
secundária.[101]
Os espectros de Dicroísmo Circular (CD) da fibroína da seda e do peptídeo em
solução aquosa foram obtidos com uma cubeta de quartzo com 1 milímetro de caminho
óptico. Os espectros de CD dos filmes automontados contendo 10 camadas de fibroína da
seda e 10 bicamadas de fibroína/NS5A-1 foram obtidos diretamente dos substratos de sílica
nos quais foram preparados.
As medidas foram realizadas em um Espectrômetro de Dicroísmo Circular J-815
(Jasco Inc., Tóquio, Japão), com a largura de banda de 1 nm, tempo de resposta de 0,5
42
segundo e velocidade de varredura de 100 nm/minuto. Os espectros CD foram obtidos
calculando a média de oito medidas.
4.5.3 Espectroscopia de Luminescência
A espectroscopia de luminescência é uma técnica baseada na propriedade que algumas
moléculas possuem de emitir luz devido às transições eletrônicas entre estados eletrônicos
excitados e estados de menor energia.[102]
É uma técnica de caracterização que apresenta grande sensibilidade, cerca de quase
100 vezes maior do que a espectroscopia UV-vis. Este método também é seletivo,
considerando que nem todas as substâncias que absorvem radiação eletromagnética são
capazes de emitir luz.[103]
Para a obtenção de um espectro de emissão, a amostra deve ser irradiada com um
comprimento de onda fixo e a intensidade de luz reemitida é medida em uma faixa espectral
definida. A escolha do comprimento de onda de excitação ideal para o registro do espectro de
emissão é feita com base no espectro de absorção e, comumente, corresponde ao
comprimento de onda de máxima absorção. Já os espectros de excitação são obtidos
mantendo-se fixo o comprimento de onda de emissão e fazendo-se variar o comprimento de
onda de excitação, sobre toda a faixa do seu espectro de absorção.[104]
As fontes de luz, utilizadas para excitação das amostras, podem variar de acordo com
o tipo de espectrofluorímetro usado, sendo as mais utilizadas as lâmpadas de xenônio,
mercúrio e LED. A fonte de luz utilizada pode ser descrita em termos de comprimento de
onda (λ), dado em nanômetros (nm), frequência (ν) ou número de ondas, dado em cm -1,
dependendo do equipamento.[105]
Neste trabalho, as medidas de Luminescência da fibroína da seda e do peptídeo NS5A1 foram realizadas com excitação a 280 nm, que é a faixa do comprimento de onda de
absorção dos resíduos da tirosina (Tyr) e do triptofano (Trp) presentes em ambas as
biomoléculas. Para os filmes contendo nanopartículas de YVO4:Eu3+, a excitação foi mantida
em 280 nm que é também um comprimento de onda próximo do máximo de absorção da
matriz de YVO4 (290 nm), que absorve e transfere energia para o íon lantanídeo.
Os espectros foram obtidos utilizando um Fluorímetro RF-5301PC da Shimadzu
Scientific Instruments, Inc. e um Fluorímetro Horiba Jobin Yvon (Spex Fluorolog-3),
medidos à temperatura ambiente. Como fonte de excitação das amostras utilizou-se lâmpada
de Xenônio 400 W.
43
4.5.4 Voltametria Cíclica (VC)
A voltametria é uma técnica eletroquímica onde as informações qualitativas e
quantitativas de uma espécie química são obtidas a partir do registro de curvas correntepotencial, em uma cela eletroquímica constituída de pelo menos dois eletrodos, sendo um
deles um microeletrodo (o eletrodo de trabalho) e o outro um eletrodo de superfície
relativamente grande (usualmente um eletrodo de referência). O potencial é aplicado entre os
dois eletrodos em forma de varredura, isto é, variando-o a uma velocidade constante em
função do tempo. O potencial e a corrente resultante são registrados simultaneamente. A
curva corrente vs potencial obtida é chamada de voltamograma.[106]
Como a área dos dois eletrodos é diferente, o microeletrodo se polarizará, isto é,
assumirá o potencial aplicado a ele. O eletrodo de referência, por possuir uma área grande,
não se polarizará, mantendo o seu potencial constante. O microeletrodo é comumente feito de
um material inerte no meio estudado, como ouro, platina, carbono ou mercúrio.[106]
Os
voltamogramas
deste
trabalho
foram
obtidos
utilizando
um
Bipotesiostato/galvanostato μStat 400 com software da DropView DropSens (Oviedo,
Espanha). O eletrodo foi o de carbono impresso e como solução eletrolítica foi utilizada
solução de tampão PBS.
A velocidade de varredura foi de 0,05 V s-1, com intervalo potencial de -0,6 a 0,6 V.
Antes das medidas, 100 L de uma solução de anti-HCV em concentrações de 0,01 g mL-1 a
1 g mL-1 anti-HCV:PBS foram adicionados em cada filme por 5 minutos, e em seguida, os
filmes foram lavados com o tampão PBS.
4.5.5 Impedância Elétrica (IE)
As medidas de impedância elétrica foram realizadas com um analisador de impedância
Solartron 1260A com ganho de fase em uma gama de frequências de 1 a 106 Hz. As medidas
foram realizadas utilizando os eletrodos interdigitados de ouro contendo filmes automontados
de 1 e 5 bicamadas de SF/NS5A-1. Sobre os filmes foram adicionados os anticorpos antiHCV diluídos em tampão PBS em diferentes concentrações (0, 0,002, 0,01, 0,02, 0,1, 0,2 e 1
g mL-1) e também adicionou-se anticorpos anti-HIV a 1 g mL-1 para testar a seletividade do
sistema. As perdas dielétricas e os valores de capacitância foram obtidos através do modelo
do circuito equivalente descrito por Taylor.[77] Os dados foram tratados com um software
PEX-sensors desenvolvido no Instituto de Ciência Matemática e Computação (ICMC/USP)
44
sob a coordenação do Prof. Fernando V. Paulovich. O método estatístico usa projeção
multidimensional que adota uma abordagem de otimização de dados visando a preservar
relações de distâncias.
4.5.6 Microscopia de Força Atômica (AFM)
A morfologia dos filmes foi avaliada através de imagens de microscopia de força
atômica (AFM) utilizando um microscópio Agilent 5500. As imagens foram obtidas pelo
modo de contato intermitente, em condições ambientes e cantilevers convencionais de silício.
Todas as imagens foram processadas utilizando o software de análise AFM Gwyddion.
45
5. RESULTADOS E DISCUSSÕES
5.1 Crescimento dos filmes automontados caracterizados por UV-visível
As Figuras 12 e 13 mostram os espectros de absorção para os filmes de fibroína da
seda e de fibroína/NS5A-1, respectivamente. As figuras inseridas em cada gráfico mostram
aumento linear (R2 = 0,98) do máximo de absorção em 280 nm com o número de camadas
depositadas. Este crescimento linear indica que a mesma quantidade de material foi
provavelmente adsorvida em cada deposição.
0.6
2
4
6
8
10
ABS
0.4
0.3
2
R = 0.98
0.06
ABS at 280 nm
0.5
0.07
filme de fibroína
n° de camadas:
0.2
0.05
0.04
0.1
0.0
200
2
4
6
8
10
number of layers
220
240
260
280
300
320
340
Comprimento de onda (nm)
Figura 12: Espectros UV-vis. do filme de fibroína da seda contendo diferentes números de camadas.
Inserção: aumento na absorção a 280 nm em função do número de camadas depositadas.
46
0.8
1
2
3
4
5
6
7
8
9
10
0.7
ABS
0.6
0.5
0.4
0.3
0.2
0.1
0.0
200
0.10
filme LbL de SF/NS5A-1
n° de bicamadas
220
240
260
2
R = 0.98
0.09
0.08
ABS at 280 nm
0.9
0.07
0.06
0.05
0.04
0.03
0
2
4
6
8
10
number of bilayers
280
300
320
340
Comprimento de onda (nm)
Figura 13: Espectros UV-vis. do filme de fibroína/NS5A-1, contendo diferentes números de
bicamadas. Inserção: aumento na absorção a 280 nm em função do número de bicamadas depositadas.
5.2 Caracterização dos filmes por Dicroísmo Circular (CD)
A Figura 14 (a) mostra os espectros de CD da fibroína da seda em solução e em filme
preparado sobre substrato de sílica. Os espectros de CD do NS5A-1 em solução aquosa e dos
filmes automontados fibroína/NS5A-1 contendo 10 bicamadas estão apresentados na Figura
14 (b). A fibroína em solução (0,025% (m/v)) exibiu um mínimo em aproximadamente 197
nm, o que é característico de uma conformação aleatória. Para a fibroína adsorvida sobre o
substrato sólido observa-se conformação folha-, que tem um mínimo característico em
aproximadamente 217 nm. A mudança conformacional pode ser atribuída ao rearranjo
molecular decorrente da sua imobilização em filmes. Isso ocorre devido às cadeias
moleculares da fibroína que interagem de forma rápida e fortemente umas com as outras e, em
seguida, são reagrupadas a uma matriz regular, até certo ponto, o que altera sua conformação
de α-hélice ou desestruturado para uma estrutura folha-.[107]
A atividade de peptídeos antigênicos, isto é, o reconhecimento antígeno-anticorpo,
está relacionado com a sua conformação ao local de ligação. O processo de reconhecimento
de peptídeo-receptor requer uma conformação preferencial ou um ajuste induzido.[37] Desta
forma, uma conformação preferencial é uma característica necessária para o seu
47
reconhecimento. No entanto, os peptídeos não têm conformação preferencial em solução,
como pode ser visto com o peptídeo NS5A-1 em solução aquosa. O espectro de CD do
NS5A-1 em água, Figura 14 (b), indica a predominância de uma estrutura randômica, com um
mínimo em 199 nm. A conformação de um peptídeo bioativo pode depender do ambiente, por
exemplo, uma alteração na conformação de peptídeos pode ser induzida através da sua
interação com biomembranas.[108] Desta forma, o NS5A-1 foi imobilizado em filmes de
fibroína, que o induziu a sua conformação bioativa. O espectro de CD do NS5A-1
imobilizado em filmes automontados de fibroína exibiu um mínimo em 216 nm que pode ser
atribuído à soma de estruturas folha- e α-hélice da fibroína e do peptídeo NS5A-1,
respectivamente.
b)
a)
40
20
NS5A-1 em solução aquosa
Filme SF/NS5A-1 - 10 bicamadas
Fibroína em solução aquosa
15
Filme de fibroína - 10 camadas
30
10
20
CD (mdegree)
CD (mdegree)
5
0
-5
-10
217 nm
-15
0
-10
-20
-20
200
199 nm
-30
197 nm
-25
10
210
220
230
240
250
Comprimento de onda (nm)
216nm
190
200
210
220
230
240
250
Comprimento de onda (nm)
Figura 14: Espectros de Dicroísmo Circular (CD) (a) da fibroína da seda em solução aquosa (linha
preta) e em filme LbL contendo 10 camadas da proteína (linha vermelha); (b) do NS5A-1 em solução
aquosa (linha preta) e dos filmes automontados fibroína/NS5A-1 com 10 bicamadas depositadas (linha
vermelha). Detalhe: predição de estrutura secundária para o NS5A-1.
48
Deste modo, é possível dizer que a fibroína induz organização estrutural do peptídeo e
o espectro de CD do filme de fibroína/NS5A-1 pode ser atribuído à soma de estruturas
secundárias da fibroína e do NS5A-1.
5.3 Caracterização dos filmes por Espectroscopia de Luminescência
A espectroscopia de luminescência é uma técnica amplamente utilizada no estudo da
estrutura de proteínas. Os aminoácidos aromáticos, triptofano (Trp), tirosina (Tyr) e
fenilalanina (Phe), oferecem intrínsecas sondas fluorescentes de conformação da proteína por
interações dinâmicas e intermoleculares. Entre estes três aminoácidos, o Trp é a sonda mais
popular para investigar a alteração estrutural da proteína e a interação com outras moléculas,
pois a luminescência do cromóforo é altamente sensível ao meio.[105]
A proteína fibroína é composta de 9% de Tyr e 0,25% de Trp, que se repetem com a
sequência de grupos laterais hidrofóbicos e hidrofílicos ao longo da cadeia. O NS5A-1 é um
peptídeo que contém 18 resíduos de aminoácidos (PPLLESWKDPDYVPPWHG), contendo
dois triptofanos e uma tirosina.[53,109]
A Figura 15 (a) mostra os espectros de emissão para a fibroína em solução e para os
filmes automontados de fibroína, ambos excitados em 280 nm. O máximo de emissão da
fibroína da seda em solução foi observado em 306 nm e uma contribuição distinta em 346 nm
devido aos resíduos de tirosina e de triptofano, respectivamente. O máximo de emissão para o
filme de fibroína da seda foi observado em 310 nm. O desvio para o vermelho, de cerca de 4
nm, no máximo de emissão indica que ocorreu uma mudança na estrutura da fibroína de
randômico para folha-, ou seja, a Trp move-se a partir do interior da proteína para um
ambiente mais polar. Além disso, estima-se que resíduos de Trp são expostos ao solvente em
estruturas folha-.[105]
A Figura 15 (b) apresenta os espectros de luminescência da fibroína em solução
aquosa, da mistura das soluções de fibroína e do NS5A-1, do filme puro de fibroína e do filme
LbL de fibroína/NS5A-1. O espectro de luminescência do NS5A-1 em solução aquosa mostra
um máximo de emissão em 351 nm, região característica da emissão de resíduos de Trp
expostos em água. Para o flme LbL de fibroína/NS5A-1 o valor máximo é observado em 320
nm, sugerindo que o Trp é incorporado no interior da estrutura. Para a mistura de fibroína da
seda e o peptídeo NS5A-1 em solução, o espectro de emissão apresenta a contribuição de duas
bandas atribuídas à fibroína e ao NS5A-1 não estruturados.
49
b)
a)
1.0
306 310
0.8
346
0.6
0.4
0.2
0.0
350
fibroína em solução aquosa
filme de fibroína - 10 camadas
351 nm
intensidade u. a. (exc. 280 m)
Intensidade u. a. (exc. 280nm)
1.2
300
250
200
350
400
450
Comprimento de onda (nm)
320 nm
150
100
50
0
300
Soluções aquosas
NS5A-1
fibroína
fibroína+NS5A-1
Filmes (10 bicamadas)
fibroína
fibroína/NS5A-1
300
350
400
450
Comprimento de onda (nm)
Figura 15: Espectros de luminescência (a) da fibroína da seda em solução aquosa (linha preta) e do
filme de fibroína com 10 camadas depositadas (linha vermelha); (b) da fibroína e da mistura de
fibroína/NS5A-1 em solução aquosa e dos filmes automontados de fibroína da seda (10 camadas
depositadas) e de fibroína/NS5A-1 (10 bicamadas depositadas) com excitação em 280 nm.
Os resultados de luminescência corroboram com os resultados obtidos por CD. Para
ambos, fibroína e NS5A-1 em solução, foi observado conformação randômica. Quando o
NS5A-1 e a fibroína são imobilizados em filmes automontados, a conformação altera-se para
estruturas α-hélice e folha-, respectivamente. Este efeito foi observado apenas para os filmes
nanoestruturados, pois não foi observada nenhuma alteração conformacional para a mistura de
fibroína e NS5A-1 em solução. Com isso, duas conclusões podem ser tomadas: i) a fibroína
exibe estrutura folha- quando em filmes nanoestruturados, ii) o filme de fibroína induz
estrutura secundária para o NS5A-1. Portanto, os filmes de fibroína podem ser utilizados
como uma matriz de imobilização adequada de biomoléculas.
50
5.4 Aplicação dos filmes de fibroína/NS5A-1/YVO4:Eu3+ como imunossensores
5.4.1. Detecção Eletroquímica
Filmes automontados de fibroína e NS5A-1 foram produzidos sobre eletrodos
impressos de carbono contendo 1 e 5 camadas ou bicamadas
A Figura 16 mostra os voltamogramas cíclicos obtidos em tampão PBS na presença e
na ausência de anticorpos anti-HCV para os filmes LbL contendo 5 camadas de fibroína
(Figura 16 (a)) e 5 bicamadas de fibroína/NS5A-1 (Figura 16 (b)).
Os voltamogramas obtidos para os filmes de fibroína na presença de PBS e de antiHCV em solução PBS mostraram alterações insignificantes com quase nenhuma diminuição
na corrente, Figura 16 (a). Em contraste, para o imunossensor obtido com filme automontado
de fibroína/NS5A-1, o voltamograma exibiu uma diminuição de corrente de cerca de 9 A
quando o anticorpo anti-HCV (100 g mL-1, 1:100 anti-HCV:PBS, ou seja, 1 g mL-1) foi
adicionado, como observa do na Figura 16 (b). Para os filmes com uma camada de fibroína e
de fibroína/NS5A-1 os mesmos resultados podem ser observados, porém com uma
diminuição de corrente de 7 A.
A diminuição de corrente pode ser atribuída ao reconhecimento molecular entre o
anticorpo anti-HCV e o peptídeo NS5A-1. Este reconhecimento só é possível quando o
peptídeo está estruturado, o que corrobora com os resultados de CD e Espectroscopia de
Luminescência.
A corrente negativa em baixos potenciais na Figura 16 (b) pode ser atribuída à redução
das espécies gerada pela interação antígeno-anticorpo e/ou pela adsorção do anticorpo na
superfície do eletrodo. O mecanismo da interação antígeno-anticorpo não é claro, mas sabe-se
que envolve a formação de múltiplas ligações não covalentes, tais como interações de Van der
Waals, ligações de hidrogênio, pontes salinas e forças hidrofóbicas entre o antígeno e os sítios
de ligação dos aminoácidos.
51
b)
2
2
0
0
-2
-2
Corrente (A)
Corrente (A)
a)
-4
-6
-8
-10
-12
-14
-4
-6
-8
-10
filme de fibroína - 5 camadas
PBS
PBS+anti-HCV
-0.6 -0.4 -0.2 0.0 0.2 0.4 0.6
Potencial (V)
-12
-14
filme LbL SF/NS5A-1 - 5 bic.
PBS
PBS+anti-HCV
-0.6 -0.4 -0.2 0.0 0.2 0.4 0.6
Potencial (V)
Figura 16: Voltamogramas Cíclicos dos filmes LbL de (a) fibroína da seda com 5 camadas
depositadas e de (b) fibroína/NS5A-1 com 5 bicamadas automontadas, em tampão PBS na ausência
(curvas pretas) e presença (curvas vermelhas) de anticorpos anti-HCV.
A Figura 17 mostra a resposta do filme contendo 5 bicamadas de fibroína/NS5A-1
quando a concentração de anti-HCV foi variada, de acordo com diluições a partir da
concentração de 1 g mL-1 a 0,01 g mL-1 anti-HCV:PBS. A diminuição de corrente
apresentou linearidade no intervalo de 0 à 0,02 g mL-1 e acima desta concentração, houve
uma tendência para a saturação, o que indica que todos os locais de reconhecimento foram
ocupados. O imunossensor descrito aqui foi capaz de detectar o anticorpo mesmo em soluções
bem diluídas, de 1 g mL-1 a 0,01 g mL-1.
52
7
6
i-i0/mA
5
4
3
2
1
0
-1
0.0
0.2
concentração de anti-HCV
1.0
(
g mL-1)
Figura 17: Curva analítica dos filmes automontados contendo 5 bicamadas de fibroína/NS5A-1 na
presença de diferentes concentrações de anti-HCV:PBS (diluições 1 g mL-1; 0,2 g mL-1; 0,1 g mL1
; 0,02 g mL-1; 0,01 g mL-1, 0 g mL-1).
5.4.2. Testes em amostras reais soropositivas do vírus da hepatite C (HCV)
A Figura 18 mostra os voltamogramas obtidos a partir de medidas com amostras reais
infectadas pelo vírus da hepatite C (HCV).
Estes testes foram realizados na Faculdade de Medicina da Unesp, Botucatu-SP, com a
colaboração da Profa. Dra. Elenice Deffune utilizando amostras soropositivas e soronegativas
para HCV. Observa-se na figura, o voltamograma em vermelho com barras de erro como uma
curva padrão, obtida através das médias de amostras soronegativas para HCV, ou seja, sem a
presença do anticorpo anti-HCV, com desvio padrão ponto a ponto. Os voltamogramas
destacados em verde são medidas de amostras soropositivas, ou seja, que possuem o anticorpo
anti-HCV. Nestes voltamogramas observa-se um aumento na densidade de elétrons, isto é, as
curvas referentes às medidas de amostras infectadas saem da curva padrão de sinal negativo
para a infecção de HCV.
De acordo com tais resultados, foi submetido para análise um pedido de patente para o
novo protótipo de imunossensor obtido durante o período deste trabalho.
53
10
5
padrão ( média das amostras
padrão ( média de amostras
soronegativas para HCV )
amostra soropositiva para
HCV ( DO média 4240 )
10 soronegativas para HCV)
amostra soropositiva para
5 HCV( 19 l/mL)
0
Corrente (A)
Corrente (A)
0
-5
-10
-15
-5
-10
-15
-20
-20
-25
-25
-0.6 -0.4 -0.2 0.0 0.2 0.4 0.6
-0.6 -0.4 -0.2 0.0 0.2 0.4 0.6
Potencial (V)
Potencial (V)
Figura 18: Voltamogramas Cíclicos dos filmes LbL de fibroína/NS5A-1 com 5 bicamadas
automontadas, na presença de amostras reais soronegativas para HCV (curva padrão vermelha) e
soropositivas para HCV, ou seja, amostras reais que contêm anticorpos anti-HCV (curvas verde).
5.4.3 Detecção Elétrica
As medidas elétricas dos filmes LbL de fibroína/NS5A-1 depositados sobre os
eletrodos interdigitados de ouro foram realizadas na presença e ausência de anticorpos antiNS5A-1 (HCV) e anti-p24 (HIV), Figura 19.
Reconhecimento específico
NS5A-1 e- anti-HCV-
-
-
Figura 19: representação esquemática do filme LbL de fibroína/NS5A-1 mostrando o reconhecimento
específico dos anticorpos anti-HCV e o não reconhecimento na presença dos anticorpos anti-HIV.
54
As Figuras 20 e 21 mostram a capacitância (C) e as perdas dielétricas (G/) em
função da frequência para os eletrodos revestidos pelo filme LbL contendo 1 e 5 bicamadas de
fibroína/NS5A-1, respectivamente. A perda dielétrica do filme contendo 1 bicamada aumenta
fortemente com o aumento da concentração de anti-HCV depositado sobre o filme. Um
comportamento semelhante, porém menos pronunciado, foi observado para o filme contendo
5 bicamadas de fibroína/NS5A-1. Os resultados de capacitância são consistentes com esta
análise, no entanto, em baixas frequências (100 a 1000 Hz) há uma maior distinção quando o
anti-HCV foi adicionado em suas diversas concentrações. Para o filme de 1 bicamada de
fibroína/NS5A-1 em presença do anti-HCV à concentração de 1 g mL-1 observou-se uma
maior capacitância, de 56 nF a 100 Hz, sendo que na ausência do anti-HCV foi observado
apenas 40 nF. Além disso, para o sistema contendo 5 bicamadas a capacitância observada foi
de 51 nF e 41 nF, na presença e ausência de anticorpos anti-HCV, respectivamente.
-8
Cp e Perdas Dielétricas
6.0x10
filme LbL SF/NS5A-1 - 1 bicamada
-8
4.0x10
-8
2.0x10
0.0
2
10
3
10
4
10
anti-HCV
(g mL-1)
0
0.002
0.01
0.02
0.1
0.2
1
5
10
Frequência (Hz)
Figura 20: Curvas de Capacitância e Perdas Dielétricas vs frequência do filme LbL contendo 1
bicamada de fibroína/NS5A-1, em ausência e presença de anticorpo anti-HCV em diferentes
concentrações.
55
-8
Cp e Perdas Dielétricas
6.0x10
filme LbL SF/NS5A-1 - 5 bicamadas
-8
4.0x10
-8
2.0x10
anti-HCV
-1
(g mL )
0
0.002
0.01
0.02
0.1
0.2
1
0.0
2
10
3
10
4
10
5
10
Frequência (Hz)
Figura 21: Curvas de Capacitância e Perdas Dielétricas vs frequência do filme LbL contendo 5
bicamadas de fibroína/NS5A-1, em ausência e presença de anticorpo anti-HCV em diferentes
concentrações.
A Figura 22 mostra os valores de capacitância a 100 Hz em função das concentrações
de anti-HCV para os filmes contendo 1 e 5 bicamadas de fibroína/NS5A-1. As curvas indicam
que a capacitância aumenta com o aumento da concentração do anti-HCV no intervalo de 0 a
0,2 g mL-1 e 0 a 0,02 g mL-1 para 1 e 5 bicamadas, respectivamente. A resposta do sensor
contendo 1 bicamada de fibroína/NS5A-1 mostrou maior sensibilidade do que o filme
contendo 5 bicamadas. Para o filme de 1 bicamada observa-se que há saturação a partir de 0,2
g mL-1 e para o filme de 5 bicamadas, houve saturação após 0,02 g mL-1.
56
58
56
Capacitância (nF)
54
52
50
48
46
44
1-bilayer SF/NS5A-1 LbL film
5-bilayer SF/NS5A-1 LbL film
42
40
0.0
0.2
1.0
-1
Concentração de anti-HCV (m mL )
Figura 22: Capacitância a 100 Hz vs concentração de anti-HCV para os filmes contendo 1 (quadrados
sólidos) e 5 (círculos) bicamadas de fibroína/NS5A-1.
A seletividade do sistema nos filmes LbL de fibroína/NS5A-1 foi investigada pela
adição do anticorpo anti-HIV. Quando o anti-HIV 1 g mL-1 foi adicionado ao sensor não
houve nenhuma mudança significativa na capacitância ou valores de perda dielétricas, como
pode ser observado na Figura 23. Desta forma, confirma-se a seletividade do sistema
imunossensor para detecção de anticorpos anti-HCV, que é alcançada quando uma unidade de
detecção contém materiais susceptíveis ao reconhecimento molecular.
57
-8
6.0x10
PBS + anti-p24 (g mL-1)
Cp e perdas
0
1
-8
4.0x10
-8
2.0x10
0.0
2
10
3
10
4
10
5
10
Frequência (Hz)
Figura 23: Curvas de Capacitância e Perdas Dielétricas vs frequência do filme LbL contendo 5
bicamadas de fibroína/NS5A-1 em ausência (curva preta) e presença (curva vermelha) de anticorpo
anti-p24 (HIV).
5.4.4 Projeções Multidimensionais
Os dados de impedância foram analisados a fim de verificar se as diferentes
concentrações de 0,002 a 1 g mL-1 foram separadas com sucesso. Para esta análise, utilizouse uma abordagem de visualização de informação, nomeada PEX-sensors. Em geral, a técnica
projeções multidimensionais mapeia cada instância dos dados incorporados em um espaço
multidimensional, neste caso, as curvas de impedância, para um elemento gráfico em espaço
visual (2D ou 3D). Neste mapa, a informação sobre a distância presente no espaço
multidimensional é preservada, tanto quanto possível no espaço visual.
Em termos matemáticos, xi, xj X são duas curvas de capacitância, e (xi,xj) é a
distância entre estas curvas. Além disso yi, yj Y são os elementos gráficos correspondentes,
normalmente um círculo, sobre o espaço visual, e d(yi,yj) a distância entre eles. Uma técnica
de projeção procura mapear X para Y de modo que |(xi,xj) - d(yi,yj)| 0 para todos xi, xj X.
Desta forma, a capacidade visual humana pode ser utilizada para analisar as relações
dissimilares entre as diferentes unidades de detecção, verificando o que é similar ou não em
outros termos de respostas de capacitância.
58
Neste trabalho foi utilizado o Mapa Interativo de Documentos (Interactive Document
Map - IDMAP), uma técnica de projeção para realizar a análise de dados, como mostrado na
Figura 24. O IDMAP é uma técnica precisa, em termos de preservação das relações de
dissimilaridade, que tem sido utilizada com sucesso em diferentes análises de detecção de
dados.
1
0.2
0.1
0.002
PBS buffer
0.02
0.01
Figura 24: Combinação das partes reais e imaginárias dos dados impedância obtidos através
de um eletrodo revestido por um filme LbL contendo 1 bicamada de fibroína/NS5A-1.
Observou-se, portanto, que os resultados foram satisfatórios e os pontos foram
separados com sucesso pela técnica de mapeamento que, neste caso, facilitou a interpretação
dos dados obtidos pela detecção via impedância elétrica.
5.4.5 Morfologia do Sistema fibroína/NS5A-1
Imagens topográficas de Microscopia de Força Atômica (AFM) das três etapas da
produção dos filmes sensores de fibroína/NS5A-1 são apresentadas na Figura 25. O filme
contendo apenas fibroína, Figura 25 (a), apresenta uma rugosidade (RMS) calculada pelo
software de análise de RRMS = 2.57 nm. Após a adição do peptídeo NS5A-1 sobre a fibroína,
não foram observadas grandes alterações na imagem topográfica, Figura 25 (b). A rugosidade
diminuiu um pouco, para RRMS = 1.84 nm. Neste caso, o peptídeo cobre as irregularidades da
superfície diminuindo, portanto, a rugosidade do filme. Quando o anticorpo anti-HCV é
adicionado (à concentração de 1 μg mL-1) sobre o filme de fibroína/NS5A-1, a morfologia é
drasticamente alterada, como pode ser observado na Figura 25 (c). O anti-HCV interage com
o peptídeo, ocorrendo o reconhecimento molecular entre eles, mudando completamente a
morfologia do filme.
59
Figura 25: Imagens topográficas de AFM dos filmes de (a) fibroína, (b) fibroina/NS5A-1 contendo
uma bicamada e (c) o filme de 1 bicamada de fibroína/NS5A-1 na presença de anticorpos anti-HCV.
As inserções em (a) e (b) mostram um zoom de alta resolução de uma área de 1 x 1 μm2 nas
respectivas imagens.
As medidas elétricas podem ser correlacionadas com a morfologia levando-se em
consideração que os sensores para detecção elétrica obtiveram resposta ao anticorpo antiHCV melhor para o filme contendo 1 bicamada de fibroína/NS5A-1. A presença do anticorpo
anti-HCV promove uma mudança drástica na morfologia e, consequentemente, nas medidas
elétricas, como observado. Estes fatos mostram que a topografia da superfície desempenha
um papel importante na variação das medidas elétricas. A reação deve ocorrer
superficialmente e um dispositivo com duas camadas ou mais, provavelmente tem uma parte
do filme que permanece intacta, levando, portanto, a menores alterações nas medidas
elétricas.
5.4.6 Detecção Óptica
As medidas espectroscópicas de Luminescência foram realizadas para as
nanopartículas de YVO4:Eu3+ em solução aquosa e para os filmes LbL de fibroína/NS5A-1
contendo nanopartículas de YVO4:Eu3+, Figuras 26 e 27 respectivamente. Como será visto a
seguir as propriedades espectroscópicas são sensíveis ao reconhecimento específico do
anticorpo, que não é alterado pela presença das nanopartículas.
60
b)
a)
Figura 26: Nanopartículas de YVO4:Eu3+ em solução aquosa vista sob a) luz branca e b) luz UV.
NS5A-1 + YVO4Eu
Fibroína
PBS
Anti-HCV
Figura 27: Representação esquemática do filme LbL de fibroína/NS5A-1+nanopartículas de
YVO4:Eu3+ mostrando o reconhecimento específico quando na presença dos anticorpos anti-HCV.
Obs: as nanopartículas estão representadas pelos círculos alaranjados e os pontos pretos representam o
tampão PBS.
A Figura 28 apresenta os espectros de emissão e excitação obtidos para o composto
YVO4:Eu3+ em solução aquosa. O espectro de emissão, Figura 28 (a), apresenta bandas em
torno de 595, 620 e 700 nm referentes à luminescência do európio. O espectro de excitação,
Figura 28 (b), apresenta as linhas finas e fracas referentes a transições ff do Eu3+ em 394 e
465 nm e uma banda larga em aproximadamente 339 nm atribuída à transição de transferência
de carga do grupo vanadato para o íon Eu3+. A intensidade relativa da banda de transferência
de carga e as bandas ff mostra a eficiência do processo de transferência de energia via este
estado excitado.
61
b)
375000
619
300000
225000
150000
704
75000
595
655
0
500
550
600
650
700
Comprimento de Onda (nm)
750
Intensidade de excitação (em. 619 nm)
Intensidade de emissão (exc. 280 nm)
a)
60000
339
50000
40000
30000
394
20000
10000
0
250
465
300
350
400
450
500
Comprimento de Onda (nm)
Figura 28: Espectros de a) emissão e b) excitação das nanopartículas de YVO4:Eu3+ em
solução aquosa.
A Figura 29 mostra o espectro de emissão obtido para o filme contendo 5 bicamadas
de fibroína da seda como matriz de imobilização, seguido da adsorção do peptídeo NS5A-1
misturado com as nanopartículas de YVO4:Eu3+, em solução aquosa. Observa-se o mesmo
espectro apresentado na Figura 28 sugerindo a preservação das nanopartículas de YVO4 no
filme. A inserção mostra o crescimento do filme de acordo com cada camada depositada,
acompanhando o máximo de emissão da banda da fibroína, em 334 nm e das nanopartículas
contendo európio, que tem uma forte emissão em 619 nm. Este crescimento quase linear
indica que as nanopartículas não alteram o crescimento do filme LbL de fibroína/NS5A-1.
550
10000
5 bicamadas SF/NS5A-1+YVO4Eu
800
8000
6000
3+
334 nm
619 nm
700
600
Intensidade
Intensidade de emissão
62
500
400
300
200
100
4000
0
-100
0
1
2
3
4
5
n° de bicamadas
2000
0
300
400
500
600
700
Comprimento de onda (nm)
Figura 29: Espectro de luminescência do filme LbL contendo 5 bicamadas de fibroína/NS5A1+nanopartículas de YVO4:Eu3+. Inserção: Aumento da emissão em 334 nm (característica da
fibroína) e em 619 nm (característica das nanopartículas de YVO4:Eu3+) para o filme em função do
número de camadas depositadas.
A figura 30 apresenta o espectro de excitação do filme contendo 5 bicamadas de
fibroína/NS5A-1+nanopartículas, que mostra essencialmente uma banda larga observada em
torno de 280 nm. É interessante notar que a intensidade relativa da banda larga é maior
quando comparada ao espectro de excitação das nanopartículas de YVO4:Eu3+ (Figura 28). A
posição da banda de transferência de carga coincide com a banda de absorção dos
aminoácidos triptofano e tirosina presentes no peptídeo e, portanto pode-se considerar a
excitação eficiente via os estados excitados dos aminoácidos. Esta transferência de energia do
peptídeo para o íon Eu3+ é fundamental na aplicação como biossensor.
Intensidade de excitação (em. 619 nm)
63
70000
60000
50000
40000
30000
20000
10000
0
275
300
325
350
375
400
425
450
Comprimento de onda (nm)
Figura 30: Espectro de excitação do filme LbL contendo 5 bicamadas de fibroína/NS5A1+nanopartículas de YVO4:Eu3+.
Os filmes foram expostos a soluções dos anticorpos anti-HCV e anti-HIV, em PBS
contendo diferentes concentrações (0, 0,01, 0,02, 0,1, 0,2 e 1 g mL-1).
A Figura 31 apresenta os espectros de emissão do filme na ausência e presença de
anticorpos anti-HCV. Na ausência do anti-HCV observam-se os espectros já apresentados
anteriormente com máximos de emissão característico da fibroína e do peptídeo por volta de
330 nm e um pico fino com máximo de emissão por volta de 620 nm, característico das
nanopartículas de európio. Quando o anti-HCV é adicionado observa-se um aumento na
emissão do európio em 619 nm. Este efeito pode ser atribuído à adsorção do anti-HCV através
do reconhecimento específico com o antígeno misturado com as nanopartículas. O aporte de
mais moléculas dos aminoácidos triptofano e/ou tirosina, presentes no anti-HCV, para as
proximadades das nanopartículas de YVO4:Eu3+, faz com que a intensidade relativa da
excitação em 280 nm sofra um aumento. Ressalta-se que é bem conhecido da literatura que a
excitação da emissão do íon Eu3+ por triptofano e/ou tirosina não é eficiente devido à posição
relativa dos estados excitados dessas moléculas e os estados receptores do íon metálico. No
vanadato de ítrio a situação não é a mesma devido a presença do estado de transferência de
carga. O que os resultados obtidos aqui mostram é que a transferência de energia entre os
64
estados excitados dos aminoácidos e o estado de transferência da carga do vanadato é bastante
Intensidade de Emissão (exc. 280 nm)
eficiente.
3+
SF/NS5A-1+NpEu - PBS
100000
3+
SF/NS5A-1+NpEu - anti HCV
80000
60000
40000
20000
0
300
400
500
600
700
Comprimento de Onda (nm)
Figura 31: Espectros de luminescência dos filmes LbL contendo 5 bicamadas de
fibroína/NS5A-1+nanopartículas de YVO4:Eu3+ na ausência de anticorpos (em PBS, curva preta) e na
presença de anticorpos anti-HCV (curva vermelha).
A Figura 32 apresenta a emissão do filme na ausência (PBS) e presença de anticorpos
anti-HIV com concentração máxima de 1g mL-1. Observa-se que não houve nenhuma
mudança significativa no máximo de emissão característico do európio, em 619 nm. Assim, é
possível confirmar também para a detecção óptica a seletividade do filme sensor.
Intensidade de emissão (exc. 280nm)
65
80000
3+
SF/NS5A-1+NpEu - PBS
3+
SF/NS5A-1+NpEu - anti HIV
70000
60000
50000
40000
30000
20000
10000
0
300
400
500
600
700
Comprimento de onda (nm)
Figura 32: Espectros de luminescência dos filmes LbL contendo 5 bicamadas de
fibroína/NS5A-1+nanopartículas de YVO4:Eu3+ na ausência de anticorpos (em PBS, curva preta) e na
presença de anticorpos anti-HIV (curva vermelha).
A Figura 33 mostra a curva analítica obtida para este sensor. Apresenta-se a
intensidade de emissão em 619 nm em função das concentrações de anti-HCV para o filme
contendo 5 bicamadas de fibroína/NS5A-1+nanopartículas de YVO4:Eu3+. A curva indica que
a emissão aumenta com o aumento da concentração do anti-HCV no intervalo de 0 a 0,01 g
mL-1, ou seja, é possível detectar o anticorpo, mesmo em concentrações mínimas, com certa
sensibilidade através da luminescência do európio. Após esta concentração, houve uma
tendência à saturação, indicando que todos os sítios de reconhecimento foram provavelmente
ocupados em acordo com as técnicas eletroquímica e elétrica apresentadas anteriormente.
i - i0 (intensidade de emissão)
66
6
5
4
3
2
1
0
0.0
0.2
1.0
-1
concentração do anti-HCV (g mL )
Figura 33: Curva analítica do filme LbL contendo 5 bicamadas de fibroína/NS5A-1+nanopartículas
de YVO4:Eu3+ na presença de diferentes concentrações de anti-HCV (concentrações 0; 0,01; 0,02; 0,1;
0,2 e 1 g mL-1).
A Figura 34 apresenta os espectros de excitação de acordo com a concentração de
anti-HCV depositada sobre o filme contendo 5 bicamadas de fibroína/NS5A-1+nanopartículas
de YVO4:Eu3+. Observa-se o aumento da banda de excitação com o aumento da concentração
de anticorpo, o que confirma a eficiência de transferência de energia entre os estados
excitados dos aminoácidos com o aumento de concentração da solução do anti-HCV, ou seja,
com a presença de um maior número de moléculas dos aminoácidos triptofano e/ou tirosina.
intensidade de excitação (em. 619 nm)
67
1500000
PBS
1250000
-1
anti-HCV 0,01g mL
-1
anti-HCV 0,02g mL
1000000
-1
anti-HCV 0,1g mL
-1
750000
anti-HCV 0,2g mL
-1
anti-HCV 1,0g mL
500000
250000
0
250
300
350
400
450
500
Comprimento de onda (nm)
Figura 34: Espectros de excitação do filme LbL contendo 5 bicamadas de fibroína/NS5A1+nanopartículas de YVO4:Eu3+ na presença de diferentes concentrações de anti-HCV.
A Figura 35 mostra o aumento na intensidade relativa entre a razão das bandas largas
observadas nos espectros de excitação com as linhas finas características das transições ff do
íon európio em função da concentração de anti-HCV. As linhas referentes às transições do
európio aparentam desaparecer, porém ficam apenas menos pronunciadas de acordo com o
grande aumento na intensidade da banda em 280 nm quando maiores concentrações de
anticorpo são adicionadas.
68
16000
R(CT/02)
14000
12000
10000
8000
6000
4000
0.0
0.2
1.0
concentração de anti-HCV
Figura 35: Razão entre as bandas largas de excitação e as linhas finas referentes às transições ff do
európio de acordo com a concentração de anticorpo.
Estes resultados indicam que o sistema de automontagem de filmes LbL contendo a
fibroína da seda como matriz de imobilização para o peptídeo NS5A-1 (do HCV) pode ser
utilizado com sucesso como um novo dispositivo imunossensor .
Mostrou-se que é possível detectar o HCV através das técnicas de voltametria cíclica,
impedância elétrica e luminescência. Cada uma delas apresenta suas vantagens umas em
relação às outras, sendo que para eletroquímica utiliza-se um potenciostato portátil para
realizar as medidas, facilitando assim a manipulação e realização da detecção, já que é
possível deslocar com facilidade o equipamento. A detecção elétrica possui a vantagem de ser
uma medida seletiva para filmes contendo apenas 1 bicamada de fibroína/NS5A-1, com a
possibilidade de utilizar com sucesso o mapeamento por projeções multidimensionais, que
facilita a análise dos resultados. Porém para ambas as medidas, eletroquímica e elétrica, fazse necessário o uso dos eletrodos, que ainda têm um custo elevado frente aos substratos de
sílica, utilizados nas medidas para detecção óptica. Esta, além de também apresentar resposta
para o sistema de detecção em baixas concentrações de anticorpo, tem custo bem menor em
relação às outras duas que utilizam eletrodos, além da praticidade e rapidez de cada medida.
Desta forma, pode-se comparar os três sistemas de detecção, bem como as vantagens de cada
um deles e a sua utilização de acordo com a necessidade e conveniência em cada caso.
69
6. CONCLUSÕES E PERSPECTIVAS
Neste trabalho, preparou-se e caracterizou-se soluções e filmes nanoestruturados via
técnica LbL (camada por camada) contendo a proteína fibroína da seda, extraída de casulos do
bicho-da-seda (Bombyx mori), que foi utilizada como matriz de imobilização para o peptídeo
antigênico derivado do vírus da hepatite C da proteína NS5A (HCV).
O peptídeo antigênico NS5A-1 foi imobilizado sobre os filmes de fibroína da seda,
sendo possível a obtenção de um imunossensor específico. As medidas e resultados de
absorção por UV-vis indicaram que o peptídeo foi proporcionalmente adsorvido em cada
camada depositada sobre a fibroína da seda. Os espectros obtidos por Espectroscopia de
Luminescência e Dicroísmo Circular (CD) indicam que a interação fibroína/peptídeo nos
filmes induziu uma estrutura secundária no peptídeo NS5A-1.
Propriedades de um imunossensor eficaz, seletivo e sensível foram observadas quando
o sistema fibroína/NS5A-1 foi testado para detecções eletroquímicas, elétricas e ópticas.
As medidas eletroquímicas foram conclusivas para a seletividade do filme
imunossensor tanto na presença de anticorpo sintético anti-HCV, quanto na presença de
amostras reais de soros sanguíneos contaminados pelo vírus.
As medidas elétricas mostraram que o sistema imunossensor é altamente específico
para detecção do vírus da hepatite C, através dos testes realizados tanto na presença do antiHCV, quanto na presença do anticorpo anti-p24 (HIV). Medidas de AFM foram conclusivas
para nos informar que a reação nas medidas elétricas ocorre provavelmente na superfície do
dispositivo, nos indicando então, que quanto mais fino o filme, melhor e mais sensível a
detecção.
Outra forma de detecção realizada foi a detecção óptica, na qual utilizou-se
nanopartículas de YVO4:Eu3+ como uma sonda luminescente para o sistema fibroína/NS5A-1.
O íon lantanídeo európio, dopado à matriz de YVO4, possui emissão característica por volta
de 620 nm, e o filme imunossensor contendo as nanopartículas, obteve luminescência 3 vezes
maior quando em contato com o anti-HCV. Testes foram realizados com a adição de antiHIV, não observando mudanças significativas na intensidade de emissão, confirmando que o
sistema fibroína/NS5A-1 com a incorporação de nanopartículas, mantém sua seletividade na
detecção para HCV e pode, portanto, ser utilizado também como um imunossensor óptico.
Desta forma, é possível afirmar que a interação fibroína-peptídeo estudada neste
período pode levar a outras novas arquiteturas de imunossensores eletroquímicos, elétricos e
70
ópticos, baseados em diversos peptídeos antigênicos utilizando a proteína da seda como uma
matriz de imobilização adequada.
As perspectivas do trabalho são o estudo sistemático da seletividade do sistema de
detecção, levando-se em conta testes utilizando anticorpos referentes a outros tipos de
hepatite e/ou outras doenças que não o HIV como já foi verificado; testes complementares da
detecção por Voltametria Cíclica que devem ser realizados na Faculdade de Medicina de
Botucatu, com colaboração da Profa. Dra. Elenice Deffune, onde serão utilizadas bolsas de
sangue de amostras não conclusivas por resultados ELISA da infecção ou não pelo HCV; o
estudo sistemático do sistema de detecção óptico, com enfoque ao processo de transferência
de energia para o íon lantanídeo; e finalmente o estudo de variados sistemas de detecção,
utilizando outras biomoléculas como matriz de imobilização e outros peptídeos específicos
em junção de nanopartículas luminescentes.
71
REFERÊNCIAS
1 BORNSCHLEGEL, K.; HOLTZMAN, D.; KLEVENS, R. M.; WARD, J. W. Vital signs:
evaluation of hepatitis C virus infection testing and reporting - eight US sites, 2005-2011.
Mmwr-Morbidity and Mortality Weekly Report, v. 62, n. 18, p. 357-361, 2013.
2 PARISE, E. R.; PORTA, G. Manual de diagnóstico e tratamento das doenças hepáticas
no paciente adulto e pediátrico. São Paulo: Diagramação, 2005.
3 BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de DST,
Aids e Hepatites Virais. Boletim Epidemiológico-Hepatites Virais, v. 3, n. 1, p. 31-46,
2012. Disponível em:
<http://www.aids.gov.br/sites/default/files/anexos/publicacao/2012/51820/boletim_epidemiol
_gico_hepatites_virais_2012_ve_12026.pdf>. Acesso em: 11 jan. 2014.
4 ZAMBERLAN, A. G. O. N. Plano de assistência de enfermagem nas reações adversas
em pacientes com hepatopatia por hepatite viral tipo C tratados com interferon-. 2002.
77 f. Dissertação (Mestrado em Doenças Tropicais) - Faculdade de Medicina, Universidade
Estadual Paulista, Botucatu, 2002.
5 GALVÃO-ALVES, J.; DANI, R. Terapêutica em gastroenterologia. Rio de Janeiro:
Guanabara Koogan, 2005.
6 FELIPPE, M. J. D. B. Comparação dos fatores de risco entre indivíduos doadores de
sangue, voluntários e de reposição, com ou sem infecção pelo vírus da hepatite C. 2005.
163 f. Tese (Doutorado em Moléstias Infecciosas e Parasitárias) - Faculdade de Medicina,
Universidade Estadual Paulista, Botucatu, 2005.
7 KUMAR, V.; ABBAS, A. K.; FAUSTO, N.; ASTER, J. C. Patologia: bases patológicas das
doenças. 7. ed. Rio de Janeiro: Elsevier Health Sciences Brazil, 2011.
8 STRAUSS, E. Hepatite C. Revista da Sociedade Brasileira de Medicina Tropical, v. 34,
n. 1, p. 69-82, 2001.
9 FERREIRA, A. W.; AVILA, S. L. M. Diagnóstico laboratorial: avaliação de métodos de
diagnóstico das principais doenças infecciosas e parasitárias e auto-imunes, correlação
clínico-laboratorial. 2. ed. Rio de Janeiro: Guanabara Koogan, 2001.
10 NELSON, D. L.; COX, M. M. Lehninger: principles of biochemistry. 4th ed. New York:
W. H. Freeman, 2005.
11 VENEGAS, M.; BRAHM, J.; VILLANUEVA, R. A. Genomic determinants of hepatitis C
virus antiviral therapy outcomes: toward individualized treatment. Annals of Hepatology,
v. 11, n. 6, p. 827-837, 2012.
12 JANG, J. Y.; CHUNG, R. T. Chronic hepatitis C. Gut Liver, v. 5, n. 2, p. 117-132, 2011.
13 TOHME, R. A.; HOLMBERG, S. D. Is sexual contact a major mode of hepatitis C virus
transmission? Hepatology, v. 52, n. 4, p. 1497-1505, 2010.
72
14 STRADER, D. B.; WRIGHT, T.; THOMAS, D. L.; SEEFF, L. B. Diagnosis, management,
and treatment of hepatitis C. Hepatology, v. 39, n. 4, p. 1147-1171, 2004.
15 GRETCH, D. R. Diagnostic tests for hepatitis C. Hepatology, v. 26, n. 3, p. 43-47, 1997.
16 ULIANA, C. V. Desenvolvimento de um biosensor amperométrico para a detecção do
vírus da Hepatite C. 2009. 100 f. Dissertação (Mestrado em Química) - Instituto de Química,
Universidade Estadual Paulista, Araraquara, 2009.
17 RICKERT, J.; GÖPEL, W.; BECK, W.; JUNG, G.; HEIDUSCHKA, P. A mixed selfassembled monolayer for an impedimetric immunosensor. Biosensors and Bioelectronics,
v. 11, n. 8, p. 757-768, 1996.
18 YUAN, Y.; ZHANG, J.; ZHANG, H.; YANG, X. Silver nanoparticle based label-free
colorimetric immunosensor for rapid detection of neurogenin 1. Analyst, v. 137, n. 2, p. 496501, 2012.
19 CHOO, Q.; KUO, G.; WEINER, A.; OVERBY, L.; BRADLEY, D.; HOUGHTON, M.
Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome.
Science, v. 244, n. 4902, p. 359-362, 1989.
20 MATSUURA, Y.; MIYAMURA, T. The molecular biology of hepatitis C virus. Seminars
in Virology, v. 4, n. 5, p. 297-304, 1993.
21 FAUQUET, C. M.; MAYO, A.; MANILOFF, J.; DESSELBERGER, U.; BALL, L. A.
Virus taxonomy: report of the international committee on taxonomy of viruses. 8th ed.
London: Elsevier Science, 2005.
22 LINDENBACH, B. D.; RICE, C. M. Unravelling hepatitis C virus replication from
genome to function. Nature, v. 436, n. 7053, p. 933-938, 2005.
23 THIMME, R.; BINDER, M.; BARTENSCHLAGER, R. Failure of innate and adaptive
immune responses in controlling hepatitis C virus infection. Fems Microbiology Reviews,
v. 36, n. 3, p. 663-683, 2012.
24 WEINER, A. J.; BRAUER, M. J.; ROSENBLATT, J.; RICHMAN, K. H.; TUNG, J.;
CRAWFORD, K.; BONINO, F.; SARACCO, G.; CHOO, Q. L.; HOUGHTON, M.; HAN, J.
H. Variable and hypervariable domains are found in the regions of HCV corresponding to the
flavivirus envelope and NS1 proteins and the pestivirus envelope glycoproteins. Virology,
v. 180, n. 2, p. 842-848, 1991.
25 ROTHWANGL, K. B.; RONG, L. J. Analysis of a conserved RGE/RGD motif in HCV E2
in mediating entry. Virology Journal, v. 6, p. 12, 2009.
26 MacDONALD, A.; CROWDER, K.; STREET, A.; McCORMICK, C.; HARRIS, M. The
hepatitis C virus NS5A protein binds to members of the Src family of tyrosine kinases and
regulates kinase activity. Journal of General Virology, v. 85, p. 721-729, 2004.
73
27 EGGER, D.; WOLK, B.; GOSERT, R.; BIANCHI, L.; BLUM, H. E.; MORADPOUR, D.;
BIENZ, K. Expression of hepatitis C virus proteins induces distinct membrane alterations
including a candidate viral replication complex. Journal of Virology, v. 76, n. 12, p. 59745984, 2002.
28 HWANG, J.; HUANG, L. Y.; CORDEK, D. G.; VAUGHAN, R.; REYNOLDS, S. L.;
KIHARA, G.; RANEY, K. D.; KAO, C. C.; CAMERON, C. E. Hepatitis C virus
nonstructural protein 5A: biochemical characterization of a novel structural class of RNAbinding proteins. Journal of Virology, v. 84, n. 24, p. 12480-12491, 2010.
29 ROSS-THRIEPLAND, D.; AMAKO, Y.; HARRIS, M. The C terminus of NS5A domain
II is a key determinant of hepatitis C virus genome replication, but is not required for virion
assembly and release. Journal of General Virology, v. 94, p. 1009-1018, 2013.
30 FRIDELL, R. A.; VALERA, L.; QIU, D.; KIRK, M. J.; WANG, C. F.; GAO, M.
Intragenic complementation of hepatitis C virus NS5A RNA replication-defective alleles.
Journal of Virology, v. 87, n. 4, p. 2320-2329, 2013.
31 TANG, H. L.; GRISE, H. Cellular and molecular biology of HCV infection and hepatitis.
Clinical Science, v. 117, n. 1/2, p. 49-65, 2009.
32 DE FRANCESCO, R.; TOMEI, L.; ALTAMURA, S.; SUMMA, V.; MIGLIACCIO, G.
Approaching a new era for hepatitis C virus therapy: inhibitors of the NS3-4A serine protease
and the NS5B RNA-dependent RNA polymerase. Antiviral Research, v. 58, n. 1, p. 1-16,
2003.
33 HAJARIZADEH, B.; GREBELY, J.; DORE, G. J. Epidemiology and natural history of
HCV infection. Nature Reviews Gastroenterology & Hepatology, v. 10, n. 9, p. 553-562,
2013.
34 TANAKA, J.; KUMAGAI, J.; KATAYAMA, K.; KOMIYA, Y.; MIZUI, M.;
YAMANAKA, R.; SUZUKI, K.; MIYAKAWA, Y.; YOSHIZAWA, H. Sex and age-specific
carriers of hepatitis B and C viruses in Japan estimated by the prevalence in the 3,485,648
first-time blood donors during 1995-2000. Intervirology, v. 47, n. 1, p. 32-40, 2004.
35 GREBELY, J.; MATTHEWS, G. V.; DORE, G. J. Treatment of acute HCV infection.
Nature Reviews Gastroenterology & Hepatology, v. 8, n. 5, p. 265-274, 2011.
36 MACHADO, A.; LIRIA, C. W.; PROTI, P. B.; REMUZGO, C.; MIRANDA, M. T. M.
Sínteses química e enzimática de peptídeos: princípios básicos e aplicações. Química Nova,
v. 27, n. 5, p. 781-789, 2004.
37 DYSON, H. J.; WRIGHT, P. E. Antigenic peptides. The FASEB Journal, v. 9, n. 1,
p. 37-42, 1995.
38 GERMAIN, R. N.; MARGULIES, D. H. The biochemistry and cell biology of antigen
processing and presentation. Annual Review of Immunology, v. 11, p. 403-450, 1993.
39 SHARON, J. Basic immunology. 2nd ed. Philadelphia: Lippincott-Williams & Wilkins,
1998.
74
40 DEMOTZ, S. The relative abundance of two measles virus fusion protein peptide-DR1
complexes expressed by B cells is independent of the form of the antigen. Cellular
Immunology, v. 193, n. 2, p. 202-208, 1999.
41 DESSEN, A.; LAWRENCE, C. M.; CUPO, S.; ZALLER, D. M.; WILEY, D. C. X-ray
crystal structure of HLA-DR4 (DRA*0101, DRB1*0401) complexed with a peptide from
human collagen II. Immunity, v. 7, n. 4, p. 473-481, 1997.
42 GHOSH, P.; AMAYA, M.; MELLINS, E.; WILEY, D. C. The structure of an intermediate
in class-II MHC maturation - clip bound to HLA-DR3. Nature, v. 378, n. 6556, p. 457-462,
1995.
43 JARDETZKY, T. S.; BROWN, J. H.; GORGA, J. C.; STERN, L. J.; URBAN, R. G.;
STROMINGER, J. L.; WILEY, D. C. Crystallographic analysis of endogenous peptides
associated with HLA-DR1 suggests a common, polyproline II-like conformation for bound
peptides. Proceedings of the National Academy of Sciences of the United States of
America, v. 93, n. 2, p. 734-738, 1996.
44 MURTHY, V. L.; STERN, L. J. The class II MHC protein HLA-DR1 in complex with an
endogenous peptide: implications for the structural basis of the specificity of peptide binding.
Structure, v. 5, n. 10, p. 1385-1396, 1997.
45 STERN, L. J.; BROWN, J. H.; JARDETZKY, T. S.; GORGA, J. C.; URBAN, R. G.;
STROMINGER, J. L.; WILEY, D. C. Crystal-structure of the human class-II MHC protein
HLA-DR1 complexed with an influenza-virus peptide. Nature, v. 368, n. 6468, p. 215-221,
1994.
46 SILVA, J. G. Desenvolvimento e automatização de um método teórico para a
avaliação quantitativa da seletividade de proteínas do MHC por diferentes antígenos.
2004. 73 f. Dissertação (Mestrado em Bioquímica) - Instituto de Química, Universidade de
São Paulo, São Paulo, 2004.
47 NEVILLE, J. A.; PRESCOTT, L. E.; BHATTACHERJEE, V.; ADAMS, N.; PIKE, I.;
RODGERS, B.; ELZAYADI, A.; HAMID, S.; DUSHEIKO, G. M.; SAEED, A. A.;
HAYDON, G. H.; SIMMONDS, P. Antigenic variation of core, NS3, and NS5 proteins
among genotypes of hepatitis C virus. Journal of Clinical Microbiology, v. 35, n. 12,
p. 3062-3070, 1997.
48 KHUDYAKOV, Y. E.; KHUDYAKOVA, N. S.; JUE, D. L.; LAMBERT, S. B.; FANG,
S.; FIELDS, H. A. Linear B-cell epitopes of the NS3-NS4-NS5 proteins of the hepatitis-C
virus as modeled with synthetic peptides. Virology, v. 206, n. 1, p. 666-672, 1995.
49 RODRIGUEZ-LOPEZ, M.; RIEZU-BOJ, J. I.; RUIZ, M.; BERASAIN, C.; CIVEIRA, M.
P.; PRIETO, J.; BORRAS-CUESTA, F. Immunogenicity of variable regions of hepatitis C
virus proteins: selection and modification of peptide epitopes to assess hepatitis C virus
genotypes by ELISA. Journal of General Virology, v. 80, p. 727-738, 1999.
75
50 ROSA, C.; OSBORNE, S.; GARETTO, F.; GRIVA, S.; RIVELLA, A.; CALABRESI, G.;
GUASCHINO, R.; BONELLI, F. Epitope mapping of the NS4 and NS5 gene-products of
hepatitis-C virus and the use of a chimeric NS4-NS5 synthetic peptide for serodiagnosis.
Journal of Virological Methods, v. 55, n. 2, p. 219-232, 1995.
51 SIMMONDS, P.; ROSE, K. A.; GRAHAM, S.; CHAN, S. W.; McOMISH, F.; DOW, B.
C.; FOLLETT, E. A. C.; YAP, P. L.; MARSDEN, H. Mapping of serotype-specific,
immunodominant epitopes in the NS-4 region of hepatitis-C virus (HCV) - use of typespecific peptides to serologically differentiate infections with HCV type-1, type-2, and type-3.
Journal of Clinical Microbiology, v. 31, n. 6, p. 1493-1503, 1993.
52 McOMISH, F.; CHAN, S. W.; DOW, B. C.; GILLON, J.; FRAME, W. D.; CRAWFORD,
R. J.; YAP, P. L.; FOLLETT, E. A. C.; SIMMONDS, P. Detection of 3 types of hepatitis-C
virus in blood-donors - investigation of type-specific differences in serologic reactivity and
rate of alanine aminotransferase abnormalities. Transfusion, v. 33, n. 1, p. 7-13, 1993.
53 DOU, X. G.; TALEKAR, G.; CHANG, J.; DAI, X.; LI, L. X.; BONAFONTE, M. T.;
HOLLOWAY, B.; FIELDS, H. A.; KHUDYAKOV, Y. E. Antigenic heterogeneity of the
hepatitis C virus NS5A protein. Journal of Clinical Microbiology, v. 40, n. 1, p. 61-67,
2002.
54 TANSIL, N. C.; KOH, L. D.; HAN, M-Y. Functional silk: colored and luminescent.
Advanced Materials, v. 24, n. 11, p. 1388-1397, 2012.
55 ALTMAN, G. H.; DIAZ, F.; JAKUBA, C.; CALABRO, T.; HORAN, R. L.; CHEN, J.;
LU, H.; RICHMOND, J.; KAPLAN, D. L. Silk-based biomaterials. Biomaterials, v. 24, n. 3,
p. 401-416, 2003.
56 MORI, H.; TSUKADA, M. New silk protein: modification of silk protein by gene
engineering for production of biomaterials. Reviews in Molecular Biotechnology, v. 74, n. 2,
p. 95-103, 2000.
57 HE, Y-X.; ZHANG, N-N.; LI, W-F.; JIA, N.; CHEN, B-Y.; ZHOU, K.; ZHANG, J.;
CHEN, Y.; ZHOU, C-Z. N-terminal domain of Bombyx mori fibroin mediates the assembly of
silk in response to pH decrease. Journal of Molecular Biology, v. 418, n. 3/4, p. 197-207,
2012.
58 NOGUEIRA, G. M. Hidrogeis e filmes de fibroína da seda para fabricação ou
recobrimento de biomateriais. 2009. 126 f. Tese (Doutorado em Engenharia Química) Faculdade de Engenharia Química, Universidade Estadual de Campinas, Campinas, 2009.
59 DECHER, G. Fuzzy nanoassemblies: toward layered polymeric multicomposites. Science,
v. 277, n. 5330, p. 1232-1237, 1997.
60 PATERNO, L. G.; MATTOSO, L. H. C.; OLIVEIRA JUNIOR, O. N. D. Filmes
poliméricos ultrafinos produzidos pela técnica de automontagem: preparação, propriedades e
aplicações. Química Nova, v. 24, n. 2, p. 228-235, 2001.
61 CLARK, S. L.; HAMMOND, P. T. Engineering the microfabrication of Layer-by-Layer
thin films. Advanced Materials, v. 10, n. 18, p. 1515-1519, 1998.
76
62 ARIGA, K.; NAKANISHI, T.; MICHINOBU, T. Immobilization of biomaterials to nanoassembled films (self-assembled monolayers, Langmuir-Blodgett films, and Layer-by-Layer
assemblies) and their related functions. Journal of Nanoscience and Nanotechnology, v. 6,
n. 8, p. 2278-2301, 2006.
63 KRAJEWSKA, B. Application of chitin and chitosan-based materials for enzyme
immobilizations: a review. Enzyme and Microbial Technology, v. 35, n. 2/3, p. 126-139,
2004.
64 JIN, X.; XI, F.; LV, D.; WU, Q.; LIN, X. The effect of the chitosan membrane properties
on the enzyme adsorption and performance for the construction of horseradish peroxidase
biosensors. Carbohydrate Polymers, v. 85, n. 4, p. 786-791, 2011.
65 WU, B-Y.; HOU, S-H.; YIN, F.; LI, J.; ZHAO, Z-X.; HUANG, J-D.; CHEN, Q.
Amperometric glucose biosensor based on Layer-by-Layer assembly of multilayer films
composed of chitosan, gold nanoparticles and glucose oxidase modified Pt electrode.
Biosensors and Bioelectronics, v. 22, n. 6, p. 838-844, 2007.
66 XUE, R.; KANG, T-F.; LU, L-P.; CHENG, S-Y. Immobilization of acetylcholinesterase
via biocompatible interface of silk fibroin for detection of organophosphate and carbamate
pesticides. Applied Surface Science, v. 258, n. 16, p. 6040-6045, 2012.
67 WANG, X.; KIM, H. J.; XU, P.; MATSUMOTO, A.; KAPLAN, D. L. Biomaterial
coatings by stepwise deposition of silk fibroin. Langmuir, v. 21, n. 24, p. 11335-11341,
2005.
68 OMENETTO, F. G.; KAPLAN, D. L. New opportunities for an ancient material. Science,
v. 329, n. 5991, p. 528-531, 2010.
69 CAI, K.; HU, Y.; JANDT, K. D. Surface engineering of titanium thin films with silk
fibroin via Layer-by-Layer technique and its effects on osteoblast growth behavior. Journal
of Biomedical Materials Research Part A, v. 82A, n. 4, p. 927-935, 2007.
70 JIANG, C.; WANG, X.; GUNAWIDJAJA, R.; LIN, Y. H.; GUPTA, M. K.; KAPLAN, D.
L.; NAIK, R. R.; TSUKRUK, V. V. Mechanical properties of robust ultrathin silk fibroin
films. Advanced Functional Materials, v. 17, n. 13, p. 2229-2237, 2007.
71 FREIRE, R. S.; PESSOA, C. A.; MELLO, L. D.; KUBOTA, L. T. Direct electron transfer:
an approach for electrochemical biosensors with higher selectivity and sensitivity. Journal of
the Brazilian Chemical Society, v. 14, p. 230-243, 2003.
72 VO-DINH, T.; CULLUM, B. Biosensors and biochips: advances in biological and medical
diagnostics. Fresenius' Journal of Analytical Chemistry, v. 366, n. 6/7, p. 540-551, 2000.
73 RICCI, F.; PALLESCHI, G. Sensor and biosensor preparation, optimisation and
applications of Prussian blue modified electrodes. Biosensors and Bioelectronics, v. 21, n. 3,
p. 389-407, 2005.
74 GRIESHABER, D.; MacKENZIE, R.; VÖRÖS, J.; REIMHULT, E. Electrochemical
biosensors - sensor principles and architectures. Sensors, v. 8, n. 3, p. 1400-1458, 2008.
77
75 PUMERA, M.; SÁNCHEZ, S.; ICHINOSE, I.; TANG, J. Electrochemical nanobiosensors.
Sensors and Actuators B: Chemical, v. 123, n. 2, p. 1195-1205, 2007.
76 BRETT, C. M. A.; BRETT, A. M. O. Electrochemistry: principles, methods, and
applications. New York: Oxford University Press, 1993.
77 TAYLOR, D. M.; MacDONALD, A. G. AC admittance of the metal-insulator-electrolyte
interface. Journal of Physics D: Applied Physics, v. 20, n. 10, p. 1277-1283, 1987.
78 ZUCOLOTTO, V.; DAGHASTANLI, K. R. P.; HAYASAKA, C. O.; RIUL, A.;
CIANCAGLINI, P.; OLIVEIRA, O. N. Using capacitance measurements as the detection
method in antigen-containing Layer-by-Layer films for biosensing. Analytical Chemistry,
v. 79, n. 5, p. 2163-2167, 2007.
79 EMPRESA BRASILEIRA DE PESQUISA AGROPECUÁRIA; FUNDAÇÃO DE
AMPARO À PESQUISA DO ESTADO DE SÃO PAULO (Brasil). A. Riul Junior; L. H. C.
Mattoso; F. J. Fonseca; D. M. Taylor; S. V. Mello; E. C. Venâncio. Sensor à base de
plásticos condutores e lipídios para avaliação de paladar de bebidas (língua eletrônica).
BR 0103502-9, 21 fev. 2001, 03 dez. 2002.
80 SAUM, A. G. E.; CUMMING, R. H.; ROWELL, F. J. Use of substrate coated electrodes
and AC impedance spectroscopy for the detection of enzyme activity. Biosensors and
Bioelectronics, v. 13, n. 5, p. 511-518, 1998.
81 ZUCOLOTTO, V.; PINTO, A. P. A.; TUMOLO, T.; MORAES, M. L.; BAPTISTA, M.
S.; RIUL JUNIOR, A.; ARAÚJO, A. P. U.; OLIVEIRA JUNIOR, O. N. Catechol biosensing
using a nanostructured Layer-by-Layer film containing Cl-catechol 1,2-dioxygenase.
Biosensors and Bioelectronics, v. 21, n. 7, p. 1320-1326, 2006.
82 VIEIRA, N. C. S. Biossensores de glicose nanoestruturados baseados em dendrímeros
PAMAM e filmes finos de In2O3:Sn. 2006. 121 f. Dissertação (Mestrado em Ciências dos
Materiais) - Instituto de Ciências Exatas, Universidade Federal de Itajubá, Itajubá, 2006.
83 PINHEIRO, S. C. L.; RAIMUNDO JUNIOR, I. M. Uso de membranas de Nafion para a
construção de sensores ópticos para medidas de pH. Química Nova, v. 28, n. 5, p. 932-936,
2005.
84 CARVALHO, R. M. D.; RATH, S.; KUBOTA, L. T. SPR: uma nova ferramenta para
biossensores. Química Nova, v. 26, n. 1, p. 97-104, 2003.
85 BRECHT, A.; GAUGLITZ, G. Optical probes and transducers. Biosensors and
Bioelectronics, v. 10, n. 9/10, p. 923-936, 1995.
86 ELISEEVA, S. V.; BUNZLI, J-C. G. Lanthanide luminescence for functional materials
and bio-sciences. Chemical Society Reviews, v. 39, n. 1, p. 189-227, 2010.
87 DE LA ESCOSURA-MUÑIZ, A.; PAROLO, C.; MERKOÇI, A. Immunosensing using
nanoparticles. Materials Today, v. 13, n. 7/8, p. 24-34, 2010.
78
88 LIU, J. B.; YANG, X. H.; HE, X. X.; WANG, K. M.; WANG, Q.; GUO, Q. P.; SHI, H.;
HUANG, J.; HUO, X. Q. Fluorescent nanoparticles for chemical and biological sensing.
Science China-Chemistry, v. 54, n. 8, p. 1157-1176, 2011.
89 REED, E. D.; MOOS, H. W. Multiphonon relaxation of excited states of rare-earth ions in
YVO4, YAsO4, and YPO4. Physical Review B, v. 8, n. 3, p. 980-987, 1973.
90 REED, E. D.; MOOS, H. W. Nonthermalization and large variation in multiphonon
relaxation rate among rare-earth-ion stark levels. Physical Review B, v. 8, n. 3, p. 988-992,
1973.
91 VENIKOUAS, G. E.; POWELL, R. C. Laser site-selection spectroscopy investigation of
Eu3+ ions in YVO4 crystals. Physical Review B, v. 17, n. 9, p. 3456-3461, 1978.
92 HSU, C.; POWELL, R. C. Energy transfer in europium doped yttrium vanadate crystals.
Journal of Luminescence, v. 10, n. 5, p. 273-293, 1975.
93 JANG, K. H.; SUNG, W. K.; KIM, E. S.; SHI, L.; JEONG, J. H.; SEO, H. J. Timeresolved luminescence spectroscopy of a YVO4:Eu3+ thin film. Journal of Luminescence,
v. 129, n. 12, p. 1853-1856, 2009.
94 RIWOTZKI, K.; HAASE, M. Wet-chemical synthesis of doped colloidal nanoparticles: YVO4:Ln (Ln = Eu, Sm, Dy). The Journal of Physical Chemistry B, v. 102, n. 50,
p. 10129-10135, 1998.
95 XU, Z.; KANG, X.; LI, C.; HOU, Z.; ZHANG, C.; YANG, D.; LI, G.; LIN, J. Ln3+ (Ln =
Eu, Dy, Sm, and Er) Ion-doped YVO4 nano/microcrystals with multiform morphologies:
hydrothermal synthesis, growing mechanism, and luminescent properties. Inorganic
Chemistry, v. 49, n. 14, p. 6706-6715, 2010.
96 GRANDHE, B. K.; BANDI, V. R.; JANG, K.; RAMAPRABHU, S.; LEE, H-S.; SHIN, DS.; YI, S-S.; JEONG, J-H. Multi wall carbon nanotubes assisted synthesis of YVO4:Eu3+
nanocomposites for display device applications. Composites Part B: Engineering, v. 43, n. 3,
p. 1192-1195, 2012.
97 HUIGNARD, A.; GACOIN, T.; BOILOT, J-P. Synthesis and luminescence properties of
colloidal YVO4:Eu3+ phosphors. Chemistry of Materials, v. 12, n. 4, p. 1090-1094, 2000.
98 ROCKWOOD, D. N.; PREDA, R. C.; YUCEL, T.; WANG, X. Q.; LOVETT, M. L.;
KAPLAN, D. L. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols, v. 6,
n. 10, p. 1612-1631, 2011.
99 BARKER, M. G.; HOOPER, A. J. Preparation and X-ray powder diffraction patterns of
the sodium vanadates NaVO3, Na4V2O7, and Na3VO4. Journal of the Chemical Society,
Dalton Transactions, v. 15, p. 1513-1517, 1973.
100 GIAUME, D.; BUISSETTE, V.; LAHLIL, K.; GACOIN, T.; BOILOT, J. P.;
CASANOVA, D.; BEAUREPAIRE, E.; SAUVIAT, M. P.; ALEXANDROU, A. Emission
properties and applications of nanostructured luminescent oxide nanoparticles. Progress in
Solid State Chemistry, v. 33, n. 2/4, p. 99-106, 2005.
79
101 FASMAN, G. D. Circular dichroism and the conformational analysis of
biomolecules. New York: Springer, 1996.
102 SKOOG, D. A.; HOLLER, F. J.; NIEMAN, T. A. Principles of instrumental analysis.
5th ed. Philadelphia: Saunders College Publishing, 1998.
103 SIERRA, M.; GIOVANELA, M.; DONARD, O.; BELIN, C. A utilização da
espectroscopia de fluorescência no estudo da matéria orgânica dissolvida nas águas naturais:
evolução e perspectivas. Química Nova, v. 19, n. 3, p. 294-301, 1995.
104 ATVARS, T. D. Z.; MARTELLI, C. Espectroscopia de luminescência. 2002. p. 1-9.
Disponível em: <http://chemkeys.com/br/2002/02/18/espectroscopia-de-luminescência/>.
Acesso em: 15 ago. 2013.
105 LAKOWICZ, J. R. Principles of fluorescence spectroscopy. 3rd ed. New York:
Springer, 2006.
106 ALEIXO, L. M. Voltametria: conceitos e técnicas. 2003. p. 1-21. Disponível em:
<http://chemkeys.com/br/2003/03/25/voltametria-conceitos-e-técnicas/>. Acesso em: 15 ago.
2013.
107 NAM, J.; PARK, Y. H. Morphology of regenerated silk fibroin: effects of freezing
temperature, alcohol addition, and molecular weight. Journal of Applied Polymer Science,
v. 81, n. 12, p. 3008-3021, 2001.
108 BUSQUETS, M. A.; ALSINA, M. A.; HARO, I. Peptides and liposomes: from
biophysical to immunogenic studies. Current Drug Targets, v. 4, n. 8, p. 633-642, 2003.
109 HOU, L.; DU, G.; TONG, Y.; WANG, H. Identification of B cell epitopes of hepatitis C
virus RNA dependent RNA polymerase. Journal of Virological Methods, v. 104, n. 1,
p. 1-8, 2002.