PLATELIA™ Parvovirus B19 IgG
96
72860
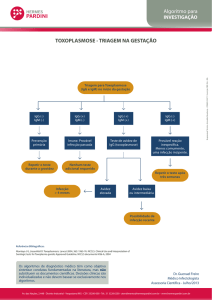
Detecção qualitativa de todos os anticorpos de Parvovírus B19 IgG em soro ou plasma
humanos mediante imunoensaio enzimático.
1)
APLICAÇÃO
O Ensaio Platelia™ Parvovírus B19 IgG é um imunoensaio ELISA para a detecção qualitativa de anticorpos IgG para
Parvovírus B19 (PVB19) em soro ou plasma humanos.
O teste deve ser utilizado como auxiliar de diagnóstico da infecção por Parvovírus B19 e em conjunto com o historial clínico do
paciente.
2)
RESUMO E EXPLICAÇÃO DO TESTE
O Parvovírus B19 (PVB19) é o único vírus da família dos parvoviridae que infecta os humanos.
É um vírus do ADN de uma só cadeia, icosaedral e pequeno, envolvido em cápside sem revestimento. O genoma B19 é
especialmente codificado para duas proteínas estruturais capsidiais, VP1 (83kDA) e VP2 (53kDA), e uma proteína nãoestrutural, NS-1, necessárias para replicação dos vírus e propagação na célula.
O Parvovírus B19 é ubíquo e ocorre endemicamente em todo o mundo. A seroprevalência varia entre 2-10% em crianças com
menos de 5 anos e 50-70% em adultos. Espalha-se essencialmente através de gotículas respiratórias, mas também pode
transmitir-se através de transfusões e de mãe para filho, se mulheres grávidas forem infectadas durante a gravidez.
O vírus possui um tropismo para precursores eritropoiéticos humanos em medula óssea e sangue, provocando lise celular.
Dependendo da competência imunológica, pode conduzir a uma anemia mais ou menos grave.
A infecção por Parvovírus B19 é comum e conduz habitualmente a sintomas ligeiros. É conhecida por ser o agente causador
de erupção eritematosa (quinta doença) em crianças ou de sintomas mais complicados, como artropatia aguda ou várias
formas de artrite em adultos. Além disso, em populações mais específicas, a infecção por Parvovírus B19 pode provocar
anemia grave, como Crise Aplástica Transiente (TAC) para pacientes com distúrbios hemolíticos pré-existentes, falência de
medula óssea crónica e anemia em pacientes imunocomprometidos e/ou hidrópsia fetal, quando transmitido por via placentária
ao feto. Uma infecção durante a gravidez pode inclusivamente conduzir a um aborto espontâneo.
A detecção do Parvovírus B19 IgG e IgM é especialmente adequada para determinar o estado imunológico de pacientes em
risco, pacientes com quadros clínicos atípicos e suspeitos de terem uma infecção recente ou aguda e, ainda mais, em
grávidas, para evitar complicações sérias no feto, em caso de suspeita de infecção por Parvovírus B19.
3)
PRINCÍPIOS DO PROCEDIMENTO
O Ensaio Platelia™ Parvovírus B19 IgG é um ensaio Elisa indirecto para a detecção de anticorpos IgG para Parvovírus B19
(PVB19) em soro ou plasma humanos.
O ensaio utiliza antigénio recombinante viral produzido pelo baculovírus, revestidos com uma microplaca. Após adição da
amostra, os anticorpos PVB19 IgG específicos, se existirem, irão unir-se ao antigénio Parvovírus revestido nos poços de
ensaio. No seguimento de um procedimento de lavagem, é acrescentado o IgG de cabra anti-humano etiquetado como
peroxidase, que se une ao IgG de Parvovírus B19 humano presente. O excesso de IgG anti-humano etiquetado é eliminado
após um segundo procedimento de lavagem e o complexo é detectado adicionando Substrato de Tetrametilbencidina (TMB),
que passa a azul na presença de peroxidase. A adição de reagente de paragem resulta num produto final amarelo estável
Substrate
Peroxidase
Labelled
Anti-IgG
Sample
anti-PVB19
IgG
Sample
IgG
Viral
PVB19
Ag
Viral
PVB19
Ag
1
4)
REAGENTES
As quantidades de reagente fornecidas foram calculadas para permitir 96 testes, num máximo de 6 ciclos. Todos os reagentes
destinam-se exclusivamente a utilização para diagnóstico in vitro.
1.
Descrição
Identificação no rótulo
Descrição
Microplaca
poços 12 x 8 revestidos com antigénio recombinante de
Parvovírus B19 humano purificado
R1
Microplate
R2
Concentrated Washing
Solution (10x)
R3
Negative Control
R4
Calibrator
R5
Positive control
R6
Conjugate
R7
Diluent
R9
R10
Solução de lavagem concentrada (10x)
Tampão fosfato com Tween® 20
Controlo Negativo
Plasma humano negativo para IgG para Parvovírus B19,
Soroalbumina Bovina.
Conservante: azida de sódio (0,08w/v%)
Calibrador Cut-Off
Plasma humano positivo para IgG para Parvovírus B19,
Soroalbumina Bovina.
Conservante: azida de sódio (0,08w/v%)
Controlo Positivo
Plasma humano positivo para IgG para Parvovírus B19,
Soroalbumina Bovina.
Conservante: azida de sódio (0,08w/v%)
Conjugar
Anticorpos policlonais de IgG anti-humano de cabra etiquetados
com peroxidase, Soroalbumina Bovina.
Apresentação
/preparação
1 microplaca
Pronto a utilizar
1 x 100 ml
Para diluir
1 x 2 ml
Pronto a utilizar
1 x 2 ml
Pronto a utilizar
1 x 2 ml
Pronto a utilizar
1 x 16 ml
Pronto a utilizar
Diluente para amostras
Tampão Fosfato, Soroalbumina Bovina.
4 x 60 ml
Pronto a utilizar
Chromogen TMB
Cromogénio
Tetrametilbencidina 3,3’,5,5’ (< 0,02%), H2O2 (<1%)
1 x 16 ml
Pronto a utilizar
Stopping Solution
Solução de Paragem
Solução de ácido sulfúrico 0,6 N
1 x 16 ml
Pronto a utilizar
2. Requisitos de manuseamento e armazenamento
O kit deve ser armazenado a +2-8 °C. Se o kit for armazenado a +2-8 °C antes de ser aberto, cada componente pode ser
utilizado até à data de validade indicada no rótulo exterior do kit (excepto se houver instruções específicas).
Identificação
R1
R2
R3, R4, R5
R7
R6
R9, R10
5)
Conservação
Em saco fechado, 4 semanas a +2-8 °C (verifique a presença de dessecativo).
Antes da diluição: até à data de validade indicada no rótulo a +2-8 °C, na ausência de
contaminação.
Após a diluição: 24 horas a +2-8 °C
Após a abertura, até à data de validade indicada no rótulo a 2-8 °C, na ausência de
contaminação
Após a abertura, até à data de validade indicada no rótulo a 2-8 °C, na ausência de
contaminação.
Após a abertura, até à data de validade indicada no rótulo a 2-8 °C, na ausência de
contaminação.
Após a abertura: até à data de validade indicada no rótulo a 2-8 °C, na ausência de
contaminação
AVISOS E PRECAUÇÕES
Para fins de diagnóstico in vitro
Apenas para utilização profissional.
1.
Instruções de segurança e saúde
Use uma bata de laboratório descartável, luvas e protecção ocular ao manusear amostras e reagentes.
Não efectue a pipetagem com a boca.
Não coma, beba nem fume durante o manuseamento de amostras e durante o teste.
Os Controlos Negativo (R3) e Positivo (R5) e o Calibrador (R4) são fabricados a partir de plasma humano que foi testado e
considerado não reactivo para HBsAg e anticorpos para VIH-1, VIH-2 e VHC. Todavia, todos os reagentes devem ser
2
tratados como se fossem passíveis de transmitir infecções. Todos os testes devem ser conduzidos em conformidade com
a Norma OSHA sobre os Agentes Patogénicos Transmissíveis pelo Sangue, Nível de Segurança Biológica 2 ou outras
práticas apropriadas de segurança biológica.
Todo o material, incluindo soluções de lavagem, que entre em contacto directo com amostras e reagentes contendo
materiais de origem humana deve ser considerado passível de transmitir doenças infecciosas.
Evite salpicar amostras ou soluções que contenham amostras. Os salpicos devem ser lavados com lixívia diluída a 10%.
No caso de um salpico com ácido, este deve ser, primeiro, neutralizado com bicarbonato de sódio e, em seguida, lavado
com lixívia diluída a 10%, 70% etanol ou 0,5% Wescodyne Plus™ e seco com papel absorvente. O material utilizado para
limpar deve ser eliminado num recipiente para resíduos contaminados.
Amostras de pacientes, reagentes contendo material de origem humana, produtos e materiais contaminados devem ser
eliminados apenas após a descontaminação
esta pode ser realizada através de imersão em lixívia na concentração final de 5 % de hipoclorito de sódio durante
30 minutos,
ou através de autoclavagem a 121 °C durante 20 minutos, no mínimo.
Não introduza soluções que contenham hipoclorito de sódio na autoclave.
Cuidado: Os controlos e o Calibrador contêm Azida de Sódio, que pode reagir com chumbo e cobre durante a solda,
formando depósitos altamente explosivos de azidas de metal; dilua em grandes quantidades de água para
eliminar
A Folha de Dados da Segurança está disponível em www.bio-rad.com.
2. Precauções relacionadas com o procedimento
Preparação
A fiabilidade dos resultados depende da implementação correcta das seguintes Boas Práticas Laboratoriais:
Não utilize reagentes expirados.
Não misture nem associe, num mesmo ciclo, reagentes de diferentes lotes.
Processamento
Armazene os reagentes nas condições recomendadas. Não congele os reagentes.
Antes de utilizar, aguarde 30 minutos para que os reagentes atinjam a temperatura ambiente (+18-30 °C).
Com cuidado, reconstitua ou dilua os reagentes, evitando qualquer contaminação.
Teste os Controlos e o Calibrador em cada ciclo.
Não realize o teste na presença de vapores reactivos (vapores ácidos, alcalinos, aldeídos) ou de poeiras que possam
alterar a actividade da enzima do conjugado.
Utilize vidros bem lavados e enxaguados com água desionizada ou, de preferência, material descartável.
Certifique-se de que as amostras ou o Conjugado não aderem às paredes do poço durante a distribuição.
Lavar a microplaca é um passo crucial do procedimento. Siga o número recomendado de ciclos de lavagem e certifique-se
de que todos os poços são totalmente enchidos e, em seguida, completamente esvaziados. Lavagens incorrectas podem
conduzir a resultados inexactos.
Não deixe a microplaca secar entre o fim das operações de lavagem e a distribuição do reagente.
Nunca utilize o mesmo recipiente para a distribuição do conjugado e de Cromogénio TMB.
A reacção enzimática é muito sensível a metal ou a iões de metal. Consequentemente, não deixe que qualquer elemento
de metal entre em contacto com várias soluções que contenham o Conjugado ou o Cromogénio TMB.
O Cromogénio TMB (R9) não deve ter qualquer cor ou então deve ser amarelo claro. O aparecimento de uma coloração
azul indica que o reagente não pode ser utilizado e deve ser substituído.
Passado algum tempo após a paragem da reacção, pode ocorrer uma precipitação preta em poços onde haja um
desenvolvimento de cor forte.
Utilize uma ponta da pipeta nova para cada amostra.
Verifique as pipetas e outro equipamento para obter precisão e um desempenho correcto.
6)
AMOSTRA
O soro e o plasma (EDTA, heparina ou citrato) são os tipos de amostra recomendados.
Cumpra as seguintes recomendações de manuseamento, processamento e armazenamento das amostras de sangue:
Recolha todas as amostras de sangue cumprindo as precauções de rotina para punção venosa.
Após a centrifugação, separe o soro ou plasma dos coágulos ou glóbulos vermelhos, num tubo de armazenamento bem
fechado.
Se não for para testar imediatamente ou num espaço de 8 horas, o soro ou plasma podem ser armazenados a 2-8 °C por
um período máximo de 7 dias.
Se as amostras não puderem ser testadas dentro de 7 dias, devem ser congeladas imediatamente após serem recebidas,
a -20 °C ou menos.
Não utilize amostras que tenham sido descongeladas mais de 3 vezes. As amostras previamente congeladas devem ser
cuidadosamente misturadas (Vortex) após a descongelação, antes do teste.
As amostras diluídas não devem ser armazenadas, se for necessário repetir o teste, deve ser utilizada uma preparação
nova.
As amostras que contenham 30 mg/dl de bilirrubina não conjugada e as amostras hemolisadas que contenham até 500
mg/dl de hemoglobina não devem afectar os resultados
Não aqueça as amostras.
3
7)
MATERIAL NECESSÁRIO
1. Materiais fornecidos
Consulte a secção 4, REAGENTES
2.
Materiais necessários mas não fornecidos
Misturador vortex.
Leitor de microplacas equipado com filtros de 450 nm e 620 nm (*).
Misturador de microplacas.
Lavador de microplacas manual, semiautomático ou automático (*).
Água desionizada e destilada.
Luvas descartáveis.
Óculos de segurança.
Papel absorvente.
Pipetas ou multi-pipetas ajustáveis ou predefinidas, automáticas ou semiautomáticas, para medir e dispensar 10 µl a 1000
µl e 5 ml a 10 ml.
Cilindros graduados de 25 ml, 50 ml, 100 ml e 1000 ml.
Hipoclorito de sódio (lixívia) e bicarbonato de sódio.
Recipiente para resíduos de risco biológico.
Tubos descartáveis.
Película ou tampa de microplaca.
(*) Consulte o nosso departamento técnico para obter informações detalhadas sobre o equipamento recomendado.
8)
INSTRUÇÕES DE UTILIZAÇÃO
1.
Preparação dos reagentes
R1: Deixar durante 30 minutos à temperatura ambiente (+18-30 °C) antes de abrir o saco. Retire a bandeja de transporte.
Volte a colocar as tiras não utilizadas no suporte de placas imediatamente no saco e verifique se há dessecativo. Volte a
selar cuidadosamente o saco e armazene a +2-8 °C.
R2: Dilua a solução de lavagem (R2) 1/10 em água destilada: por exemplo 100 ml de R2 e 900 ml de água destilada, para
preparar a solução de lavagem pronta a utilizar. Prepare 160 ml de solução de lavagem diluída para uma placa de 12 tiras,
se lavar manualmente.
Todos os outros reagentes são pronto a utilizar.
2. Preparação de amostras
O soro recolhido em tubos secos e o plasma (EDTA, heparina ou citrato) são os tipos de amostra recomendados.
Cumpra as seguintes recomendações de manuseamento, processamento e armazenamento de amostras de sangue:
Recolha todas as amostras de soro cumprindo as precauções de rotina.
Deixe que as amostras coagulem completamente antes da centrifugação
Mantenha os tubos sempre bem fechados.
Após a centrifugação, separe o soro e armazene-o num tubo de armazenamento bem fechado.
3. Procedimento
Siga rigorosamente os procedimentos do ensaio e as Boas Práticas Laboratoriais.
Antes de utilizar, deixe que os reagentes atinjam a temperatura ambiente (+18-30 °C).
Utilize todos os controlos com cada ciclo, para validar os resultados do ensaio e calcule o cut-off.
1. Estabeleça cuidadosamente o plano de identificação e distribuição para amostras de pacientes e controlos.
2. Prepare a Solução de Lavagem diluída (R2) [Consulte a Secção 8.1].
3. Retire a bandeja de transporte e as tiras (R1) da bolsa de protecção [Consulte a Secção 8.1].
4. Todas as amostras, os controlos e o calibrador devem ser misturados em vortex antes de serem utilizados.
Dilua todas as amostras de teste 1:201 (por exemplo, adicionando 10 µl de amostra a 2 ml de Diluente (R7)).
Não dilua os Controlos e o Calibrador.
Misture bem todas as amostras diluídas.
5. Siga rigorosamente a sequência indicada abaixo, distribua por cada poço 100 µl de Controlo Negativo (R3), Calibrador
(R4) em duplicado, Controlo Positivo (R5) e amostras diluídas, deixando um poço para o branco de reagente.
A
B
C
D
E
F
G
H
1
Em
branco
R3
R4
R4
R5
S1
S2
S3
2
3
4
5
6
7
8
9
10
11
12
S4
S5
S6
S7
S8
S9
S10
S11
4
6.
14.
Misture bem, colocando a placa num misturador de placas durante vários segundos.
Cubra a microplaca com uma película ou tampa de microplaca. Incube a microplaca durante 1 hora 5 minutos à
temperatura ambiente (18 – 30 °C)
No fim do período de incubação, retire a película ou tampa de microplaca. Aspire o conteúdo de todos os poços para um
recipiente de resíduos de risco biológico (contendo hipoclorito de sódio). Lave a microplaca 3 vezes com 200 µl de
Solução de Lavagem (R2) diluída por poço. Inverta a microplaca e passe suavemente papel absorvente para remover o
líquido restante.
Distribua imediatamente 100 µl de Conjugado (R6) por todos os poços, excepto para Branco.
Misture bem, colocando a placa num misturador de placas durante vários segundos.
Cubra a microplaca com uma película ou tampa de microplaca. Incube a microplaca durante 1 hora 5 minutos à
temperatura ambiente (18 – 30 °C)
No fim do período de incubação, retire a película ou tampa de microplaca. Aspire o conteúdo de todos os poços para um
recipiente de resíduos de risco biológico (contendo hipoclorito de sódio). Lave a microplaca 5 vezes com 200 µl de
Solução de Lavagem (R2) diluída por poço. Inverta a microplaca e passe suavemente papel absorvente para remover o
líquido restante.
Distribua imediatamente, afastado da luz, 100 µl de Cromogénio TMB (R9) por cada poço, incluindo Branco. Deixe a
reacção desenvolver-se no escuro durante 30 ± 5 minutos à temperatura ambiente (+18-30 °C). Cubra a microplaca
com película ou tampa de microplaca. Não utilize vedante de placa adesivo durante esta incubação.
Pare a reacção enzimática acrescentando 100 µl de Solução de Paragem (R10) a cada poço, incluindo Branco. Utilize a
mesma sequência e razão de distribuição utilizada para a solução cromogénica.
Limpe cuidadosamente a parte inferior da placa. Leia a densidade óptica a 450/620 nm utilizando um leitor de placa num
espaço de 30 minutos após parar a reacção. Ajuste a absorvância zero do instrumento em relação ao Branco.
As tiras devem sempre ser mantidas afastadas da luz, antes da leitura.
Antes de comunicar os resultados, verifique o acordo entre a leitura e o plano de distribuição da placa e das amostras.
9)
CONTROLO DE QUALIDADE
7.
8.
9.
10.
11.
12.
13.
Todos os reagentes fabricados são preparados de acordo com o nosso Sistema de Qualidade, desde a recepção das matériasprimas até à comercialização do produto final. Cada lote de produto é sujeito a avaliações de controlo da qualidade, sendo
apenas comercializado quando estiver em conformidade com os critérios de aceitação pré-definidos. Os registos relativos à
produção e controlos de cada lote são mantidos em arquivo pela Bio-Rad.
10) INTERPRETAÇÃO DOS RESULTADOS
Nas secções seguintes, DO é a densidade óptica para cada Controlo, Calibrador e amostra obtida, à qual a absorvância de
Branco foi subtraída.
1. Cálculo do valor de Cut-Off (COV)
O COV é calculado da seguinte forma: DO média (R4)
O COV é utilizado para interpretação e cálculo da razão da amostra
A razão da amostra (R. da Amostra) é a DO do resultado da amostra (DO. A) comparada com o COV: R. da Amostra = DO A /
COV
2. Critérios de validação de teste
Razão e valores de densidade óptica:
0,100 ≤ DO R4 ≤ 0,600
DO R3 / COV < 0,600
DO R5 / COV >1,500
DO (R4 máx.) / DO (R4 mín.) < 2
Se os critérios de validação supracitados não forem cumpridos, o ciclo de teste deve ser repetido.
3. Interpretação dos resultados
A presença ou ausência de anticorpo IgG para Parvovírus B19 na amostra testada é determinada comparando a densidade
óptica da amostra com o valor de cut-off.
Razão da amostra
Resultado
R. da Amostra < 0,800
Negativo
0,800 ≤ R. da Amostra < 1,000
Equívoco
R. da Amostra ≥ 1,000
Positivo
Deve prestar muita atenção aos outros elementos de diagnóstico, em resultados muito próximos da zona cinzenta.
Em caso de resultados Equívocos, recomenda-se que volte a testar uma amostra recentemente recolhida 1 ou 2 semanas mais tarde.
Podem ser considerados outros sintomas clínicos e métodos.
Atenção: amostras com DO<0 devem ser consideradas como não interpretáveis e devem ser testadas novamente.
5
NOTA:
Recomenda-se que, simultaneamente, efectue ensaios de detecção de anticorpos IgG e IgM, para compreender melhor a fase da
infecção.
Supostamente, o paciente não está infectado com Parvovírus B19 humano, se os resultados de IgG e IgM são negativos.
Supostamente, o paciente foi infectado recentemente com Parvovírus B19 quando IgM é positivo, independentemente do
resultado de IgG.
Supostamente, o paciente já esteve anteriormente infectado com o Parvovírus B19, quando IgG é positivo e IgM é
negativo.
11) LIMITAÇÕES DO TESTE
O diagnóstico de Parvovírus B19 só pode ser estabelecido com base numa combinação de dados clínicos e biológicos.
1. A utilização de PLATELIA™ Parvovírus B19 IgG foi validada apenas em amostras de plasma e soro humano.
2. Uma amostra numa fase inicial da infecção poderá ser considerada negativa.
3. Não é possível determinar se uma infecção é recente ou não apenas numa amostra de sangue. Deve ser testado um par
de amostras.
4. O diagnóstico do Parvovírus B19 deve ser realizado com base na combinação do ensaio Platelia™ Parvovírus B19 IgG,
sintomas clínicos e resultados de outro ensaio de serologia, como Platelia™ Parvovírus B19 IgM.
5. Os desvios do procedimento poderão levar a resultados aberrantes
12) CARACTERÍSTICAS DE DESEMPENHO
1.
Precisão
Repetibilidade
Para avaliar a repetibilidade intra-ensaio, foram testadas uma amostra positiva, uma positiva fraca e uma negativa 32 vezes,
durante o mesmo ciclo. A razão da amostra foi calculada para cada amostra. Resultados: A Razão média, o Desvio padrão
(DP) e o Coeficiente da variação (%CV) para cada uma das 3 amostras são listadas na tabela abaixo:
N=32
Amostra negativa
Amostra positiva fraca
Amostra positiva
Média
0,187
1,841
3,890
DP
0,0100
0,0473
0,0762
%CV
5,3
2,6
2,0
Reprodutibilidade
Para avaliar a reprodutibilidade intra-ensaio, foram testadas em duplicado duas amostras positivas, duas positivas fracas e
duas negativas, em dois ciclos por dia, durante um período de 20 dias. A razão da amostra foi calculada para cada amostra. A
Razão média, o Desvio padrão (DP) e o Coeficiente da variação (%CV) para cada uma das 3 amostras são listadas na tabela
abaixo:
N=80
Amostra negativa
Amostra positiva fraca
Amostra positiva
Média
0,17
1,96
4,07
DP
0,0140
0,0600
0,1075
%CV
8,1
3,1
2,6
2. Especificidade e Sensibilidade Relativa
O Desempenho Relativo de Platelia™ Parvovírus B19 IgG foi avaliado num total de 166 amostras clínicas que foram, primeiro,
caracterizadas utilizando um ensaio IgG comercial.
Os resultados de cada estudo são ilustrados abaixo:
Ensaio Parvovírus B19 IgG EIA Comercial
Positivo
Equívoco
Negativo
Total
Positivo
95
3
9
107
Ensaio Platelia™
Equívoco
1
1
Parvovírus B19
Negativo
1
1
56
58
IgG
Total
96
4
66
166
Os resultados equívocos obtidos no ensaio IgG comercial foram excluídos do cálculo.
A concordância total do ensaio Platelia™ Parvovírus B19 IgG com o ensaio IgG EIA de referência é calculada como sendo de
93,2%.
Especificidade relativa
A especificidade relativa do ensaio Platelia™ Parvovírus B19 IgG foi determinada em comparação com os resultados negativos
obtidos no ensaio comercial utilizado como referência. Foi calculada como sendo 86,2% (75,3% - 93,5%).
6
Todos os resultados positivos obtidos com o ensaio Platelia™ Parvovírus IgG em amostras caracterizadas como negativas
foram testados com um método alternativo EIA Parvovírus IgG. Um foi confirmado como positivo e o outro foi determinado
como equívoco.
Sensibilidade relativa
A sensibilidade relativa do ensaio Platelia™ Parvovírus B19 IgG foi determinada em comparação com os resultados positivos
obtidos no ensaio comercial utilizado como referência. Foi calculada como sendo 99,0% (94,3% - 100,0%).
A única amostra caracterizada como positiva testada como negativa com o ensaio Platelia™ Parvovírus B19 IgG, foi testada
com um método alternativo EIA Parvovírus IgG e confirmada como negativa.
3. Reactividade cruzada
Realizar uma avaliação de possível reactividade cruzada num elemento patogénico que não o Parvovírus B19 implicaria ter
acesso a soros negativos para PVB19 IgG e positivos para o elemento patogénico X (ou possivelmente perfurado com o
elemento patogénico X). Devido à prevalência elevada de PVB19 IgG na população mundial (cerca de 50-70 %), a
probabilidade de encontrar amostras assim é baixa. Assim, não foi realizada qualquer avaliação de reactividade cruzada no
ensaio Platelia™ Parvovírus B19 IgG
4. Substância interferente
O citrato de sódio, o EDTA-2Na e as heparinas anticoagulantes não afectaram a reacção a concentrações até 3 mg/ml, 1
mg/ml e 20 IU/ml, respectivamente.
A hemoglobina e a bilirrubina não afectaram a reacção a concentrações até 500 mg/ml e 30 mg/ml, respectivamente.
O factor reumatóide não afectou a reacção a concentrações até 360 IU/ml.
13) BIBLIOGRAFIA
1.
2.
3.
4.
5.
6.
7.
8.
9.
Cossart, Y. E., Field, A. M., Cant, B. & Widdows, D. : Parvovirus-like particles in human sera. Lancet I : 72-73, 1975.
Pattison, J. R., Jones, S. E., Hodgson, J., Davis, L.R., White, J. M., Stroud, C. E. & Murtaza, L. : Parvovirus infection and
hypoplastic crisis in stckle cell anaemia. Lancet, I : 664, 1981
Maria Soderlund, Caroline S. Brown, Willy J. M. Spaan, Lea Hedman, and Klaus Hedman : Epitope Type-Specific IgG
Responses to Capsid Proteins VP1 and VP2 of Human Parvovirus B19
Allyson R. Butchko and Jeanne A. Jordan : Comparison of Three Commercially Available Serologic Assays Used To Detect
Human Parvovirus B19-Specific Immunoglobulin M(IgM) and IgG Antibodies in Sera of Pregnant Women
Elisabetta Manaresi, Giorgio Gallinella, et al. : Humoral Immune Response to Parvovirus B19 and Serological Diagnosis of
B19 Infection
Caroline S. Brown, Marcel M.M. Salimans, et al. : Antigenic parvovirus B19 coat proteins VP1 and VP2 produced in large
quantities in a baculovirus expression system
Marcel M.M. Salimans, Mario J.A.W.M. van Bussel, et al. : Recombinant parvovirus B19 capsids as a new substrate for
detection of B19-^specific IgG and IgM antibodies by an enzyme-linked immunosorbent assay
C.H. Woernle, L.J. Anderson, P. Tattersall, and J.M. Davison : Human Parvovirus B19 Infection During Pregnancy
Elisabetta Manaresi, Elisa Zuffi, Giorgio Gallinella, et al. : Differential IgM Response to Conformational and Linear Epitopes
of Parvovirus B19 VP1 and VP2 Structural Proteins
Bio-Rad
3, boulevard Raymond Poincaré
92430 Marnes-la-Coquette França
Tel. : +33 (0) 1 47 95 60 00
Fax : +33 (0) 1 47 41 91 33
www.bio-rad.com
11/2011
881080
7