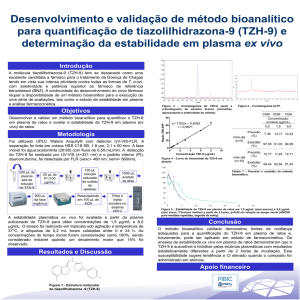
Bolsa de Integração
Integraç na Investigaçãoo (BII)
CEFT/BII/2009/01
Estudo da Camada de Plasma em
e
Microcanais
Cátia Marisa Lourenço Fidalgo
Engenharia Biomédica
Porto, Dezembro 2010
Estudo da Camada de Plasma em Microcanais
Bolsa de Integração na Investigação (BII)
CEFT/BII/2009/01
______________________________________________________________________
Estudo da Camada de Plasma em
e
Microcanais
______________________________________________________________________
Orientado por: Rui Lima
Co-Orientado por: Ricardo Dias
Realizado por: Cátia Marisa Lourenço Fidalgo
Com a colaboração de:
Cátia Fidalgo
2
Estudo da Camada de Plasma em Microcanais
Agradecimentos
À Fundação para a Ciência e Tecnologia pela bolsa concedida no âmbito da
Bolsa de Integração na Investigação CEFT/BII/2009/01.
Ao orientador, Professor Drº Rui Lima, por todo o apoio, orientação e dedicação
que me deu na realização deste projecto, fico-lhe muito agradecida.
Ao Drº Ricardo Dias, pelo incentivo, simpatia e atenção ao longo do projecto.
Cátia Fidalgo
3
Estudo da Camada de Plasma em Microcanais
Resumo
Tem havido um interesse crescente, por parte da comunidade científica na área
da Engenharia Biomédica, na concepção de microdispositivos como ferramentas
alternativas no diagnóstico de doenças cardiovasculares e cancerígenas. É, portanto,
importante compreender o comportamento do escoamento sanguíneo neste tipo de
microdispositivos, de forma a optimizar a concepção e utilização de biochips para
análises clínicas. Assim, neste projecto pretendeu-se estudar as principais variáveis que
influenciam a formação da camada de plasma em microcanais circulares de vidro e
polidimetilsiloxano (PDMS).
Após a obtenção de vários vídeos por intermédio de um sistema de
microvisualização confocal, o presente estudo concentrou-se essencialmente na
utilização de um método de análise de imagem para a medição da espessura da camada
de plasma em microcanais de vidro borosilicato com diâmetros de aproximadamente
100µm. Assim, com o auxílio do Image J (NIH) e do plugin MtrackJ foi possível
investigar a influência do hematócrito (Hct) no comportamento da camada de plasma
neste tipo microcanais.
Os resultados sugerem que a espessura da camada de plasma livre de células
sanguíneas tende a aumentar com a diminuição do Hct e com o aumento do diâmetro do
microcanal.
Cátia Fidalgo
4
Estudo da Camada de Plasma em Microcanais
Abstract
In recent years, there has been a growing interest by the biomedical community
to develop biochips as an alternative tool to diagnose both cardiovascular and cancer
diseases. It is therefore important to understand the behavior of the blood flow and this
type of microdevices in order to optimize the design and the use of biochips for clinical
analysis. Thus, in this project it is aimed to study the main variables that influence the
formation of the plasma layer in circular microchannels of borosilicate glass and
polydimethylsiloxane (PDMS).
After obtaining several videos through a confocal microvisualization system,
this study focused primarily on the use of a method of image analysis for measuring the
thickness of the plasma layer in a microchannel of borosilicate glass with diameters of
about 100 µm. With the help of the Image J (NIH) and the plugin MtrackJ it was
possible to investigate the influence of the hematocrit (Hct) on the behavior of the
plasma layer in such kind of microchannels.
The results suggest that the thickness of the blood-cell-free layer tends to
increase with the decrease of the Hct and with the increase of the diameter of the
microchannel.
Cátia Fidalgo
5
Estudo da Camada de Plasma em Microcanais
Índice
Resumo ............................................................................................................................. 4
Abstract ............................................................................................................................. 5
Índice de Figuras .............................................................................................................. 8
Índice de Tabelas ............................................................................................................ 10
Nomenclatura.................................................................................................................. 11
1.
Introdução ............................................................................................................ 12
2.
O Sangue ............................................................................................................. 14
2.1.
Constituição do Sangue ................................................................................... 14
2.1.1.
Glóbulos Vermelhos ................................................................................. 14
2.1.2.
Glóbulos Brancos ..................................................................................... 16
2.1.3.
Plaquetas sanguíneas ................................................................................ 17
2.1.4.
Plasma Sanguíneo ..................................................................................... 17
2.2.
Comportamento dos Fluidos ............................................................................ 19
2.3.
Viscosidade Sanguínea .................................................................................... 20
2.4.
Escoamento Sanguíneo .................................................................................... 22
2.5.
Velocidade do Sangue ..................................................................................... 24
3.
Microcanais e Fluidos Fisiológicos ..................................................................... 25
3.1.
Capilares de Vidro Borosilicato ....................................................................... 25
3.2.
Dextran 40 (Dx40) ........................................................................................... 26
3.3.
Etilenodiamino tetra-acético (EDTA) .............................................................. 26
3.4.
Soro Fisiológico ............................................................................................... 27
4.
Software para o Estudo da Camada de Plasma.................................................... 28
4.1.
Phantom ........................................................................................................... 28
4.2.
Image J ............................................................................................................. 28
4.2.1.
“Z-Project”................................................................................................ 29
4.2.2.
“MTrackJ” ................................................................................................ 30
4.2.3.
“Brightness/Contrast” ............................................................................... 31
4.2.4.
“Find Edges” ............................................................................................ 32
4.2.5.
“Binary” .................................................................................................... 33
Cátia Fidalgo
6
Estudo da Camada de Plasma em Microcanais
5.
Procedimento Experimental ................................................................................ 34
5.1.
Materiais e Métodos ......................................................................................... 34
5.1.1.
Microcanais e Fluidos Utilizados ............................................................. 34
5.2.
Aquisição de Imagens ...................................................................................... 35
5.3.
Image J ............................................................................................................. 36
5.3.1.
“Z-Project”................................................................................................ 37
5.3.2.
“MTrackJ” ................................................................................................ 38
5.4.
6.
Processamento em Excel ................................................................................. 41
Resultados Experimentais ................................................................................... 42
6.1.
Análise e processamento de imagem ............................................................... 43
6.2.
Resultados da Espessura da Camada de Plasma .............................................. 49
7.
Análise e Discussão dos Resultados .................................................................... 56
8.
Conclusões e Trabalho Futuro ............................................................................. 61
9.
8.1.
Conclusões ....................................................................................................... 61
8.2.
Trabalho Futuro ............................................................................................... 62
Referências Bibliográficas ................................................................................... 63
Anexos ............................................................................................................................ 66
Cátia Fidalgo
7
Estudo da Camada de Plasma em Microcanais
Índice de Figuras
Figura 2.1 Capilar sanguíneo ……………………………………………...………….14
Figura 2.2 Estrutura dos glóbulos vermelhos ……………………………...…………15
Figura 2.3 Técnica de obtenção do hematócrito ……………………………...……....16
Figura 2.4 Representação dos tipos de leucócitos ……………………………...…….17
Figura 2.5 Ilustração do plasma numa amostra sanguínea ………………………...…18
Figura 2.6 Variação da tensão de corte em relação ao gradiente de velocidade
………………………………………………………………………………..………...20
Figura 2.7 Variação da viscosidade com o hematócrito ……………………………...20
Figura 2.8 Efeito da viscosidade do sangue in vitro através de capilares de vidro ......21
Figura 2.9 Escoamento laminar e turbulento num tubo de vidro ……………………..23
Figura 3.1 Modelo do microcanal de vidro …………………………………….……..25
Figura 4.1 Esquematização do procedimento para o comando “Z-Project” ………….29
Figura 4.2 Imagem de um microcanal com 15% Hct ……………………………...…30
Figura4.3 (a) Imagem aplicando a intensidade máxima (15% Hct); (b) Imagem
aplicando a intensidade mínima (15% Hct) ……...…………………………………....30
Figura 4.4 Esquematização do “MTrackJ” ……………………….…………...…..….31
Figura 4.5 Esquematização do “Brightness/Contrast” ……………….…….……...….31
Figura 4.6 (a) Imagem original com 24% Hct; (b) Imagem aplicando o
“Brightness/Contrast” ………………………………………………………………....32
Figura 4.7 (a) Imagem depois de aplicada a intensidade máxima com 9% Hct; (b)
Imagem aplicando o “Find Edges” ……..……………………………………………..32
Figura 4.8 Esquematização do “Binary” ……………………………………………...33
Figura 5.1 Representação da preparação das amostras de sangue …………...……….35
Figura 5.2 Esquematização de todos os elementos usados na aquisição de imagem ...36
Figura 5.3 Procedimento para a análise de imagem: (a) Imagem original; (b) Imagem
resultante da intensidade máxima do “Z-Project”; (c) Imagem resultante da aplicação
do “Find Edges” e (d) Imagem com a análise do MTrack J. ………………………….38
Figura 5.4 Representação de uma análise por trajectória de um GV (neste caso na PB),
com 35% Hct …………...…………………………………………………………...…39
Figura 5.5 Imagem de 15% Hct com os pontos da análise ……...………………...….40
Cátia Fidalgo
8
Estudo da Camada de Plasma em Microcanais
Figura 6.1 Imagem melhorada com 35% de hematócrito …………………………….42
Figura 6.2 Imagem resultante do método da trajectória dos GVs (“Tracking”) ...……43
Figura 6.3 Imagem resultante do método do “Z-Project” …………………………….43
Figura 6.4 Imagem resultante do método das trajectórias dos GVs (“Tracking”) …....44
Figura 6.5 Imagem resultante do método do “Z-Project” …………………………….44
Figura 6.6 Imagem resultante do método da trajectória dos GVs (“Tracking”) ..…….45
Figura 6.7 Imagem resultante do método do “Z-Project” …………………………….45
Figura 6.8 Imagem resultante do método da trajectória dos GVs (“Tracking”) ...……46
Figura 6.9 Imagem resultante do método do “Z-Project” …………………………….46
Figura 6.10 Imagem resultante do método do “Z-Project” …………………………...47
Figura 6.11 Imagem resultante do método da trajectória dos GVs (“Tracking”) .……47
Figura 6.12 Imagem resultante do método do “Z-Project” …………………………...48
Figura 6.13 Imagem resultante do método do “Z-Project” …………………………...48
Figura 6.14 Representação gráfica da variação da ECP para 35% hematócrito ……...50
Figura 6.15 Representação gráfica da variação da ECP para 24% hematócrito …...…51
Figura 6.16 Representação gráfica da variação da ECP para 15% hematócrito ...……52
Figura 6.17 Representação gráfica da variação da ECP para 9% hematócrito …...…..53
Figura 6.18 Representação gráfica da variação da ECP para 2% hematócrito .……....54
Figura 7.1 Representação gráfica da variação da ECP para todos os hematócritos para
microcanais de vidro ………………………………………………………………......57
Figura 7.2 Representação gráfica da variação da ECP para todos os hematócritos para
microcanais de diâmetro 100µm (35%, 24%, 15% e 2%), 92µm (9%) e 75µm para o
caso dos microcanais em PDMS……………………………………………………….59
Figura 7.3 Representação gráfica da espessura da camada de plasma em função do
diâmetro do microvaso in vivo, adaptado de [31] ………………………………………60
Cátia Fidalgo
9
Estudo da Camada de Plasma em Microcanais
Índice de Tabelas
Tabela 6.1 Resultados da média da ECP para 35% Hct ……………………………...50
Tabela 6.2 Resultados da média da ECP para 24% Hct ……………………………...51
Tabela 6.3 Resultados da média da ECP para 15% Hct ……………………………...52
Tabela 6.4 Resultados da média da ECP para 9% Hct ……………………………….53
Tabela 6.5 Resultados da média da ECP para 2% Hct ……………………………….54
Tabela 7.1 Resultados da ECP em microcanais de PDMS …………………………...56
Cátia Fidalgo
10
Estudo da Camada de Plasma em Microcanais
Nomenclatura
GV- Glóbulo vermelho;
Hct – Hematócrito;
ECP – Espessura da Camada de Plasma;
PC – Parede de Cima;
PB – Parede de Baixo;
PDMS – Polidimetilsiloxano;
Dx40 – Dextran 40;
EDTA - Etilenodiamino tetra-acético;
Cátia Fidalgo
11
Estudo da Camada de Plasma em Microcanais
1. Introdução
Diversos estudos têm demonstrado a importância de estudar o escoamento
sanguíneo na microcirculação. Isto porque existem inúmeras doenças que afectam tanto
os vasos sanguíneos de pequeno calibre como o próprio sangue. Assim, torna-se muito
importante melhorar os nossos conhecimentos por forma a encontrar soluções para estes
problemas. Para tal, já se efectuaram estudos sobre os efeitos de várias doenças nas
propriedades do sangue na microcirculação, que podem afectar a viscosidade do plasma,
a concentração de glóbulos vermelhos (GVs), propriedades mecânicas dos eritrócitos,
viscosidade da membrana, entre outras.
Recentemente, tem havido também interesse por parte da comunidade científica na
área da Engenharia Biomédica, na concepção de microdispositivos como ferramentas
alternativas de análises clínicas. Assim, torna-se imperativo estudar o comportamento
do escoamento sanguíneo em microcanais in vitro, tais como microcanais de vidro em
borosilicato e PDMS, de forma a optimizar a concepção e utilização deste tipo de
microdispositivos em aplicações biomédicas.
O principal objectivo deste projecto consiste na determinação da espessura da
camada de plasma (ECP) em microcanais de vidro borosilicato para diferentes
hematócritos (Hcts). Os microcanais têm diâmetro de 100µm ±2 excepto o caso de 9%
hematócrito em que o microcanal tem apenas 92µm.
O escoamento sanguíneo tem vindo a ser estudado em microcanais de vidro ao
longo dos anos, devido às semelhanças com o escoamento in vivo, apresentando
fenómenos hemodinâmicos como por exemplo o efeito de Fahraeus-Lindqvist. Este
efeito está muito relacionado com o diâmetro do microcanal em análise, tendo grande
importância quando é realizado um estudo como a determinação da ECP em
microcanais de vidro.
Através de um sistema de microvisualização, Micro-PTV Confocal, foi possível,
numa primeira fase, obter as imagens do escoamento sanguíneo com diferentes
hematócritos. Estas imagens foram posteriormente analisadas usando o programa de
Cátia Fidalgo
12
Estudo da Camada de Plasma em Microcanais
análise de imagem Image J, com o qual foi possível determinar a ECP, sendo este o
principal objectivo deste trabalho.
Cátia Fidalgo
13
Estudo da Camada de Plasma em Microcanais
2. O Sangue
2.1. Constituição do Sangue
O sangue é uma substância líquida que circula nas artérias e veias do organismo.
Pode ser descrito como um fluido opaco, com viscosidade superior à água e heterogéneo
sendo constituído por um líquido claro – plasma – e uma série de componentes
elementares.
Num adulto saudável com cerca de 70Kg de peso, o volume de sangue corresponde
a aproximadamente 7% do peso do corpo, a que correspondem cerca de 5 litros, dos
quais quase 60% é plasma.
Na Figura seguinte (2.1), é possível observar um vaso sanguíneo em corte, onde se
podem visualizar vários elementos (glóbulos vermelhos e brancos e plaquetas)
suspensos no plasma sanguíneo [10].
Figura 2.1 Capilar sanguíneo. [11]
2.1.1. Glóbulos Vermelhos
Os glóbulos vermelhos são unidades morfológicas da parte vermelha do sangue,
também são conhecidos por eritrócitos ou hemácias. São cerca de 700 vezes mais
numerosos que os leucócitos (glóbulos brancos) e 17 vezes mais que as plaquetas. Em
condições normais existem no sangue aproximadamente 4.5 a 6.5x106/mm3, variando
Cátia Fidalgo
14
Estudo da Camada de Plasma em Microcanais
do sexo masculino (5.2 milhões de eritrócitos/mm3) para o sexo feminino (4.5 milhões
de eritrócitos/mm3).
São constituídos basicamente por globulina e hemoglobina, esta última
composta por 4 moléculas proteicas de estrutura terciária e 4 grupos heme que contêm
ferro. A sua principal função é transportar o oxigénio (maior quantidade) e o dióxido de
carbono (menor quantidade) para os tecidos; têm um período de vida de
aproximadamente 120 dias [1], [12].
Figura 2.2 Estrutura dos glóbulos vermelhos. [13]
Os eritrócitos não se movem activamente, são movidos através da circulação
pelas forças responsáveis pela circulação sanguínea. Apresentam a forma de disco
bicôncavo, com cerca de 7.5 µm (micrómetros) de diâmetro com as extremidades mais
espessas que o centro da célula (Figura 2.2). De modo a tornar mais fácil o seu
movimento pelos pequenos vasos sanguíneos, os eritrócitos dobram-se pelo centro.
2.1.1.1.
Hematócrito (Htc)
O hematócrito é a percentagem ocupada pelos glóbulos vermelhos no volume
total de sangue. Antigamente era usado o método do microhematócrito onde a
percentagem de eritrócitos era obtida pela centrifugação a 10000 r.p.m. durante 5
minutos do sangue dentro de um tubo capilar.
Actualmente é obtido recorrendo a aparelhos automatizados. Esta metodologia
automatizada não mede directamente o hematócrito, mede o volume dos eritrócitos ou o
tamanho médio dos eritrócitos (VCM) e quantifica o número de eritrócitos no sangue
(Figura 2.3), sendo calculado da seguinte forma:
Cátia Fidalgo
15
Estudo da Camada de Plasma em Microcanais
ú
á
10
Os valores médios diferem segundo o sexo e a idade, podendo variar 36%-52%,
sendo nos homens 42%-52% e nas mulheres 36%-48%. Esta é uma medida cada vez
mais importante para efeitos clínicos. Caso o valor seja inferior à média significa que
existe pouca quantidade de eritrócitos, o que pode levar a hemorragias, anemias e
leucemias. Caso o valor seja superior à média existem muitos eritrócitos em relação ao
volume de sangue, podendo ocorrer doença pulmonar obstrutiva crónica (DPOC) [14].
Figura 2.3 Técnica de obtenção do hematócrito. [15]
2.1.2. Glóbulos Brancos
Os glóbulos brancos ou leucócitos são células produzidas na medula óssea, que
estão presentes no sangue, linfa, órgãos linfóides e vários tecidos conjuntivos. Têm a
função de combater os microrganismos que causam doenças fazendo a sua captura ou
usando anticorpos. Existem três tipos de leucócitos: os granulados (50 a 60%), os
agranulados ou linfáticos (30 a 40%) e os monócitos (até 7%) (Figura 2.4).
Os leucócitos são capazes de realizar a diapdese (migrar para fora dos vasos
capilares) e também a fagocitose que é a captura de organismos estranhos por projecção
das suas extremidades (pseudópodes).
Um adulto normal possui entre 3.800 e 9.800 mil leucócitos/mm3 de sangue e
pode produzir aproximadamente 100 milhões de leucócitos por dia. Uma quantidade
muito pequena de leucócitos (leucopenia) ou muito grande de leucócitos (leucocitose)
Cátia Fidalgo
16
Estudo da Camada de Plasma em Microcanais
indica um distúrbio. No caso da leucopenia, o indivíduo fica susceptível a infecções, no
caso da leucocitose pode ser uma resposta a infecções ou a substâncias estranhas [16].
Figura 2.4 Representação dos tipos de leucócitos. [17]
2.1.3. Plaquetas sanguíneas
A plaqueta sanguínea ou trombócito é um fragmento de célula presente no
sangue que é formado na medula óssea. A sua principal função é a formação de
coágulos, tendo um papel muito importante na coagulação sanguínea. As plaquetas
estão em circulação no sangue durante cerca de 5 dias sendo depois destruídas no baço.
Um indivíduo normal tem entre 150.000 e 400.000 plaquetas/mm3 de sangue. A
sua diminuição (trombocitopenia) ou disfunção pode levar a sangramentos e o seu
aumento (trombocitose) eleva o risco de trombose [18].
2.1.4. Plasma Sanguíneo
Todos os fluidos fora do compartimento celular constituem o fluído extracelular,
do qual 14 ou cerca de 3 litros (considerando um adulto com cerca de 70Kg) está no
interior de vasos sanguíneos constituindo o plasma, a porção líquida ou não celular do
sangue.
O plasma é um líquido (92% água) amarelado e claro no qual as células
sanguíneas estão suspensas; é o maior componente único do sangue, correspondendo a
Cátia Fidalgo
17
Estudo da Camada de Plasma em Microcanais
55% do volume total do sangue, como se pode observar na Figura 2.5. Contém
inúmeras substâncias em solução ou suspensão, substâncias de pequeno e elevado peso
molecular, correspondendo a 10% do volume de plasma. Destas substâncias, as
proteínas plasmáticas correspondem a 7%, os sais inorgânicos são cerca de 0,9% e o
restante são compostos orgânicos diversos: aminoácidos, glicose, vitaminas, mediadores
químicos, entre outros.
A concentração total de proteína plasmática é aproximadamente 7.0-7.5g/dl
incluindo não só proteínas simples mas também conjugadas: lipoproteínas e
glicoproteínas. É possível separar as proteínas plasmáticas em três grupos: as
albuminas, as globulinas e o fibrinogénio (proteínas da coagulação) [10].
Figura 2.5 Ilustração do plasma numa amostra sanguínea. [20]
A principal função do plasma é transportar as proteínas e as substâncias
dissolvidas, como nutrientes, medicamentos, produtos tóxicos (por exemplo o dióxido
de carbono que as células eliminam) e também transporta para todo o corpo os
medicamentos ingeridos.
O plasma permite uma troca livre dos seus componentes com o líquido
intersticial, através dos poros existentes na membrana capilar. As proteínas plasmáticas
em condições normais, não atravessam a membrana devido às suas grandes dimensões,
permanecendo assim no plasma. O mesmo não acontece com a água e outras
substâncias dissolvidas, que atravessam a membrana facilmente.
A saída de água do plasma através dos capilares é controlada pela pressão
coleidosmótica e pelo estado da permeabilidade das membranas, ou seja, as proteínas
extraem água dos tecidos para os capilares mas dificultam a sua saída dos capilares para
Cátia Fidalgo
18
Estudo da Camada de Plasma em Microcanais
os tecidos. O principal responsável pela manutenção da pressão coleidosmótica no
plasma é a albumina.
Um método simples de separar as células do sangue do plasma é através de
centrifugação, sendo mais específico a plasmaferese que separa o plasma das hemácias.
Se ao plasma sanguíneo forem retirados os factores de coagulação naturalmente
(como a fibrina), este fica com o nome de soro sanguíneo. Este soro é obtido através da
coagulação do sangue total pois os factores de coagulação foram consumidos pela
coagulação das hemácias.
O plasma não é um meio de armazenamento e transporte para os factores de
coagulação, as proteínas envolventes são necessárias para manter a pressão oncótica do
sangue [19].
2.2. Comportamento dos Fluidos
Os fluidos podem ter dois comportamentos distintos: pode ser newtoniano ou nãonewtoniano, como pode ser observado na Figura 2.6.
Um fluido newtoniano é um fluido em que a tensão de corte aumenta
proporcionalmente com a taxa de deformação. Apresentam a mesma viscosidade em
qualquer velocidade do escoamento. Como exemplos temos a água, gases, plasma e
líquidos com uma forma química simples, em condições normais.
Um fluido não-newtoniano é aquele em que a viscosidade varia de acordo com o
grau de deformação aplicado, e sendo assim, não tem viscosidade bem definida. Alguns
exemplos são suspensões coloidais, emulsões e géis, o sangue é também um exemplo de
um fluido não-newtoniano, pois não apresenta um comportamento linear [28],[29].
Cátia Fidalgo
19
Estudo da Camada de Plasma em Microcanais
Figura 2.6 Variação da tensão de corte em relação ao gradiente de velocidade. [29]
2.3. Viscosidade Sanguínea
A viscosidade do sangue depende directamente da quantidade de sangue composta
por hematócrito. Quanto maior
maior o hematócrito, maior é o atrito entre as camadas de
sangue, então a viscosidade aumenta significativamente com o aumento do hematócrito.
É possível observar esta relação no gráfico seguinte (Figura 2.7).
Figura 2.7 Variação da viscosidade com o hematócrito. [22]
Cátia Fidalgo
20
Estudo da Camada de Plasma em Microcanais
Como a resistência no sistema circulatório é maior nos vasos de pequeno calibre
(capilares), é importante estudar o comportamento da viscosidade nestes vasos. Além do
hematócrito e das proteínas plasmáticas, existem outros factores que afectam a
viscosidade sanguínea.
Um dos factores é o comportamento da viscosidade nos pequenos vasos em relação
aos grandes vasos; nos pequenos vasos, a viscosidade tem muito menos efeitos. Este
efeito denomina-se efeito de Fahraeus-Lindqvist, que começa a notar-se quando o
diâmetro do vaso é menor que 1.5mm, aproximadamente. Nos capilares, este efeito é
muito acentuado, pois, teoricamente, a viscosidade nos pequenos vasos deveria ser
metade da observada nos grandes vasos, o que não se verifica, como se pode observar
na Figura 2.8.
Figura 2.8 Efeito da viscosidade do sangue in vitro através de capilares de vidro. [23]
O efeito Fahraeus-Lindqvist pode ser causado pelo alinhamento das hemácias
quando atravessam os vasos. As hemácias alinham-se no centro do vaso e o plasma
junto às paredes dos vasos, eliminando-se assim a resistência viscosa característica do
sangue.
Por outro lado, este efeito é compensado pela velocidade do fluxo e pelo
acoplamento de células. A viscosidade sanguínea aumenta significativamente quando há
uma queda na velocidade do fluxo. Assim, como a velocidade do fluxo nos pequenos
vasos é muito baixa, por vezes menor que 1mm/s., a viscosidade pode aumentar até 10
Cátia Fidalgo
21
Estudo da Camada de Plasma em Microcanais
vezes mais por este motivo. Este efeito pode ser causado pela aderência das hemácias
entre si e às paredes dos vasos [22],[23].
2.4. Escoamento Sanguíneo
O escoamento sanguíneo varia bastante nos diferentes tecidos. Alguns tecidos
necessitam de um escoamento bastante maior do que outros. Os tecidos esqueléticos
apresentam grandes variações no escoamento sanguíneo em diferentes situações.
Durante o repouso, o escoamento é relativamente pequeno, mas aumenta
significativamente durante o trabalho, quando existe um acréscimo não só do consumo
de oxigénio e nutrientes como também da produção de dióxido de carbono.
Através de uma vasoconstrição ou de uma vasodilatação, a cada momento, o
escoamento sanguíneo pode aumentar ou diminuir, devido a uma maior ou menor
resistência proporcionada ao mesmo [1].
O escoamento do sangue nos vasos sanguíneos tem de obedecer aos princípios
físicos do escoamento no interior de condutas, ou seja, da conservação da massa,
energia e quantidade de movimento. As forças que provocam o movimento (circulação
do sangue) são as forças da gravidade e as forças devidas aos gradientes de pressão. A
pressão nos vasos sanguíneos varia de ponto para ponto. É essa variação da pressão com
a distância que provoca o movimento do sangue. As forças que, pelo contrário, se
opõem à circulação do sangue são as forças de corte (tangencial) e as devidas à
turbulência do escoamento [24].
Existem dois tipos principais de escoamento: o escoamento turbulento e o
escoamento laminar, como se pode verificar na Figura 2.9
Cátia Fidalgo
22
Estudo da Camada de Plasma em Microcanais
Figura 2.9 Escoamento laminar e turbulento num tubo de vidro. [25]
O escoamento laminar é aquele no qual o fluido se move em camadas, ou lâminas,
uma camada deslizando sobre a adjacente e havendo apenas troca de quantidade de
movimento molecular. A viscosidade tende a moderar o aparecimento de instabilidade
ou turbulência. Para o escoamento laminar o número de Reynolds tem um valor inferior
a 2300 em condutas rectilíneas circulares.
No escoamento turbulento, as partículas apresentam um movimento irregular por
isso a velocidade apresenta componentes transversais ao movimento geral do conjunto
do fluido. Tem algumas características especiais, tais como elevado número de
Reynolds (superior a 2300), flutuações tridimensionais e dissipação de energia. [25]
Pode-se analisar se um escoamento é laminar ou turbulento através da sua posição
relativa numa escala de turbulência em que se indica o número de Reynolds (Re). O
número de Reynolds é a relação entre as forças de inércia e forças viscosas µ :
∑
∑ ; também pode ser calculado para condutas circulares de diâmetro D: µ
ρ !
µ
! [24], [25]
"
.
A resistência ao escoamento no interior de um tubo é significativamente inferior no
caso de escoamentos laminares quando comparados com os turbulentos. O escoamento
do sangue é em muitos locais turbulento, sendo laminar nos vasos sanguíneos pequenos,
o que dificulta o estudo do seu escoamento, uma vez que escoamentos laminares são
mais fáceis de entender e a sua teoria está bem desenvolvida, ou contrário dos
turbulentos que são mais difíceis de estudar, sem suporte teórico suficiente.
O sangue nos microcanais em estudo, comporta-se como um escoamento laminar,
apresentam um valor de Re de aproximadamente 0.005.
Cátia Fidalgo
23
Estudo da Camada de Plasma em Microcanais
A resistência ao escoamento pode depender de factores como o comprimento do
vaso, o diâmetro do vaso e a viscosidade do sangue [1].
2.5. Velocidade do Sangue
A velocidade do sangue nos vasos depende do diâmetro do vaso e da sua
proximidade ao ventrículo esquerdo. Quanto mais próximo do ventrículo, maior será a
velocidade do sangue. Por outro lado, quando o sangue flui numa velocidade contínua,
através de um vaso liso e longo, a velocidade de escoamento no centro do vaso é maior
do que próximo às paredes [26],{27].
Um exemplo para o cálculo da velocidade no sangue no sistema circulatório seria: a
área de secção de recta da artéria aorta é de aproximadamente 2,5 cm2. Já a área de
secção de recta de todos os capilares existentes no nosso corpo (somados) seria de,
aproximadamente, 1000 vezes maior do que a da aorta (2,5 cm2 x 1.000 = 2500 cm2 =
25 m2). A velocidade do sangue na artéria aorta é de, aproximadamente, 30 cm/segundo.
Sendo assim, a velocidade do sangue num capilar seria de, aproximadamente, 1.000
vezes menor, ou seja, 30 cm/seg / 1.000 = 0,3 mm/seg. [27].
Cátia Fidalgo
24
Estudo da Camada de Plasma em Microcanais
3. Microcanais e Fluidos Fisiológicos
3.1. Capilares de Vidro Borosilicato
O vidro borosilicato é um tipo de vidro resistente ao calor e aos químicos, sendo
fabricado pela adição de boro aos componentes tradicionais do vidro. O seu baixo
coeficiente de dilatação permite que instrumentos de vidro possam manter a precisão
das suas medidas mesmo quando sujeito ao calor. Este tipo de vidro é resistente ao
calor, o que o torna útil em material de laboratório em que tenha que suportar
temperaturas elevadas.
Além de laboratórios, também pode ser usado em indústrias químicas,
equipamento de cozinha, iluminação, telescópios e armazenamento de resíduos
nucleares.
Os capilares de vidro borosilicato usados neste projecto têm 100µm ±2 com a
excepção de um deles que tinha apenas 92µm, usado para o estudo do hematócrito 9%,
este diâmetro diferente talvez seja erro da empresa. Estes capilares foram fabricados
pela Vitrocom (Mountain Lakes, NJ, EUA), que foram montados sobre uma lâmina de
vidro imersa em glicerina que tem o mesmo índice de refracção, como pode ser
observado na Figura 3.1 [3].
O fluxo laminar através de tais microcanais gera um fluxo meramente axial, que
é semelhante ao comportamento do fluxo através dos capilares [21].
Figura 3.1 Modelo do microcanal de vidro. [21]
Cátia Fidalgo
25
Estudo da Camada de Plasma em Microcanais
3.2. Dextran 40 (Dx40)
O Dextran 40 é um polissacarídeo modificado, solúvel em água, composto por
resíduos de D-glucose e apresenta ligações glicosídicas. É muito usado medicinalmente
como um antitrombótico (anti-plaquetário), reduzindo a viscosidade do sangue e tem
vindo a ter bastantes aplicações na área farmacêutica e biomédica.
O dextran aumenta a electronegatividade das hemácias, plaquetas e do endotélio
vascularizado, reduzindo assim a agregação das plaquetas e dos eritrócitos.
As grandes vantagens da utilização deste composto são que é biodegradável em
humanos, não é tóxico e não provoca reacções no organismo. Por outro lado, existem
poucos efeitos colaterais mas que podem ser graves [1],[2].
3.3. Etilenodiamino tetra-acético (EDTA)
O ácido etilenodiamino tetra-acético (EDTA) é um composto orgânico que actua
como agente quelante, e forma complexos muito estáveis com vários iões metálicos. Os
iões podem ser o magnésio, cálcio (para valores de pH superiores a 7), o manganês,
ferro (II e III), zinco, cobalto e cobre (II), chumbo e níquel (para valores de pH
inferiores a 7). O EDTA é um ácido que actua como um ligante hexadentado.
Como apresenta afinidade com o cálcio este ácido é usado como anticoagulante,
sendo também utilizado como descolorante para cabelos, fabricação de pão e outros
derivados da indústria alimentar [6].
Cátia Fidalgo
26
Estudo da Camada de Plasma em Microcanais
3.4. Soro Fisiológico
O soro fisiológico é uma solução de água destilada e cloreto de sódio (NaCl) sendo
isotónica em relação aos líquidos corporais. Contém 0,9% (em massa) de NaCl em água
destilada, ou seja, cada 100mL da solução aquosa contém 0,9 gramas de sal. A presença
do sal faz com que a solução apresente, normalmente, um pH=7.
Devido às suas características, é muito usado em variadas situações. Em medicina,
pode ser usado em pessoas que apresentam sintomas diversos como gripes, respostas
alérgicas, limpeza de ferimentos (cortes e queimaduras) e desidratação (meio
intravenoso). Em laboratórios é utilizado como meio de soluções para observação ao
microscópio. Pode ainda ser usado para a limpeza de lentes de contacto [7],[8].
Neste projecto o soro fisiológico foi utilizado para lavagem de células
sanguíneas durante a centrifugação.
Cátia Fidalgo
27
Estudo da Camada de Plasma em Microcanais
4. Software para o Estudo da Camada de Plasma
4.1. Phantom
O progama Phantom faz parte de uma classe de alta velocidade de câmaras digitais
que começou no início de 1990.
O projecto original (patenteado pela Vision Research), inclui num mesmo programa
um sistema completo que inclui um sensor CMOS, um processador e um sistema
operacional interno com memória suficiente para armazenar a enorme quantidade de
informação capturada pelo sensor, um sistema de interface poderosa que permite
downloads e streaming de dados, sinalização de vídeo e controlo do software da câmara,
além da possibilidade de várias redes câmaras sincronizadas. [5]
Com este programa foi possível obter e converter os vídeos numa sequência de
imagens para posterior análise.
4.2. Image J
O Image J é um programa de processamento de imagem desenvolvido no National
Institutes of Health.
Image J permite exibir, editar, analisar, processar, guardar e imprimir de imagens de
8 bits, 16 bits e 32 bits. Este programa possibilita a leitura de variados formatos de
imagem, tais como: TIFF, PNG, JPEG, BMP, DICOM, FITS e também formatos RAW.
Suporta imagens em série, que são partilhadas numa única janela. Permite ainda o
cálculo de ângulos e distâncias, assim como a realização de histogramas de densidade.
Suporta funções de processamento de imagem padrão, tais como operações
aritméticas e lógicas entre imagens, manipulação de contraste, convolução, análise de
Fourier, nitidez, suavização, detecção de bordas e filtragem mediana. Faz
Cátia Fidalgo
28
Estudo da Camada de Plasma em Microcanais
transformações geométricas como escala, rotação e saltos. O programa suporta qualquer
número de imagens simultaneamente, limitado apenas pela memória disponível. [4]
4.2.1. “Z-Project”
O “Z-Project” é um dos subprogramas usados para efectuar a análise da camada de
plasma. É obtido através dos comandos “Image” – “Stacks” – “Z-Project” (Figura 4.1).
Figura 4.1 Esquematização do procedimento para o comando “Z-Project”.
O “Z-Project” projecta a imagem ao longo de um eixo perpendicular ao plano da
imagem (eixo do z). Existem 5 tipos de projecções: a intensidade média, intensidade
máxima, intensidade mínima, soma e desvio-padrão.
A intensidade média (Average Intensity) caracteriza-se por armazenar a média
da intensidade de todos os pixels de uma imagem. A intensidade máxima (Max
Intensity), permite projectar uma imagem de saída, cujos valores de máxima intensidade
dos pixels são demonstrados. A intensidade mínima (Min Intensity) dá-nos o valor
máximo possível do padrão de intensidade dos brilhos da fonte. A soma (Sum slices),
cria uma imagem real, resultante da soma de todos os pixels de imagem original. O
desvio padrão (Standard Deviation) representa a raiz quadrada da variância e informa
sobre a maior ou menor homogeneidade, ou heterogeneidade, de uma imagem digital.
Cátia Fidalgo
29
Estudo da Camada de Plasma em Microcanais
Deste subprograma foram usadas apenas dois tipos de projecções (intensidade
mínima e máxima) como se pode visualizar nas Figuras seguintes (4.2 e 4.3):
Figura 4.2 Imagem de um microcanal com 15% Hct.
(a)
(b)
Figura4.3 (a) Imagem aplicando a intensidade máxima (15% Hct); (b) Imagem aplicando a intensidade mínima (15%
Hct).
4.2.2. “MTrackJ”
O “MTrackJ” permite seguir os GV e determinar a espessura da camada de plasma
(ECP), efectuando a marcação manual, para posterior análise. Pode ser usado para
seguir a trajectória de um GV através de um filme, resultando uma sequência de valores,
ou mesmo ser utilizado numa imagem para marcar a zona da ECP.
Na Figura 4.4 pode-se ver a esquematização do “MTrackJ”.
Cátia Fidalgo
30
Estudo da Camada de Plasma em Microcanais
Figura 4.4 Esquematização do “MTrackJ”.
4.2.3. “Brightness/Contrast”
Este comando é obtido no ImageJ através dos comandos “Image” – “Adjust” “Brightness/Contrast”, como é possível observar na Figura 4.5:
Figura 4.5 Esquematização do “Brightness/Contrast”.
Cátia Fidalgo
31
Estudo da Camada de Plasma em Microcanais
Este comando permite fazer uma pré-análise das imagens obtidas, ou seja, ajustar o
contraste (contrast), a luminosidade (brightness), o mínimo (minimum) e o máximo
(maximum). Assim, torna-se mais fácil analisar as imagens pois melhora
significativamente a visualização da ECP, como se pode verificar na Figura 4.6.
(a)
(b)
Figura 4.6 (a) Imagem original com 24% Hct; (b) Imagem aplicando o “Brightness/Contrast”.
4.2.4. “Find Edges”
Este comando também foi muito útil para determinar a camada de plasma. É obtido
no Image J através os comandos “Process” – “Find Edges”. Permite encontrar os limites
que temos na imagem a analisar, como se pode verificar na Figura 4.7, muitas vezes é
efectuado um pré-processamento da mesma imagem.
(a)
(b)
Figura 4.7 (a) Imagem depois de aplicada a intensidade máxima com 9% Hct; (b) Imagem após a aplicação do “Find
Edges”.
Cátia Fidalgo
32
Estudo da Camada de Plasma em Microcanais
4.2.5. “Binary”
Este é outro comando do ImageJ, que permite fazer o binário de uma imagem,
ficando apenas a preto e branco. Em algumas análises melhora os resultados, devido ao
contraste da imagem. É obtido através dos comandos “Process” – “Binary” – “Make
Binary” (Figura 4.8).
Figura 4.8 Esquematização do “Binary”.
Incluído neste subprograma está também o comando “Erode”, com o qual se pode
fazer, como indica o próprio nome, uma erosão da imagem obtida. Os resultados
obtidos podem ser melhores ou não, dependendo da imagem que estamos a analisar e do
processamento efectuado.
Cátia Fidalgo
33
Estudo da Camada de Plasma em Microcanais
5. Procedimento Experimental
5.1. Materiais e Métodos
5.1.1. Microcanais e Fluidos Utilizados
O fluido utilizado - o sangue - foi obtido a partir de um adulto saudável, sendo
adicionado ácido atilenodiamino tetra-acético (EDTA) para impedir a coagulação. Os
eritrócitos foram separados por centrifugação e de seguida foi feita uma aspiração dos
restantes componentes sanguíneos, sendo lavados duas vezes com soro fisiológico.
Posteriormente, os eritrócitos foram marcados com um marcador de fluorescência
celular (CM-Dill, c-7000, Molecular Probles) e diluídos com Dextran40 (Dx40) para
obter a concentração volúmica necessária aos eritrócitos.
Todas as amostras de sangue foram armazenadas hermeticamente a 4ºC até serem
realizados as experiências a uma temperatura controlada de 37ºC. Assim foram obtidos
cinco fluidos contendo Dx40: um fluido com 35% de hematócrito (35% Hct), 24% Hct,
15% Hct, 9% Hct e 2% Hct (Figura 5.1).
Os microcanais usados neste projecto são microcanais de vidro borosilicato, com
um diâmetro de 100µm ±2, com excepção de um que tem um diâmetro de 92µm para o
caso do hematócrito 9%.
Cátia Fidalgo
34
Estudo da Camada de Plasma em Microcanais
Figura 5.1 Representação da preparação das amostras de sangue [23].
5.2. Aquisição de Imagens
Numa primeira parte experimental, (Figura 5.2) foi usado um sistema denominado
“Micro-PTV Confocal”, que é constituído por um microscópio invertido (IX71,
Olympus, Japão) combinado com uma unidade confocal (CSU22, Yokogawa) e um
laser DPSS (Laser Quantum Ltd) com um comprimento de onda de 532nm. Para a
aquisição de imagens, foi utilizada uma câmara de alta velocidade (Phantom v7.1) que
está ligada à unidade confocal CSU22.
O microcanal obtido anteriormente foi colocado no microscópio invertido onde o
caudal do fluido foi mantido constante com o valor de Re de aproximadamente 0.005
usando uma bomba de seringa (KD Scientific Inc, USA). Para verificar a temperatura
foi usado um sistema controlador de temperatura (Tokai Hit) sendo colocado a 37ºC.
Assim, já é possível fazer a obtenção de imagens. Todas as imagens adquiridas por
este sistema confocal foram captadas no centro dos microcanais com uma resolução de
640x480 pixels, usando uma taxa de 100 imagens/segundo e um tempo de exposição de
9.4ms.
Por fim, estas imagens são transferidas para o computador e no programa Phantom
vão ser convertidas de vídeos para uma sequência de imagens. Esta sequência obtida
pode ser então processada no Image J (NIH)
Cátia Fidalgo
[31]
, utilizando também os outros
35
Estudo da Camada de Plasma em Microcanais
subprogramas, entre eles o “MTrackJ”
[32]
. É possível agora determinar a espessura da
camada do plasma no microcanal em análise.
Figura 5.2 Esquematização de todos os elementos usados na aquisição de imagem.[21]
5.3. Image J
Para as imagens poderem ser analisadas neste programa, primeiro têm que ser
importadas, usando os comandos File – Import – Image Sequence, seleccionando a
primeira imagem da sequência e num aviso seleccionar a opção para “8-bit
Grayscale”. Assim as imagens estão prontas a serem analisadas.
Numa primeira parte é efectuado um pré-processamento das imagens usando o
comando “Brightness/Contrast”, para tornar mais fácil a sua análise.
Cátia Fidalgo
36
Estudo da Camada de Plasma em Microcanais
5.3.1. “Z-Project”
Neste subprograma, foram usados os parâmetros de intensidade máxima e
mínima que projectam a imagem num eixo perpendicular ao plano de imagem (eixo
“z”) com o propósito de obter uma distribuição estatística das células ao longo do
microcanal. Em função do hematócrito e da qualidade das imagens, foram usados os
dois parâmetros, sendo de seguida feito outro ajuste de brilho e contraste.
Com o método do “Find Edges”, foram obtidos os contornos da imagem que
possibilitam uma melhor análise da espessura da camada de plasma.
Uma outra forma de efectuar a análise depois de aplicar a intensidade máxima
ou mínima é pelo método “Erode”, que elimina grande parte do ruído existente na
imagem. De seguida, em cada imagem obtida, quer do “Find Edges” quer do “Erode”,
foi medida manualmente a espessura da camada de plasma (ECP) usando o plugin
“MTrackJ”. As medições efectuadas foram obtidas por localização visual do limite da
camada de plasma, tendo um ponto de referência na parede do microcanal para se poder
obter valores de forma a determinar a ECP. Este procedimento pode ser observado na
Figura 5.3.
Cátia Fidalgo
37
Estudo da Camada de Plasma em Microcanais
(a)
(b)
(c)
(d)
Figura 5.3 Procedimento para a análise de imagem: (a) Imagem original; (b) Imagem resultante da intensidade
máxima do “Z-Project”; (c) Imagem resultante da aplicação do “Find Edges” e (d) Imagem com a análise do
MTrack J.
5.3.2. “MTrackJ”
Esta ferramenta foi das mais usadas neste projecto. Numa primeira parte, antes
de analisar qualquer imagem, é muito importante fazer a calibração da mesma. Para tal,
coloca-se uma linha desde a parede de cima (PC) até à parede de baixo (PB) do
microcanal e usando o Set Scale é possível inserir o valor de referência (100 ±2µm) e a
unidade de medida a usar, que neste caso é pixels/µm. Considerou-se que 1 pixel ≅ 0.56
µm.
Cátia Fidalgo
38
Estudo da Camada de Plasma em Microcanais
5.3.2.1.
O método das trajectórias dos GVs (“Tracking”)
O “MTrackJ” permite obter a trajectória dos glóbulos vermelhos (GVs)
“labeled” (células marcadas com corante fluorescente - corados) através de uma
sequência de imagens quando estes estão envolvidos na vizinhança da camada de
plasma, sendo possível adquirir valores viáveis da ECP.
Assim, neste caso, é usado o comando “Add tracks” para colocar um primeiro
ponto de referência na PC e sendo os seguintes pontos colocados de forma a seguir a
trajectória do GV ao longo do microcanal. Este processo é igualmente repetido para a
PB. Com os valores resultantes, é feita uma média dos valores que permite determinar a
ECP.
Como nas imagens obtidas nem sempre se tem uma boa visualização dos GVs
envolvidos na camada de plasma, este processo não foi realizado para todas elas, sendo
apenas efectuado para aquelas que se tem uma boa iluminação dos GVs, como se pode
verificar na Figura 5.4.
Figura 5.4 Representação de uma análise por trajectória de um GV (neste caso na PB), com 35% Hct.
Cátia Fidalgo
39
Estudo da Camada de Plasma em Microcanais
5.3.2.2.
O método “Z-Project”
Nas imagens pré-processadas do “Z-Project”, foi efectuada da mesma forma a
calibração. De seguida, com o comando “Add tracks” é colocado o primeiro ponto
(ponto de referência) na PC do microcanal. Neste caso, vão ser distribuídos 25 pontos,
pois este é o valor que é estatisticamente correcto para uma avaliação deste tipo.
Sendo assim, o 1º ponto é o ponto de referência da PC, e são colocados ao longo
da PC 14 pontos; na PB o 16º ponto é o ponto de referência e os restantes são
distribuídos na PB, como se pode visualizar na Figura 5.5.
Figura 5.5 Imagem de 15% Hct com os pontos da análise.
Os valores dos pontos são obtidos recorrendo ao Measure Tracks, que depois de
guardados em formato ‘.txt’, podem transferidos para o Excel de modo a proceder à sua
análise. Para guardar a imagem final com os pontos respectivos foi usado o comando
Make movie, que permite guardar a imagem em formato TIFF, GIF, JPEG, entre outros;
este último procedimento foi igualmente efectuado para o caso da trajectória dos GVs.
Cátia Fidalgo
40
Estudo da Camada de Plasma em Microcanais
5.4. Processamento em Excel
Com os valores obtidos do “MTrackJ” já transferidos para o Excel, foi possível
obter os valores médios da ECP para posterior comparação.
Numa primeira fase é feita a diferença entre o valor de referência e todos os outros
valores quer da PC, quer da PB; de seguida é realizado o cálculo da média e do desviopadrão. Este procedimento foi efectuado para todos os resultados obtidos de cada
imagem analisada.
De modo a poder fazer uma comparação de todos os dados de cada hematócrito,
foram colocados os valores da média e desvio padrão de cada análise numa nova folha
de Excel e foram feitos gráficos. Assim, é mais simples fazer um melhor estudo de
resultados.
Cátia Fidalgo
41
Estudo da Camada de Plasma em Microcanais
6. Resultados Experimentais
Após a aquisição das imagens com diferentes hematócritos, verificou-se
verificou
que estas
não tinham boa qualidade pois não era possível visualizar com clareza os limites das
paredes do microcanal, os GVs e a espessura da camada de plasma. Assim,
As
como se
pode verificar na Figura
igura 6.1, após
após o melhoramento da imagem, já é possível fazer uma
melhor análise.
Parede de Cima
Parede de Baixo
Espessura da
Camada de Plasma
Glóbulo Vermelho
Figura 6.1 Imagem melhorada com 35% de hematócrito.
Este procedimento foi efectuado em todas as imagens independentemente do
método a usar (oo método “Tracking” ou o método “Z-Project”).
). Para as todas as
imagens dos vários hematócritos (35%, 24%, 15%, 9% e 2%), foram realizados os dois
métodos ou apenas um deles dependendo da imagem.
Depois da aplicação de cada um dos métodos, pode-se
pode se observar a análise realizada
nas Figuras resultantes: Figura 6.2 até à Figura 6.13, depois da utilização do “Add
tracks” do “MTrackJ”.
Cátia Fidalgo
42
Estudo da Camada de Plasma em Microcanais
6.1. Análise e processamento de imagem
•
35% hematócrito:
Na Figura abaixo (6.2) encontra-se um exemplo dos resultados obtidos pela análise
do seguimento manual por intermédio do “MTrackJ”.
Figura 6.2 Imagem resultante do método da trajectória dos GVs (“Tracking”).
Figura 6.3 Imagem resultante do método do “Z-Project”.
Na Figura 6.3 foi realizado um pré-processamento com a utilização da
intensidade máxima seguido de um “binary” e um “erode”.
Cátia Fidalgo
43
Estudo da Camada de Plasma em Microcanais
•
24% hematócrito:
Na Figura abaixo (6.4) encontra-se um exemplo dos resultados obtidos pela
análise do seguimento manual por intermédio do “MTrackJ”.
Figura 6.4 Imagem resultante do método das trajectórias dos GVs (“Tracking”).
Figura 6.5 Imagem resultante do método do “Z-Project”.
Na Figura 6.5 foi realizado um pré-processamento com a utilização da
intensidade máxima seguido de um binário.
Cátia Fidalgo
44
Estudo da Camada de Plasma em Microcanais
•
15% hematócrito:
Na Figura abaixo (6.6) encontra-se um exemplo dos resultados obtidos pela análise
do seguimento manual por intermédio do “MTrackJ”.
Figura 6.6 Imagem resultante do método da trajectória dos GVs (“Tracking”).
Figura 6.7 Imagem resultante do método do “Z-Project”.
Na Figura 6.7 foi realizado um pré-processamento com a utilização da
intensidade máxima seguido de um “binary”.
Cátia Fidalgo
45
Estudo da Camada de Plasma em Microcanais
•
9% hematócrito:
Na Figura abaixo (6.8) encontra-se um exemplo dos resultados obtidos pela análise
do seguimento manual por intermédio do “MTrackJ”.
Figura 6.8 Imagem resultante do método da trajectória dos GVs (“Tracking”).
Figura 6.9 Imagem resultante do método do “Z-Project”.
Na Figura 6.9 foi realizado um pré-processamento com a utilização da
intensidade máxima seguido de um “find edges”.
Cátia Fidalgo
46
Estudo da Camada de Plasma em Microcanais
Figura 6.10 Imagem resultante do método do “Z-Project”.
Na Figura 6.10 foi realizado um pré-processamento com a utilização da
intensidade mínima seguido de um “find edges”.
•
2% hematócrito:
Na Figura abaixo (6.11) encontra-se um exemplo dos resultados obtidos pela análise
do seguimento manual por intermédio do “MTrackJ”.
Figura 6.11 Imagem resultante do método da trajectória dos GVs (“Tracking”).
Cátia Fidalgo
47
Estudo da Camada de Plasma em Microcanais
Figura 6.12 Imagem resultante do método do “Z-Project”.
Na Figura 6.12 foi realizado um pré-processamento com a utilização da
intensidade máxima seguido de um “find edges”.
Figura 6.13 Imagem resultante do método do “Z-Project”.
Na Figura 6.13 foi realizado um pré-processamento com a utilização da
intensidade mínima seguido de um “find edges”.
Cátia Fidalgo
48
Estudo da Camada de Plasma em Microcanais
6.2. Resultados da Espessura da Camada de Plasma
De todas as análises efectuadas, apenas foram apresentados anteriormente um
exemplo de cada, ou seja, uma imagem com o método das trajectórias do GV
(“Tracking”) e outra resultante do método “Z-Project”, que pode ser de intensidade
máxima ou mínima.
Em anexos encontram-se os valores retirados do “MTrackJ” para todos os
hematócritos de ambos os métodos (um exemplo de cada método), com os quais foi
possível retirar os resultados seguintes.
Como foram obtidos muitos valores com cada análise, foi feito o cálculo das
médias de cada método para facilitar o estudo. Assim, de seguida são apresentados em
tabelas e gráficos os resultados obtidos.
Para uma melhor compreensão das tabelas e gráficos, é de referir que a
intensidade máxima e mínima das tabelas corresponde ao máximo e mínimo nos
gráficos e que o “Tracking” mencionado refere-se ao método da trajectória dos GVs.
Nas tabelas encontram-se os valores da análise efectuada quer para a parede de
cima (PC) quer para a parede de baixo (PB) do microcanal e as respectivas médias, com
ambos os métodos.
Nos gráficos, estão representados os valores da média da espessura da camada
de plasma (ECP) de cada hematócrito, retirados das tabelas.
Cátia Fidalgo
49
Estudo da Camada de Plasma em Microcanais
•
35% hematócrito:
Assim, para o hematócrito 35%, são apresentados na tabela 6.1 os valores e na
Figura 6.14 o respectivo gráfico.
Tabela 6.1 Resultados da média da ECP para 35% Hct.
35% Hematócrito (µ
µm)
Intensidade Máxima
PC
“Tracking”
Média Total
7,0714
---------
7,0714
PB
6,4552
9,5192
7,9872
Média ECP
6,7633
9,5192
8,1412
“Z-Project”
Espessura da Camada de Plasma
(µ
µm)
35% Hct
10
9
8
7
6
5
4
3
2
1
0
Média Máximos
Média Tracking
Média Total
Figura 6.14 Representação gráfica da variação da ECP para 35% hematócrito.
Cátia Fidalgo
50
Estudo da Camada de Plasma em Microcanais
•
24% hematócrito:
Para 24% hematócrito, os valores encontram-se na tabela 6.2 e estão
representados no gráfico da Figura 6.15.
Tabela 6.2 Resultados da média da ECP para 24% Hct.
Intensidade
Intensidade
Máxima
Mínima
“Z-Project”
“Z-Project”
PC
5,5931
PB
Média ECP
24% Hematócrito (µ
µm)
“Tracking”
Média Total
12,9061
12,2468
10,2486
5,2381
11,1271
11,3132
9,2262
5,4156
12,0166
11,7799
9,7374
Espessura da Camada de Plasma (µ
µm)
24% Hct
14
12
10
8
6
4
2
0
Média Máximo
Média Mínimo
Média Tracking
Média Total
Figura 6.15 Representação gráfica da variação da ECP para 24% hematócrito.
Cátia Fidalgo
51
Estudo da Camada de Plasma em Microcanais
•
15% hematócrito:
No caso de 15% hematócrito, na tabela 6.3 estão os valores que estão
apresentados no gráfico da Figura 6.16.
Tabela 6.3 Resultados da média da ECP para 15% Hct.
Intensidade
Intensidade
Máxima
Mínima
“Z-Project”
“Z-Project”
PC
8,2723
PB
Média ECP
15% Hematócrito (µ
µm)
“Tracking”
Média Total
19,0988
19,2622
15,5444
8,9379
14,3242
14,2
12,4873
8,6051
16,7115
16,7311
14,0159
Espessura da Camada de Plasma
(µ
µm)
15% Hct
18
16
14
12
10
8
6
4
2
0
Média Máximo Media Mínimo Média Tracking
Média total
Figura 6.16 Representação gráfica da variação da ECP para 15% hematócrito.
Cátia Fidalgo
52
Estudo da Camada de Plasma em Microcanais
•
9% hematócrito:
Em 9% hematócrito, o gráfico da Figura 6.17 foi obtido com os valores da tabela
6.4.
Tabela 6.4 Resultados da média da ECP para 9% Hct.
Intensidade
Intensidade
Máxima
Mínima
“Z-Project”
“Z-Project”
PC
10,0821
PB
Média ECP
9% Hematócrito (µ
µm)
“Tracking”
Média Total
14,4449
--------
12,2635
10,5944
12,5025
20,95
14,6823
10,3382
13,4737
20,95
14,9206
Espessura da Camada de Plasma
(µ
µm)
9% Hct
25
20
15
10
5
0
Média Máximo Média Mínimo Média Tracking
Média Total
Figura 6.17 Representação gráfica da variação da ECP para 9% hematócrito.
Cátia Fidalgo
53
Estudo da Camada de Plasma em Microcanais
•
2% hematócrito:
Por fim, para 2% hematócrito, os valores da tabela 6.5 estão representados no
gráfico da Figura 6.18
Tabela 6.5 Resultados da média da ECP para 2% Hct.
Intensidade
Intensidade
Máxima
Mínima
“Z-Project”
“Z-Project”
PC
14,5526
PB
Média ECP
2% Hematócrito (µ
µm)
“Tracking”
Média Total
13,0462
--------
13,7994
13,0382
12,2426
26,45
17,2436
13,7954
12,6444
26,45
17,6299
Espessura da Camada de Plasma
(µ
µm)
2% Hct
30
25
20
15
10
5
0
Média Máximo Média Mínimo Média Tracking
Média Total
Figura 6.18 Representação gráfica da variação da ECP para 2% hematócrito.
Cátia Fidalgo
54
Estudo da Camada de Plasma em Microcanais
Nos casos em que o método “Tracking” não apresenta valores para a PC ou PB é
devido a não haver GVs excitados pelo laser com os quais é possível realizar o
“tracking”; considera-se que o comportamento é semelhante na PC e PB.
Cátia Fidalgo
55
Estudo da Camada de Plasma em Microcanais
7. Análise e Discussão dos Resultados
Após a análise das imagens, verifica-se que a concentração dos GVs vai sendo
maior no centro do microcanal do que junto às paredes, o que influencia a viscosidade
sanguínea. Assim, a viscosidade é maior no centro do canal e vai diminuindo com a
aproximação da parede. Assim, é importante ter a viscosidade me consideração quando
é feita a análise dos resultados.
Num trabalho realizado anteriormente em microcanais em PDMS
[1]
, foi efectuado
um estudo semelhante ao realizado no presente trabalho. Apesar de os diâmetros serem
diferentes foi decidido compará-los qualitativamente (tabela 7.1)
Tabela 7.1 Resultados da ECP em microcanais de PDMS.[1]
Microcanais
37%
23%
13%
3%
de PDMS
Hematócrito
Hematócrito
Hematócrito
Hematócrito
Média (µ
µm)
7,561
9,283
11,190
22,80
Para se poder comparar os resultados obtidos com microcanais de vidro borosilicato
com os resultados de microcanais de PDMS (tabela 7.1), foram realizados alguns
ajustes, pois a análise foi efectuada para diferentes hematócritos. Assim, vão ser
considerados o Hct 37% como Hct 35%, Hct 23% como Hct 24%, Hct 13% como Hct
15% e Hct 3% como Hct 2%. Estes acertos podem ser considerados válidos pois as
percentagens de hematócrito são muito próximas.
De seguida vai ser feita a análise do gráfico da Figura 7.1, no qual estão
representados todos os resultados obtidos para cada hematócrito.
Cátia Fidalgo
56
Estudo da Camada de Plasma em Microcanais
Espessura da Camada de Plasma (µ
µm)
30
25
20
Z-Project
Project (Máximo)
15
Z-Project
Project (Mínimo)
Tracking
10
5
0
35% Hct
24% Hct
15% Hct
9% Hct
2% Hct
Figura 7.1 Representação gráfica da variação da ECP para todos os hematócritos para microcanais de vidro.
Para 35% hematócrito, foram usados ambos os métodos (“tracking” e “Z-Project”).
“Z
No caso do método do “Z--Project”
Project” apenas foi usada a intensidade máxima, pois com a
intensidade mínima não era possível
possível efectuar uma boa análise. Sendo assim, podem-se
podem
considerar ambos os métodos eficazes desde que seja efectuada a intensidade máxima
no método “Z-Project”.
No caso de 24% hct, também foram usados ambos os métodos (ver
(
Figura 7.1). Para
o método “Z-Project”,
t”, aplicou-se
aplicou se a intensidade máxima e a intensidade mínima. Os
resultados da intensidade máxima estão muito distantes dos outros dois obtidos, por isso
pode-se
se desde já considerar que esta análise não é eficaz. Assim pode-se
pode
concluir que
tanto o método do “tracking” como o do “Z-Project”
“Z Project” de intensidade mínima são bons
métodos para determinar a ECP.
Quanto a 15% hct, pode-se
pode observar no gráfico da Figura 7.1 os resultados obtidos
para ambos os métodos. Verifica-se
Verifica se novamente que a intensidade máxima apresenta
apresent um
resultado bastante inferior em relação aos outros dois resultados. Por isso, os melhores
Cátia Fidalgo
57
Estudo da Camada de Plasma em Microcanais
métodos para determinar a ECP para este hct são o “tracking” e a intensidade mínima
no caso do “Z-Project”.
Para 9% hct, apresentam-se os resultados obtidos de ambos os métodos no gráfico
da Figura 7.1. Neste caso, tanto a intensidade máxima como a intensidade mínima do
método “Z-Project” têm valores bastante inferiores em relação ao “tracking”. Assim,
pode-se considerar que o método do “Z-Project” não é o mais aconselhável para este
hct. Com o método do “tracking” foram obtidos melhores resultados porque é possível
comparar a imagem original com a análise dos GVs que estão iluminados o que permite
assim ter uma melhor noção do limite da ECP, o que não é possível fazer no caso do
método “Z-Project”.
Por último, para o caso de 2% hct, existe uma grande diferença entre os resultados
da análise pelo método do “Z-Project” e pelo “tracking”, representados no gráfico da
Figura 7.1. Tanto o resultado da intensidade mínima como da intensidade máxima estão
muito abaixo do resultado do “tracking”. Considera-se que a melhor forma para
determinar a ECP neste hct é o “tracking”.
Em termos gerais, os resultados sugerem que a espessura da camada de plasma
aumenta com a diminuição do hematócrito, sendo que o método “tracking” é aquele que
apresenta resultados mais próximos da realidade. Isto também se verifica quando é feita
uma comparação dos resultados do “tracking” obtidos com os resultados de PDMS
apresentados na Figura 7.2.
Cátia Fidalgo
58
Espessura da Camada de Plasma (µ
µm)
Estudo da Camada de Plasma em Microcanais
30
25
20
15
Tracking
Média PDMS
10
5
0
Hct 35%
Hct 24%
Hct 15%
Hct 9%
Hct 2%
Figura 7.2 Representação gráfica da variação da ECP para todos os hematócritos para microcanais de diâmetro
100µm
m (35%, 24%, 15% e 2%), 92µm
92
(9%) e 75µm
m para o caso dos microcanais em PDMS. [1]
Para 35% hct, verifica-se
verifica se que os valores não diferem muito, sendo resultado do
“tracking” um pouco mais elevado, possivelmente devido à diferença de diâmetros.
Nos casos de 24%, 15% e 2% hct, verifica-se novamente que o resultado do
“tracking” tem um valor superior ao do PDMS.
Quanto ao resultado de 9% hct, não estão disponíveis valores de PDMS, por isso
não pode ser feita a comparação. No entanto pode-se
pode se dizer que este resultado está de
acordo com a evolução da ECP.
Estudos efectuados in vivo
[33]
obtiveram os resultados apresentados no gráfico da
Figura 7.3. Pela análise dos resultados in vivo a ECP aumenta com a diminuição do
hematócrito, o que corrobora com os resultados obtidos no presente de estudo. Por outro
lado, também é possível observar que
que quanto maior for o diâmetro do microcanal, maior
vai ser a ECP. Este aumento dá-se
dá se segundo uma regressão linear para cada hematócrito
representado na Figura 7.3.
Cátia Fidalgo
59
Estudo da Camada de Plasma em Microcanais
Figura 7.3 Representação gráfica da espessura da camada de plasma em função do diâmetro do microvaso in vivo,
adaptado de [33].
No entanto, quando se comparam os resultados da ECP do gráfico da figura 7.3
com os resultados deste estudo apresentados no gráfico da Figura 7.2, verifica-se uma
diferença significativa. Por exemplo, para o caso de um hct de 15% os resultados
correspondem a cerca de 17 µm enquanto que o valor para o caso in vivo (ver Figura
7.2 para um diâmetro 10µm) é de aproximadamente 10µm. O mesmo acontece para o
caso de 35% hct, ou seja a diferença é também bastante significativa verifica-se
novamente que o resultado obtido é bastante superior. Esta grande diferença de
resultados pode ser devido ao tipo de microcanais que foram analisados. Os valores do
gráfico da Figura 7.3 são referentes ao estudo de microcanais in vivo, nos quais
interferem vários factores, como por exemplo os factores biológicos, a existência de
bifurcações e de glóbulos brancos em circulação, entre outros. Já no caso dos
microcanais que foram usados neste estudo, estes são microcanais de vidro nos quais
estes factores não são considerados durante o escoamento sanguíneo.
Cátia Fidalgo
60
Estudo da Camada de Plasma em Microcanais
8. Conclusões e Trabalho Futuro
8.1. Conclusões
Este projecto teve como principal objectivo a determinação da espessura da camada
de plasma (ECP) em microcanais circulares de vidro (92 e 100µm) em função do
hematócrito. As principais conclusões retiradas deste estudo são as seguintes:
- O sistema usado para a análise e tratamento de imagens confocais é um sistema
bastante promissor para estudar escoamento sanguíneo ao longo do microcanal;
- Os resultados experimentais sugerem que a trajectória dos GVs e a ECP são
fortemente dependentes do Hct;
- Pelos ensaios experimentais realizados foi possível concluir que aumentando o
hematócrito diminui a ECP, o que corrobora com os resultados encontrados na
literatura.
- Durante a análise dos resultados foi observado, principalmente para hematócritos
elevados, que ECP variava ao longo do microcanal, uma vez que os GVs ao
deslocarem-se ao longo do plasma realizam movimentos rotacionais e translacionais,
chocando uns com os outros e assim movendo-se de uma forma irregular;
- Em termos gerais, os resultados da ECP obtidos em microcanais de vidro são
qualitativamente concordantes com os resultados obtidos em microcanais de PDMS;
- Os resultados da ECP in vivo são qualitativamente semelhantes aos resultados in
vitro, mas o mesmo não se verifica quantitativamente, em que a ECP in vitro é sempre
superior à ECP in vivo;
- Em termos gerais, dos vários métodos de análise de imagem utilizados neste
estudo, aquele que apresentou resultados mais satisfatórios para a determinação da ECP
foi o método de seguimento (“tracking”) dos GVs ao longo de várias imagens. Para o
caso do método “Z-Project”, a opção da intensidade mínima foi aquela que apresentou
melhores resultados quando comparada com os resultados da opção intensidade
máxima;
Cátia Fidalgo
61
Estudo da Camada de Plasma em Microcanais
- Os métodos usados neste estudo são muito dependentes da perícia do utilizador, ou
seja é um método manual, se fosse usado um método automático ou semi-automático,
talvez houvesse melhoria dos resultados.
8.2. Trabalho Futuro
Uma proposta para a realização de trabalhos futuros será a melhoria das imagens
obtidas, como foi referido durante este estudo, por vezes era complicado efectuar uma
correcta análise devido à qualidade das imagens. Algumas imagens estavam desfocadas,
com ruído e esbatidas, o que dificulta bastante a identificação da zona de transição entre
o escoamento sanguíneo com os glóbulos vermelhos e a camada de plasma, bem como a
correcta identificação dos limites da parede do microcanal.
Por outro lado, uma forma de melhorar os resultados obtidos será com a utilização
de métodos automáticos ou semi-automáticos de modo a melhorar a análise de imagem
e seu processamento. Os métodos automáticos para além de melhorar a qualidade das
imagens, podem também ajudar a ultrapassar os erros humanos associados à análise
manual de uma imagem.
Cátia Fidalgo
62
Estudo da Camada de Plasma em Microcanais
9. Referências Bibliográficas
[1] Cerdeira, T., Estudo do Escoamento Sanguíneo em Microcanais, Projecto Final de
Curso, Escola Superior de Tecnologia e Gestão, Instituto Politécnico de Bragança,
2009.
[2] http://en.wikipedia.org/wiki/Dextran; (Consultado em 28/06/10)
[3] Lima, R.; Wada, S.; Takeda, M., Tsubota, K.; Yamaguchi, T., In vitro confocal
micro-PIV measurements of blood flow in a square microchannel: the effect of the
hematocrit on instantaneous velocity profiles; Journal of Biomechanics 40: 2752-2757;
2007.
[4] http://en.wikipedia.org/wiki/ImageJ; (Consultado em 12/06/10)
[5] Phantom Camera Control Software Documentation, Version 607, Vision Research,
Inc., New Jersey 07470;
[6] http://pt.wikipedia.org/wiki/EDTA; (Consultado em 28/06/10)
[7]http://fernandaguedes.weblog.com.pt/arquivo/2007/10/soro_fisiologic.html;
(Consultado em 28/06/10)
[8] http://pt.wikipedia.org/wiki/Soro_fisiol%C3%B3gico; (Consultado em 28/06/10)
[9] http://pt.wikipedia.org/wiki/Catalisador; (Consultado em 28/06/10)
[10] Teixeira, M.; Sebenta Anatomofisiologia Humana, ESTiG, IPB, 2008;
[11]http://2.bp.blogspot.com/_S7Qz9a3DX6s/SeKPdGxVQLI/AAAAAAAAAn4/Mrf4
811JBaY/s400/constitui%25C3%25A7aodosangue.jpg; (Consultado em 29/06/10)
[12] http://pt.wikipedia.org/wiki/Hem%C3%A1cia; (Consultado em 29/06/10)
[13]http://lqes.iqm.unicamp.br/images/pontos_vista_artigo_divulgacao_94_1_globulos_
vermelhos.jpg; (Consultado em 29/06/10)
[14] http://pt.wikipedia.org/wiki/Hemat%C3%B3crito; (Consultado em 29/06/10)
Cátia Fidalgo
63
Estudo da Camada de Plasma em Microcanais
[15] http://www6.ufrgs.br/favet/lacvet/hematocrito_files/hemato1.jpg; (Consultado em
29/06/10)
[16] http://pt.wikipedia.org/wiki/Leuc%C3%B3cito; (Consultado em 29/06/10)
[17]http://www.sobiologia.com.br/figuras/Corpo/leucocitos.jpg;
(Consultado
em
29/06/10)
[18]
http://pt.wikipedia.org/wiki/Plaqueta_sangu%C3%ADnea;
(Consultado
em
29/06/10)
[19] http://pt.wikipedia.org/wiki/Plasma_%28sangue%29; (Consultado em 29/06/10)
[20]http://4.bp.blogspot.com/_pMxMXFn7L4/St3O5lWuFnI/AAAAAAAAKFo/aU7n6
Z6i9Ds/s400/19432.jpg; (Consultado em 29/06/10)
[21] Lima, R.; Wada, S.; Tsubota, K.; Yamaguchi, T., Confocal micro-PIV
measurements of three-dimensional profiles of cell suspension flow in a square
microchannel; Measurement Science and Technology, 17: 797-808, 2006;
[22] http://www.icb.ufmg.br/fib/neurofib/Engenharia/Hemodinamica/viscosidade.htm;
(Consultado em 30/06/10)
[23] Lima, R.; Ishikawa, T.; Imai, Y.; Yamaguchi, T., Blood flow behavior in
microchannel: past, current and future trends; Single and two-Phase Flow on Chemical
and Biomedical Engineering, 2010;
[24] Rosa, S.; Sebenta Teórica de Biofluidos, ESTiG, IPB, 2010;
[25]http://www.hidro.ufcg.edu.br/twiki/pub/Disciplinas/Fen%F4menosDeTransporte/E
xp_Reynolds.pdf; (Consultado em 30/06/10)
[26]http://www.icb.ufmg.br/fib/neurofib/Engenharia/Hemodinamica/fluxo_laminar.htm
; (Consultado em 30/06/10)
[27]http://br.answers.yahoo.com/question/index?qid=20081130093115AAepljs;
(Consultado em 30/06/10)
[28]
http://www.estv.ipv.pt/paginaspessoais/jqomarcelo/OT/DEMad_OT_Fluidos.pdf;
(Consultado em 30/06/10)
Cátia Fidalgo
64
Estudo da Camada de Plasma em Microcanais
[29]
http://www.deq.ufba.br/docs/downloads/material_maria_fatima/ENG008_8.pdf;
(Consultado em 30/06/10)
[30] http://pt.wikipedia.org/wiki/Vidro_borossilicato; (Consultado em 01/07/10)
[31] Abramoff M., Magelhaes P., Ram, S. Image Processing with Image J.
Biophotonics International 11: 36-42, 2004.
[32] Meijering, E., Smal, I., and Danuser, G., Tracking in Molecular Bioimaging. IEEE
Signal Processing Magazine 3 (23): 46-53, 2006.
[33] Maeda, N.; Erythrocyte Rheology in Microcirculation. Japanese Journal of
Physiology 46: 1-14, 1996.
Cátia Fidalgo
65
Estudo da Camada de Plasma em Microcanais
Anexos
• 35% Hematócrito
“Tracking”
Número de pontos
Parede Baixo
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
Cátia Fidalgo
Valores
Diferença
185,2336
173,3592
173,3075
173,1961
173,2015
173,2057
173,1712
173,0992
173,1198
173,1163
173,0456
173,0646
173,0682
173,0048
172,9994
172,9962
172,8924
172,9036
172,5054
172,4643
172,0578
172,0155
171,6491
171,5694
171,5946
171,5568
171,6046
171,6407
171,9141
171,8602
171,8722
171,7831
11,8744
11,9261
12,0375
12,0321
12,0279
12,0624
12,1344
12,1138
12,1173
12,188
12,169
12,1654
12,2288
12,2342
12,2374
12,3412
12,33
12,7282
12,7693
13,1758
13,2181
13,5845
13,6642
13,639
13,6768
13,629
13,5929
13,3195
13,3734
13,3614
13,4505
13,8374
66
Estudo da Camada de Plasma em Microcanais
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
Cátia Fidalgo
171,3962
171,4041
171,4596
171,4942
171,4776
171,6338
171,6936
171,7764
171,794
171,9151
172,2966
171,9806
171,9551
172,0953
172,5466
172,5115
172,5944
172,5978
172,5557
172,8163
172,2471
172,1785
172,0484
172,0534
172,1534
171,9865
171,9589
171,9724
171,9023
172,0569
172,0678
171,8599
172,1068
171,9291
171,9836
171,9557
171,8901
171,7482
171,6772
171,6612
172,3207
172,2095
13,8295
13,774
13,7394
13,756
13,5998
13,54
13,4572
13,4396
13,3185
12,937
13,253
13,2785
13,1383
12,687
12,7221
12,6392
12,6358
12,6779
12,4173
12,9865
13,0551
13,1852
13,1802
13,0802
13,2471
13,2747
13,2612
13,3313
13,1767
13,1658
13,3737
13,1268
13,3045
13,25
13,2779
13,3435
13,4854
13,5564
13,5724
12,9129
13,0241
13,3883
67
Estudo da Camada de Plasma em Microcanais
75
76
77
78
79
80
81
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
104
105
106
107
108
109
110
111
112
113
114
115
116
Cátia Fidalgo
171,8453
171,835
171,3288
171,2851
171,6155
171,2761
171,6285
171,5067
171,6347
171,6184
171,6284
171,6662
171,6857
171,6456
171,4678
171,4743
171,4842
171,8853
171,5528
171,7077
171,6446
171,386
171,3475
171,2916
171,3423
171,2345
171,3376
171,3653
171,3717
171,336
171,514
171,348
171,3236
171,293
171,0299
170,8926
170,9661
171,566
171,6479
171,7899
172,0456
171,9048
13,3986
13,9048
13,9485
13,6181
13,9575
13,6051
13,7269
13,5989
13,6152
13,6052
13,5674
13,5479
13,588
13,7658
13,7593
13,7494
13,3483
13,6808
13,5259
13,589
13,8476
13,8861
13,942
13,8913
13,9991
13,896
13,8683
13,8619
13,8976
13,7196
13,8856
13,91
13,9406
14,2037
14,341
14,2675
13,6676
13,5857
13,4437
13,188
13,3288
13,3236
68
Estudo da Camada de Plasma em Microcanais
117
118
119
120
121
122
123
124
125
126
127
128
129
130
131
132
133
134
135
136
137
138
139
140
141
142
143
144
171,91
171,8971
171,8272
171,8188
171,8004
171,7695
171,7911
171,7927
171,8397
171,9651
171,732
171,8012
171,8097
171,8094
171,8016
171,8488
171,4811
171,6661
171,8029
172,3981
171,8886
171,9048
171,9629
171,898
172,7942
172,8642
172,5992
172,4728
13,3365
13,4064
13,4148
13,4332
13,4641
13,4425
13,4409
13,3939
13,2685
13,5016
13,4324
13,4239
13,4242
13,432
13,3848
13,7525
13,5675
13,4307
12,8355
13,345
13,3288
13,2707
13,3356
12,4394
12,3694
12,6344
12,7608
Média
13,27207
Desvio-padrão
0,553397715
“Z-Project” – Intensidade Máxima
Número de Pontos
Parede Cima
1
2
3
4
5
6
7
8
Cátia Fidalgo
Valores
Diferença
80,7116
86,6105
86,1423
86,0872
85,1124
87,4532
86,5169
87,2659
5,8989
5,4307
5,3756
4,4008
6,7416
5,8053
6,5543
7,0225
69
Estudo da Camada de Plasma em Microcanais
9
10
11
12
13
14
15
87,7341
88,3895
88,6578
87,5894
87,8411
88,7936
88,5843
7,6779
7,9462
6,8778
7,1295
8,082
7,8727
Parede Baixo
16
17
18
19
20
21
22
23
24
25
181,7884
174,2978
175,8427
175,0562
175,3786
175,309
176,1838
175,9404
176,1798
175,4607
7,4906
5,9457
6,7322
6,4098
6,4794
5,6046
5,848
5,6086
6,3277
Média
6,6297
Desvio-padrão
1,115003934
Média
6,271844
Desvio-padrão
0,60556233
• 24% Hematócrito
“Tracking”
Número de Pontos
Parede Cima
1
2
3
4
5
6
7
8
9
10
11
12
13
Cátia Fidalgo
Valores
Diferença
84,1213
96,6319
96,6968
97,072
97,5454
97,032
97,143
97,1632
97,1963
97,3615
97,2738
97,1625
97,6698
12,5106
12,5755
12,9507
13,4241
12,9107
13,0217
13,0419
13,075
13,2402
13,1525
13,0412
13,5485
13,6091
70
Estudo da Camada de Plasma em Microcanais
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
Cátia Fidalgo
97,7304
97,428
97,5935
98,115
98,1593
98,1507
97,7348
97,6515
97,5923
97,6099
97,567
97,4415
97,567
97,6043
97,5739
97,5793
97,4415
97,5937
97,5444
97,567
97,567
97,64
97,5836
97,6667
97,2588
97,6027
97,2588
97,2588
97,4415
97,8068
97,4415
97,567
97,0677
97,0548
97,0191
96,6113
96,5441
96,5069
96,4794
96,5441
96,0491
96,0231
13,3067
13,4722
13,9937
14,038
14,0294
13,6135
13,5302
13,471
13,4886
13,4457
13,3202
13,4457
13,483
13,4526
13,458
13,3202
13,4724
13,4231
13,4457
13,4457
13,5187
13,4623
13,5454
13,1375
13,4814
13,1375
13,1375
13,3202
13,6855
13,3202
13,4457
12,9464
12,9335
12,8978
12,49
12,4228
12,3856
12,3581
12,4228
11,9278
11,9018
11,8439
71
Estudo da Camada de Plasma em Microcanais
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96
97
Cátia Fidalgo
95,9652
96,0633
96,1036
96,1338
96,1526
96,0873
95,706
95,7107
95,6854
95,4205
95,4094
95,4958
95,4916
95,615
95,615
95,9275
96,0099
96,0081
96,4955
96,4461
96,3987
96,4074
95,9957
95,6034
95,8846
95,8773
95,615
95,615
95,615
95,615
95,615
95,615
95,615
95,615
95,615
95,615
95,752
95,3999
95,412
95,3875
95,4482
95,3875
11,942
11,9823
12,0125
12,0313
11,966
11,5847
11,5894
11,5641
11,2992
11,2881
11,3745
11,3703
11,4937
11,4937
11,8062
11,8886
11,8868
12,3742
12,3248
12,2774
12,2861
11,8744
11,4821
11,7633
11,756
11,4937
11,4937
11,4937
11,4937
11,4937
11,4937
11,4937
11,4937
11,4937
11,4937
11,6307
11,2786
11,2907
11,2662
11,3269
11,2662
11,3469
72
Estudo da Camada de Plasma em Microcanais
98
99
100
101
102
103
104
105
106
107
108
109
110
111
112
113
114
115
116
95,4682
95,4308
95,4063
95,4613
95,4532
95,4165
95,0782
95,1577
95,1636
95,4206
95,6072
95,5565
95,6724
95,5083
95,6483
95,5945
95,6616
95,7017
95,7522
11,3095
11,285
11,34
11,3319
11,2952
10,9569
11,0364
11,0423
11,2993
11,4859
11,4352
11,5511
11,387
11,527
11,4732
11,5403
11,5804
11,6309
Parede Baixo
117
118
119
120
121
122
123
124
125
126
127
128
129
130
131
132
133
134
135
136
137
184,1512
175,6426
175,7281
176,1562
176,144
176,3683
176,2922
176,2987
176,4029
175,872
176,4243
176,409
176,4015
175,9342
175,9426
175,9577
175,9106
175,922
176,4119
175,9293
175,9768
8,5086
8,4231
7,995
8,0072
7,7829
7,859
7,8525
7,7483
8,2792
7,7269
7,7422
7,7497
8,217
8,2086
8,1935
8,2406
8,2292
7,7393
8,2219
8,1744
8,2045
Cátia Fidalgo
Média
12,3308
Desvio-padrão
0,908458
73
Estudo da Camada de Plasma em Microcanais
138
139
140
141
142
143
144
145
146
147
148
149
150
151
152
153
154
155
156
157
158
159
160
161
162
163
164
165
166
167
168
169
170
171
172
173
174
175
176
177
178
179
Cátia Fidalgo
175,9467
176,4714
176,4611
176,47
175,9706
175,9766
176,401
176,4357
176,4357
176,4235
176,494
176,5057
176,47
176,4015
176,4124
176,4471
176,5727
176,5191
177,0065
177,0419
176,9836
176,7097
176,9254
176,9494
176,9432
176,9494
176,9494
176,9137
176,9494
176,9494
176,9137
176,9241
177,0303
176,9603
176,936
176,8935
176,8884
176,767
176,8015
176,733
176,6595
176,5418
7,6798
7,6901
7,6812
8,1806
8,1746
7,7502
7,7155
7,7155
7,7277
7,6572
7,6455
7,6812
7,7497
7,7388
7,7041
7,5785
7,6321
7,1447
7,1093
7,1676
7,4415
7,2258
7,2018
7,208
7,2018
7,2018
7,2375
7,2018
7,2018
7,2375
7,2271
7,1209
7,1909
7,2152
7,2577
7,2628
7,3842
7,3497
7,4182
7,4917
7,6094
7,3976
74
Estudo da Camada de Plasma em Microcanais
180
181
182
183
184
185
186
187
188
189
190
191
192
193
194
195
196
197
198
199
200
201
202
203
204
205
206
207
208
209
210
211
212
213
214
215
216
217
218
219
220
221
Cátia Fidalgo
176,7536
176,8468
176,8966
177,007
177,5393
177,6198
177,9384
177,9647
177,969
177,9837
177,9723
178,0096
178,033
177,9334
178,0439
178,0473
178,0865
178,0785
178,1001
178,0182
177,9022
177,9983
178,0776
178,0491
178,0533
178,0673
178,0414
178,055
178,0381
178,0323
178,1274
178,1235
178,0516
177,5253
177,5167
177,5201
177,5181
177,5181
177,5105
177,4334
177,4631
177,43
7,3044
7,2546
7,1442
6,6119
6,5314
6,2128
6,1865
6,1822
6,1675
6,1789
6,1416
6,1182
6,2178
6,1073
6,1039
6,0647
6,0727
6,0511
6,133
6,249
6,1529
6,0736
6,1021
6,0979
6,0839
6,1098
6,0962
6,1131
6,1189
6,0238
6,0277
6,0996
6,6259
6,6345
6,6311
6,6331
6,6331
6,6407
6,7178
6,6881
6,7212
6,1512
75
Estudo da Camada de Plasma em Microcanais
222
223
224
225
226
227
228
229
230
231
232
233
234
178
177,9199
177,8681
177,923
177,9314
177,8587
177,8841
177,8869
177,9179
177,8685
177,4083
177,4697
177,5316
6,2313
6,2831
6,2282
6,2198
6,2925
6,2671
6,2643
6,2333
6,2827
6,7429
6,6815
6,6196
Média
7,051867
Desvio-padrão
0,747678
“Z-Project” – Intensidade Máxima
Número de Pontos
Parede Cima
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Valores
Diferença
84,9336
91,517
91,2568
91,413
91,3479
90,4372
91,1658
91,1658
90,8015
91,1658
91,1658
90,4372
91,5301
90,4372
90,4372
6,5834
6,3232
6,4794
6,4143
5,5036
6,2322
6,2322
5,8679
6,2322
6,2322
5,5036
6,5965
5,5036
5,5036
Parede Baixo
16
17
18
19
20
21
185,2757
180,0546
179,6903
179,6903
179,6903
179,6903
5,2211
5,5854
5,5854
5,5854
5,5854
6,314
Cátia Fidalgo
Média
6,086279
Desvio-padrão
0,422141849
76
Estudo da Camada de Plasma em Microcanais
22
23
24
25
•
178,9617
178,9617
180,0546
180,4189
6,314
5,2211
4,8568
Média
5,5854
Desvio-padrão
0,481923601
15% Hematócrito
“Tracking”
Número de Pontos
Parede Cima
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
Cátia Fidalgo
Valores
Diferença
83,4901
102,2861
102,4128
102,6072
103,1889
102,7691
102,743
102,606
102,5101
102,6292
103,0298
103,0536
103,1766
103,5869
103,7822
103,3606
103,2513
103,1901
103,0378
103,0953
103,2241
103,5171
103,3989
103,1871
103,1948
103,3181
103,7318
103,8718
18,796
18,9227
19,1171
19,6988
19,279
19,2529
19,1159
19,02
19,1391
19,5397
19,5635
19,6865
20,0968
20,2921
19,8705
19,7612
19,7
19,5477
19,6052
19,734
20,027
19,9088
19,697
19,7047
19,828
20,2417
20,3817
20,3242
77
Estudo da Camada de Plasma em Microcanais
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
Cátia Fidalgo
103,8143
103,7192
103,4557
103,2218
103,1775
103,2286
103,2021
103,1378
103,0974
102,5964
102,3993
102,3401
102,4739
102,7186
102,6745
102,7184
102,5019
102,3348
102,0352
101,9498
102,0644
101,8724
101,5953
101,6907
102,2591
102,3069
102,4868
102,6291
102,5883
102,5908
102,3871
102,017
102,0928
102,4994
102,7418
102,8601
102,8368
102,8795
102,9014
102,7844
102,7792
102,7847
20,2291
19,9656
19,7317
19,6874
19,7385
19,712
19,6477
19,6073
19,1063
18,9092
18,85
18,9838
19,2285
19,1844
19,2283
19,0118
18,8447
18,5451
18,4597
18,5743
18,3823
18,1052
18,2006
18,769
18,8168
18,9967
19,139
19,0982
19,1007
18,897
18,5269
18,6027
19,0093
19,2517
19,37
19,3467
19,3894
19,4113
19,2943
19,2891
19,2946
19,3514
78
Estudo da Camada de Plasma em Microcanais
71
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
87
88
89
102,8415
103,105
103,2121
103,2378
103,1339
102,9629
102,7822
102,6654
102,8398
102,9893
103,2126
103,3603
103,2567
102,8005
102,5851
102,4878
102,6275
102,5967
102,9129
19,6149
19,722
19,7477
19,6438
19,4728
19,2921
19,1753
19,3497
19,4992
19,7225
19,8702
19,7666
19,3104
19,095
18,9977
19,1374
19,1066
19,4228
Média
19,34871
Desvio-padrão
0,48024
“Z-Project” – Intensidade Máxima
Número de Pontos
Parede Cima
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Valores
Diferença
86,9984
96,508
96,2173
96,508
97,0893
96,508
96,508
97,0893
96,508
97,0893
96,508
97,0893
97,0893
97,38
97,6707
9,5096
9,2189
9,5096
10,0909
9,5096
9,5096
10,0909
9,5096
10,0909
9,5096
10,0909
10,0909
10,3816
10,6723
Média
9,841779
Desvio-padrão
0,424401
Parede Baixo
Cátia Fidalgo
79
Estudo da Camada de Plasma em Microcanais
16
17
18
19
20
21
22
23
24
25
187,5655
178,5785
178,1909
179,3536
178,9661
179,3536
178,5785
178,5785
178,9661
179,0872
8,987
9,3746
8,2119
8,5994
8,2119
8,987
8,987
8,5994
8,4783
Média
8,715167
Desvio-padrão
0,394651
• 9% Hematócrito
“Tracking”
Número de Pontos
Parede Baixo
1
2
3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
Cátia Fidalgo
Valores
Diferença
178,086
178,087
178,093
155,664
155,707
156,155
156,041
156,048
156,044
156,074
156,151
156,153
156,117
156,075
156,069
155,616
155,575
155,583
155,567
155,386
155,306
155,539
22,422
22,379
21,931
22,045
22,038
22,042
22,012
21,935
21,933
21,969
22,011
22,017
22,47
22,511
22,503
22,519
22,7
22,78
22,547
22,63
22,555
22,503
80
Estudo da Camada de Plasma em Microcanais
20
21
22
23
24
25
26
27
28
155,456
155,531
155,583
155,57
155,67
154,994
155,006
155,194
155,047
22,516
22,416
23,092
23,08
22,892
23,039
23,764
23,764
Média
22,5005
Desvio-padrão
0,494229721
“Z-Project” – Intensidade Mínima
Número de Pontos
Parede Cima
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Valores
Diferença
90,6136
103,0211
102,6183
103,4065
103,1125
104,1289
105,8409
104,6324
103,8268
102,9159
101,8127
101,8127
101,8127
102,6183
103,0211
12,4075
12,0047
12,7929
12,4989
13,5153
15,2273
14,0188
13,2132
12,3023
11,1991
11,1991
11,1991
12,0047
12,4075
Parede Baixo
16
17
18
19
20
21
22
23
24
25
189,7281
176,61
177,3414
177,6435
177,3414
178,852
176,435
176,1329
175,5287
176,7372
13,1181
12,3867
12,0846
12,3867
10,8761
13,2931
13,5952
14,1994
12,9909
Cátia Fidalgo
Média
12,57074
Desvio-padrão
1,140984708
Média
12,77009
Desvio-padrão
0,969420672
81
Estudo da Camada de Plasma em Microcanais
• 2% Hematócrito
“Tracking”
Número de Pontos
Parede Baixo
1
2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
Cátia Fidalgo
Valores
Diferença
187,05
187,06
158,002
158,052
158,129
158,147
158,111
158,129
157,976
157,879
157,879
157,882
157,824
157,761
157,789
157,878
157,909
157,916
157,871
157,727
157,75
157,718
157,755
157,731
157,725
157,653
157,704
157,668
157,714
29,048
28,998
28,921
28,903
28,939
28,921
29,074
29,171
29,171
29,168
29,226
29,289
29,261
29,172
29,141
29,134
29,179
29,323
29,3
29,332
29,295
29,319
29,325
29,397
29,346
29,382
29,336
29,311
Média
29,19221
Desvio-padrão
0,151488261
82
Estudo da Camada de Plasma em Microcanais
“Z-Project” – Intensidade Mínima
Número de Pontos
Parede Cima
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Valores
Diferença
77,5758
85,9863
86,3791
86,0963
88,6809
88,057
86,7201
88,2353
88,1253
86,8984
85,8289
87,9703
86,0071
87,7897
87,6114
8,4105
8,8033
8,5205
11,1051
10,4812
9,1443
10,6595
10,5495
9,3226
8,2531
10,3945
8,4313
10,2139
10,0356
Parede Baixo
16
17
18
19
20
21
22
23
24
25
176,836
167,3797
167,6471
166,3993
169,1622
166,5775
167,1123
168,2709
168,0036
167,3797
9,4563
9,1889
10,4367
7,6738
10,2585
9,7237
8,5651
8,8324
9,4563
Cátia Fidalgo
Média
9,594636
Desvio-padrão
0,997803428
Média
9,287967
Desvio-padrão
0,855386201
83