Desenvolvimento e validação de método bioanalítico
para quantificação de tiazolilhidrazona-9 (TZH-9) e
determinação da estabilidade em plasma ex vivo
Introdução
A molécula tiazolilhidrazona-9 (TZH-9) tem se destacado como uma
excelente candidata a fármaco para o tratamento da Doença de Chagas
tendo em vista sua intensa atividade contra todas as formas de T. cruzi,
com seletividade e potência superior ao fármaco de referência
benznidazol (BNZ). A continuidade do desenvolvimento do novo fármaco
requer a disponibilidade de um método bioanalítico para a execução de
uma série de avaliações, tais como o estudo de estabilidade em plasma
e análise farmacocinética.
Objetivos
Figura 2 - Cromatograma do TZH-9 (azul) e
cromatograma da amostra branco (vermelho),
apresentando a seletividade do método.
Desenvolver e validar um método bioanalítico para quantificar o TZH-9
em plasma de ratos e avaliar a estabilidade de TZH-9 em plasma (ex
vivo) de ratos.
CQB CQM CQA
Concentração
nominal (μg/mL)
0,5
1,5
6,0
y= 7,922x – 0,6392
r = 0,9971
Metodologia
Foi utilizado UPLC Waters Acquity® com detector UV-VIS-FLR. A
separação foi feita em coluna HSS C18 SB, 1.8 µm, 2,1 x 50 mm. A fase
móvel foi água:acetonitrila (20:80) com fluxo de 0,55 mL/min. A detecção
do TZH-9 foi realizada por UV-VIS (λ=331 nm) e o padrão interno (PI),
daunorrubicina, foi detectada por FLR (λexc= 480 nm; λemi= 560nm).
Figura 3 – Cromatograma do PI.
intra-dia
(n=5)
inter-dia
(n=10)
Figura 4 - Curva de linearidade do TZH-9 em
plasma
140
200 µL de
plasma
add de
solução
de TZH-9
25 µL do
PI (100
µg/mL)
100 µL
solução
saturada
de sulfato
de
amônio
1000 µL
acetato
de etila
Precisão
(%)
7,36
13,17 12,24
Exatidão
97,05 91,03 94,99
(%)
Precisão
10,77 11,93 12,71
(%)
Exatidão
99,44 92,84 91,45
(%)
Tabela 1 - Precisão e exatidão do método
bioanalítico.
120
*
100
80
60
40
900 µL
da fase
orgânica
Ressuspende
em 100 µL de
ACN
Filtra e
injeta
amostra no
sistema
UPLC
A estabilidade plasmática ex vivo foi avaliada a partir do plasma
adicionado de TZH-9 para obter concentrações de 1,5 μg/mL e 6,0
μg/mL. O ensaio foi realizado em triplicata sob agitação e temperatura de
37°C, e alíquotas de 0,2 mL foram coletadas entre 0 e 24 h. As
concentrações do tempo inicial foram consideradas como 100%, sendo
considerado instável quando um decaimento maior que 15% foi
observado.
Resultados e Discussão
20
0
0
5
10
15
20
25
Figura 5 - Estabilidade do TZH-9 em plasma de ratos em 1,5 μg/mL (azul escuro) e 6,0 μg/mL
(azul claro). *Fármaco instável a partir de 2 horas, p<0,05 em relação ao tempo inicial (ANOVA
para medidas repetidas, seguido de tukey).
Conclusão
O método bioanalítico validado demonstrou limites de confiança
adequados para a quantificação do TZH-9 em plasma de ratos e,
futuramente, pode ser aplicado em estudo de farmacocinética. Os
ensaios de estabilidade ex vivo em plasma de ratos demonstraram que o
TZH-9 é suscetível à hidrólise pelas enzimas plasmáticas com resultados
estatisticamente diferentes a partir de 2 horas de incubação. Esta
susceptibilidade sugere tendência a Cl elevado quando o composto for
administrado em animais.
Apoio financeiro
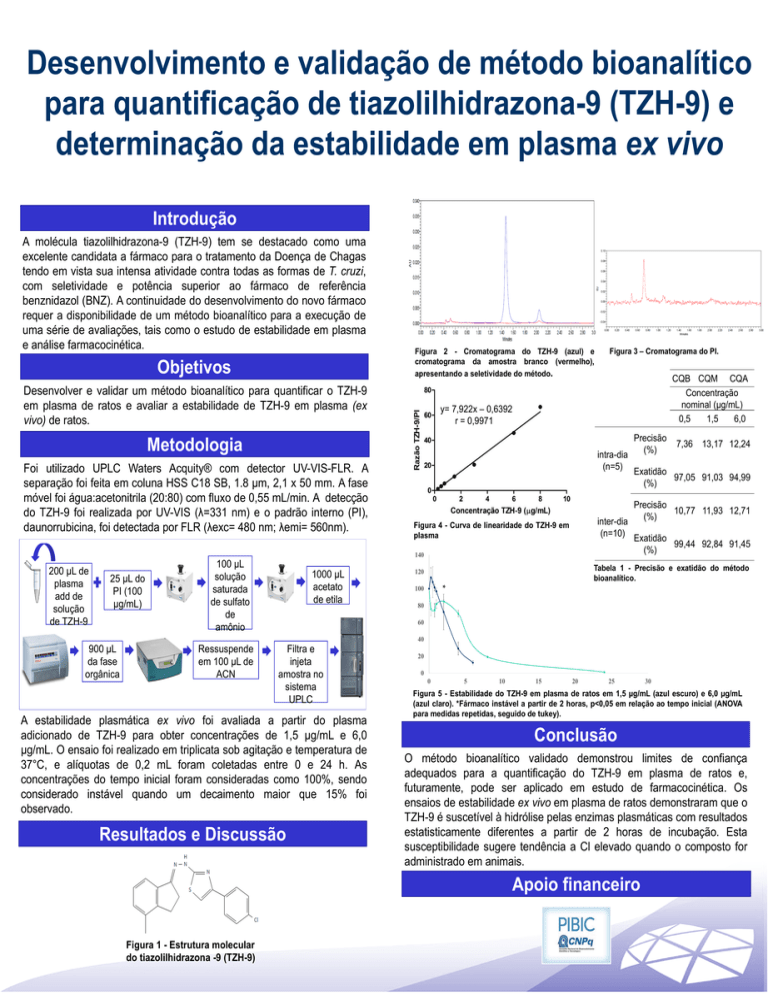
Figura 1 - Estrutura molecular
do tiazolilhidrazona -9 (TZH-9)
30












