DESENVOLVIMENTO DE INTERFACE AMIGÁVEL DE
ROTINAS EM C++ PARA SEGMENTAÇÃO DE IMAGENS DE
ESPERMATOZÓIDES OBTIDAS DE ESFREGAÇOS DE
SÊMEN
ALINE GUARATO DOS SANTOS1, MARCELO EMÍLIO BELETTI2
Resumo: O espermograma feito pela análise visual em microscopia de luz é hoje o método
mais utilizado para avaliar a fertilidade do macho em medicina veterinária. No entanto, este é
um exame subjetivo com grande variação entre examinadores. Tentando diminuir a
subjetividade foram desenvolvidas rotinas em ambiente de programação Scilab para avaliação
de espermatozóides. Visto que, no momento, estas rotinas são de uso complexo, exigindo do
usuário grande conhecimento de informática e análise de imagem, o objetivo deste trabalho
foi desenvolver uma interface amigável, que qualquer pessoa com um mínimo de
conhecimento de informática possa utilizá-la, principalmente médicos veterinários. Foi
desenvolvido um sistema de segmentação de imagens por limiar (thresholding), semiinterativo, isto é, o usuário fornece o arquivo (caminho) em que se encontra a imagem a ser
trabalhada, e o limiar mais adequado para essa imagem. O limiar fornecido será usado para
“binarizar” a imagem, ou seja, convertê-la para preto e branco. Depois de feito o thresholding,
a imagem, salva em preto e branco, é segmentada e dividida em rótulos que são regiões
específicas da imagem (espermatozóide ou fundo). Algumas regiões são descartadas, como a
de fundo e nos casos em que houver aglomeração ou pedaços de espermatozóides, por não
serem de interesse. Por fim, para cada rótulo, que represente uma região de espermatozóide,
de interesse, é criado um arquivo de imagem, que será utilizado para futuros cálculos e
avaliações. A interface demonstrou ser de fácil uso por pessoas sem grandes conhecimentos
de informática.
Palavras-chave: análise de imagem, espermatozóide, fertilidade, segmentação.
1
Faculdade de Computação - Universidade Federal de Uberlândia - Av. João Naves de Ávila,
2121 – Uberlândia - CEP: 38.400-902 - [email protected]
2
Instituto de Ciências Biomédicas - Universidade Federal de Uberlândia - Av. Pará, 1720
Uberlândia - CEP: - [email protected]
2
Abstract: The espermograma made for the visual analysis in light microscopy is today the
method more used to evaluate the fertility of the male in medicine veterinary medicine.
However, this is a subjective examination with great variation between examiners. Trying to
diminish the subjectivity routines in environment of Scilab programming had been developed
for evaluation of spermatozoa. Since, at the moment, these routines are of complex use,
demanding of the user great knowledge of computer science and analysis of image, the
objective of this work was to mainly develop a friendly interface, that any person with a
minimum of computer science knowledge can use it, doctors veterinarians. A system of
segmentation of images for threshold (thresholding), half-interactive was developed, that is,
the user supplies the archive (way) where if finds the image to be worked, and the adjusted
threshold more for this image. The supplied threshold will be used “to binarizar” the image,
that is, to convert it for black person and white. After made thresholding, the image, saved in
black person and white, is segmented and divided in labels that are specific regions of the
image (deep spermatozoon or). Some regions are discarded, as of deep and in the cases where
it will have agglomeration or pieces of spermatozoa, for not being of interest. Finally, for each
label, that represents an interest, spermatozoon region, is created an image archive, that will
be used for future calculations and evaluations. The interface demonstrated to be of easy use
for people without great knowledge of computer science.
Keywords: analysis of image, spermatozoon, fertility, segmentation
que pode indicar melhor o “status”
1. INTRODUÇÃO
funcional dos espermatozóides, habilidade
O espermograma é o principal
método
de
avaliação
fecundação
e
desenvolvimento
fertilidade
embrionário (UNANIAN, 2000). Estudos
utilizado na rotina veterinária. Dentre
mostram que a permanência de histonas
várias
espermáticas
somáticas ou ocorrência de anormalidades
avaliadas no espermograma de rotina,
nas protaminas podem levar à formação de
estão a avaliação da motilidade e da
distúrbios de condensação da cromatina
morfologia dos espermatozóides. Estas
(complexo
análises podem não ser suficientes, uma
espermatozóides, a qual se torna frouxa
vez que não avaliam a estrutura da célula
com repercussões sobre a fertilidade
espermática
a
(EVENSON et al., 1980; BELETTI e
cromatina (DNA e proteínas específicas),
MELLO, 1996; BELETTI e MELLO
características
como,
por
de
de
exemplo,
DNA
-
proteína)
dos
3
2004; BELETTI et al., 2004). Estas
MACLEOD e IRVINE, 1995). Para que a
alterações
análise
cromatínicas
podem
ser
de
imagem
seja
realmente
identificadas por cito fotometria de fluxo
otimizada,
com sêmen corado com alaranjado de
parâmetros sejam avaliados, tais como:
acridina, contudo o alto custo desta
regularidade da superfície, largura da base,
metodologia inviabiliza seu uso na rotina
centralização da implantação da cauda,
veterinária brasileira. Métodos alternativos
presença
utilizando esfregaços corados com azul de
regularidade da cauda (peça intermediária
toluidina (BELETTI e MELLO, 1997;
e principal), textura (condensação) do
BELETTI e MELLO, 2004) ou alaranjado
acrossoma e compactação da cromatina. O
de
uso de análise de imagem por computador
acridina
(TEJADA,
desenvolvidos
e
1984)
são
foram
utilizados
para
é
necessário
de
a
vacúolos
avaliação
da
que
novos
na
cabeça,
motilidade
e
principalmente em bovinos e humanos.
morfologia
Estas técnicas, assim como a avaliação de
sendo proposto. (GARRETT e BAKER,
motilidade
1995,
e
da
morfologia
dos
dos
espermatozóides
BELETTI
e
COSTA,
vem
2003)
espermatozóides, por serem realizadas
Recentemente
através de análise visual do examinador,
"Cybernetic Vision" do Instituto de Física
possuem certo grau de subjetividade e
de São Carlos - USP em colaboração com
mesmo tendenciosidade. Ao contrário da
Instituto de Ciências Biomédicas da UFU
motilidade, a morfologia normal dos
criaram programas em ambiente "Scilab",
espermatozóides, e mesmo as anomalias,
para
variam para cada espécie e se faz
espermatozóides, independente da espécie
necessário uma padronização da técnica
(BELETTI e COSTA, 2003; BELETTI et
para cada uma. A maioria das técnicas até
al., 2004, BELETTI et al., 2005a, b). Estes
agora
programas
padronizadas
para
alterações
morfológicas
espermatozóides
é
morfométrica
da
espermatozóides
restrita
determinar
à
cabeça
humanos,
o
grupo
análise
de
pesquisa
morfológica
avaliam
detalhadamente
de
a
de
morfologia da cabeça e a estabilidade da
análise
cromatina, utilizando esfregaços corados
de
com azul de toluidina. Já está demonstrado
sendo
que estes programas identificam alterações
mensuradas apenas a área, perímetro,
morfológicas
comprimento, largura e razão largura/altura
percebidas
(KATZ et al., 1986; JAGOE et al., 1986;
espermograma de rotina (BELETTI e
SCHRADER et al., 1990; DAVIS et al.,
COSTA, 2003, BELETTI et al., 2004,
1992; DAVIS e GRAVANCE, 1993;
BELETTI et al., 2005a). Entretanto, não se
e
pela
de
cromatina
análise
visual
não
do
4
sabe
a
verdadeira
influência
destas
pequenas alterações na fertilidade.
As
avaliação
claro que a analise de imagem por
computador não substituirá o médico
rotinas
desenvolvidas
da
morfologia
para
de
veterinário, mas servira como mais uma
ferramenta para esse profissional.
espermatozóides de touro são de uso
complexo, exigindo do usuário grande
2. MATERIAL E MÉTODOS
conhecimento de informática e análise de
imagem. Este trabalho teve como objetivo
principal
desenvolver
uma
2.1. Confecção dos esfregaços
interface
amigável, usando a análise de imagem por
computador,
para
da
de 8 reprodutores suínos e 5 bovinos,
morfologia dos espermatozóides de touro
independente de idade e raça. Três gotas de
(GARRETT e BAKER, 1995, BELETTI e
cada amostra de sêmen foram armazenadas
COSTA, 2003), permitindo que qualquer
em 1 ml de solução 2,94% de citrato de
pessoa, com um mínimo de conhecimento
sódio, formolada a 4% (WEITZE, 1977).
de
Desta
informática,
a
avaliação
Foram coletadas amostras de sêmen
possa
utilizá-la,
principalmente médicos veterinários.
Essa interface foi desenvolvida na
solução
foram
feitos
cinco
esfregaços de sêmen de cada amostra.
Para
testar
a
segmentação
tentativa de aumentar a precisão e rapidez
automática foram utilizadas variações da
da avaliação do sêmen, diminuindo a
coloração com azul de toluidina (BELETTI
subjetividade, tendenciosidade e falhas do
e MELLO, 1996) e rosa de Bengala
técnico/examinador. E importante deixar
(SILVA et al., 1993) (Figura 1).
Figura 1: Diferença de contrastes – (a) Imagem preparada com coloração Azul de
Toluidina. (b) Imagem preparada com coloração Rosa de Bengala.
5
através de microscópio trinocular Olympus
2.2. Captura das imagens
BX40 acoplado a câmera Olympus OLYApós definir-se a coloração rosa de
Bengala
como
sendo
a
de
200, ligada a um computador PC através
melhor
de placa digitalizadora Data Translation
contraste, como mostra a Figura 1, foram
3153. As imagens dos esfregaços foram
feitos preparados de todas as amostras de
obtidas utilizando-se objetiva de 40x e
sêmen e posteriormente, capturadas 10
100x em microscopia de luz comum
imagens digitalizadas de cada esfregaço
(transiluminação).
Seta 2
Seta 1
Seta 3
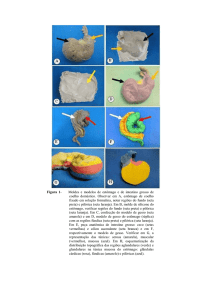
Figura 2: Interface – Tela Inicial. (Seta 1) Informar o arquivo de imagem a ser
trabalhada. (Seta 2) Informar o valor de limiar. (Seta 3) Informar o valor de limiar.
6
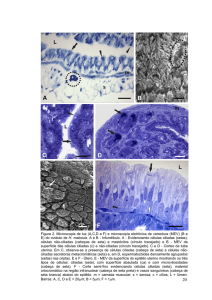
Figura 3: Exemplos de “binarização” conforme variação no valor do limiar – (a) Imagem
de referência com coloração azul de toluidina. (b) Limiar igual a 200. (c) Limiar igual a
205. (d) Limiar igual a 215. (e) Limiar igual a 218. (f) Limiar igual a 222.
7
Figura 4: Exemplos de “binarização” conforme variação no valor do limiar – (a) Imagem
de referência com coloração rosa de Bengala. (b) Limiar igual a 180. (c) Limiar igual a 190.
(d) Limiar igual a 200. (e) Limiar igual a 210. (f) Limiar igual a 220.
8
2.3. Desenvolvimento do sistema de
ser trabalhada e, então, informa o limiar
entrada e segmentação de imagens
mais adequado para essa imagem, no local
indicado pela seta 2, na mesma figura. O
Foi desenvolvido um sistema, com
limiar fornecido é usado para “binarizar” a
uma interface simples (Figura 2), de
imagem desejada, ou seja, convertê-la para
segmentação
preto e branco. Essa técnica é conhecida
de
imagens
por
limiar
(thresholding) (BELETTI et al., 2004;
como thresholding.
BELETTI et al., 2005a), semi-interativo,
Outra opção para informar o limiar
isto é, o usuário fornece, no local indicado
é por utilizar a barra, numerada de 1 à 255,
pela Seta 1 na Figura 2, o arquivo
mostrada pela seta 3 na Figura 2.
(caminho) em que se encontra a imagem a
Seta 3
Seta 2
Seta 1
Figura 5: Interface exibindo imagem fornecida (Seta 1) e aguardando um valor de limiar
(Seta 2 ou 3).
9
A Figura 3 mostra exemplos de
preciso informá-la na interface, como
“binarização” conforme o valor do limiar,
podemos observar na Figura 5, bem como
de uma imagem preparada com coloração
o limiar mais adequado que, como
azul de toluidina. A Figura 4, de uma,
observamos na Figura 4, para a imagem
preparada com coloração rosa de Bengala.
em questão é 200. Ao clicar no botão
Nesta, observamos que a “binarização”
indicado na Figura 6, pela Seta 2, será feito
apresenta melhores resultados pela questão
o thresholding com o valor de limiar
do contraste, resultante do tipo de corante
confirmado e a imagem “binarizada” será
usado para o preparo da imagem.
exibida na interface, conforme a Figura 6.
Consideraremos
a
imagem
da
Porém, a imagem resultante ainda não está
Figura 4 (a) como exemplo. Para isso, é
salva, pois a função dessa visualização é
Seta 1
Seta 2
Seta 3
Seta 4
Figura 6: Interface – (Seta 1) Valor de limiar informado. (Seta 2) Botão para confirmação de
limiar. (Seta 3) Imagem “binarizada” conforme o valor de limiar confirmado.
(Seta 4) Botão para salvar imagem “binarizada” e suas respectivas segmentações.
10
permitir uma análise do limiar fornecido e
avaliações. Na Figura 7, (a) apresenta um
possíveis correções.
exemplo
didático
de
uma
imagem
Depois de feito o thresholding, a
“binarizada” e (b) essa imagem depois de
imagem, salva em preto e branco, é
rotulada. Nesse exemplo, o rótulo de valor
segmentada e dividida em rótulos, que são
zero será descartado e para os outros
regiões
imagem
rótulos (1, 2, 3, 4 e 5), que representam
(espermatozóide ou fundo). Por fim, para
regiões de interesse (espermatozóides),
cada rótulo, que represente uma região de
formaremos cinco imagens que serão
espermatozóide, é criado um arquivo, que
salvas em cinco arquivos diferentes.
específicas
da
será utilizado para futuros cálculos e
Figura 7: Exemplo didático – (a) Imagem “binarizada”. (b) Imagem rotulada
(5 rótulos de interesse)
Voltemos para o exemplo da
imagem mostrada na Figura 4 (a). Depois
mostradas na Figura 8, que serão salvas em
arquivos distintos.
de fornecido o valor do limiar mais
adequado
e
a
desenvolvido, até então, faz a segmentação
rotulação nos dá um resultado de quatro
de uma imagem fornecida, separando suas
rótulos. Porém, serão selecionados apenas
regiões de interesse. Essas regiões são
dois rótulos de interesse, para os quais
salvas,
serão
separados para análises futuras.
criadas
feito
o
duas
thresholding,
Tendo como visão geral, o sistema
imagens
como
como
imagem,
em
arquivos
11
Figura 8: Rótulos extraídos e salvos como imagens.
A
interface
desenvolvida
foi
utilizada por quatro usuários (alunos de
de segmentação e aproveitar quase todos
os espermatozóides das imagens.
graduação e pós-graduação da Faculdade
A
interface
desenvolvida
foi
de Medicina Veterinária) sem grande
facilmente utilizada pelos usuários sem
conhecimento de informática para testar
grandes conhecimentos de informática e
sua interatividade e facilidade de uso.
sem experiência em análise de imagem,
desde que fosse dada uma explicação
anterior do funcionamento do software. A
3. RESULTADOS E DISCUSSÃO
linguagem C++ mostrou-se adequada para
A coloração com rosa de Bengala,
o desenvolvimento deste tipo de interface.
por ser mais intensa quando comparada
com
o
azul
de
toluidina,
permitiu
estabelecer o limiar de segmentação com
Ainda se faz necessário interligar
esta interface com as rotinas de análise das
imagens já segmentadas.
maior facilidade. Assim, a segmentação
em esfregaços realizados com ros de
Bengala
foi
realizada
aproveitando
quase
rapidamente
todos
e
4. CONCLUSÃO
os
espermatozóides contidos nas imagens. Já
Conclui-se que a interface desenvolvida
na coloração com azul de toluidina, os
facilita a segmentação de imagens de
espermatozóides
pouco
espermatozóides obtidas de esfregaços de
contraste com o fundo da imagem,
sêmen, mesmo quando o usuário não
dificultando a definição do limiar de
possui
segmentação. Porém, apesar da maior
informática ou análise de imagem.
apresentaram
dificuldade, foi possível definir-se o limiar
grandes
conhecimentos
de
12
BELETTI, M. E.; MELLO, M. L. S.
5. AGRADECIMENTOS
Comparison between the toluidine blue
Este trabalho foi apoiado pela FAPEMIG -
stain
Fundação de Amparo à Pesquisa do Estado
evaluation of rabbit sperm chromatin
de Minas Gerais e pelo Instituto de
condensation and their relationship with
Ciências Biomédicas da Universidade
sperm morphology. Theriogenology v. 62,
Federal de Uberlândia (UFU).
n. 3-4, p. 398-402, 2004.
and
the
feulgen
reaction
for
BELETTI, M. E.; COSTA, L. F.; VIANA,
6. REFERÊNCIAS BIBLIOGRÁFICAS
M. P. A computational approach to the
characterization
of
bovine
sperm
BELETTI, M. E.; COSTA, L. F. A
chromatin
systematic
Histochemistry v. 79, n. 1, p. 17-23, 2004.
approach
to
multi-species
alterations.
Biotechnic
&
sperm morphometrical characterization.
Analytical and Quantitative Cytology and
BELETTI, M. E.; COSTA, L. F.; VIANA,
Histology v. 25, n. 2, p. 97-107, 2003.
M. P. A comparison of morphometric
characteristics of sperm from fertile Bos
BELETTI, M. E.; MELLO, M. L. S.
Taurus and Bos indicus bulls in Brazil.
Methodological variants contributing to
Animal Reproduction Science v. 85, n. 1-2,
detection
p. 105-116, 2005a.
of
abnormal
DNA-protein
complexes in bull spermatozoa. Brazilian
Journal of Genetic v. 19, n. 1, p. 97-103,
BELETTI, M. E.; COSTA, L. F.; VIANA,
1996.
M. P. A spectral framework for sperm
shape
characterization.
Computers
in
BELETTI, M. E.; MELLO, M. L. S.
Biology and Medicine v. 35, n. 6, p. 463-
Testicular and semen alteration after three
473, 2005b.
days of experimental cryptorchidism in
rabbit. Brazilian Journal of Morphological
DAVIS, R.O.; BAIN, D.E.; SIEMERS,
Science v. 14, p. 88-88, 1997.
R.J.; THAL, D.M.; ANDREW, J.B.;
GRAVANCE,
C.G.
precision
the
of
Accuracy
and
CellForm-Human
automated sperm morphometry instrument.
Fertility and Sterility v.58, n.4, p.763-769,
1992.
13
DAVIS,
R.O.;
GRAVANCE,
C.G.
MACLEOD, I.C.; IRVINE, D.S.
The
Standadization of specimen preparation,
predictive
staining, and sampling methods improves
analysis in the context of a donor
automated
insemination
sperm-head
morphometry
analysis. Fertility and Sterility v.59, n.2,
value
of
computer-assisted
programme.
Human
Reproduction v.10, n.3, p.580-586, 1995.
p.412-417, 1993.
SCHRADER, S.M.; TURNER, T.W.;
EVENSON, D. P.; DARZYNKEIWICZ,
SIMON, S.D. Longitudinal study of semen
Z.; MELAMED, M. R. Relation of
quality of unexposed workers: sperm head
mammalian
morphometry. Journal of Andrology v.11,
sperm
heterogeneity
to
chromatin
fertility.
Science,
n.1, p.32-39, 1990.
Washington, v. 210, p. 1131-1133, 1980.
SILVA, A. E. D. F.; DODE, M. A. N.;
GARRETT, C.; BAKER, H. W. A new
fully
automated
system
for
the
morphometric analysis of human sperm
heads. Fertility and Sterility v. 63, n. 6, p.
1306-1317, 1995.
JAGOE,
J.R.;
HUDSON,
UNANIAN,
M.
M.
Capacidade
reprodutiva de touros de corte: funções,
anormalidades
e
fatores
que
a
influenciam. Campo Grande: EMBRAPACNPGC, 1993. 128p.
WASHBROOK,
E.A.
Morphometry
N.P.;
of
spermatozoa using semiautomatic image
analisys. Journal of Clinical Pathology
TEJADA, R. I.; MITCHELL, J. C.;
NORMAN,
A.;
MARIK,
J.
J.;
FRIEDMAN, S. A test for the practical
evaluation of male fertility by acridine
v.39, n.12, p.1347-1352, 1986.
orange (AO) fluorescence. Fertility and
KATZ,
D.F.;
OVERSTREET,
J.W.;
Sterility v. 42, p. 87-91, 1984.
SAMUELS, S.J.; NISWANDER, P.W.;
BLOMM,
T.D.;
LEWIS,
E.L.
Morphometric analysis of spermatozoa in
the assessment of human male fertility.
Journal of Andrology v.7, n.4, p.203-210,
1986.
UNANIAN,
M.
M.
Integridade
da
cromatina: método complementar para
avaliação da qualidade do sêmen bovino.
Ministério da Agricultura – Embrapa, Doc.
56, dez/2000.
14
WEITZE K. F.. Untersuchungen zur
Tiefgefrierkonservierung
von
Kaninchensperma. Tese (Livre-Docência)
– Tierärztliche Hochschule, Hannover,
1977. 165 p.