Lista de
Química – P2 – 2°Ano III Bimeste 2014
Professora: Núbia de Andrade
Aluno: ________________________________________________________
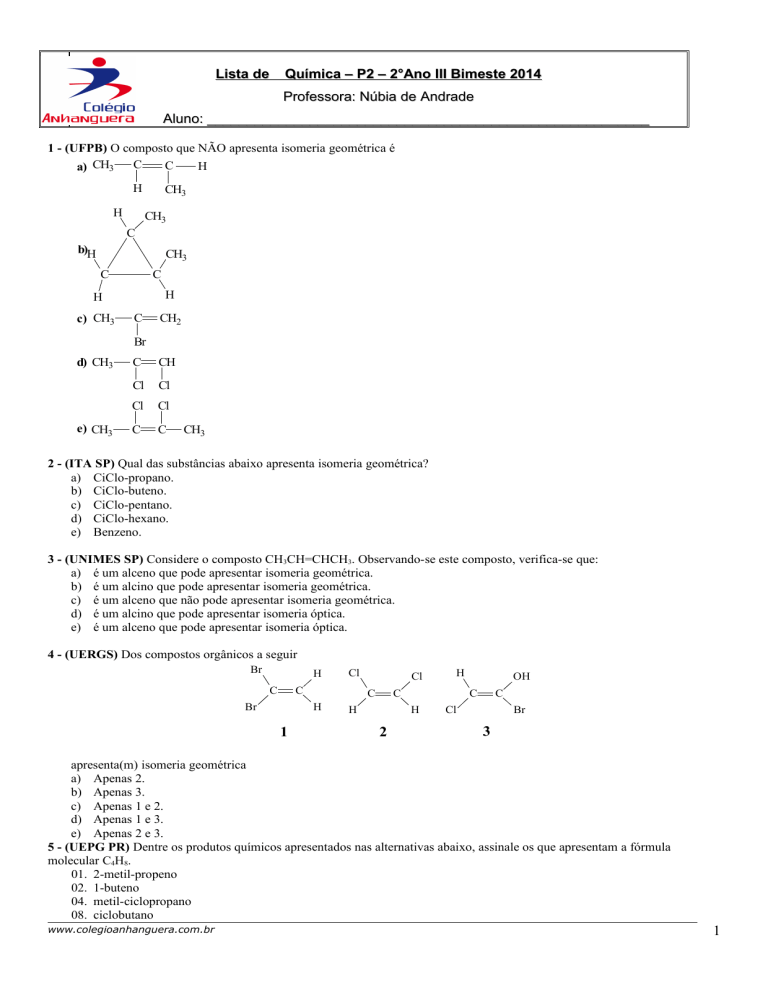
1 - (UFPB) O composto que NÃO apresenta isomeria geométrica é
C
C
H
a) CH3
H
H
CH3
CH3
C
b)H
CH3
C
C
H
H
c) CH3
C
CH2
Br
d) CH3
e) CH3
C
CH
Cl
Cl
Cl
Cl
C
C
CH3
2 - (ITA SP) Qual das substâncias abaixo apresenta isomeria geométrica?
a) CiClo-propano.
b) CiClo-buteno.
c) CiClo-pentano.
d) CiClo-hexano.
e) Benzeno.
3 - (UNIMES SP) Considere o composto CH3CH=CHCH3. Observando-se este composto, verifica-se que:
a) é um alceno que pode apresentar isomeria geométrica.
b) é um alcino que pode apresentar isomeria geométrica.
c) é um alceno que não pode apresentar isomeria geométrica.
d) é um alcino que pode apresentar isomeria óptica.
e) é um alceno que pode apresentar isomeria óptica.
4 - (UERGS) Dos compostos orgânicos a seguir
Br
H
C
Cl
C
Br
C
H
1
Cl
H
C
H
H
2
OH
C
C
Cl
Br
3
apresenta(m) isomeria geométrica
a) Apenas 2.
b) Apenas 3.
c) Apenas 1 e 2.
d) Apenas 1 e 3.
e) Apenas 2 e 3.
5 - (UEPG PR) Dentre os produtos químicos apresentados nas alternativas abaixo, assinale os que apresentam a fórmula
molecular C4H8.
01. 2-metil-propeno
02. 1-buteno
04. metil-ciclopropano
08. ciclobutano
www.colegioanhanguera.com.br
1
6 - (UFRR) Quais das seguintes estruturas representam combinações de isômeros constitucional?
Br
CH3
CH3CHCH2Br
CH2Br
CH3
CH3CHCH2CH3
CH3CCH2Br
CH3
I
a)
b)
c)
d)
e)
II
III
IV
Assinale a alternativa que os identificam, respectivamente:
I, II, e III
I e II
II e III
I, III, e IV
II, III, e IV
7 - (UEM PR) Escreva apenas uma das possíveis estruturas para cada fórmula molecular abaixo e atribua o nome (usual ou
IUPAC) ao composto. Indique todos os átomos envolvidos e os tipos de ligações entre os átomos (ligações simples, ligações
duplas ou ligações triplas).
a) C7H6O2
b) C3H5ON
8 - (MACK SP) Luvas cirúrgicas, balões e chupetas são feitos de poliisopreno, material obtido na polimerização do isopreno. O
isopreno, cujo nome oficial é metil-1,3-butadieno,
a) tem fórmula molecular C4H6.
b) é isômero do ciclopenteno.
c) é isômero do 3-metil-1-pentino.
d) possui cadeia carbônica aberta, saturada e ramificada.
e) possui dois carbonos terciários.
9 - (MACK SP) Em uma substância iônica, o número de elétrons cedidos e recebidos deve ser o mesmo. Assim, em
uma fórmula de óxido de alumínio, esse número de elétrons é igual a
Dado: grupo Al = 13 ou 3A, O = 16 ou 6A.
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
10 - (UERJ) Compostos de enxofre são usados em diversos processos biológicos. Existem algumas bactérias que
utilizam, na fase da captação de luz, o H2S em vez de água, produzindo enxofre no lugar de oxigênio, conforme a
equação química:
6 CO2 + 12 H2S
→ C6H12O6 + 6 H2O + 12 S
O elemento reduzido na equação química está indicado em:
a) enxofre
b) carbono
c) oxigênio
d) hidrogênio
11 - (UFRR) Determine o número de oxidação do elemento cloro nas substâncias a seguir:
(i) HCl
(ii) Cl2
(iii) NaClO
(iv) LiClO2
(v) HClO3
(vi) HClO4
Respectivamente, da esquerda para direita, podemos afirmar que a resposta correta é:
a) 1-, 0, 1+, 3+, 5+, 7+
b) 0, 1-, 1+, 3+, 5+, 7+
c) 7+, 5+, 0, 1-, 1+, 3+
d) 7+, 5+, 3+, 1+, 0, 1e) 5+, 7+, 1-, 0, 3+, 1+
12 - (UNIFOR CE) Os metais alcalinos reagem com água deixando a solução resultante alcalina. A equação a seguir
representa a reação do sódio metálico com água:
2Na (s) + 2H2O (l) → 2NaOH (aq) + H2 (g)
Nessa reação, cada átomo de sódio se
www.colegioanhanguera.com.br
2
a)
b)
c)
d)
e)
oxida, cedendo elétron a um átomo de oxigênio.
oxida, cedendo elétron a um átomo de hidrogênio.
oxida, recebendo elétron de um átomo de oxigênio.
reduz, recebendo elétron de um átomo de oxigênio.
reduz, recebendo elétron de um átomo de hidrogênio.
13 - (MACK SP) O número de oxidação do cloro, nas substâncias formuladas abaixo é, respectivamente
NaClO3 , NaCl , NaClO , Cl2
a) +1 , +7 , –1 e –1.
b) +5 , –1 , +1 e zero.
c) +5 , +7 , zero e -2.
d) +7 , +1 , –1 e zero.
e) +4 , –1 , zero e zero.
14 - (UNAMA AM) Considere o número de oxidação (Nox) do hidrogênio e do oxigênio.
Em seguida, responda: o número de oxidação (Nox) do fósforo no ácido pirofosfórico (H 4P2O7) é:
a) zero
b) +2
c) +5
d) +10
e) +11
15 - (Fac.Filo.Recife PE) Os Nox do nitrogênio nas espécies KNO3, N2O, NO2-, H2N2O2, Ba(NO2)2 e N2 são
respectivamente:
a) +5, +1, +1, +4, +3, -3
b) +2, +3, +3, +1, +3, 0
c) +5, +1, +3, +1, +5, -3
d) +5, +3, +3, +4, +3, -3
e) +5, +1, +3, +1, +3, 0
16 - (UFRRJ)
Os números de oxidação do enxofre nas substâncias H2S, H2SO4, Na2SO3, SO2 e Na2S são,
respectivamente,
a) +1, -7, +4, -3 e +1
b) –1, +2, -6, +2 e –2
c) +1, +6, +7, +2 e +2
d) –2, -7, +3, +4 e –1
e) –2, +6, +4, +4 e –2
17 - (ACAFE SC) Determinando o número de oxidação do elemento central do ácido sulfúrico (H 2SO4) ácido
carbônico (H2CO3) ácido silícico (H2SiO4) ácido pirofosfórico (H4P2O7) e ácido perclórico (HClO 4), os valores são,
respectivamente:
a) +2, +4, +5, +5, +7
b) +1, +1, +1, +2, +3
c) +4, +4, +4, +5, +7
d) +3, +3, +3, +7, +4
e) -2, +4, +5, -5, +7
18 - (UFES) Os estados de oxidação do manganês (Mn) nos óxidos MnO, MnO 2, Mn2O4 são respectivamente:
a) +2, +3, +9
b) -2, -4, -7
c) +2, +4, +7
d) +2, +4, +14
e) +2, +2, +7
19 - (UFSE SE) Calcule o número de oxidação do loro nos compostos:
a) HCl
b) HClO
c) HClO2
www.colegioanhanguera.com.br
3
d) Ba(ClO3)2
e) Al(ClO4)3
20 - (UNIFESP SP) Em qual composto o nitrogênio apresenta maior número de oxidação?
a) NO.
b) NO2.
c) N2O.
d) N2O3.
e) N2O5.
www.colegioanhanguera.com.br
4












