3.1 Mecanismos de transferência de energia
sob a forma de calor
Condução – Processo de transferência de energia sob a
forma de calor que ocorre devido ao choque das partículas
e sem transporte de matéria (as partículas não se deslocam).
As partículas que estão perto da fonte de calor aquecem
(ficam com mais energia cinética), chocam com as
partículas mais próximas e transferem parte da sua energia.
Este processo repete-se e o calor é conduzido ao logo do
material.
3.1 Mecanismos de transferência de energia
sob a forma de calor
Ocorre principalmente nos sólidos, mas também ocorre nos
líquidos e nos gases.
Os metais são bons condutores de calor porque têm
eletrões livres, que podem chocar facilmente e transferir
rapidamente a energia através do material.
Os materiais pouco densos, como o ar, a lã, a cortiça ou
a esferovite são maus condutores de calor, porque têm
menos partículas, o que torna mais difícil a condução do calor.
3.1 Mecanismos de transferência de energia
sob a forma de calor
Convecção – Processo de transferência de energia sob a
forma de calor que ocorre em gases e líquidos devido ao
movimento das partículas.
O gás ou o líquido aquece, fica menos denso e sobe,
transferindo parte da sua energia para outras partículas.
Depois, arrefece, fica mais denso e desce até se aproximar
da fonte de calor e aquecer novamente.
3.1 Mecanismos de transferência de energia
sob a forma de calor
Este processo repete-se formando correntes de convecção
que permitem uma transferência rápida de calor.
Para aumentar a eficiência do processo podem usar-se
ventoinhas.
3.1 Mecanismos de transferência de energia
sob a forma de calor
Balanço energético – É um esquema que permite
compreender as transformações e transferências de
energia num sistema.
O sistema é representado por um círculo.
A energia que entra no sistema (energia fornecida)
e a energia que sai do sistema (energia útil e energia
dissipada) são representadas por setas.
3.1 Mecanismos de transferência de energia
sob a forma de calor
Num balanço energético pode-se efetuar os seguintes
cálculos:
Energia fornecida = Energia útil + Energia dissipada
Ef = Eu + Ed
Rendimento = Energia útil / Energia fornecida x 100
η = Eu / Ef x 100
O rendimento mede-se em percentagem.
Não existe nenhum processo com rendimento de 100%
(é sempre menor que 100%) porque há sempre energia
que se dissipa.
3.1 Mecanismos de transferência de energia
sob a forma de calor
Numa lâmpada incandescente, cerca de 95% da energia
elétrica fornecida vai ser transformada em calor (energia
dissipada), que se perde para o ambiente.
Apenas cerca de 5% da energia elétrica é transformada em
energia luminosa (energia útil).
3.1 Mecanismos de transferência de energia
sob a forma de calor
Numa lâmpada incandescente o rendimento é 5%.
Isto significa que por cada 100 J de energia elétrica
fornecida, 5 J saem na forma de energia luminosa e 95 J
são dissipados para o ambiente na forma de calor.
h = Eu / Ef x 100 = 5 / 100 x 100 = 5%
3.1 Mecanismos de transferência de energia
sob a forma de calor
Numa lâmpada fluorescente compacta o rendimento é 20%.
Isto significa que por cada 100 J de energia elétrica
fornecida, 20 J saem na forma de energia luminosa
e 80 J são dissipados para o ambiente na forma de calor.
3.1 Mecanismos de transferência de energia
sob a forma de calor
Numa central térmica de produção de energia elétrica o
rendimento é 40%.
Isto significa que 40% da energia fornecida pelo
combustível fóssil é transformada em energia elétrica,
sendo a restante energia (60%) dissipada na forma de calor.
3.1 Mecanismos de transferência de energia
sob a forma de calor
3.2 Bons e maus condutores de calor
Bom condutor do calor (mau isolante térmico) –
Material que possui uma condutividade térmica elevada.
Ex: metais.
Mau condutor de calor (bom isolante térmico) –
Material que possui uma condutividade térmica baixa.
Ex: lã, cortiça, esferovite, madeira, borracha, poliestireno
ou poliuretano.
Estes materiais reduzem as trocas de energia na forma
de calor, entre o interior e o exterior das habitações,
e baixam os custos de consumo energético dos aparelhos
de climatização.
3.2 Bons e maus condutores de calor
Condutividade térmica (KT) – Quantidade de energia,
sob a forma de calor (Q), que atravessa, em cada segundo (∆t),
a espessura (L) de 1 m do material, compreendida entre duas
superfícies paralelas de área (A) igual a 1 m2, quando a diferença
entre as temperaturas (T2 – T1) dessas superfícies é de 1 K (1 °C).
A unidade SI de condutibilidade térmica é W.m-1.K-1 (W = J.s-1)
Quantidade de calor que atravessa
o material por segundo:
𝑄
𝑇) − 𝑇+
= 𝐾𝑇𝐴
∆𝑡
𝐿
T2
T1
L
3.2 Bons e maus condutores de calor
3.2 Bons e maus condutores de calor
Capacidade térmica mássica (c) – Quantidade de
energia, na forma de calor, que o material absorve ou
liberta, por unidade de massa, quando a sua temperatura
varia de 1 K (1°C), sem ocorrer mudança de estado físico.
c - capacidade térmica mássica do material
Q - quantidade de energia transferida como calor
m – massa do material
∆θ – variação da temperatura do material
3.2 Bons e maus condutores de calor
A capacidade térmica mássica da água é 4186 J.kg-1.K-1
Isto significa que é necessário fornecer 4186 J de energia a
1 kg de água para que a sua temperatura aumente 1 K (1°C).
A capacidade térmica mássica do ferro é menor do que a da
água (443 J.kg-1.K-1), o que significa que a temperatura do
ferro aumenta mais facilmente.
Quando se fornece igual quantidade de energia, na forma
de calor, a dois corpos com igual massa, um constituído por
ferro e o outro constituído por água, verifica-se um aumento
de temperatura no ferro superior ao aumento de temperatura
na água.
3.2 Bons e maus condutores de calor
A água tem uma capacidade térmica mássica muito elevada.
A água necessita de absorver muita energia para aumentar
a sua temperatura, e também liberta muita energia quando
a sua temperatura baixa.
3.2 Bons e maus condutores de calor
Isto significa que a água demora mais tempo a aquecer e a
arrefecer.
Durante o dia, a temperatura atmosférica é menor junto ao
mar porque a temperatura do mar não aumenta tanto como
a do continente.
Durante a noite, temperatura atmosférica é maior junto ao
mar porque a temperatura do mar não desce tanto como a
do continente.
3.2 Bons e maus condutores de calor
3.2 Primeira Lei da Termodinâmica
A energia fornecida a um sistema termodinâmico resulta
da soma de:
Q – Energia que o sistema recebe sob a forma de calor;
W – Energia fornecida ao sistema sob a forma de trabalho.
Energia fornecida = Q + W
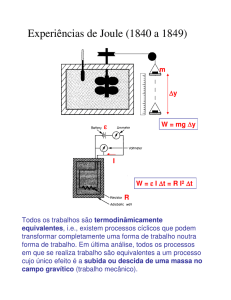
3.2 Primeira Lei da Termodinâmica
Primeira Lei da Termodinâmica – A variação da energia
interna (∆U ) de um sistema com massa constante
só pode ficar a dever-se a trocas de energia entre o
sistema e a sua vizinhança, quer na forma de calor,
quer na forma de trabalho.
Sistema
Q
U
i
U
∆U = Uf - Ui
∆U = Q + W
f
W
3.2 Primeira Lei da Termodinâmica
Q e W são positivos quando a energia entra no sistema.
Q e W são negativos quando a energia sai do sistema.
Primeira Lei da Termodinâmica (Lei da Conservação da Energia) –
Num sistema isolado, não há trocas de energia com o
exterior, pelo que Q = 0, W = 0 e ∆U = Q + W = 0.
Neste caso, a energia do sistema fica constante:
∆U = Uf - Ui = 0 e Uf – Ui = 0
A energia total do Universo não varia porque é um sistema
isolado (∆U = 0).
3.2 Primeira Lei da Termodinâmica
A energia libertada pela combustão da gasolina num
motor de automóvel nunca é totalmente transferida
para o motor na forma de trabalho mecânico (energia útil).
A maior parte dessa energia perde-se como calor
(energia dissipada), sendo transferida para o motor e
para o ambiente durante o movimento do automóvel.
Universo
Motor
3.2 Segunda Lei da Termodinâmica
A entropia (S) é uma grandeza que mede a desordem
de um sistema.
Quando o gelo funde a entropia aumenta.
Quando o gelo funde (recebe energia na forma de calor),
a água passa do estado sólido para o estado líquido e a
estrutura ordenada das moléculas de água no gelo é
destruída. Isto acontece porque a energia cinética
média das moléculas é maior no estado líquido do que
no estado sólido.
Q
3.2 Segunda Lei da Termodinâmica
Segunda Lei da Termodinâmica – A entropia (desordem)
do Universo aumenta em todos os processos naturais.
O sentido da transferência espontânea de energia do
corpo mais quente para o corpo mais frio obedece à
Segunda Lei da Termodinâmica.
http://nautilus.fis.uc.pt/molecularium/pt/entropia/pags/demonmax
3.2 Segunda Lei da Termodinâmica
Máquina térmica – Transforma calor em trabalho
(energia útil). Ex: máquina a vapor, motor de automóvel
e reator nuclear.
3.2 Segunda Lei da Termodinâmica
A máquina térmica recebe de uma fonte quente (gasolina ou carvão
em combustão…) a energia Q1 na forma de calor, e converte-a
parcialmente em trabalho útil (movimento de um êmbolo, rotação
de um eixo…), cedendo o restante calor Q2 a uma fonte fria
(atmosfera, água do rio…). O sentido da transferência de calor está
de acordo com a 2ª Lei da Termodinâmica.
3.2 Segunda Lei da Termodinâmica
Rendimento (h) – Quociente entre a energia transferida
para o exterior na forma de trabalho (W) e a energia
recebida da fonte quente na forma de calor (Q1).
O rendimento mede-se em percentagem.
h = W / Q1 x 100
Não existe nenhuma máquina térmica com rendimento
de 100% (é sempre menor que 100%) porque a máquina
não transforma em trabalho toda a energia que recebe
da fonte quente (perde energia na forma de calor para
a fonte fria).
3.2 Segunda Lei da Termodinâmica
• Escola Secundária de Maria Lamas
• Física e Química – 12º Ano Profissional
• Nelson Correia