mama
Diagnóstico precoce em câncer
de mama – Como proceder e
quais são as controvérsias?
Divulgação
Introdução
Cláudia T. Salviato Mameri
* Mestre em radiologia pela
Unifesp; mastologista; professora
e coordenadora da residência de
mastologia da Universidade Federal
do Espírito Santo; presidente do
Departamento de Prevenção e
Detecção Precoce do Câncer
de Mama da Sociedade Brasileira
de Mastologia (SBM);
coordenadora do Serviço de
Imaginologia Mamária do
Multiscan – Vitória, ES.
Contato:
[email protected]
28
agosto/setembro 2011 Onco&
O câncer de mama se constitui em grave problema
de saúde pública em países desenvolvidos e em
desenvolvimento, apresentando altos níveis de incidência e mortalidade específica em mulheres a
partir de 35 anos de idade, segundo dados estatísticos mundiais.
Sabemos que uma em cada oito mulheres da
população geral desenvolverá câncer de mama em
alguma fase da vida e que essa doença figura entre
as três maiores causas de morte não acidental de
mulheres entre 35 e 70 anos de idade.
Apesar de exibir taxas médias de crescimento
tumoral lento, seu diagnóstico clínico se mantém
tardio no Brasil, devido à falta de programas de rastreamento populacional. As consequências, além da
alta mortalidade, são alto custo no tratamento e alta
morbidade física e psicológica das pacientes.
O câncer de mama é mais incidente em mulheres com história familiar de 1o grau, em nulíparas, nas sedentárias, nas obesas e também nas
etilistas. Entretanto, não apresentar nenhum dos fatores de risco listados acima não representa segurança, já que o maior e principal fator de risco é ser
do sexo feminino.
Protocolo de rastreamento
na população geral
A literatura nos mostra que o autoexame não serve
como técnica de rastreamento do câncer de mama,
já que os estudos não evidenciaram mudança na
taxa de mortalidade específica em grupos de mulheres submetidas a esse método isoladamente.
Há cerca de 30 anos, o exame de mamografia,
realizado periodicamente em alguns trials em intervalos de um a dois anos, vem demonstrando redução na mortalidade específica por câncer de
mama, com índices que variam de 30% a 60% (Ver-
beek, 1985; Roberts, 1990; Miller, 1992; Otto,
2003). Esse método tem a capacidade de detectar
lesões mínimas, a partir de 3 mm. Quanto mais precoce a detecção da lesão maligna mamária, menores
são os riscos de metástase axilar e/ou de metástase
à distância, aumentando a possibilidade de cura e
de tratamento cirúrgico conservador.
A recomendação atual da Sociedade Americana
de Câncer (ACS, na sigla em inglês), do Colégio
Americano de Radiologia (ACR, na sigla em inglês)
e da Sociedade de Imaginologia Mamária (SBI, na
sigla em inglês) preconiza realização de mamografia
anual para mulheres a partir de 40 anos de idade.
Vale observar que essas são as recomendações para
a população geral, ou seja, sem risco elevado.
Apesar dos números indicarem incidência semelhante dos 40 aos 50 anos (Kerlikowke, 1993; Evans,
2006; Hendrick, 1997; Moss, 2006) e dos 50 aos 60
anos, alguns grupos ainda tentam difundir o conceito de que o rastreamento deve ser iniciado aos 50
anos de idade (Shapiro, 1994; Sox, 1995).
Outra discussão se refere ao intervalo entre os
exames: anual ou bianual. Essa divergência se mantém, a despeito dos achados contundentes de maior
índice de detecção precoce e menor taxa de carcinoma de intervalo com o rastreamento anual.
Em 2009, a U.S. Preventive Services Task Force
(USPSTF), força-tarefa independente constituída por
profissionais médicos e paramédicos nos EUA, publicou recomendação, que vigora até hoje, para a realização de rastreamento bianual de mulheres entre
50 e 74 anos de idade, “calculando” manter 81% do
benefício do rastreamento anual a partir de 40 anos
e obter sensível redução nos “danos” (alto custo, estresse e morbidade referentes às biópsias dos achados
falso-positivos). Para as pacientes entre 40 e 49 anos,
o rastreamento deveria considerar seu risco pessoal.
Respondendo às recomendações da USPSTF,
cientistas representando as entidades ACS, ACR e
SBI publicaram manisfesto contrário, considerando que:
1) A literatura não dá sustentação ao estabelecimento do ponto de
corte em 50 anos (Kopans, 1996);
2) Não há evidência de redução na mortalidade ao se rastrear pacientes por risco individual;
3) Ao se rastrear somente alto risco para mulheres entre 40 e 49 anos,
perde-se a maioria dos cânceres de mama, já que entre 80% e 90% das
pacientes com diagnóstico da doença não apresentam fatores de alto risco;
4) Quanto à idade para interromper o rastreamento, não há estudos
incluindo mulheres com mais de 74 anos. Sabe-se, porém, que a sensibilidade e a especificidade são maiores nessa idade (Kopans, 1996),
o que motivou o consenso internacional a estender o rastreamento até
a expectativa de vida de 5 a 7 anos, desde que as possíveis comorbidades não impeçam e o tratamento de possível lesão seja viável.
Sensibilidade da mamografia
A eficiência do rastreamento mamográfico está diretamente relacionada
ao grau de densidade mamária – refere-se ao percentual de componente fibroglandular em relação ao componente adiposo. Sabe-se que
a sensibilidade da mamografia é progressivamente menor quanto
maior o grau de densidade mamária. Esse fato fica ainda mais relevante
se considerarmos que os estudos apontam para a alta densidade
mamária como um fator de risco independente para câncer de mama,
ou seja, quanto mais densa a mama, maior o risco (Wolfe, 1976;
Lehman, 2002). Esses dados vêm motivando a pesquisa científica a
buscar maior eficiência no rastreamento de mamas densas. Nessa linha,
temos tido alguns progressos:
1) Em 2006 foi publicado o DMIST, trial que envolveu 49 mil mulheres dos EUA e do Canadá, comparando a mamografia analógica
com a mamografia digital. A tecnologia digital teve maior sensibilidade
em pacientes com menos de 50 anos, nas mamas densas e nas mulheres na pré e perimenopausa;
2) Em 2008, o ACR publicou o ACRIN 6666, que avaliou 2.809
mulheres de alto e moderado risco (mamas densas, biópsia prévia com
atipia e história pessoal ou familiar de câncer de mama). Nos 12 meses
iniciais de rastreamento, 40 mulheres apresentaram câncer de mama.
A mamografia isolada demonstrou 20 dos 40 cânceres (50% de sensibilidade), enquanto a associação da mamografia com ultrassonografia
aumentou a taxa de detecção para 78%.
Rastreamento no alto risco
Não há estudos randomizados que demonstrem redução na mortalidade com rastreamento mamográfico de pacientes de alto risco. As recomendações de conduta são baseadas em consenso internacional:
1) Pacientes com quadrantectomia prévia: realizar mamografia
anual, independentemente da idade (5%-10% risco em dez anos);
2) História prévia de carcinoma de ovário: realizar mamografia anual,
independentemente da idade (risco relativo de câncer de mama: 3-4);
3) Irradiação prévia do mediastino: realizar mamografia anual, iniciando oito anos após o término da radioterapia;
4) Biópsia prévia com atipia: realizar mamografia anual, independentemente da idade;
5) Mutação de BRCA 1 e/ou 2: 85% de risco durante a vida (ocorre
mais precocemente nas pacientes com mutação do BRCA 1). O consenso é iniciar mamografia entre 25 e 30 anos.
Ressonância magnética no rastreamento
do câncer de mama
Vários pesquisadores vêm demonstrando a superioridade da ressonância magnética para rastreamento de pacientes de alto risco (Kriege,
2004; Warner, 2004; Leach, 2005; Kuhl, 2005 e 2010; Lehman, 2005;
Sardanelli, 2007). Esses dados deram sustentação às recomendações
do National Comprehensive Cancer Network guidelines (NCCN)
desde 2009, que preconizam a associação da ressonância magnética
com a mamografia para as seguintes situações:
• Mutação de BRCA 1 e/ou 2;
• Parente de 1o grau com mutação de BRCA 1 e/ou 2;
• Alto risco em modelos de cálculo de risco (GAIL é o modelo mais
utilizado);
• Radioterapia torácica entre 10 e 30 anos: por exemplo, doença de
Hodgkin;
• Portadora ou parente de 1o grau com mutação em TP53 ou PTEN
genes (síndrome Li-Fraumeni e síndromes de Cowden e BannayanRiley-Ruvalcaba);
• Rastreamento de lesões adicionais homolaterais e/ou de lesão contralateral sincrônica em pacientes com diagnóstico recente de câncer
de mama. Nesse grupo especial, a ressonância tem demonstrado
grande influência no planejamento terapêutico adequado, como
demonstraram alguns estudos (Mameri, 2008; Liberman, 2003; Lee,
2003; Berg, 2004).
EVA TRIAL
Estudo Multicêntrico Prospectivo para Estabelecer Recomendações
no Rastreamento de Mulheres com Risco Familiar Elevado para
Câncer de Mama, publicado em 2010 no Journal of Clinical Oncology.
Esse estudo, envolvendo 687 mulheres, visou avaliar mamografia,
ultrassonografia e ressonância magnética mamária, isoladas ou em
diferentes combinações, para rastreamento de pacientes com alto risco
para câncer de mama. A conclusão foi de que a mamografia isolada
teve sensibilidade muito baixa para detectar as lesões malignas (33%);
mamografia e USG associadas tiveram 48% de sensibilidade; enquanto
a ressonância magnética isolada demonstrou 92% de sensibilidade. A
associação da mamografia com a ressonância resultou em 100% de
sensibilidade na detecção dos cânceres das pacientes de alto risco.
Onco& agosto/setembro 2011
29
Quando usar a ultrassonografia associada à mamografia
• Quando o único fator de risco forem mamas densas;
• Nas pacientes de alto risco indicadas para ressonância magnética e
que, por alguma razão, não podem realizá-la.
Cálculo de risco para câncer de mama
É importante que os médicos envolvidos na saúde feminina saibam
atuar na prevenção do câncer de mama, incluindo prevenção primária
(prevenir o aparecimento da doença) e prevenção secundária (reduzir
a mortalidade pela doença).
Na prevenção primária, devemos conscientizar nossas pacientes a
evitar os fatores de risco passíveis de controle, como manter-se magra,
reduzir ingesta de gordura, praticar exercícios aeróbicos regularmente,
evitar bebidas alcoólicas e outros. É claro que fica mais difícil planejar
quantos filhos ter ou qual a idade para engravidar pela primeira vez,
mas é nosso papel informá-las da influência que esses fatores exercem
no risco futuro para câncer de mama.
A prevenção secundária constitui-se basicamente na detecção precoce da doença, o que só é possível utilizando o protocolo adequado
de rastreamento conforme o grau de risco. Ao realizar a anamnese, o
médico identifica os fatores de risco e deve utilizá-los para calcular o
risco da paciente e orientar seu rastreamento. Os modelos de cálculo
de risco levam em consideração: raça, idade da menarca, primiparidade, número de biópsias, atipia prévia, número de parentes de 1o
grau doentes, idade do diagnóstico em parente de 1o grau, história paterna, parentes de 2o grau etc. Após esse cálculo, a paciente será enquadrada como risco geral ou risco aumentado, o que determinará seu
protocolo de rastreamento do câncer de mama.
Casos clínicos
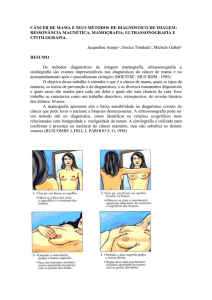
Caso 1: Paciente com 41 anos de idade cuja mãe teve câncer de mama aos 45 anos.
No rastreamento anual somente a RM detectou a lesão maligna na mama direita
1
2
3
Figura 1 Mamografia mostrando alta densidade mamária,
sem evidência de achados suspeitos
Figura 2 Ressonância magnética, MIP vista superior da fase
precoce do estudo dinâmico, evidenciando realces agrupados
no quadrante inferolateral da mama direita
Figura 3 Ressonância magnética, MIP vista lateral da fase
precoce do estudo dinâmico, evidenciando realces agrupados
no quadrante inferolateral da mama direita
30
agosto/setembro 2011 Onco&
Caso 2: Paciente com 32 anos cuja mãe teve câncer de mama aos 35 anos com evolução fatal.
Exame físico normal, mamografia negativa e RM mostrou lesão extensa na mama direita.
4
1
2
Figura 1 Mamografia com alta densidade mamária
3
Figura 2 Ressonância magnética, MIP vista superior da
fase precoce do estudo dinâmico, evidenciando realce
suspeito extenso na união dos quadrantes laterais da
mama direita, com distribuição segmentar
Figura 3 Ressonância magnética, MIP vista lateral da
fase precoce do estudo dinâmico, evidenciando realce
suspeito extenso na união dos quadrantes laterais da
mama direita, com distribuição segmentar
Figura 4 Observem que a magnificação mamográfica
tangencial orientada pela ressonância também não
evidencia a lesão visualizada na RM
32
agosto/setembro 2011 Onco&
Caso 3: Paciente com 39 anos, com diagnóstico recente de câncer de mama,
através de core biópsia de lesão única detectada por USG, medindo 9,5 mm.
Figura 1 Mamografia mostrando mamas acentuadamente
densas, sem achados suspeitos
Figura 2 USG demonstrando lesão sólida altamente
suspeita no QSL da mama direita, medindo 9,5 mm
Figura 3 Ressonância magnética pré-operatória, MIP
vista superior da fase precoce do estudo dinâmico,
evidenciando realce extenso na região central da
mama direita, medindo 4,6 cm (a lesão era muito
maior do que o tamanho demonstrado pela USG),
e uma outra lesão na região central da mama
esquerda, medindo 1,3 cm, não detectada pelos
métodos convencionais (mamografia e USG)
1
Para saber
1. NCCN® National Comprehensive Cancer Network®. Practice Guidelines in Oncology – 2011.
2. Pisano ED, Gatsonis C, Hendrick E, et al.
Diagnostic performance of digital versus film
mammography for breast-cancer screening.
Digital Mammographic Imaging Screening
Trial (DMIST) Investigators Group. N Engl J
Med. 2005 Oct 27;353 (17):1773-83. Epub
2005 Sep 16.
3. Berg WA, Blume JD, Cormack JB, et al.
Combined screening with ultrasound and
mammography vs mammography alone in
women at elevated risk of breast cancer.
2
4. ACRIN 6666 Investigators. JAMA. 2008 May
14;299(18):2151-63.
5. Mameri CS, Kemp C, Goldman SM, et al. Impact of breast MRI on surgical treatment, axillary approach, and systemic therapy for
breast cancer. Breast J. 2008 May-Jun;
14(3):236-44.
3
6. Kuhl C, Weigel S, Schrading S, et al.
Prospective multicenter cohort study to refine management recommendations for
women at elevated familial risk of breast
cancer: the EVA trial. J Clin Oncol. 2010 Mar
20;28(9):1450-7. Epub 2010 Feb 22.
Onco& agosto/setembro 2011
33