Encontro_1_Biomecânica, 2 e 3 de Fevereiro de 2005, Martinchel, Abrantes
Comportamento de Próteses de Anca de Baixa
Rigidez Material: a Interface Osso-Implante
J. Costa Reis, J. C. Potes, L. Fialho, F. Capela e Silva
ICAM – Universidade de Évora
7002 - 554 Évora
[email protected], [email protected], [email protected], [email protected]
A. Cabrita
Instituto de Patologia Experimental da
Faculdade de Medicina da Universidade de Coimbra
[email protected]
A.T. Marques
Departamento de Engenharia Mecânica e Gestão Industrial
da Faculdade de Engenharia da Universidade do Porto
[email protected]
J. A. Simões
Departamento de Engenharia Mecânica da Universidade de Aveiro
[email protected]
RESUMO
O presente trabalho refere-se aos resultados de um estudo do comportamento de um
componente femoral para prótese de anca fabricado em PEEK com reforço aleatório de fibra de
carbono, colocado por press-fit, usando como modelo animal a ovelha. Aqui somente se
relatam os resultados relativos ao exame histológico de secções de osso de dois animais, após
três meses de implantação.
Os resultados enfatizam o carácter determinante das características mecânicas do biomaterial
e da adaptação da geometria do implante ao canal femoral para a regulação dos eventos
biológicos na interface osso-implante.
INTRODUÇÃO
À rigidez da prótese têm sido associados diversos fenómenos mecânicos e biológicos, de
carácter interdependente. É sabido que o efeito de stress shielding resulta da elevada rigidez
das próteses e tem como consequência reabsorção óssea. A rigidez material tem também forte
influência na estabilidade mecânica na interface; a presença de micromovimentos entre o
implante e o tecido ósseo parece ter uma influência muito superior na regeneração do tecido
ósseo do que o material implantado per si [1]. Frost et al. sugeriram que os factores mecânicos
poderão ser preponderantes na regulação fisiológica do osso [2]. A adaptação do tecido ósseo
a estímulos mecânicos está dependente essencialmente de esforços dinâmicos (por oposição a
carregamento estático); a duração do estímulo mecânico pode ser de curta duração, dado que
a resposta adaptativa é prontamente iniciada. A ocorrência de esforços não habituais induz
uma resposta celular mais marcada [3]. Este padrão de comportamento adaptativo, associado
à reacção inflamatória após a cirurgia, implica que o início precoce e depois continuado de
micromovimentos na interface osso/implante condicione a formação do tecido ósseo, dando
origem a tecido fibroso cicatricial [1].
55
MATERIAIS E MÉTODOS
Concepção e Maquinagem das Próteses
O compósito de PEEK/C utilizado no fabrico das próteses foi o KETRON® PEEK-CA30 (matriz
de polieteretercetona com 30% de reforço de fibra de carbono curta). As fibras distribuem-se de
forma aleatória na matriz polimérica, pelo que se considera que é um material de
características isotrópicas. Este material pode ser esterilizado por autoclavagem sem
comprometimento das suas propriedades.
As próteses foram concebidas e fabricadas tendo como referência as radiografias das ovelhas
a serem implantadas. Definiu-se o diâmetro da cabeça da prótese, a distância de “offset” entre
o seu centro e o eixo da sua haste, assim como o seu comprimento total e secção transversal,
esta do tipo rectangular. Foram fabricadas três próteses totalmente em PEEK/C (Figura 1) e
três próteses em PEEK/C mas com a cabeça em polietileno.
Figura 1 – Tipo de prótese maquinada em PEEK/C.
Implantação das Próteses em Ovelha
Os animais foram submetidos a jejum de 24 horas previamente à cirurgia, após o que foram
tranquilizados com xilazina (Rompun®, via endovenosa), a anestesia induzida com tiopental
sódico, via endovenosa, e mantida com anestésico volátil (isoflurano).
A observância dos procedimentos de assepsia é especialmente importante neste tipo de
intervenção cirúrgica em que o desenvolvimento de infecção in situ pode determinar o
insucesso do procedimento.
As próteses foram implantadas no fémur esquerdo e após a cirurgia os animais não foram
submetidos a qualquer tipo de restrição de exercício.
Dois dos animais (num total de seis animais implantados) foram sacrificados três meses após a
implantação: a ovelha A (implantada com uma prótese totalmente em PEEK/C) e a ovelha B
(implantada com uma prótese de PEEK/C com cabeça de polietileno).
Exame Histológico
Foram realizados cortes, a diversos níveis, dos fémures implantados e contralaterais, sem que
a prótese fosse retirada: base do trocânter maior (região 1), a meio do terço proximal da haste
femoral (região 2), bem como junto ao término da haste (região 3). Foi também realizado um
corte, na ovelha A, do conjunto da cabeça protésica e da região acetabular (região 4A); na
ovelha B a prótese afundou no interior do canal medular o que fez com que a cabeça protésica
não articulasse com a cavidade cotiloídea, pelo que não foi possível obter um corte do conjunto
mas efectuou-se um corte longitudinal da região imediatamente distal à cabeça protésica
(região 4B) (Figura 2).
56
Figura 2 – Fémures da ovelha B após o corte. Em cima, na imagem:
fémur implantado; em baixo, fémur contralateral (usado como controlo).
As secções de osso não descalcificado, após fixação, foram desidratadas e depois incluídas
em metilmetacrilato, sem que fosse retirado o implante. O bloco de grandes dimensões
resultante foi depois cortado em blocos com aproximadamente 2,5 cm de aresta, após o que
foram fixados a lâminas de vidro para microscopia usando uma cola de tipo resina epóxido de
cura rápida (Araldite®). Só então foi efectuado o corte do bloco em máquina de corte (Struers
Disco-Plan TS), polimento maquinado (Struers Planopol V) após o que a espessura do corte
histológico foi diminuída por polimento manual.
A coloração utilizada foi o azul de toluidina, coloração metacromática, que cora o osteóide de
cor azul pálida, o osso mineralizado de púrpura/ púrpura claro, os núcleos celulares de azul e a
linha reversa de azul-escuro ou púrpura.
RESULTADOS E DISCUSSÃO
Apesar de aproximadamente uma semana após a cirurgia os animais apoiarem o membro
implantado, o apoio em carga foi observado apenas um mês após cirurgia. Foram observados
diversos graus de claudicação, consoante o animal intervencionado e as complicações
intraoperatórias.
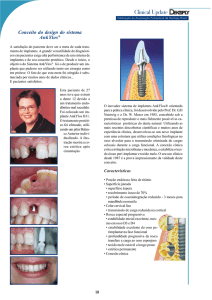
O exame das secções histológicas obtidas a partir de uma das ovelhas (ovelha A), cuja prótese
aparentemente se encontrava estável, não revelou evidências de osteólise devida a stressshielding, e a marcada remodelação presente caracteriza-se pela formação de osso trabecular
em redor da haste protésica e reacção perióstica com formação de osso (Figura 3). A reacção
perióstica poderá ser explicada quer pelo eventual trauma induzido pela cirurgia, quer como
sendo uma resposta ao aumento da tensão transmitida a esta superfície.
Figura 3 – Reacção do periósteo na face caudal do fémur implantado (região 1).
Na região 2 do fémur implantado da ovelha A o osso neoformado é de tipo cortical (Figura 4)
(tal como descrito por Sumner et al. em fémures caninos seis meses após implantação de
hastes compósitas) [4].
57
Figura 4 – Região 2 do fémur implantado: a partir do endósteo há formação de osso que tende
a organizar-se seguindo o padrão do osso compacto: lamelar e formando sistemas de Havers.
A presença de um anel de osso trabecular em redor de toda a haste protésica sugere um
aumento de transferência de carga. Tais achados parecem estar directamente relacionados
com o aumento de carga devido à proximidade do implante, uma vez que a hipertrofia óssea da
cavidade medular é menor na face cranial, mais distante da haste. A presença de osso reactivo
em redor da prótese, tal como observado na ovelha A, é denominada neocórtex e pode ser
considerada como um sinal da aceitação do implante [5].
O observado nas secções histológicas do fémur de uma outra ovelha, ovelha B, é condizente
com a situação, constatada à necrópsia, de afundamento e rotação da haste protésica no
interior da cavidade femoral. O posicionamento do implante poderá explicar a extensa osteólise
cortical que se observa nas diferentes regiões do fémur, talvez devido a uma transmissão
anómala de tensão, bem como devido à instabilidade do implante. Na ovelha B os fenómenos
de remodelação conduziram a uma clara perda de massa óssea, com adelgaçamento do
córtex. Embora exista uma zona de aposição directa entre osso e implante, esta continua-se
por áreas de osteólise activa, ocorrendo substituição do osso por tecido conjuntivo (Figura 5).
Figura 5 – Região 1 do fémur implantado da ovelha B: o espaço vazio visível entre o
implante e o osso cortical (canto inferior direito), e o implante e tecido conjuntivo, é um
artefacto resultante do processamento. É evidente o processo de osteólise do osso cortical.
A zona de osteólise activa pela qual esta área de aposição se continua poderá ser devido a
instabilidade mecânica na interface ou a eventual activação de fagócitos devido a partículas de
polímero libertadas a partir da cabeça protésica, uma vez que surge na região mais proximal do
fémur, onde a presença destas partículas seria mais provável.
A presença de uma cápsula fibrosa de espessura variável é um achado constante no exame
histológico destes especímenes. A existência de tecido fibroso em redor da haste de implantes
colocados por press-fit, ou entre o osso e o cimento (em implantes cimentados),
independentemente do material implantado ser metálico ou compósito, é frequente, mesmo em
pacientes assintomáticos, e representa uma consequência do processo inflamatório originado
pela sua implantação cirúrgica e do reconhecimento do implante pelo organismo hospedeiro
como estranho [4, 6].
58
CONCLUSÕES
Os resultados do presente trabalho sugerem que as características mecânicas do biomaterial e
a adaptação da geometria do implante ao canal femoral são determinantes para a regulação
dos eventos biológicos na interface osso-implante.
Estes resultados sugerem ainda que o comportamento de implantes de baixa rigidez material
pode ser satisfatório in vivo, estando largamente dependente da adaptação da prótese ao canal
femoral (e logo, à sua estabilidade e transferência de carga tão próxima da fisiológica quanto
possível). No entanto, deve ser prestada particular atenção ao nível de micromovimentos na
interface, bem como à libertação de partículas por desgaste do implante.
REFERÊNCIAS
[1] Brunski, J.B. (1991): Influence of Biomechanical Factors at the Bone-Material Interface. In: The BoneMaterial Interface. J. E. Davies (Ed.). University of Toronto Press, Toronto, pp.391-403.
[2] Frost, H.M., Ferretti, J.L. and Jee, W.S.S. (1998): Perspectives: Some Roles of Mechanical Usage,
Muscle Strengh, and the Mechanostat in Skeletal Physiology, Disease, and Research. Calcified Tissue
International, 62(1),1-7.
[3] Turner, C.H. (1998): Three Rules for Bone Adaptation to Mechanical Stimuli. Bone, 23(5), 399-407.
[4] McCarthy, E. and Frassica, F.J. (1998): The Pathology of Failed Total Joint Arthoplasty. In: Pathology
of Bone and Joint Disorders, W.B. Saunders, Philadelphia, pp.353-363.
[5] Maharaj, G.R., Stait, L.H., Gavens, A.J. and Jamison, R.D. (1991): Characterization of creep and
environmental effects on composite materials for human hip prostheses. In: Proc. of the 8th
International Conference on Composite Materials, Honolulu, Stephen W. Tsai and Springer, G. S.
(Eds.), Society for the Advancement of Material and Process Engineering, pp. 7A1-7A10.
[6] Thomsen, P. and Ericson, L. E. (1991): Inflammatory Cell Response to Bone Implant Surfaces. In The
Bone-Material Interface. J. E. Davies (Ed.). University of Toronto Press, Toronto, pp.153-161.
59
60