ASSOCIAÇÃO EDUCACIONAL DOM BOSCO
FACULDADE DE ENGENHARIA DE RESENDE
Prof.: Washington Lemos
2014
Fenômenos de Transporte
Notas de Aula – PARTE I
Versão Beta.
Comunique incorreções usando qualquer um destes meios:
[email protected]
https://www.facebook.com/groups/SalaDeAulaAEDB
https://www.facebook.com/w.m.lemos
26/01/2014
0.0 Apresentação
Este material é resultado do gentil e árduo trabalho de alguns alunos dos
cursos de Engenharia da AEDB. Estes senhores e senhoras compilaram as
aulas ministradas na disciplina de Fenômenos de Transporte ao longo do
ano de 2013.
Seu propósito é servir de auxílio como uma forma elementar de consulta e
acompanhamento da disciplina, uma espécie de caderno seminal, que
você, caríssimo aluno, deve ser complementar com suas próprias
anotações e comentários ao longo do curso.
Este material é um trabalho coletivo, dinâmico, espontâneo com origem
em uma linguagem oral, estando, apesar das revisões, sujeito a equívocos
de digitação, frases de compreensão dúbia e ainda eventuais incorreções
em desenhos, gráficos e equações. Desta forma convido a todos que
critiquem
o
presente
material
e
comuniquem
eventuais
melhorias/correções1.
Agradecemos às futuras colaborações e, claro, aos alunos que tornaram
este iniciativa uma realidade.
Agradecimentos especiais a:
Fernanda Cecília Leticia Carneiro
Giuliano Roberti
Lucas Balbino
Jéssica Peixoto
Luma Diniz
Joyce Nunes
Rafael Bruno
Juliane Custódio Rhamon Carvalho
Kassya Caroline
Samira Ponce
Leizy Oliveira
1
Isso pode lhe render alguns pontos. Informe-se.
2
AULA 1
Bibliografia básica
1. Ciências Térmicas, Merle Potter, Elaine Scott, Ed. Thomson,
2007.
2. Fenômenos de transporte, Leighton E. Sissom, D. Pitts, Ed.
Guanabara, 1996.
3. Fundamentos da termodinâmica, Van Wylen, Sonntag,
Borgnakke, Ed. Blücher, 2003.
4. Termodinâmica, G. Ieno, L. Negro, Ed. Pearson Education
Brasil, 2004
5. Introdução à mecânica dos fluídos, Robert W. Fox, McDonald,
Ed. LTC, 1998.
6. Mecânica dos fluídos, Franco Brunetti, Ed. Pearson, 2008.
3
Ementa
Introdução – 1°BI
Termodinâmica – 1°BI
Mecânica dos fluídos (estática) – 2°BI
Mecânica dos fluídos (dinâmica) – 3°BI
Transferência de calor – 4°BI
4
1. Introdução
Muitos sistemas físicos envolvem armazenamento, conversão e
transporte de energia. O estudo de fenômenos de transporte aborda estes
processos de modo a descrevê-los através de uma formulação matemática
comum. Ex.:
Transferência de Calor
q
T
k
A
x
Mecânica dos Fluidos
v
el
y
Nestes processos necessariamente haverá um movimento no sentido
de equilíbrio (devido ao Segundo Princípio termodinâmico: aumento da
entropia do universo) e o transporte de uma “quantidade”.
1.1 Propriedades dos fluidos e meios contínuos
Na matéria as moléculas estão em constante movimento conferindo
uma série de propriedades. Nós nos interessamos nas manifestações
destes movimentos moleculares, ou seja, nas propriedades do sistema.
Entendemos como propriedade dos sistemas aquelas grandezas (físicoquímicas, como temperatura, pressão etc.) que permanecem constantes
no sistema sempre que este sistema estiver nas mesmas condições. Além
disso, consideraremos sempre que as propriedades serão constantes ao
longo de todo o volume/superfície de interesse, pois a matéria está
uniformemente distribuída (meio contínuo).
5
1.2 Gás perfeito
É um gás cujas moléculas colidem de modo perfeitamente elástico.
Para as nossas aplicações o ar pode ser considerado um gás perfeito
(ideal) quando estiver em baixas pressões (+/-1 atm) e altas temperaturas
(dobro da temperatura crítica2).
1.3 Fluídos compressíveis e incompressíveis
A incompressibilidade é medida pelo módulo volumétrico da
elasticidade isotérmica ( E ).
T
ET
1
onde:
1 dV
V dP
Sendo o coeficiente de compressibilidade, um fluído é
denominado incompressível quando sua variação de densidade é
insignificante frente variação de pressão. Dessa forma podemos deduzir
que os líquidos podem ser considerados incompressíveis enquanto os
gases precisam ter quase sempre sua compressibilidade levada em
consideração.
Ex.: Considerando a elasticidade isotérmica da água (H20) igual a 300.000
PSI/ft³, vamos verificar a variação do volume do sistema que consiste em 1
ft³ (0,03 m3) de H20 quando a pressão sofrer um acréscimo igual a 1000
PSI (variação de 68,07 atm).
.
2
Éa temperatura acima da qual a substância pode existir somente na forma de gás.
6
AULA 2
2. Termodinâmica
A termodinâmica estuda as interações de energia. Esta ciência é
baseada em princípios físicos, ou seja, verificações experimentais não
deduzidas matematicamente das quais deduzimos seus princípios (1° e 2°
Lei da Termodinâmica).
2.1 Conceitos e definições
2.1.1 Sistemas termodinâmicos
Fronteira
Sistema
Sistema
Vizinhança
(meio)
O sistema é uma região limitada por uma superfície real ou
imaginária. Sempre que a energia atravessa essa fronteira ela se
manifestará na forma de calor e/ou trabalho.
ENERGIA
E Energia [J]
W Trabalho [J]
Q Calor [J]
CALOR E/OU TRABALHO
Calor (Q) e Trabalho (W) nada mais são
do que a manifestação de energia
quando esta atravessa a fronteira de
um sistema. Ou seja, são formas de
energia em transição!
7
Por definição:
+
Q
Sistema
-
+
W
Q
-
W
Trabalho realizado pelo sistema é positivo. Trabalho realizado sobre o
sistema é negativo.
Calor que entra no sistema é positivo. Calor que sai do sistema é negativo.
Os sistemas podem ser classificados de três maneiras:
a) Sistema isolado: a fronteira não permite a passagem de massa,
calor ou trabalho.
Ex.: garrafa térmica.
Sistema
b) Sistema fechado: a fronteira não permite a passagem de massa.
8
Ex.: Seringa fechada ou um êmbolo.
Sistema
c) Sistema aberto ou volume de controle: a fronteira permite a
passagem de massa, calor e/ou trabalho.
Ex.: Macaco hidráulico.
+
W
Sistema
Em uma única imagem poderíamos resumir que:
9
2.1.2 Temperatura
A temperatura é o resultado do grau de agitação molecular. Quando
colocamos dois corpos em contato e em sistema isolado podemos garantir
que haverá uma sucessão de alteração em suas temperaturas de modo
que o equilíbrio térmico seja estabelecido (este princípio é conhecido
como “Lei Zero” da termodinâmica, veremos mais adiante que ele é
redundante pois é consequência da Segunda Lei da termodinâmica).
2.1.3 Equilíbrio, processo e estado
Neste momento é conveniente fazermos uma série de definições de
modo que a linguagem se torne precisa e clara.
a) Estado: é a condição física de um sistema descrita pela atribuição
de valor às suas propriedades (qualquer grandeza físico-química que
descreva o sistema) em um determinado instante.
b) Equilíbrio:
o
equilíbrio
termodinâmico
existe
quando
as
propriedades do sistema são constantes de um ponto ao outro e
não apresentam tendência de mudança ao longo do tempo.
c) Processo: é a trajetória descrita pelos sucessivos estados de um
sistema que sai de uma condição de equilíbrio rumo à outra.
T
Estado I
Estado II
P
10
d) Ciclo termodinâmico: quando um sistema em dado estado inicial
experimenta uma série de processos ao final do qual ele retorna ao
estado inicial dizemos que possuímos um ciclo termodinâmico.
11
AULA 3
2.1.4 Trabalho
Na mecânica entendemos trabalho como sendo um produto de uma
força pela distância deslocada na direção de aplicação da força.
W Fdx
c
De um modo mais conveniente precisamos definir trabalho (W) em
função dos conceitos termodinâmicos de sistema, propriedade e processo.
Desta forma, a definição termodinâmica de trabalho é a energia
transmitida através da fronteira do sistema de modo que um único efeito
na vizinhança seja a variação da energia potencial gravitacional de um
corpo ou algo que possa ser interpretado com tal.
FRONTEIRA
FRONTEIRA
MOTOR
MOTOR
BATERIA
BATERIA
PESO
O ventilador pode ser substituído por uma polia de modo que todo
efeito na vizinhança pode ser interpretado como a variação da energia
12
potencial de um corpo, logo trata-se de trabalho. Por definição, o
trabalho executado pelo sistema sobre a vizinhança é positivo.
No SI sua unidade é W = [J] = [N.m].
Sempre que falarmos da taxa de realização de trabalho em um
intervalo de tempo nós falaremos de potência, que nada mais é que W :
W
W
J
[Watts ]
dt
s
Frequentemente será conveniente tratarmos do trabalho executado
ao longo de um processo em relação à massa de um sistema, ou seja:
w é o trabalho específico ou trabalho por unidade de massa
W
w
[J/kg]
m
Podemos então definir o trabalho realizado por um processo de
quase-equilíbrio devido ao movimento de fronteira:
W Fdx
F
P
c
Logo, W
2
1
F
F PA
A
2
PAdx W PdV
1
dx
Onde,
A
P é a pressão; A é a área e V é o
A
t1
t2
volume.
2
Este trabalho pode ser representado pelo diagrama:
13
I
P1
II
P2
V1
V2
PdV
Quando a trajetória muda , a área muda. Fica clara assim a dependência
do trabalho em relação ao processo efetuado, ou seja, ao caminho no qual
se dá a transferência de energia.
14
AULA 4
2.1.5 Calor
Denominamos calor a transferência de energia que atravessa a
fronteira naturalmente devido à diferença de temperatura entre o sistema
e a vizinhança.
Tal como o trabalho, o calor é a manifestação da energia ao atravessar
a fronteira e tem como unidade no SI: Q = [J] = [N.m]. Contudo, é muito
comum o uso de calorias (cal), de modo que”1 J = 0,2388 cal
Por unidade de tempo (potência térmica), temos:
Q
Q
dt
[W ]
Por unidade de massa, temos:
Q
q
m
Termodinamicamente, consideraremos calor positivo quando ele
entra no sistema.
15
2.1.6 Exemplo de sistema com calor e trabalho
BATERIA
C
B
A
Sistema A: Energia atravessa a fronteira devido à diferença de
temperatura, logo trata-se de calor.
Sistema B: Energia atravessa a fronteira com uma energia elétrica que
pode estar sendo gerado pela variação da energia potencial de um corpo
na vizinhança. É trabalho.
Sistema C: Não há qualquer energia atravessando a fronteira, logo não há
calor nem trabalho.
16
AULA 5
2.1.7 Processos Politrópicos
Quando um gás realiza um processo reversível de quase-equilíbrio
sua curva log P x log V assume uma função linear de tal modo que PVn =
Constante (onde n também é constante).
n=∞
Log P
Q=0
n=1
n=0
n≠1
n=k
Log V
Vamos
deduzir
os
principais
formulações
para
processos
politrópicos.
n=0
PVn = Constante – Processo isobárico (P = Constante)
P1 P2 P3 P cte
2
W PdV W P dV W P(V2 V1 )
1
17
n=1
PVn = PV = Constante – Processo isotérmico
PV 1 PV cte
PV
1 1 PV
2 2 PV
3 3 PV cte
2
W PdV
se
1
W
2
1
Se
P
cte
logo
V
2 1
V
cte
dV W cte dV W cte[ln V2 ln V1 ]W cte ln( 2 )
1 V
V
V1
PV cte
n≠1
logo: W PV
1 1 ln(
V2
V2
) ou W PV
)
2 2 ln(
V1
V1
PVn = Constante
n
n
n
n
PV
1 1 PV
2 2 PV
3 3 PV Cte
2
W PdV W
1
Se
n
cte PV
1 1
2
1
2
V21n V11n
V n1
cte
n
dV
W
cte
V
dV
W
cte
W
cte
n 1
1
Vn
1 n
logo W
PV
2 2 PV
1 1
1 n
.
n = ∞ - Processo isovolumétrico
W 0
18
Exercícios:
1) 3 5kg de um gás contido em um cilindro sofre inicialmente um
aquecimento mantendo-se constante seu volume. Em seguida sofre uma
expansão à pressão constante devido ao movimento do êmbolo. Calcule o
trabalho desenvolvido quando a variação do volume for de 0,5m³
sabendo-se que a área do êmbolo é de 100cm² e a força aplicada sob o
êmbolo é de 50 Kgf.
3
Exercício retirado do livro Termodinâmica, G. Ieno, L. Negro, Ed. Pearson Education Brasil, 2004, pg 61.
19
2) Um gás perfeito sofre uma compressão isotérmica passando de 1
Kgf/cm² para 5 Kgf/cm². Sabendo-se que na situação inicial o volume
ocupado pelo gás é de 2m³. Determine o trabalho necessário para esta
compressão.
20
AULA 6
2.2 1° Lei da Termodinâmica
A 1° lei da termodinâmica estuda as relações existentes entre as
diferentes formas de energias. É, portanto, conhecida como a lei de
conservação de energia. É fácil perceber no cotidiano que a energia não
pode simplesmente aparecer do nada, se um sistema ganha energia é
preciso que esta energia venha de algum lugar.
Podemos dizer de um modo mais abrangente que “a taxa de
transmissão de calor para o sistema menos a taxa com a qual o sistema
realiza trabalho é igual à taxa pela a energia total do sistema está
variando”4.
Matematicamente:
Q W E
Se considerarmos um ciclo saberemos que suas propriedades no
início e no final devem se igualar de modo que o calor total trocado ao
longo do ciclo deve ser igual ao trabalho total realizado também ao longo
do ciclo de modo que a energia total se conserve.
4
Ciências Térmicas, Merle Potter, Elaine Scott, Ed. Thomson, 2007
21
2.2.1 1°Lei para um sistema fechado
Considerando um ciclo termodinâmico:
W
I
A
Q
W
II
B
Q
2
2
1
1
1
2
1
2
2
1
1
2
2
QA QB WA WB QA WA QB WB
2
1
2
1
1
2
(Q W ) A (Q W ) B
1
Desta forma provamos que (Q-W) independe do caminho.
Podemos escrever então que:
1
Q2 1W2 E2 E1
Onde “E” é a energia total do sistema sendo, portanto, uma
propriedade do sistema, de modo que podemos dizer que:
22
EC1
EC2
EP1
EP2
ΔU
W
Q
SISTEMA
ETotal1 U ETotal 2
1
Q2 EC1 EP1 1 W2 EC 2 EP 2 U
1
Q2 1 W2 ( EC 2 EC1 ) ( EP 2 EP1 ) U .
Desta equação precisamos definir as descrições para as energias
cinéticas e potencial.
Energia Cinética
F
d (m Vel )
dP
F
dt
dt
Logo F
se
m cte
1
1
mdVel
mdVel
dF
dx dE mVel dV
0
0
dt
dt
mVel2
Ec
Energia Cinética
2
Energia Potencial
F m
dV
dx dxF m a dx dE m a dx
dt
z
E m a dx E m a z E p m g z Energia potencial
0
23
1°Lei para sistemas fechados:
m(V22 V12 )
U
1 Q2 1 W2 mg ( z2 z1 )
2
Desconsiderando as energias mecânicas (cinética e potencial)
chegamos em:
Q W U
A energia interna U é uma propriedade do sistema!
Exercícios:
1) Um ventilador de 5HP é usado em uma sala grande para promover a
circulação de ar. Admitindo-se que esta sala é bem isolada e selada,
determine o aumento da energia interna depois de uma hora de
operação. 1HP = 746 Watts
2) Calcule o trabalho se o ar se expande de 0,2 m³ para 0,8 m³, quando
P=(0,2+0,4V).
24
2.2.2 Entalpia
A entalpia é a propriedade termodinâmica que representa as
energias relacionadas à pressão e a temperatura.
Caso forneçamos lentamente calor a um sistema mantido à pressão
constante teremos: W PCte (V2 V1 )
Como 1 Q2 1 W2 U 1 Q2 ( PV2 PV1 ) U 2 U1
Logo 1 Q2 (U 2 PV2 ) (U1 PV1 ) .
h
H
m onde h é a entalpia específica
Observe que, quando a pressão é constante (P=cte), a variação de
entalpia (∆H) é igual ao calor trocado pelo sistema: Q H
.
2.2.3 Calor latente e calores específicos
T (°C)
Calor especifico
-100
Tempo (s)
-10
Calor Latente
a) Calor latente
É a quantidade de energia transferida na forma de calor a uma
substância de modo a conduzi-la a mudança de fase. O calor necessário
25
para derreter uma unidade de massa de uma dada substância à pressão
constante denomina-se calor latente de fusão.
b) Calor específico
Quando tratamos uma substância pura à pressão constante e de
uma única fase, definiremos calor específico como a quantidade de
energia necessária para elevar em um grau de temperatura uma unidade
de massa.
C
Q
mT
O calor específico é uma propriedade do sistema tabelado nos
ábacos da termodinâmica.
Calor específico à pressão constante (Cp)
C
Q
, P Cte e Q H
mT
Logo Cp
H
h
Cp
m T
T
Calor específico à volume constante (Cv)
Cv
1
Q
mT
Q2 1 W2 U 1W2cte 0 1 Q2 U
Então: Cv
Q
U
u
Cv
Cv
mT
mT
T
26
AULA 7
Exercícios:
1) Se a energia de um sistema sem escoamento aumenta 90KJ, enquanto
o sistema desenvolve o trabalho de 125KJ, determine o calor transferido.
2) Um sistema sem escoamento à pressão constante recebe calor a 350
KPa. A energia interna do sistema aumenta de 180 KJ enquanto a
temperatura aumenta 170° C e o trabalho desenvolvido é de 75 KJ.
Determine o calor específico à pressão constante e a variação do volume
se o sistema corresponde a 1,5 Kg de gás em um cilindro.
27
2) Calor é fornecido a um gás em um recipiente rígido. Se o recipiente
contém 0,6 Kg de gás ao qual são fornecidos 100 KJ. Determine as
variações na temperatura e na energia interna. Calor específico à pressão
constante (Cv) = 1,47 KJ/KgK
3) O Cp e o Cv são respectivamente 0,24 e 0,17 kcal/KgK. Se 1000 Kcal
forem adicionados a 20 Kg de ar em um processo sem escoamento à
pressão constante. Determine a temperatura final do ar se a inicial for de
100 K e o trabalho desenvolvido pelo gás.
28
4) Um conjunto cilindro-êmbolo sem escoamento contém 0,05 Kg de um
gás. Se 10 KJ são fornecidos na forma de trabalho para comprimir um gás,
sua temperatura cresce de 21° C para 66 °C. Determine a troca de energia
na forma de calor se o Cv é igual a 0,92 kJ/Kg°C.
5) Um sistema sem escoamento é submetido a um processo no qual 42 KJ
de calor são rejeitados. Se a pressão é mantida constante a 125 KPa
enquanto o volume varia de 0,2 m³ para 0,06 m³. Determine o trabalho
desenvolvido e a mudança na energia interna.
29
AULA 6
2.2.4 Conservação de massa em volume de controle
(sistemas abertos)
Introduziremos agora uma análise mais completa na qual
relacionaremos trabalho, calor, variação de pressão, variação de
temperatura e vazão mássica ( W , Q, P, T e m ).
Até agora abordamos variação de energia, sem mencionarmos a
relação com massa, o que contradiz a física moderna na sua mais famosa
equação:
E mc 2
onde c 2,99 x108 Km/s que é a velocidade da luz no vácuo.
Esta equação relaciona a massa de um sistema com sua variação de
energia. Contudo a ordem de grandeza dessa relação é muito pequena,
conforme o exemplo a seguir.
Imaginemos 1 Kg de mistura gasolina-ar constituindo um sistema com
recipiente rígido. A combustão da mistura libera 2900 kJ. Qual será a
variação da massa?
W 0
Q W U
2900 KJ U
Esta variação de energia resulta em uma variação de massa que é
2
3
8 2
11
dada por: E m c 2900 10 m (2,99 10 ) m 3, 2 10 Kg .
(houve perda de massa, pois o resultado foi negativo)
30
A variação de massa resultante é um número dividido por
100.000.000.000! Ou seja, um número ínfimo!
Desta forma apesar de existir uma relação entre massa e energia,
para fins deste curso podemos considerar a lei de conservação de energia
independente da lei de conservação de massa.
Neste momento nos concentraremos em um sistema específico,
caracterizado por um regime permanente e uniforme5.
Observação:
Regime permanente: As variáveis do escoamento em um ponto do espaço
são independentes do tempo.
Regime Uniforme: A velocidade, a pressão e a densidade são constantes
ao longo da seção perpendicular ao escoamento.
Assim antes de aplicarmos a lei da conservação de energia
aplicaremos o princípio de conservação de massa.
1
2
A
m
vel
Volume de controle
x vel.t
O principio de conservação de massa nos diz que a taxa de variação da
massa armazenada no volume de controle é igual à diferença entre o fluxo
de massa total entrando no volume de controle e o volume de massa
saindo do volume de controle: mvc m1 m2
5
Voltaremos a falar de tipos de escoamento no terceiro Bimestre.
31
ou seja,
dm dm1 dm2 dmvc
m1 m2
dt
dt
dt
dt
m
v
Como
Vel Ax
m
m
m
m AVel
A Vel t
AVel
Logo
dmvc
1 AV
1 el1 2 A2Vel 2
dt
Se a massa no interior do volume de controle permanece constante
(hipótese válida, principalmente quando tratamos de fluídos
dmvc
0.
incompressíveis), teremos um regime permanente:
dt
Então: 1. A1.Vel1 2 . A2 .Vel2 0
1 AV
1 el1 2 A2Vel 2
Para i entradas e j saídas:
AV
i
i
i eli
j AjVelj
j
Equação continuidade na sua forma básica6.
6
Veremos a equação da continuidade na sua forma completa no 3º Bi.
32
Exemplo:
A água escoa em um duto com diâmetro variando de 20 mm para 40 mm
ao longo do escoamento. Se a água no ponto A tem VelA = 40m/s,
determine a velocidade VelB bem como sua vazão mássica.
H 2O 1000 kg
m3
33
2.2.5 Trabalho desenvolvido por um fluxo
O trabalho total desenvolvido pelo sistema durante o processo é
composto por duas partes: um trabalho denominado trabalho de fluxo,
associado às massas que cruzam o sistema; e um trabalho que inclui as
demais forças como: as de cisalhamento, superficiais ou de um eixo que
atravessa o sistema (trabalho de eixo).
W Weixo W fluxo
* Obs.: A energia só pode variar pelos dois meios.
Onde:
W f p1dV1 p2 dV2
W f PV
1 1 PV
2 2
W f PVel
1
1 A1t PVel
2
2 A2 t
Entra no sistema (-)
Sai do sistema (+)
Considerando a convenção de trabalho positivo quando sai do
sistema teremos:
W f P2 A2Vel 2 t P1 AV
1 el1t
O trabalho de fluxo resulta do escoamento de um fluído através de
um campo de pressão.
34
2.2.6 Formulação geral da 1°Lei para volume de
controle
Q
1
.
m
Volume de Controle
t
Volume de Controle
2
Q
t+∆t
Digite a equação aqui
.
m
Da 1ª Lei teremos: Q W Etotal
Considerando as energias mecânicas e termodinâmicas:
Q W Etotalt t Etotalt
mVel22
Q W U 2 m2 gz2
E2 U1 m1 gz1 mVel
E1
1
2
Então:
2
mVel22
mVel
1
1
Q W U 2 m2 gz2
E2 U1 m1 gz1
E1
2
2
35
Para nossa comodidade é interessante colocarmos as grandezas em
função das propriedades relativas à vazão mássica.
Vel 2
Vel 2
Q W m2 u2 gz2 2 m1 u1 gz1 1 E
2
2
Como:
.
m
m
m m.t m .Vel. A.t
t
Assim sendo, pode-se escrever:
Vel22
Vel12
Q W 2Vel2 A2 t u2 gz2
1Vel1 A1t u1 gz1
E
2
2
Contudo sabemos que: W We W f
E se W f PVel
2
2 A2 t PVel
1
1 A1t
Vel22
Vel12
Q (We PVel
1Vel1 A1t u1 gz1
E
2
2 A2 t PVel
1
1 A1t ) 2Vel2 A2 t u2 gz2
2
2
.
Dividindo tudo pelo tempo:
.
.
Vel22
Vel12 E
Q We PVel
A
Vel
A
u
gz
PVel
A
Vel
A
u
gz
1 1 1
2
2 2
2
2 2 2
2
1
1 1 1
1
2
2
t
.
.
Vel 2 P
Vel 2 P E
Q We 2Vel2 A2 u2 gz2 2 2 1Vel1 A1 u1 gz1 1 1
2
2
2
1 t
.
Vel22 P2 .
Vel12 P1 E
Q We m 2 u2 gz2
m1 u1 gz1
2
2
2
1 t
.
Se
.
1
; h Pv u
v
Então:
.
.
.
Vel 2 .
Vel 2 E
Q We m2 h2 gz2 2 m1 h1 gz1 1
2
2 t
36
Escoamento Permanente:
.
Então, concluindo:
E
zero ;
t
.
.
.
m1 m2
.
Q We m (h2 h 1 ) g ( z2 z 1 ) 1 (Vel22 Vel12 )
2
.
Sem energias mecânicas:
.
.
Q We m(h2 h 1 )
Para sistema fechado sem variação de energia mecânica tínhamos:
Q W U
Agora, para sistema aberto sem variação de energia mecânica temos:
Q We H ou Q We mh
Exercícios:
1) 7O gás hélio deve ser comprimido desde 100 KPa e 300 K até 500 KPa e
400 K. A perda de calor pelo revestimento do compressor é estimada em
60 KWatts. Desprezando-se as variações de energia potencial e cinética,
determine o fluxo de massa capaz de ser comprimido supondo-se uma
potência de 700 KWatts. Cp = 5,1926 KJ/KgK.
7
Exercício 1, pág 247 do “Fenômenos de Transporte para engenharia; Braga, Washington; LTC, 2006”
37
2) Uma bomba utilizada em um sistema de irrigação transfere 5 Kg/s de
água de um rio para uma superfície livre de um reservatório que está
localizado ao nível de 20 m acima do rio. Se a temperatura da água ocorre
de modo adiabático. Determine a potência necessária do equipamento.
Obs.: Considere que não haja variação significativa da velocidade ao longo
de escoamento.
Reservatorio
Bomba
RIO
38
AULA 7
Exercícios:
1) Uma bobina a gás recebe uma mistura de ar-combustível, tendo uma
entalpia de 1200 KJ/Kg. Se 20 KJ/Kg são perdidos pela turbina por
transmissão de calor e a entalpia do gás na saída é de 100 KJ/Kg. Quando
de trabalho por unidade de massa pode ser obtido desta turbina.
Desconsidere as variações de energia mecânica.
39
2) Uma bobina produz uma potência de 0,1 KW. O estado na seção de
entrada da turbina é 50°C e na saída de -30°C. Admitindo-se que as
velocidades sejam baixas e que a turbina seja adiabática. Determine a
vazão de ar necessária para esta turbina. Cp = 1,004 KJ/KgK.
3) Uma turbina pequena de alta velocidade é alimentada com ar
comprimido e produz uma potência de 0,1KW. A temperatura na entrada
da turbina é 50°C e na saída é de -30°C. Admitindo-se que a turbina seja
adiabática, determine a vazão de ar necessária se o Cp=1,004 KJ /kg K.
40
2.2.7 Aplicações em equipamentos de uso industrial
a) Dispositivos de estrangulamento: são válvulas ou placas que
provocam uma queda de pressão sem significativa variação de
energia potencial ou cinética. Este processo ocorre sem a realização
de trabalho de eixo e de modo adiabático.
2
1
m
.
.
.
1
Q W e m (h2 h1 ) g ( z2 z1 ) (V22 V12 )
2
Adiabatico
Zero
Sem
trabalho do
eixo
Sem variação
de energia
potencial
Sem
variação de
energia
cinética
h2 h1 0
.
m(h2 h1 ) 0
.
m 0 sem escoamento
b) Bombas Compressoras e Turbinas: Bombas compressoras e
turbinas são dispositivos que transferem energia para um fluido
de trabalho ao passo que turbinas são equipamentos capazes de
captar energia do fluido e transferi-la ao meio externo. Muitas
vezes, a transmissão de calor bem como as variações de energia
cinética e potencial são ignoradas nesses dispositivos, sendo
consideradas
perdas
e
consequentemente
inclusas
ao
definirmos seu rendimento. Para regimes permanentes temos:
41
.
.
.
1
Q W e m (h2 h1 ) g ( z2 z1 ) (V22 V12 )
2
Considerando
no COP
Sem variação
de energia
potencial
.
W
.
.
W e m(h2 h1 )
.
m
Sem
variação de
energia
cinética
W
t
m
t
.
W e
.
(h2 h1 ) W e (h2 h1 )
m
Obs1: Nas bombas e compressores o trabalho é negativo quando o volume de controle sofre o
trabalho.
Obs2: As turbinas executam trabalho sobre o meio, logo o trabalho é positivo.
Obs3: Obviamente situações que envolvam troca de calor significativa exigem que este calor
seja incluso na equação.
c) Bocais e difusores
Ep’’
Ep’
Z
2
1
1
2
.
m
X
.
m
-Z
-Ep’
-Ep’’
Bocal
Difusor
V1<<V2
P1<<P2
42
Bocais são dispositivos utilizados para gerar escoamentos com
velocidades altas a partir de uma queda de pressão. Difusores são
utilizados para desacelerar escoamentos ou aumentar sua pressão.
Em ambos os dispositivos, não há realização de trabalho de eixo e a
transmissão de calor é muito baixa.
Vel
Cp
RT
Cv
Subsônico
Sendo escoamento permanente
.
.
.
1
Q W e m (h2 h1 ) g ( z2 z1 ) (V22 V12 )
2
Zero, considerando o PHR no eixo de Simetria
.
1
m (h2 h1 ) (V22 V12 ) 0
2
Logo, (h2 h1 )
1 2
(V2 V12 ) 0
2
d) Trocador de Calor
São equipamentos utilizados para transmitir energia de um corpo mais
quente para outro mais frio, considerando as variações de energia
mecânica desprezível.
.
.
.
1
Q W e m (h2 h1 ) g ( z2 z1 ) (V22 V12 )
2
Q m(h2 h1 )
ou
q (h2 h1 )
43
Para aumentar a eficiência podemos analisar esse equipamento quando
utilizamos dois fluidos de trabalho.
mB
mA
Q
1
2
Não havera troca de calor
mB
Em um determinado tempo, haverá
equilíbrio térmico entre ambos
QA QB
mA (hA2 hA1 ) mB (hB 2 hB1 )
Exercícios:
1) O vapor entra em uma turbina a 4000 Kpa. Para uma velocidade de
entrada de 200m/s calcule a potência de saída desconsiderando as
variações de energia cinética e transmissão de calor. Mostre que a a
variação de energia cinética é desprezível.
Dados:
Øinterno da entrada da turbina = 50mm
Øexterno da saída da turbina = 250 mm
h saída = 2665,7 KJ/kg
h entrada = 3445,2 KJ/kg
volume específico da saída da turbina = 2,087 m3/kg
volume específico da saída da turbina = 0,08643 m3/kg
44
45
AULA 8
2.3 Segunda Lei da Termodinâmica
CARGA
Os reservatórios
serão considerados
Perfeitos.
CARGA
SISTEMA
QC
SISTEMA
QH
PLACA HOT
PLACA COLD
A segunda Lei da Termodinâmica indica que todos os processos
conhecidos ocorrem em um determinado sentido, por exemplo, a queda
de um corpo, provoca um aquecimento na atmosfera ao seu redor,
porém, o aquecimento na atmosfera não faz com que esse corpo seja
erguido.
Algumas definições:
a) Máquinas térmicas: São dispositivos que operam segundo um ciclo
termodinâmico utilizando dois reservatórios térmicos.
b) Motor térmico: é uma maquina térmica que realiza trabalho liquido
através do fluxo de calor entre dois reservatórios térmicos.
c) Bomba de Calor: é uma máquina térmica que recebe calor de um
corpo a baixa temperatura, com objetivo de fornecê-lo a um corpo a alta
temperatura.
46
d) Refrigerador: é uma maquina térmica cujo objetivo é retirar calor de
um corpo frio, tendo, como consequência o envio de calor a um
reservatório térmico quente.
e) Reservatório Térmico: São sistemas que recebem ou cede calor sem
variar sua temperatura.
2.3.1 Eficiência e Coeficientes de Performance (COP)
Podemos deduzir o trabalho útil produzido por um motor térmico. T1>T2
Sei que:
W QH QC
W
energia útil
QH energia disponível
QH QC
QH
1
QC
QH
Eficiência de um motor
Quando tratarmos de bombas térmicas ou refrigeradores:
W
Fornece energia para o sistema
funcionar.
47
COPBom.Térm.
QH
W
COPrefri
QC
W
COPBomb.Term.
QH
QH QC
COPrefri
QC
QH QC
COPrefri
1
COPBom.Térm.
1
Q
1 C
QH
QH
1
QC
2.3.2 Enunciados
Kelvin – Planck: É impossível construir um
dispositivo que opere em ciclo cujos únicos
efeitos sejam a realização de trabalho e a
troca de calor com um único reservatório
térmico.
Clausius: É impossível construir um dispositivo que em um ciclo e
cujo único efeito seja a transmissão de calor de um corpo mais frio
para um corpo mais quente.
Somente se houver a presença de uma máquina térmica:
48
AULA 10
2.3.3 Máquina de Carnot
É a máquina térmica que opera com a maior eficiência (ou
coeficiente de performance – COP) entre dois reservatórios térmicos.
Trata-se de um processo idealizado com o maior rendimento possível no
qual todos os processos envolvidos são necessariamente reversíveis.
Idealizado
Maior
rendimento
possível
Processos
reversíveis
Um processo reversível é aquele que quando invertido, o sistema e o meio
não apresentam qualquer evidência de que processo tenha existido.
Desta forma, podemos descrever o ciclo de Carnot como sendo:
P
Isotérmico
Adiabatico
V
49
F
F
F
F
QC
QH
TC
TH
Princípio de Carnot
1°) O rendimento de uma máquina térmica irreversível será sempre
inferior ao de uma máquina reversível que funcione entre as mesmas
fontes.
2°) O rendimento de qualquer máquina térmica reversível que funcione
entre as mesmas duas fontes será sempre igual independente do ciclo ou
dos fluídos de trabalho.
η
irreversível (real)
< η
reversível (Carnot - A)
=
η
reversível (Carnot - B)
Observação: Como as fontes de energia resumem-se aos reservatórios
térmicos, o rendimento de uma maquina reversível são proporcionais às
temperaturas de seus reservatórios térmicos.
QH TH *
QC TC *
*desde que as temperaturas estejam em
escala absoluta (K).
Desta maneira podemos reescrever as equações de rendimento e
COP para processos que obedeçam ao ciclo de Carnot:
50
Q
1 C
QH
1
TC
TH
COPrefri
COPrefri
1
QH
1
QC
1
TH
1
TC
COPBomb.Term.
1
Q
1 C
QH
COPBomb.Term.
1
T
1 C
TH
Exercícios:
1) Um ciclo de potência proposto é desenvolvido para operar entre dois
reservatórios térmicos. Deseja-se produzir 43 HP a partir de 2.500 KJ de
energia por minuto. Determine se este ciclo é possível.
900° QH
Motor
Elétrico
W
20° QC
51
2) Uma máquina térmica de Carnot produz 10 HP transferindo energia
entre dois reservatórios à temperatura de 500 K e 672 K. Calcule a taxa de
transmissão de calor do reservatório de maior temperatura.
3) Um automóvel que tem um rendimento de 13 Km/l está viajando a 100
km/h. A esta velocidade essencialmente toda força produzida pelo motor
é utilizada para superar a resistência do ar. Se a força do ar é dada como
FD CD 1 Vel2 A , determine a eficiência térmica do motor a esta
2
velocidade considerando uma área de resistência do ar ao movimento de
2 m³. Sabe-se que o coeficiente de resistência do ar (CD = 0,28), o poder
calorífico da gasolina é de 9.000 KJ / Kg, a massa específica da gasolina é
de 740 Kg/m³ e que a massa específica do ar de 1,23 Kg/m³.
52
4) Um refrigerador esta resfriando um espaço a 5°C transferindo calor
para atmosfera que esta a 20°C. O objetivo é reduzir a temperatura no
espaço para -25°C. Calcule a porcentagem mínima de trabalho necessário
assumindo um refrigerador de Carnot que retire a mesma quantidade de
calor.
Interior
I
II
Ambiente
-5°C
20°C
QC
QH
Interior
Ambiente
-25°C
20°C
QC
QH
53
5) Considere uma máquina cíclica que troca 6KW de calor com um
reservatório térmico a 250°C. Essa maquina apresenta as seguintes
características:
a- QC 0 KW
W 6KW
b- QC 6 KW
W 0KW
O QC é trocado com o ambiente externo que apresenta temperatura igual
a 30°C. Considerando que essa maquina seja um motor, diga se essas
operações são possíveis. Caso ela seja uma bomba de calor, faça o
mesmo.
54
55
AULA 11
2.3.4 Entropia
Denominamos entropia a propriedade do sistema que nos permite aplicar
a 2ª Lei de forma quantitativa. Essa grandeza indica o que é possível e o
que é impossível no mundo real, indicando em ultima analise aquilo que
chamamos de “antes e depois”.
Do enunciado de Clausius, temos:
T1 > T2
Para um ciclo:
T1
irreversivel 1
QH
Motor
QC
T
Carnot 1 C
QH
TH
Assim:
W
QC=0
T2
QC
T
C
QH
TH
Retornando à anotação para o calor, um dos Q, no caso QC será negativo,
então obrigatoriamente temos:
QC
T
C
QH
TH
QH QC
0
TH TC
Este conceito pode ser estendido para processos múltiplos e mistos
independente de suas naturezas, ou seja, ele vale para qualquer ciclo.
Para i processos:
Qi
T
i
i
0
Q
T
0
Desigualdade de Clausius
56
Se o ciclo é reversível, podemos deduzir que a desigualdade de Clausius
assume seu valor limite, ou seja, igual à zero,
Q
T
0 , de modo que:
P
II
A
B
I
Q
T
2
QA
T
1
2
QB
1
T
0
QA 2 QB
1 T 1 T 0
2
2
1
QA
T
2
1
V
S2 S1
QB
Q
T
var iação da Entropia(S )
*Propriedade não depende do caminho
T
Dessa forma, percebemos que
Q
T
0 independe do caminho, sendo por
tanto uma propriedade do sistema, a esta propriedade denominaremos
entropia.
Para “S” continuo, acha-se a fórmula geral.
ds
Q
T
Para um ciclo qualquer composto de processos reversíveis e irreversíveis,
podemos fazer que:
P
Reversivel
II
Irreversivel
I
V
57
2
1
Q
T
1
2
Q
T
Q 1 Q
1 T 2 T
2
0
Então, entropia de um processo irreversível, deve ser menor ou igual à
entropia de um processo reversível.
Q
1 T S ; irreversivel reversivel
2
Em um processo irreversível (adiabático), a ∆S é sempre positiva, ou seja,
se o sistema for termicamente isolado, a entropia não pode decrescer.
Por exemplo: Considere um refrigerador “perfeito”: T1>T2
S
T1
QH QC
TH TC
Considerando esse esquema, esse processo
é necessariamente impossível visto que
nos levaria a um decréscimo de entropia.
Refri
T2
T1
Refri
W
QH QC W
S
QH QC
T1 T2
T2
58
Fazendo análise:
S
QC W QC
0
T1
T2
QC W QC
T1
T2
No refrigerador me interessa QC, então:
QC
QC
T2
T
QC 2 W
T1
T1
T2
T
QC 2 W
T1
T1
QC
W
T2
T1T2
T1
T1
T T
QC 1 2 2 W
T1 T1
T
QC W 2
T1 T2
T2
1
QC W
T
1 T 1
2
T1
QC
W
T2
1
T1
QC WCarnot Max de energia
Para um ciclo de Carnot
Temp
P
Isotérmico
1
Isotérmico
1
2
2
Adiabatico
4
Adiabatico
3
4
V
3
S (entropia)
59
S
dQ
T
Para um ciclo reversível
dS
Q
T
Q TdS
Para um ciclo irreversível
S
Q
T
Podemos verificar a desigualdade de Clausius com base em uma
análise entrópica:
- Refrigerador ideal:
TH
S
Q
Q Q
0
T1 T2
Impossível.
T 1 > T2
TC
60
- Refrigerador real:
T1
S
R
W
Logo,
QH QC
Q QC W
T1 T2 , se H
S
QH
QH W QC
T1
T2
S 0 Possível.
T2
No limite da igualdade:
QH W QC
QCT2 WT2 QCT1
T1
T2
QC (T1 T2 ) WT2 QC W (
T2
T2
QC W (
T
(T1 T2 )
( 1 1)
T2
Observações:
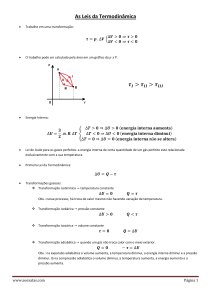
1. Em processo irreversível (real) obrigatoriamente ΔS > 0, em processos
reversíveis podem se considerar ΔS = 0, ou seja, ΔS ≥ 0. Isso significa que
se um sistema for termicamente isolado a entropia não pode decrescer.
2. Se um processo é ideal para o refrigerador teremos como limite de
performance.
QC W (
T2
T
( 1
T2
1)
)
T2 0
quando
Q2 0
3. É impossível atingir o zero absoluto em um número finito de operações
(3° Lei da Termodinâmica).
61
4. O calor específico tende a zero na vizinhança do zero absoluto.
Dessa forma podemos reescrever a 1ª Lei para sistemas fechados como:
U Q W
dU Q W
dU TdS W dividindo todos por massa
(dU TdS W )%
du TdS W
Como W PdV
du Tds PdV
-> I
Lembrando a formulação de entalpia, H U PV
d (h u Pv)
dh du Pdv vdP
Então:
dh Tds Pdv Pdv vdP
dh Tds vdP
-> II
Assim podemos reescrever I e II:
Tds du Pdv
Tds dh vdP
Observando um mol de gás perfeito e que os calores específicos
são constantes, podemos fazer:
62
Equação I
Como Pv RT
Cv
U
du
du CvdT
mT dT
Logo, I fica:
Tds CvdT Pdv
ds Cv
2
2
1
1
dT Pdv
T
T
ds Cv
sendo,
P
=R/v
T
2
dT
Rdv
T 1 v
S 2 S1 Cv ln
T2
v
R ln 2
T1
v1
Equação II
Como Pv RT
Cp
dh
dT
S2 S1 Cp ln
T2
P
R ln 2
T1
P1
63
Exercícios:
1) Dois blocos de cobre de 1 Kg são postos em dois subsistemas isolados.
Após retirarmos o isolante entre eles determine qual será a variação de
entropia no novo sistema gerado se o calor específico do cobre é de 386
J/KgK
1
T1
1Kg
ΔS1 = ?
2
60°C
Q
T2
20°C
1Kg
ΔS2 = ?
ISOLANTE
64
2) Imagine uma maquina de Carnot que opera entre as temperaturas de
850K e 300K. A máquina realiza trabalho de 1200J a cada ciclo que dura
0,25s. Determine:
a- A eficiência dessa máquina
b- A potência dessa máquina
c- Quanto é a energia que é exercida na forma de calor do
reservatório de alta temperatura q cada ciclo.
d- Qual é a energia liberada sob a forma de calor para o
reservatório de baixa temperatura.
e- De quanto varia a entropia do fluido de trabalho devido à
transferência de energia do reservatório de alta temperatura?
E quanto varia a entropia devido à transferência de entropia
do reservatório de baixa temperatura?
65
66
3) Um trocador de calor é alimentado por 2Kg/s de um fluido refrigerante
com entalpia de 147,4 KJ/Kg. Este fluido é descarregado do trocador,
apresentando pressão igual “aquela” da seção de entrada e com entalpia
de 211,94KJ/Kg. A energia necessária para ocorrer o processo é fornecida
por uma bomba de calor de COP=2,5. Determine nessas condições a
potência necessária para operar essa bomba.
67