58° Congresso Brasileiro de Cerâmica – 18 a 21 de maio de 2014
IDENTIFICAÇÃO DOS SÍTIOS ATIVOS SUPERFICIAIS DA
ALUMINA PARA ADSORÇÃO DE ÁCIDO ESTEÁRICO
J. Webber, C. A. Perottoni, R.C.D. Cruz, J.E. Zorzi
IMC - Instituto de Materiais Cerâmicos, Universidade de Caxias do Sul
95765-000, Bom Princípio – RS
[email protected], [email protected]
INTRODUÇÃO
Um dos atributos que determina a aplicação da
alumina (α-Al2O3) é a capacidade de sua superfície
interagir com o meio. Devido ao caráter anfotérico, sua
reatividade é influenciada pelos grupos superficiais, nos
quais predominam as hidroxilas. A capacidade de
adsorver moléculas orgânicas na superfície depende
do sistema partícula-surfactante. Foi estudado o regime
de hidroxilação-desidroxilação de partículas de alumina
(d50= 0,4 µm) com o objetivo de identificar e classificar
os sítios superficiais. Também foi realizado o
recobrimento superficial com diferentes teores de ácido
esteárico, com o objetivo de determinar o tipo de
interação e a adsorção máxima.
EXPERIMENTAL
Desaglomeração
2ª monocamada
1ª monocamada
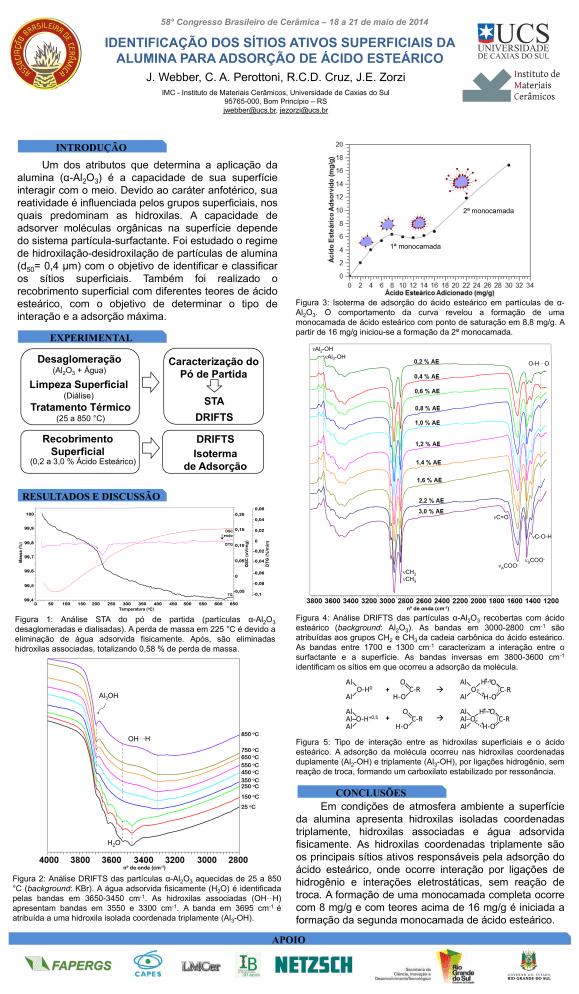
Figura 3: Isoterma de adsorção do ácido esteárico em partículas de αAl2O3. O comportamento da curva revelou a formação de uma
monocamada de ácido esteárico com ponto de saturação em 8,8 mg/g. A
partir de 16 mg/g iniciou-se a formação da 2ª monocamada.
νAl2-OH
νAl3-OH
Caracterização do
Pó de Partida
(Al2O3 + Água)
O-H.....O
Limpeza Superficial
(Diálise)
Tratamento Térmico
STA
DRIFTS
(25 a 850 °C)
Recobrimento
Superficial
(0,2 a 3,0 % Ácido Esteárico)
DRIFTS
Isoterma
de Adsorção
RESULTADOS E DISCUSSÃO
νC=O
νC-O-H
νCH2
νCH3
νACOO-
νSCOO-
nº de onda (cm-1)
Figura 1: Análise STA do pó de partida (partículas α-Al2O3
desaglomeradas e dialisadas). A perda de massa em 225 °C é devido a
eliminação de água adsorvida fisicamente. Após, são eliminadas
hidroxilas associadas, totalizando 0,58 % de perda de massa.
Figura 4: Análise DRIFTS das partículas α-Al2O3 recobertas com ácido
esteárico (background: Al2O3). As bandas em 3000-2800 cm-1 são
atribuídas aos grupos CH2 e CH3 da cadeia carbônica do ácido esteárico.
As bandas entre 1700 e 1300 cm-1 caracterizam a interação entre o
surfactante e a superfície. As bandas inversas em 3800-3600 cm-1
identificam os sítios em que ocorreu a adsorção da molécula.
Al3OH
OH.....H
Figura 5: Tipo de interação entre as hidroxilas superficiais e o ácido
esteárico. A adsorção da molécula ocorreu nas hidroxilas coordenadas
duplamente (Al2-OH) e triplamente (Al3-OH), por ligações hidrogênio, sem
reação de troca, formando um carboxilato estabilizado por ressonância.
H2O
nº de onda (cm-1)
Figura 2: Análise DRIFTS das partículas α-Al2O3 aquecidas de 25 a 850
°C (background: KBr). A água adsorvida fisicamente (H2O) é identificada
pelas bandas em 3650-3450 cm-1. As hidroxilas associadas (OH....H)
apresentam bandas em 3550 e 3300 cm-1. A banda em 3695 cm-1 é
atribuída a uma hidroxila isolada coordenada triplamente (Al3-OH).
CONCLUSÕES
Em condições de atmosfera ambiente a superfície
da alumina apresenta hidroxilas isoladas coordenadas
triplamente, hidroxilas associadas e água adsorvida
fisicamente. As hidroxilas coordenadas triplamente são
os principais sítios ativos responsáveis pela adsorção do
ácido esteárico, onde ocorre interação por ligações de
hidrogênio e interações eletrostáticas, sem reação de
troca. A formação de uma monocamada completa ocorre
com 8 mg/g e com teores acima de 16 mg/g é iniciada a
formação da segunda monocamada de ácido esteárico.
APOIO











