2º
Química B
Wesley
Av. Trimestral
EM
21/10/15
INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA
LEIA COM MUITA ATENÇÃO
1.
Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos.
2.
Esta prova contém 21 questões dissertativas.
3.
Leia todas as questões com atenção.
4.
A prova deverá ser feita com caneta esferográfica de tinta azul ou preta.
5.
É vedada a utilização de qualquer material de consulta, eletrônico ou impresso.
6.
É terminantemente proibido retirar-se do local da prova antes de ocorrido o tempo mínimo estipulado,
qualquer que seja o motivo.
7.
Tempo de duração da avaliação - Mínimo: 50 min
Máximo: 50 min
8.
Ao final, entregue a prova ao professor aplicador.
BOA PROVA!
Assinatura do Aluno: _________________________________________________
QUESTÕES
Escolha 7 questões, qualquer questão a mais será levada em consideração!! Aproveite!
1.
(Unicamp 2008) Para a sobremesa, os Mitta prepararam o "Arroz-doce à moda do Joaquim". Dina
explicava aos convidados: "Um dos segredos da receita é não deitar o açúcar logo no início porque ele é
muito hidrofílico e compete com o amido do arroz pela água, e também porque a elevada pressão
osmótica dificulta a entrada de água para o interior dos grãos, não deixando que eles cozinhem de forma
uniforme e completa." Como Dina usava uma linguagem muito científica, um dos convidados logo fez
duas perguntas:
a) "Ô Dina, o que significa hidrofílico e como se explica isso no caso do açúcar?"
b) "Ao fazer o arroz salgado, a gente põe o sal no início e o arroz cozinha de maneira uniforme. Então,
essa tal de pressão osmótica não existe no caso do sal? Por quê?"
1/12
2.
(Unicamp 2008) O nosso herói, logo depois de tratar o Pipetão, foi à cozinha e resolveu "traçar"
alguma coisa. Encontrou uma embalagem de pão ainda fechada. Pensou: "Vai ser isso mesmo, mas
com manteiga ou margarina? Eu sei que se recomenda uma baixa ingestão diária de colesterol e que a
gordura saturada, quando ingerida em excesso, aumenta o 'mau' colesterol (LDL) e também o 'bom'
colesterol (HDL). Essa manteiga contém colesterol e gordura saturada. Por outro lado, essa margarina
não tem nada de colesterol e tem muita gordura trans, que, assim como as gorduras saturadas, aumenta
o LDL, mas tende a baixar o HDL". Com as duas embalagens na mão e todas essas informações, Rango
ficou ali babando e se perguntando...
a) "Meu mais recente exame de sangue mostrou que o nível de HDL está na faixa aceitável. Se eu
pensar só nisso, será que eu devo usar a manteiga ou a margarina? Por quê?"
b) "Mas há outra coisa, meu valor de LDL está acima da faixa aceitável. E agora? Se eu levo em conta
só esse fato, eu devo ou não besuntar o pão com manteiga ou margarina? Por quê?"
3.
(Uema 2015) Deu no noticiário do Bom Dia Brasil:
“A polícia civil de São Paulo está à procura de seis mulheres suspeitas de aplicar um golpe conhecido como boa
noite, Cinderela”.
Boa noite, Cinderela refere-se a um crime que consiste em drogar uma vítima para roubá-la ou estuprá-la. As drogas
que costumam ser usadas nessa prática são GHB (ácido 4-hidroxibutanoico), Ketamina, rohypnol e clorofórmio
(triclorometano). Em comum essas drogas apresentam um efeito depressor sobre o sistema nervoso central.
Fonte: Telejornal Bom dia Brasil. São Paulo. TV Globo, 15 set. 2014
Para as duas substâncias destacadas em negrito, demonstre se ambas apresentam carbonos quirais.
Justifique sua resposta.
4.
(Uel 2014) A gasolina é uma mistura de vários compostos. Sua qualidade é medida em octanas,
que definem sua capacidade de ser comprimida com o ar, sem detonar, apenas em contato com uma
faísca elétrica produzida pelas velas existentes nos motores de veículos. Sabe-se que o heptano
apresenta octanagem 0 (zero) e o 2,2,4-trimetilpentano (isoctano) tem octanagem 100. Assim, uma
gasolina com octanagem 80 é como se fosse uma mistura de 80% de isoctano e 20% de heptano.
Com base nos dados apresentados e nos conhecimentos sobre hidrocarbonetos, responda aos itens a
seguir.
a) Quais são as fórmulas estruturais simplificadas dos compostos orgânicos citados?
b) Escreva a equação química balanceada da reação de combustão completa de cada um dos
hidrocarbonetos usados.
5.
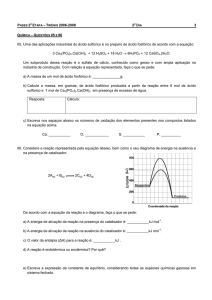
(Uerj 2014) O trióxido de diarsênio é um sólido venenoso obtido pela reação do arsênio (As) com o
gás oxigênio. Sua entalpia padrão de formação é igual a 660 kJ.mol1.
Escreva a equação química completa e balanceada da obtenção do trióxido de diarsênio. Em seguida,
calcule a quantidade de energia, em quilojoules, liberada na formação desse sólido a partir da oxidação
de 1,5 kg de arsênio.
2/12
6.
(Ufpr 2013) Armadilhas contendo um adsorvente com pequenas quantidades de feromônio sintético
são utilizadas para controle de população de pragas. O inseto é atraído de grandes distâncias e fica
preso no artefato por meio de um adesivo. O verme invasor do milho europeu utiliza o acetato de cis-11tetradecenila (figura) como feromônio de atração sexual. Isômeros de posição e geométrico desse
composto têm pouco ou nenhum efeito de atração.
Responda:
a) A que função orgânica pertence o composto orgânico?
b) Forneça o nome oficial pela norma IUPAC do isômero geométrico do feromônio da figura.
7.
(Unicamp 2010) Com a finalidade de manter uma imagem jovem, muitas pessoas eliminar as rugas
do rosto utilizando a quimioesfoliação (peeling químico), um processo que envolve algum risco à saúde.
A quimioesfoliação consiste na aplicação de um ou mais agentes à pele, visando promover esfoliação
cutânea, o que leva à renovação celular e à eliminação das rugas. Dois tipos de peeling podem ser
realizados: o superficial ou o médio e o profundo.
a) Para um peeling superficial ou médio, costuma-se usar uma solução da substância indicada a seguir:
Simplificadamente, a literatura afirma que, além da concentração da solução, o valor de pH ideal para
uma boa esfoliação deve estar abaixo de sete. Considerando somente a dissolução dessa substância
em água, seria possível obter essa condição de pH? Explique e justifique com uma equação química
pertinente.
b) Para um peeling químico profundo, pode-se usar uma microemulsão denominada solução de BakerGordon, que contém a substância cuja fórmula estrutural está representada a seguir. Do ponto de vista
da representação química, o hexágono com o círculo representa as possíveis estruturas ressonantes da
cadeia carbônica. Desenhe essas possíveis estruturas ressonantes para a cadeia e escreva a fórmula
molecular da substância.
3/12
8.
(Uerj 2015) As amidas podem ser obtidas pela reação entre um ácido carboxílico e a amônia,
conforme a seguinte equação geral:
R COOH NH3 R CONH2 H2O
Considere um laboratório no qual estão disponíveis quatro ácidos carboxílicos: etanoico, propanoico,
butanoico e pentanoico.
Escreva a equação química completa da reação da amônia com o composto de caráter ácido mais
acentuado dentre os disponíveis no laboratório.
Admitindo a substituição da amônia pelo metanol na equação geral, indique a função orgânica do
produto formado e o tipo de hibridação do átomo de carbono do grupo funcional desse produto.
9.
(Pucrj 2014) Na transesterificação representada a seguir, 1 mol da substância I reage com 1 mol
de etanol, na presença de um catalisador (cat), gerando 1 mol do produto III e 1 mol do produto IV.
Considerando-se os reagentes, o produto III e o produto IV (que pertence à função orgânica álcool)
responda ao que se pede.
a) Represente a estrutura do produto III utilizando notação em bastão.
b) Dê o nome do produto IV, segundo as regras de nomenclatura da IUPAC.
c) Escreva a fórmula molecular da substância I.
10. (Ufsc 2012) “[...] Era o carro do Fábio que tinha acabado o freio. Mandei que ele apertasse o pedal e vi que ia
até o fundo. Percebi que era falta de fluido. [...] Perguntei ao Luis se ele tinha fluido de freio e ele disse que não
tinha. E ninguém tinha. Então falei com o Antonino que o jeito era tirar um pouco de cada carro, colocar naquele e ir
assim até chegar numa cidade”.
FRANÇA JÚNIOR, Oswaldo. Jorge, um brasileiro. Rio de Janeiro: Nova Fronteira, 1988. p. 155-156.
O fluido para freios, ou óleo de freio, é responsável por transmitir às pastilhas e lonas do sistema de freios a força
exercida sobre o pedal do automóvel quando se deseja frear. Em sua composição básica há glicois e inibidores de
corrosão.
Disponível em: <http://www.inmetro.gov.br/consumidor/produtos/fluidos.asp> [Adaptado] acesso em: 26 out. 2011.
Considere as informações acima e os dados da tabela abaixo, obtidos sob pressão de 1 atm e
temperatura de 20 °C:
Nome IUPAC
Ponto de ebulição (°C)
I. Etan-1,2-diol
197
II. Propan-1,2-diol
187
III. Propan-1,3-diol
215
4/12
Escreva:
a) o nome da função orgânica presente nos compostos apresentados na tabela.
b) a fórmula estrutural de cada um dos compostos, conforme a ordem da tabela I, II e III.
c) o nome da força intermolecular responsável pelo elevado valor do ponto de ebulição dos compostos
citados.
11. (Udesc 2011) O ácido acetilsalicílico é empregado como princípio ativo em diversos medicamentos.
Estes medicamentos são consumidos pela população mundial para aliviar dores de cabeça, reumatismo
e controlar a febre. O mais conhecido deste medicamento é a aspirina. Na reação abaixo está descrita a
síntese do ácido acetilsalicílico.
Em relação ao contexto, responda:
a) Quais são as funções orgânicas presentes no ácido acetilsalicílico?
b) Qual é a fórmula molecular do ácido salicílico?
c) A qual função orgânica pertence o composto número 1, da reação acima?
12. (Unesp 2011) Kevlar® é um polímero de condensação com alta resistência ao calor e à tração,
sendo empregado na confecção de esquis, coletes à prova de bala, roupas e luvas utilizadas por
bombeiros, entre outras aplicações. A intensa atração existente entre as cadeias confere ao polímero
propriedades excepcionais de resistência, que têm permitido utilizar cordas do Kevlar® em substituição
aos cabos de aço.
Com base no exposto, qual a função orgânica nitrogenada que compõe a estrutura desse polímero? Dê
a fórmula estrutural de seus monômeros e diga que tipo de interação existe entre as cadeias adjacentes.
5/12
13. (Pucrj 2013) Uma das reações mais comuns é a de neutralização de um ácido inorgânico forte. Por
exemplo, uma solução aquosa de ácido clorídrico é neutralizada por carbonato de sódio conforme
mostrado na equação abaixo:
Dado: M(Na2CO3) = 106 g/mol
HC
(aq)
Na2CO3(s) Produtos
Considerando essa reação, seus reagentes e produtos, faça o que se pede.
a) Antes de ser dissolvido em água, o ácido clorídrico é um gás corrosivo. Escreva o tipo de ligação que
existe entre os átomos dos elementos H e C no HC gasoso.
b) Considerando excesso de HC e a reação completa com o carbonato de sódio, calcule a quantidade
de matéria, em mol, do produto gasoso produzido a partir de 5,3 g do sal.
c) A água é um produto da reação e se ioniza muito pouco a ponto de o valor da constante de ionização,
a 25 °C, ser 1 x 10
–14
. Escreva a expressão da constante de ionização da água líquida em função das
concentrações, em quantidade de matéria (mol/L), das espécies iônicas.
14. (Ufmg 2011) Observe este gráfico:
A análise das camadas de lixo em aterros e vazadouros a céu aberto, ou lixões, permite uma visão
sociológica de diferentes comunidades e, também, fornece subsídios para pesquisas biológicas.
Em determinado aterro, por exemplo, além dos mais diversos materiais biodegradáveis, foram
recuperados jornais da década de 1970 perfeitamente legíveis.
Com base nessas informações e em outros conhecimentos sobre o assunto, EXPLIQUE por que jornais
com 40 anos de idade puderam ser encontrados, em condições de leitura, em aterros sanitários.
15. No início de 2010, ocorreu um grave acidente em uma área da cidade de Niterói/RJ, em que houve
muitas mortes devido a deslizamentos de terra e a explosões. Divulgou-se, na época, que essa área
tinha sido utilizada, há 50 anos, como depósito de lixo urbano.
CITE uma substância que, nesse caso, pode contribuir para a ocorrência de explosões e EXPLIQUE, do
ponto de vista biológico, de que modo ela se forma.
6/12
16. O chorume é um líquido escuro formado em aterros sanitários como resultado da decomposição de
materiais orgânicos que constituem o lixo urbano. Por ser extremamente tóxico e poder contaminar
lençóis freáticos, esse produto deve ser devidamente tratado.
Em um dos processos utilizados, atualmente, no tratamento do chorume, uma das etapas consiste na
remoção da amônia, que, nesse material, se encontra em equilíbrio com o íon amônio, em meio aquoso.
ESCREVA a equação química que representa esse equilíbrio.
–5
17. A constante de basicidade para a equação do item anterior é, aproximadamente, 2 x 10 .
CALCULE o pH que esse sistema deve ter para que a concentração de amônia seja cinco vezes maior
que a concentração do íon amônio.
(Deixe seus cálculos indicados, explicitando assim seu raciocínio.)
18. A remoção da amônia, nesse caso, dá-se pela passagem de uma corrente de ar pelo chorume.
a) Assinalando com um X a quadrícula apropriada, INDIQUE se esse processo é mais eficiente em meio
básico ou em meio ácido.
A remoção da amônia é mais eficiente em meio
I)
(
) básico.
II)
(
) ácido.
b) JUSTIFIQUE sua indicação, considerando o equilíbrio entre a amônia e o íon amônio, em solução
aquosa, bem como a interação dessas espécies químicas com a água.
19. A amônia arrastada pelo fluxo de ar pode ser recuperada por absorção em uma solução de ácido
sulfúrico.
ESCREVA a equação química balanceada que representa a reação completa envolvida nesse processo.
20. (Ufpr 2011) As moléculas de triacilglicerol são diferenciadas em função das cadeias carbônicas
oriundas dos ácidos graxos que sofreram condensação por esterificação com os grupos álcool da
molécula de glicerol (propano-1,2,3-triol). Os principais ácidos graxos apresentam cadeias não
ramificadas e número par de átomos de carbono, podendo ser saturados ou insaturados. Em função da
presença de uma insaturação entre átomos de carbono, tem-se a possibilidade de ocorrência dos dois
isômeros geométricos: cis e trans. O isômero trans é mais estável que o cis. A principal fonte de ácidos
graxos trans é a hidrogenação parcial de óleos vegetais (triacilglicerol) usados na produção
de margarina e gordura hidrogenada, conforme a equação de equilíbrio indicada abaixo. O mecanismo
da reação envolve a adição da molécula de hidrogênio à dupla ligação, mediada pelo catalisador, e
formação de uma ligação saturada entre átomos de carbono.
Ácido graxo insaturado + H2 → Ácido graxo saturado
7/12
a) A partir das informações fornecidas acima e utilizando o Princípio de Le Châtelier, que condição
garante um maior rendimento da reação de hidrogenação?
b) Considerando que no início de uma reação são empregados apenas ácidos graxos de origem vegetal
nos quais apenas a forma cis está presente, por que, ao final da reação, há a presença de gordura
trans?
21. (Uerj 2010) O biodiesel, constituído basicamente por um éster, é obtido a partir da reação entre um
triacilglicerol e um álcool.
Analise o esquema:
Industrialmente, para aumentar a produção de biodiesel, utiliza-se álcool em quantidade muito superior à
proporção estequiométrica da reação.
Com base no equilíbrio químico da reação, explique por que quantidades elevadas de álcool aumentam
o rendimento do processo industrial. Indique, também, o nome oficial do éster que contém cinco átomos
de carbono formado a partir do etanol.
RESPOSTAS
1
NOTA
8/12
2
NOTA
3
NOTA
9/12
4
NOTA
5
NOTA
10/12
6
NOTA
7
NOTA
11/12
8
NOTA
9
NOTA
12/12