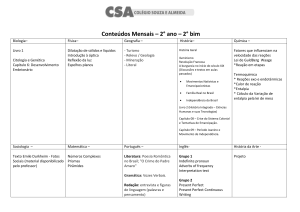
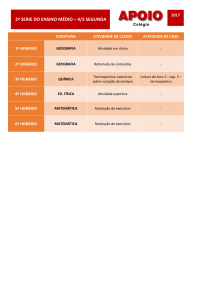
CURSINHO ETWB 2012
Componente Curricular: Química
Professor: Ricardo Honda
Data: Terça-feira, 21/08/2012
Tema da aula: Termoquímica: Reações endotérmicas e exotérmicas
“O estudo das trocas de energia na forma de calor envolvidas nas reações químicas e nas mudanças de estado
físico das substâncias é chamado de termoquímica”.
Processos endotérmicos e exotérmicos
São dois os processos em que há troca de energia na forma de calor: o processo endotérmico e o
exotérmico.
Processo endotérmico é aquele que ocorre com absorção de calor. Genericamente, podemos representar os
processos endotérmicos por:
Processo exotérmico é aquele que ocorre com liberação de calor. Genericamente, podemos representar os
processos exotérmicos por:
Entalpia
A foto mostra uma reação de combustão que pode ser representada, simplificadamente, por:
madeira + oxigênio → gás carbônico + água + calor
Uma pergunta interessante sobre essa reação é: “De onde vem essa energia ou esse calor?”.
A resposta mais simples é: A energia liberada estava contida nos reagentes e foi liberada
quando eles se transformaram nos produtos. Isso permite concluir que cada substância deve
apresentar um certo conteúdo de energia, denominado entalpia e representado pela letra H. Não se
conhece nenhuma maneira de determinar o conteúdo de energia (entalpia = H) de uma substância. Na
prática, o que conseguimos medir é a variação da entalpia (ΔH) de um processo, utilizando
calorímetros. Essa variação corresponde à quantidade de energia liberada ou absorvida durante o
processo, realizado a pressão constante. O cálculo da variação da entalpia é dado pela expressão
genérica:
ΔH em reações exotérmicas
Nas reações exotérmicas, como ocorre liberação de calor, a entalpia dos produtos (HP) é menor do que a
entalpia dos reagentes (HR). Genericamente, temos:
Aula 39
Página 1
Se considerarmos a síntese da amônia (NH3), teremos:
N2 (g) + 3 H2 (g) → 2 NH3 (g) + 92,2 kJ
ou N2 (g) + 3 H2 (g) → 2 NH3 (g) ΔH = –92,2 kJ
Pelas equações ou pelo gráfico, devemos entender que na
síntese de 2 mol de NH3 ocorre a liberação de 92,2 kJ.
ΔH em reações endotérmicas
Nas reações endotérmicas, como ocorre absorção de calor, a entalpia dos produtos (HP) é maior do que a
entalpia dos reagentes (HR). Genericamente, temos:
Se considerarmos a decomposição da amônia (NH3), teremos:
2 NH3 (g) + 92,2 kJ → N2 (g) + 3 H2 (g)
ou 2 NH3 (g) → N2 (g) + 3 H2 (g) ΔH = +92,2 kJ
Pelas equações ou pelo gráfico, devemos entender que na
decomposição de 2 mol de NH3 ocorre a absorção de 92,2 kJ.
EXERCÍCIOS DE CLASSE
1. (FUVEST) – Qual dos diagramas abaixo, no sentido Reagentes → Produtos, representa a reação mais
endotérmica? (Obs.: eixo x = caminho da reação; eixo y = energia; R = reagentes; P = produtos)
2. (UFV-MG 2011) – A Termoquímica estuda os aspectos relacionados às energias envolvidas nas
transformações químicas e físicas. Com base nesse conhecimento, é CORRETO afirmar que:
a) a energia de ativação numa reação química é sempre uma energia a ser liberada no início do processo.
b) os processos exotérmicos ocorrem com absorção de energia.
c) nos processos endotérmicos, a energia dos reagentes é maior que a energia dos produtos.
d) a diferença de energia entre reagentes e produtos é denominada entalpia da reação.
Aula 39
Página 2
3. (FUVEST) – Considere a reação de fotossíntese e a reação de combustão da glicose representadas abaixo:
6 CO2 (g) + 6 H2O (l) → C6H12O6 (s) + 6 O2 (g)
C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (l)
6
Sabendo-se que a energia envolvida na combustão de um mol de glicose é 2,8 ∙ 10 J, ao sintetizar meio mol de
glicose, a planta:
6
6
a) libera 1,4 ∙ 10 J.
6
b) libera 2,8 ∙ 10 J.
6
c) absorve 1,4 ∙ 10 J.
d) absorve 2,8 ∙ 10 J.
6
e) absorve 5,6 ∙ 10 J.
4. (UNESP 2011/2) – Diariamente podemos observar que reações químicas e fenômenos físicos implicam em
variações de energia. Analise cada um dos seguintes processos, sob pressão atmosférica.
I. A combustão completa do metano (CH4) produzindo CO2 e H2O.
II. O derretimento de um iceberg.
III. O impacto de um tijolo no solo ao cair de uma altura h.
Em relação aos processos analisados, pode-se afirmar que:
a) I é exotérmico, II e III são endotérmicos.
b) I e III são exotérmicos e II é endotérmico.
c) I e II são exotérmicos e III é endotérmico.
d) I, II e III são exotérmicos.
e) I, II e III são endotérmicos.
EXERCÍCIOS COMPLEMENTARES
1. (UNESP 2011) – Alquimia subterrânea transforma mina de carvão em mina de hidrogênio
Em uma área de mineração de carvão localizada no sul da Polônia, um grupo de cientistas está usando
uma mina de carvão para avaliar experimentalmente um método alternativo para a produção de energia limpa e,
assim, oferecer uma utilização para pequenos depósitos de carvão ou minas exauridas, que são tradicionalmente
deixados de lado, representando passivos ambientais. Na teoria e no laboratório, a injeção de oxigênio e de vapor
no carvão resulta na produção de hidrogênio. No processo, oxigênio líquido é colocado em um reservatório
especial, localizado nas galerias da mina de carvão, onde se transforma em oxigênio gasoso, começando o
processo denominado de gaseificação de carvão.
(www.inovacaotecnologica.com.br. Adaptado.)
A passagem do oxigênio líquido para oxigênio gasoso é uma transformação física
a) exotérmica, classificada como fusão.
b) exotérmica, classificada como ebulição.
c) endotérmica, classificada como liquefação.
d) endotérmica, classificada como evaporação.
e) espontânea, classificada como sublimação.
2. (UNICAMP 2011) – A obesidade está se tornando um problema endêmico no mundo todo. Calcula-se que em
2050 um terço de todos os homens e a metade das mulheres serão obesos. Considere a promoção de uma
lanchonete, composta de um lanche, uma porção de fritas, uma torta de maçã e 500 mL de refrigerante. A tabela
abaixo resume as quantidades (em gramas) de alguns grupos de substâncias ingeridas, conforme aparecem nas
embalagens dos produtos.
Grupo/produto
Carboidratos
Proteínas
Gorduras totais
Cálcio
Sódio
Lanche
36
31
32
0,28
1,22
Porção de batata
35
4,1
15
0,11
0,31
Torta de maçã
33
2,2
11
0,33
0,18
a) Considerando-se um valor diário de referência em termos de energia (VDE) de 8400 kJ, que percentual desse
VDE foi atingido apenas com essa refeição? Considere a energia por grama de lipídeos igual a 38 kJ e a de
açúcares e proteínas igual a 17 kJ. Considere também que cada 100 mL de refrigerante contém 11 gramas de
açúcar.
b) Considerando-se que o consumo diário máximo de sal comum (recomendado pela OMS) é de 5,0 gramas por
dia, esse limite teria sido atingido apenas com essa refeição? Responda sim ou não e justifique. (Dadas as
massas molares em g/mol: Na = 23; Cl = 35,5).
Aula 39
Página 3