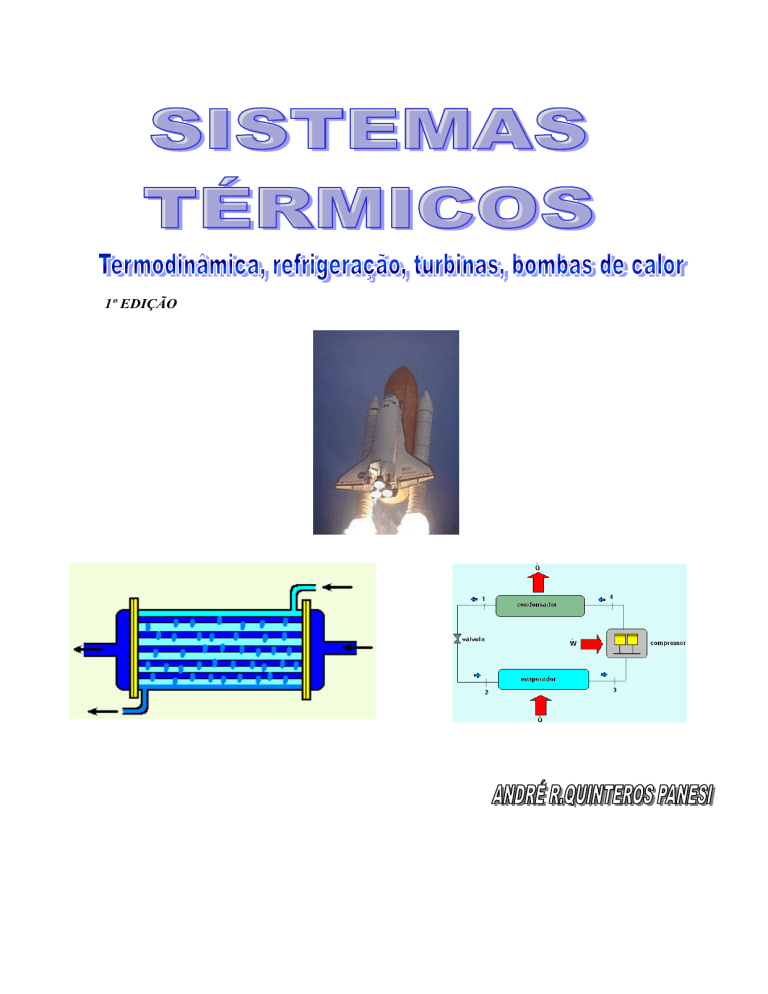
1º EDIÇÃO
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
PREFÁCIO
A presente publicação é destinada aos engenheiros e tecnólogos da área de mecânica que visam
a se desenvolver no extenso campo da ciência térmica. Desenvolvida basicamente através das
notas de aulas, os alunos encontrarão noções teóricas apresentadas de maneira clara e dinâmica,
seguidas quando for o caso, de problemas resolvidos de aplicação prática na engenharia.
Abordando temas essenciais para quem busca se aprofundar em engenharia térmica foi
elaborado com o propósito de transmitir os conhecimentos básicos do assunto. Através de uma
linguagem de fácil compreensão, temas cotidianos são apresentados e discutidos de forma que o
estudante possa aproveitar as informações obtidas através de sua leitura. O conceito das leis da
termodinâmica é fundamental para que se entenda o processo prático de ciclos e sistemas
térmicos.
André R. Quinteros Panesi
1
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
SUMÁRIO
Introdução
4
CAPÍTULO 1
1.1 Termodinâmica
1.2 Sistemas
1.2.1 Tipos de Sistemas
1.3 Propriedades
1.4 Estado
1.5 Número de Mols
1.6 Volume Molar
1.7 Volume Específico e Massa Específica
1.8 Densidade Relativa
1.9 Transformações Gasosas
1.9.1 Transformação Isotérmica
1.9.2 Transformação Isobárica
1.9.3 Transformação Isométrica
1.10 Equação de Estado dos Gases Ideais
1.11 Introdução a 1º Lei da Termodinâmica
1.12 Várias Formas da 1º Lei
1.12.1 Sistema Isolado
1.12.2 Sistema Fechado sem Fluxo
1.13 Calor e Trabalho
1.13.1 Trabalho PV
1.13.2 Trabalho de Eixo e de Fluxo
1.13.3 Calor
1.14 Entalpia
1.15 Capacidade Calorífica e Calor Específico
1.16 1º Lei Aplicada em Escoamento de Fluidos
1.16.1 Balanço de Energia e de Massa para Regime Permanente
1.17 Transformações Reversíveis dos Gases Ideais
1.17.1 Transformação Isotérmica
1.17.2 Transformação sem troca de calor
1.17.3 Transformação Isométrica
1.17.4 Transformação Isobárica
1.18 Mudanças de Estado
8
8
8
8
8
8
9
9
9
9
9
10
10
10
11
13
13
13
14
14
15
16
16
16
17
17
19
21
21
21
22
22
1.18.1 Temperatura de Saturação
1.18.2 Estados de Líquido
1.18.3 Estados de Vapor
1.18.4 Título
1.19 Aplicações da 1° Lei na Eng. Mecânica para Regime Permanente
1.19.1 Trocador de Calor
1.19.2 Bocais e Difusores
1.19.3 Turbinas
1.19.4 Compressores e Bombas
1.20 Regime Transiente
Exercícios Resolvidos do Capítulo
22
23
23
23
24
24
26
27
29
30
31
2
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Exercícios complementares
37
CAPÍTULO 2
2º Lei da Termodinâmica
2.1 Introdução a 2º Lei da Termodinâmica
2.2 Dois Enunciados Importantes
2.3 Enunciado Principal da 2º Lei
2.4 O Nascimento da Entropia
2.5 Caminhos Reversíveis e Irreversíveis
2.6 Irreversibilidades
2.7 Balanço de Entropia para Sistemas Fechados
2.8 Balanço de Entropia para Escoamentos de Fluidos
Exercícios Resolvidos do Capítulo
40
40
44
45
45
46
46
48
48
CAPÍTULO 3
Estudo dos Ciclos Termodinâmicos
3.1 Ciclo de Rankine
3.2 Efeitos da Pressão da Caldeira e do Condensador
3.3 Eficiência Isoentrópica
3.4 Melhorando o Desempenho do Ciclo de Rankine
3.5 Ciclo Otto
3.5.1 Cilindrada
3.5.2 Taxa de Compressão
3.5.3 Eficiência x Taxa de Compressão
3.6 Ciclo Diesel
3.7 Turbinas à Gás
3.8 Sistemas de Refrigeração
3.8.1 Sistemas de Refrigeração a Vapor
3.8.2 O Ciclo de Refrigeração por Compressão de Vapor
3.8.3 O Ciclo Ideal
3.8.4 Diminuindo a Temperatura de Evaporação e Aumentando a de Condensação
3.8.5 O Ciclo Real
3.9 O Ciclo de Refrigeração por Absorção
3.9.1 Sistemas Água- Amônia
Exercícios complementares
Bibliografia
Apêndice
54
57
58
59
64
65
65
66
67
68
70
70
71
71
75
76
78
79
85
87
88
3
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
INTRODUÇÃO
Não se sabe exatamente em que época da evolução do homem o fogo foi descoberto, mas,
supõem –se que sua descoberta aconteceu com o surgimento das primeiras espécies inteligentes
como, por exemplo, a do homo - habiles que surgiu em torno de 35.000 anos aC. Já nessa época
o homem percebia que quando se esfregava objeto um no outro, dependendo da intensidade,
esses objetos produziam calor e conseqüentemente o fogo. Fenômeno facilmente explicado
atualmente como sendo o movimento mecânico originando uma fricção de um objeto no outro
causando assim atritos e terminando na produção de calor. Fato que de forma alguma ninguém
poderia explicar tal fenômeno nesse grande período de desenvolvimento do homem.
Com o passar do tempo e o surgimento de povos mais desenvolvidos, foram aparecendo
necessidades onde apenas a energia proveniente do calor não era suficiente para resolver
problemas que surgiam a cada instante. Através do desenvolvimento da agricultura e também da
domesticação de animais, o homem sentiu a dificuldade que havia no transporte e elevação de
cargas para outros lugares criando então assim, mecanismos que funcionavam através da força
muscular do próprio homem ou dos animais. Foram criados dispositivos que facilitavam
enormemente suas tarefas como, por exemplo, à utilização de polias para a elevação de cargas
ou também o plano inclinado para a execução de pequenos esforços. Assim, a humanidade
começou a ter um dos primeiros contatos com um tipo de energia onde era necessário o esforço
braçal: a energia mecânica.Mais cedo ou mais tarde o homem teria de descobrir a força das
águas, e foi o que ocorreu, aprendeu a utilizar a energia proveniente de rios que acabava
praticamente substituindo o esforço braçal e animal. Foi assim que surgiram grandes
mecanismos como moinhos, bombas etc.
O SURGIMENTO DA MÁQUINA A VAPOR
Até o início do século XVIII, a madeira era uma das principais matérias primas para os
ingleses. Eles a utilizavam principalmente na produção do calor utilizado no aquecimento nas
indústrias que produziam ferro. Mas, com o tempo, essa madeira foi escasseando devido ao
desmatamento crescente, e com isso os ingleses passaram a utilizar outro combustível muito
empregado até hoje, que era o carvão mineral. Esse carvão era retirado de minas onde a
extração era demorada e trabalhosa sendo que durante a extração sempre se acumulava água nas
galerias causando grande perigo para os operários devido a grande umidade existente no solo.
Esse excesso de água era retirado através de bombas que funcionavam pelo princípio das
máquinas a vapor cujo combustível era o próprio carvão mineral retirado das minas. Podemos
dizer então que o surgimento das máquinas a vapor deveu-se com o objetivo maior que era o
bombeamento das águas das minas de carvão. No início elas eram poucos eficientes, pesadas e
perigosas sendo que aos poucos foram sendo desenvolvidas máquinas mais econômicas,
menores e menos perigosas. A máquina a vapor que era muito utilizada na época, era a de
Thomas Newcomen (1663 – 1729), mecânico inglês que construiu uma de suas primeiras
máquinas por volta de 1720.
4
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A ENERGIA NUCLEAR
A energia nuclear teve origem através de uma grande explosão na madrugada do dia 16
de julho de 1945, numa área de testes de bombardeios do exército norte-americano, em
Alamogordo, Novo México. Esse foi praticamente o teste da primeira bomba atômica chamado
de projeto Manhattan. Naquela época uma partícula recém descoberta o nêutron que se encontra
no núcleo do átomo poderia facilmente escapar de seu núcleo original e entrar em outro e
quebrá-lo. A fissão nuclear, nome dado a esse fenômeno, foi comprovada em 1939 pelo físico
italiano Enrico Fermi. O núcleo representa a mais densa concentração de matéria já vista, e isso
significa muita energia. Um único grama de matéria, como o urânio, representa 20 trilhões de
calorias, o suficiente para fazer ferver 900.000 toneladas de água. Atualmente a energia atômica
é utilizada na geração de energia elétrica em muitos países inclusive o Brasil nas usinas de
Angra.
Muito se falou qual seria a energia que moveria o planeta terra num futuro próximo. De
energia atômica até a solar ou a eólica, mas poucas foram realmente estudadas a fundo a ponto
de serem produzidas em larga escala. Como a humanidade reconheceu que o futuro é energia
renovável e limpa estão praticamente descartadas a energia proveniente do petróleo e nuclear.
As alternativas como a solar, eólica e geotérmica apresentam grandes dificuldades de serem
captadas tornando a construção dos equipamentos muito caro favorecendo apenas a poucos que
podem comprá-las. Já a hídrica apresenta o inconveniente de inundar grandes áreas verdes
agredindo assim o meio ambiente. A geração de energia por fusão termonuclear é vista hoje
como uma das alternativas na substituição do combustível fóssil sujeito a escassez em curto
prazo. É considerada como energia limpa, não produzindo rejeitos e evitando o problema do
efeito estufa tão comentado ultimamente. A energia por fusão já é obtida em laboratórios pelo
mundo inteiro através de máquinas denominadas de Tokamak que funcionam através do
aprisionamento de plasma. O plasma é um gás de íons e elétrons livres, onde que para gerar,
energia por fusão, o plasma deve ser aquecido a temperatura acima de 15 milhões de graus
Celsius, tal ocorre nas estrelas e no sol. Atualmente diversas versões estão em operação em
países como a Inglaterra, Estados Unidos, Rússia e Japão, sendo que no Brasil existem
máquinas em funcionamento na Universidade de São Paulo e no Instituto Nacional de Pesquisas
Espaciais em São José dos Campos. Outro tipo de energia que promete muito é as células de
combustível que existem há muito tempo sendo primeiramente utilizada no final dos anos 50
pela NASA no projeto Apollo na geração de eletricidade no espaço. As células de combustíveis
são baterias (pilhas) que convertem energia química diretamente em energia elétrica e térmica,
elas possuem uma operação contínua graças a alimentação constante de um combustível. A
conversão ocorre por meio de duas reações químicas parciais em dois eletrodos separados por
um eletrólito: a oxidação de um combustível no ânodo e a redução de um oxidante no cátodo.
Tendo o hidrogênio como combustível e o oxigênio como oxidante. Resumindo, a célula de
combustível é um dispositivo eletroquímico que realiza o processo inverso da eletrólise, na
eletrólise através de eletricidade água e um sal geramos hidrogênio, já na célula de combustível
ocorre o contrário, ou seja, é introduzido hidrogênio e oxigênio obtendo assim água e energia
elétrica.O Brasil possui projetos nessa área principalmente em transporte coletivo que será
implantado na cidade de São Paulo em meados de 2005 alguns ônibus movidos a células de
combustível.
5
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
CAPÍTULO 1
TERMODINÂMICA
A termodinâmica estuda materiais nas suas diversas fases como sólido, líquido e gasoso,
com o objetivo de transformar um tipo de energia em outra, por exemplo, transformar lixo em
energia térmica, aquecer sua água através da queima de gás ou do aquecimento solar, obter
energia elétrica através de células fotovoltaicas. Portanto, antes de iniciar com a termodinâmica,
vamos identificar algumas propriedades que serão importantes no decorrer do curso.
1.1
SISTEMA
É o objeto de análise, é tudo aquilo que desejamos estudar. Tudo que for externo ao
sistema é considerado parte das vizinhanças do sistema. O sistema é diferenciado de sua
vizinhança por uma fronteira que pode estar em repouso ou em movimento.
1.1.1 TIPOS DE SISTEMAS
Sistema fechado: sempre contém a mesma quantidade de matéria. Não pode ocorrer fluxo de
massa através de suas fronteiras.
Sistema aberto ou volume de controle: nesse caso a massa pode escoar através da fronteira.
1.2
PROPRIEDADES
Uma propriedade é uma característica macroscópica de um sistema como massa, volume,
energia, pressão e temperatura, para o qual um valor numérico pode ser atribuído.
1.3
ESTADO
Refere-se a condição de um sistema descrito pelas suas propriedades.
1.4
NÚMERO DE MOLS (n)
Mol é definido como sendo a quantidade de matéria que contém um número constante de
partículas. Essa constante é o número de Avogadro que vale 6,023x1023 unidades. O número de
mols de uma substância é dado por
n = m / M onde
m = massa da amostra ou substância
M = massa molar da substância
1.1
Exemplo: dado o elemento O2 com uma composição de 96g, determinar o número de mols.
n = 96 / 32 = 3 mols
6
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
1.5
VOLUME MOLAR
É o volume ocupado por um mol de gás nas CNTP ( T=273K, P= 1atm). O volume molar
foi medido experimentalmente com diversos gases e verificou-se grande proximidade entre os
valores obtidos. Esses valores ficaram todos próximos de 22,4 L.
1.6
VOLUME ESPECÍFICO E MASSA ESPECÍFICA(DENSIDADE ABSOLUTA)
A massa específica de uma certa substância é dada por
= m /V Kg/m3 ( SI)
1.2
já o seu volume específico é o inverso da massa específica, ou seja,
v = 1 /
m3 /Kg ( SI)
1.3
Em algumas aplicações é conveniente exprimir o volume específico em uma base molar
em vez de uma base mássica
v= V/n
1.7
1.4
DENSIDADE RELATIVA
Define-se densidade relativa(δ) como a relação entre a massa específica de uma substância
e a da massa específica da água ( a 4ºC) no caso dos líquidos, e em relação a massa específica
do ar ( a0ºC e 1atm) no caso dos gases. Exemplo
Determine a densidade relativa do mercúrio e o oxigênio
δ = Hg / água = 13600 Kg/m3 / 1000 Kg/m3 = 8,04
δ = oxig. / ar = 1,4229 Kg/m3 / 1,293 Kg/m3 = 1,1051
1.8
TRANSFORMAÇÕES GASOSAS
Em qualquer transformação num sistema fechado não há variação de massa. No estudo de
gases é importante que trabalhemos com o conceito de gases ideais ou perfeito que é um gás
hipotético onde a força de coesão entre suas moléculas é inexistente. O estado de um gás é
caracterizado pelo seu volume, temperatura e pressão. O gás ideal está sempre em baixa pressão
e alta temperatura. Nesse caso temos as seguintes transformações:
7
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
1.8.1 TRANSFORMAÇÃO ISOTÉRMICA
Variam pressão e volume. Aumento da pressão resulta em diminuição de volume. Aqui se
aplica a lei de Boyle-Mariotte que diz:
“ O volume ocupado por um gás varia inversamente com a pressão nele exercida, à
temperatura constante.”
V = 1/P .cte
PV = cte
Exemplo: uma seringa sendo comprimida
A relação PV será constante em qualquer instante da transformação, o que nos permite escrever
P1V1 = P2V2
1.5
1.8.2 TRANSFORMAÇÃO ISOBÁRICA
Ocorre a pressão constante, variam volume e temperatura. Aqui se aplica a lei de CharlesGay Lussac que diz:
“ O volume de um gás varia diretamente com a sua temperatura absoluta, à pressão
constante.”
V /T = cte
Exemplo: um termômetro
1.8.3 TRANSFORMAÇÃO ISOMÉTRICA
Ocorre a volume constante, variam pressão e temperatura.
P /T = cte
Exemplo: um botijão de gás exposto em altas temperaturas, com o aumento da temperatura ele
pode explodir.
Para uma mesma amostra de gás, podemos relacionar as três variáveis de estado como
P1V1 / T1 = P2V2 / T2
1.6
1.9 EQUAÇÃO DE ESTADO DOS GASES IDEAIS
Como vimos, para uma certa massa de gás vale a seguinte relação
PV /T = cte
1.7
Para 1 mol nas CNTP temos
8
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
PV/T = (1atm . 22,4L) / 273 K = 0,082 atm.L/mol K
Para qualquer número de mols a Eq. 1.7 fica
PV/T = n.0,082
Onde 0,082 chamamos de constante universal dos gases e designamos por R. Então a Eq. 1.7 se
torna
PV = nRT
1.8
Essa é a equação de estado dos gases ideais ou também conhecida como equação de Clapeyron.
Outras formas da equação:
Em função do volume específico:
PV/m = (R/M) T
Pv = RgásT
1.8.1
1.10 INTRODUÇÃO A 1º LEI DA TERMODINÂMICA
Antes da descoberta de calor e trabalho já eram conhecidas as energias cinética, potencial
e interna, representadas por K, T e U respectivamente. A energia mecânica é dada por
Em = K + T = cte
1.9
Pela 2º lei de Newton, a força F é definida por
F m
dv ds
dv
mv
dt ds
ds
Fds = mvdv
Integrando fica:
m
v2
v1
v2
2
=
s2
s1
Fds
½ m (v22 - v21 ) = F (s2 - s1)
1.12
A quantidade ½ mv2 é a energia cinética (K). A integral do lado direito da equação 1.12 é o
trabalho realizado pela força F quando o corpo se move de s1 até s2. Assim temos a seguinte
equação
s2
½ m (v22 - v21 ) =
Fds = W
1.13
s1
9
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
O trabalho realizado sobre uma partícula pela força resultante é sempre igual a variação de
energia cinética da partícula. Essa equação é conhecida como o teorema do trabalho-energia.
A energia potencial (T) é dada por
z2
mg dz = mg (z
1.14
2 - z1 )
z1
onde g é a aceleração da gravidade que vale 9,8 m/s2. e (z2 - z1 ) é a variação das alturas que o
corpo se encontra da superfície.
Se adicionarmos calor ou trabalho a um sistema podemos alterar sua energia cinética,
potencial ou energia interna. A energia interna é a energia das moléculas de um corpo, devida às
forças de atração que mantém os líquidos e sólidos e gases nas suas formas.A energia total do
sistema E inclui energia cinética, energia potencial, e outras formas de energia denominadas de
energia interna como energia química, energia nuclear, energia elétrica, energia de massa.
A variação total de energia de um sistema é
E = K + T + U
1.15
Exemplo:
Considere uma panela com água colocada no fogo para aquecer. No estado inicial, a
água possui uma certa quantidade de energia. A chama fornece energia à panela na forma
de calor e, com o passar do tempo, a água vai ficando cada vez mais quente. À medida que
a água vai aquecendo, parte dela vai evaporando, quando toda a água tiver evaporado
podemos determinar a energia do vapor. Os resultados experimentais nos mostram que o
vapor possui mais energia do que a água fria que foi colocada inicialmente na panela. Mas,
como essa água recebeu energia do fogo, é preciso somar essa energia com aquela que a
água possuia originalmente. Feito isso, encontraremos um valor maior do que a energia
calculada para o vapor, ou seja:
E água + E chama > E vapor
Assim, parte da energia do sistema foi perdida pelas paredes da panela através da
transmissão do calor para o ambiente, portanto, essa energia foi desperdiçada. Pela
conservação da energia ou 1a Lei, a energia no início teria que ser igual a energia no final.
Se somarmos a energia térmica desperdiçada com a energia da água, e a energia térmica
introduzida, o resultado será igual a energia térmica do vapor.
10
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
1.11 VÁRIAS FORMAS DA 1º LEI
1.11.1 SISTEMA ISOLADO
Aqui não entra e não sai nada, nem massa, nem calor ou trabalho. Durante um intervalo de
tempo t1 e t2, pode haver interações entre as energias potencial, cinética e interna, dentro do
sistema, mas não com seus arredores. Assim a energia total do sistema permanece inalterada.
Podemos realizar um balanço de energia como
E = E t1 - E t2 = 0
( U + T + K) 2 - ( U + T + K) 1 = 0
na prática esse tipo de sistema é muito raro.
1.11.2 SISTEMA FECHADO SEM FLUXO
Nesse sistema não existe nenhuma massa entrando ou saindo, entretanto pode ocorrer
troca de calor ou trabalho com os arredores. Exemplo, um gás contido num conjunto cilindro
pistão.
E = Et2 - Et1 = ( U + T + K) 2 - ( U + T + K) 1
Considere a figura 1.1 que mostra um sistema recebendo calor e executando trabalho. Para
calor entrando estipula-se um sinal positivo e saindo, sinal negativo. No caso de trabalho,
quando o sistema fornece o sinal é positivo e quando recebe interpreta-se como negativo.
Figura 1.1 Calor e Trabalho cruzando a fronteira de um sistema
Energia que entra no sistema = variação da energia interna + energia que sai do sistema
Nesse caso Q = ET + W
ET = Q - W
1.16
ou
d ET = Q -W (J)
dU + dK + dT = Q -W
1.17
Se a massa é constante podemos representar a eq. 1.17 como:
(dU + dK +dT) / m = Q/m - W/m (J/Kg)
1.18
retirando m agora, temos todas as energias conhecidas como específica:
du + v2/2 + gh = q - w
1.19
Integrando fica:
11
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
2
2
2
du + v /2 + gh
2
1
1
= q - w
1.20
1
(u2 - u1) + ½ ( v22 - v21 ) + g ( h2 - h1 ) =
1q2
- 1w2 (J/Kg)
1.21
Considerando taxas no tempo temos:
dE/dt = dK/dt +dT/dt + dU/dt = Q - ẇ
(W)
1.22
1.12 CALOR E TRABALHO
A definição básica de trabalho foi definida por Newton como
W = Fx
onde
W = trabalho realizado
F = força aplicada ao objeto
x = distância percorrida pelo objeto enquanto a força atua
Ou de forma geral
x2
W=
Fdx
( N.m = J)
1.23
x1
1.12.1 TRABALHO PV
É o tipo de trabalho quando se trata de cilindros e pistões. Para um pistão com área de
secção reta A, podemos escrever:
Força do gás
Empurrando
A cabeça do pistão
W = FdX =
Volume do gás
P (A dx)
1.24
Ou
12
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Realizado
pelo gás
Pressão do
gás
V2
W=
P dV
( Pa.m3= N/m2.m3 = J )
1.25
V1
O trabalho também pode ser representado por gráfico conforme a figura1.2
Figura 1.2 Trabalho PV
Para o trabalho adota-se sinais como positivo ou negativo, Isto é, ele é positivo quando o
sistema perde energia ou realiza trabalho e negativo quando o sistema recebe energia dos
arredores.
1.12.2 TRABALHO DE EIXO E DE FLUXO
O trabalho de eixo serve para mover como, por exemplo, o eixo de um gerador para
gerar eletricidade. E o de fluxo é quando ocorre a expansão, então o trabalho total produzido é:
PdV
W = WE + WF
1.26
1.12.3 CALOR
O calor é energia em trânsito que pode ser retirado ou fornecido a um sistema somente
através de uma diferença de temperatura. O calor também é considerado positivo quando o
sistema recebe energia térmica e negativo quando a perde.
13
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
1.13 ENTALPIA (H)
A energia total de um corpo, por exemplo, um gás em seu recipiente, é sua energia mais
a energia extra necessária para “abrir o espaço V” que ele ocupa à pressão P. vamos chamar
essa energia total H definida como
Pressão do
sistema
H= U+ PV
Ou
1.27
h = u + Pv
Para uma certa substância, à medida que a temperatura T aumenta, U e H aumentam. Porque
U = f1(T) e H = f2(T)
1.14 CAPACIDADE CALORÍFICA( C) E CALOR ESPECÍFICO
A capacidade calorífica de um sistema, em qualquer processo no qual a temperatura varia
por dT, é a quantidade de calor dQ que flui, dividido pela variação de temperatura, ou seja, para
um sistema estacionário a 1º lei fica
dU = dQ - dW
dQ = dU + dW em relação a temperatura fica:
Capacidade
calorífica
dQ/dT = dU/dT + dW/dT
C = dQ/dT
(J/K,BTU/ºR, Kcal/ºC)
1.28
O calor específico é definido para uma substância pura qualquer a pressão constante ou
volume constante, como a razão da capacidade calorífica pela massa da substância. Assim
temos
cp = CP/m
ou
cp = CP/n
dQ = CdT
e
cv = CV/m ( J/KgK, Kcal/KgºC, BTU/lbºF )
e
cv = CV/n ( J/molK, Kcal/molºC, BTU/molºF )
dQ = cpndT ou cvndT para um processo temos
1.29
1.30
2
1Q2
=n
cdT
para pequenas variações de temperatura o calor específico
1
Pode ser considerado constante, então
2
1Q2
= n dT
1.31
1
14
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Essa é a equação da calorimetria.
1.15 Iº LEI APLICADA EM ESCOAMENTO DE FLUIDOS
Os escoamentos podem ser de dois tipos, permanente ou transiente, permanente é
quando as propriedades de um sistema não mudam com o tempo são sempre as mesmas tudo
que entra é igual a tudo que sai, e transiente é quando algumas propriedades mudam com o
passar do tempo.
Para os dois casos temos a conservação da energia e a conservação da massa.
1.15.1 BALANÇO DE ENERGIA E DE MASSA PARA REGIME PERMANENTE
Considere o sistema representado na figura 1.3 onde podemos realizar um balanço de
energia:
Figura 1.3 Balanço de energia e de massa
Pela conservação da energia temos
Eentra = Esai
K1 + T1 + U1 + Wf1 + Q = K2+ T2 + U2 + Wf2 + Weixo
Desprezando-se as energias potenciais e cinéticas fica:
P1V1
P2V2
Wf1 + U1 + Q = Wf2 + U2 + Weixo
H1
H2
P1V1 + U1 + Q = P2V2 + U2 + Weixo
Q – W = H2 - H1
1.32
15
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
E pela conservação da massa admitindo que a densidade e a velocidade são as mesmas em todos
os pontos de uma certa seção, num certo instante temos
medindo-se o percurso pela distância dx, o volume correspondente é
dV = A1dx
a massa específica ou densidade absoluta é
= m/V e m = .V = A1dx
se o escoamento se deu em um tempo dt fica
velocidade
dm/dt = m1 = 1A1dx/dt = 1 A1 v1
mas como o regime é permanente dm/dt = 0 assim temos
1 A1 v1 = 2 A2 v2
ou
A1v1/1 = A2v2/2
Onde
= volume específico
1.33
1.34
As equações 1.33 e 1.34 são conhecidas como equação da continuidade
Considere agora a figura 1.4 onde podemos realizar um balanço de energia e de massa
simultaneamente através de um volume de controle.
Figura 1.4
Considerando que não haja transferência de calor e trabalho no eixo, teremos:
me ( u +v2/2 + gZ)et + Wfe = EVC(t) + ms ( u+v2/2 + gZ)st + Wfs
mas
Wf = PV = P.m/ = P.m. então
me ( u +v2/2 + gZ)et +( P.m.)e = EVC(t) + ms ( u+v2/2 + gZ)st +( P.m.)s
he
hs
me [ (u + P +v2/2 + gZ)e ]t = EVC(t) + ms[ (u + P +v2/2 + gZ)s ]t
me (h +v2/2 + gZ)e = EVC(t) + ms (h+v2/2 + gZ)s
dEVC /dt = me (h +v2/2 + gZ)e - ms (h+v2/2 + gZ)s
16
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
considerando várias entradas e saídas de massa e calor e trabalho no eixo, teremos finalmente
1.35
A equação 1.35 é a forma da 1ºlei para regime transiente através da conservação da massa
e da energia. Se o regime for permanente dEVC /dt = 0 e a equação 1.35 se reduz a
Se o regime for uniforme, isto é, as propriedades como h, k e T não variam no tempo elas
permanecem constantes de forma que:
(h +v2/2 + gZ)e = cte = Ke
(h+v2/2 + gZ)s = cte = K s
Assim a eq. 1.36 fica
1.16 TRANSFORMAÇÕES REVERSÍVEIS DOS GASES IDEAIS
Transformação reversível é uma transformação ideal durante ao qual o sistema permanece
sempre em equilíbrio, ou seja, é aquele que exige a menor quantidade de trabalho.
Joule realizou a seguinte experiência: pegou dois recipientes interligados e os colocou
submersos em água. Definindo o sistema o conjunto desses dois recipientes e a água a sua
vizinhança, introduzimos um gás qualquer num dos recipientes e conectamos uma válvula no
outro que está vazio. Com um termômetro introduzido na água mede-se a temperatura inicial. A
válvula é então aberta e a pressão se iguala nos frascos. Joule observou que para um gás ideal a
temperatura antes da abertura da válvula é a mesma após a liberação do gás para o outro
recipiente. Portanto T1 = T2
Figura 1.5 Experiência de Joule
Pela 1º lei para sistemas fechados, podemos escrever
U +T + K = Q - W
Então a 1º lei nos diz que a energia interna permanece constante, U = 0.
U = f(T) independente de P e V
17
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Para 1 mol de gás
PV = RT
vamos considerar uma mudança de entalpia em um gás ideal. Por definição para 1 mol de gás,
h = u + Pv ( eq. 1.27)
h = u + Pv = u +RT
considerando cv constante
u = cv T para um mól de gás
também por definição
h = cp T
cv = u / T
cp = h / T
1.38
1.39
1.40
diferenciando a Eq. 1.38 em relação a temperatura fica
dh/dT = du/dT + R
e introduzindo as Eq. 1.39 e 1.40 temos
cp dT /dT = cv dT/dT + R
cp = cv + R para gás ideal
Assim para 1 mol de gás ideal
u = cv T
h = cp T
independente de p e v
cp = cv + R
1.16.1 TRANSFORMAÇÃO A TEMPERATURA CONSTANTE
No processo isotérmico, como a temperatura não varia então não ocorre variação de
energia interna.
T1 = T2 e p1v1 = p2v2
dU = 0 porque T é constante
Logo pela 1º lei fica:
dU = dQ – dW
0 = dQ – dW
dQ = dW num gás ideal P = Rgás T/V
2
1Q2 = 1W2 =
PdV = R
1
1Q2 =
2
gás
TdV/V
1
Rgás Tln V2 /V1
ou
P1 V 1 ln V2 /V1
1.41
18
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
1.16.2 TRANSFORMAÇÃO SEM TROCA DE CALOR (ADIABÁTICO) COM Cv
CONSTANTE
No processo adiabático não ocorre troca de calor então Q = 0
dU = 0 – dW
dU= - dw
du = cv dT = - PdV e P = Rgás T/V
cv dT = - Rgás TdV/V
cv dT/T = - Rgás dV/V
1.42
Cálculo do trabalho:
dU = 0 – dW
- cv dT = dW
1W2 = - cv ( T2 – T1 )
1.43
1.16.3 TRANSFORMAÇÃO A VOLUME CONSTANTE
Como o volume é constante então não há realização de trabalho
V1 = V2 e P1/T1 = P2/ T2
dU = dQ – dW
dU = dQ
2
1Q2
=
dU
1
2
1Q2
=
c
v dT
1
Como c v é constante sai da integral, ficando
1Q2
= c v (T2 – T1 ) para 1 mol temos
= nc v (T2 – T1 )
ou em base mássica
1.44
= mc v (T2 – T1 )
1.45
1Q2
1Q2
1.16.4 TRANSFORMAÇÃO A PRESSÃO CONSTANTE
P1 = P2 e V1/T1 = V2/ T2
dU = dQ – dW
19
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
= dU + PdV = u2 – u1 + p2v2 - p1v1
= (u2 + p2v2) – (u1 + p1v1 )
Q
1 2 = h2 - h1
1Q2 = h
cpdT = h
cp = (dh/dT)cpcte
1Q2
1Q2
1.46
1.17 MUDANÇAS DE ESTADO
1.17.1 TEMPERATURA DE SATURAÇÃO
Temperatura na qual uma mudança de fase ocorre para uma dada pressão, que por sua vez,
é denominada pressão de saturação.
Figura 1.6 Gráfico Temperatura x volume específico
1.17.2 ESTADOS DE LÍQUIDO
À medida que o sistema é aquecido a uma pressão constante, a temperatura aumenta de
forma considerável, enquanto o volume específico apresenta uma elevação menos significativa.
Eventualmente, o sistema alcança o estado representado por f. Esse é o estado de líquido
saturado correspondente à pressão especificada. Para a água a 1,014 bar, a temperatura de
saturação é de 100ºC. Os estados de líquido ao longo do segmento l–f, são denominados
estados de líquido sub-resfriado, uma vez que a temperatura nestes estados é inferior a de
saturação na pressão especificada. Estes são também denominados estados de líquido
comprimido. O ponto g é o estado de vapor saturado. As misturas líquido-vapor podem ser
distinguidas entre si pelo seu título que define a condição de que se encontra a substância.
1.17.3 ESTADOS DE VAPOR
O estado denominado por s é representativo de estados que seriam alcançados por
contínuo aquecimento, à medida que a pressão é mantida constante. Um estado tal como s é
normalmente chamado de estado de vapor superaquecido.
20
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
1.17.4 TÍTULO (X)
É a razão entre a massa de vapor e a massa total ( líquido + vapor). O volume total da
mistura é a soma dos volumes das fases líquida e de vapor.
V = Vliq + Vvap
1.47
Dividindo pela massa total da mistura, m, um volume específico para a mistura é obtido:
v = V / m = Vliq /m + Vvap / m
1.48
Uma vez que a fase líquida é composta por líquido saturado e que a fase vapor é composta por
vapor saturado. Nesse caso temos
Vliq = mliqvf e Vvap = mvapvg
:
1.49
Substituindo 1.49 em 1.48 fica
v = (mliq /m )vf + (mvap /m )vg
1.50
Utilizando a definição de título:
x = mvap /m = x = mvap / mliq + mvap
x = 1 / mliq + 1
mliq = 1 – x
1.51
A Eq 1.50 se torna
v = ( 1 – x)vf + xvg = vf - vf x + xvg
v = vf + x(vg - vf )
1.52
No caso da entalpia temos
h = (1-x) hf + xhg = hf - hf x + xhg = hf + x(hg - hf )
1.18 APLICAÇÕES EM REGIME PERMANENTE
1.18.1TROCADOR DE CALOR
São dispositivos que transferem energia entre fluidos de diferentes temperaturas. Eles
podem ser de diversos tipos, como aplicação temos trocadores de calor na refrigeração, nos
automóveis, nas caldeiras a vapor, em usinas de potência etc. Normalmente eles operam em
regime permanente.
Exemplo:
Um sistema de refrigeração utilizando R-134a como fluido refrigerante, é composto com um
condensador resfriado a água. O refrigerante entra no condensador a 60ºC e 1Mpa e o deixa
21
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
como líquido a 0,95 MPa e 35ºC. A água de resfriamento entra no condensador a 10ºC e sai a
20ºC. Sabendo que a vazão do refrigerante é de 0,2 Kg/s, determine a vazão de água de
resfriamento que circula no condensador.
Hipóteses:
• Não há trabalho de eixo
• As energias potencial e cinética podem ser desprezíveis.
• Não há transferência de calor na superfície de controle.
Pela conservação da energia e regime permanente através da 1º Lei ( Eq. 1.36) temos
Pelas hipóteses a equação se reduz a
Utilizando o índice r para o refrigerante e a para a água fica
mrhe + mahe = mrhs + mahs
Das tabelas de R-134a e de vapor d`água temos
Água
Refrigerante
Entrada (h) KJ/Kg
42
441,89
Saída (h) KJ/Kg
83,95
249,10
mrhe + mahe = mrhs + mahs
0,2 Kg/s.441,89KJ/Kg + ma42KJ/Kg = 0,2Kg/s.249,10 KJ/Kg + ma83,95 KJ/Kg
ma42 KJ/Kg- ma83,95 KJ/Kg = 49,82 KJ/s – 88,4 KJ/s
-ma41,95 KJ/Kg = -38,58 KJ/s
ma = 0,91 Kg/s
22
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
1.18.2 BOCAIS E DIFUSORES
Um bocal é um duto com área de seção reta na qual a velocidade de um gás ou líquido
aumenta na direção do escoamento. Em um difusor, o líquido ou gás perde aceleração na
direção do escoamento.
Figura 1.7 Bocal e difusor
Exemplo:
Vapor d`água entra em um bocal que opera em regime permanente com P 1= 40 bar, T1 =
400ºC a uma velocidade de 10m/s. O vapor escoa através do bocal sem transferência de calor e
sem variação de energia potencial. Na saída, P2 = 15 bar e a velocidade é de 665m/s. a vazão
mássica é de 2Kg/s. determine a área de saída do bocal em m2.
Hipóteses:
• O regime é permanente
• A transferência de calor e o trabalho de eixo são desprezíveis.
• A variação da energia potencial entre a entrada e saída pode ser abandonada.
A área de saída pode ser determinada pela equação da continuidade:
A = mv2/ V2
É necessário determinarmos o volume específico v2 na saída e isto significa que o estado na
saída deve ser determinado. Tendo P2 falta determinarmos a entalpia específica h2 onde pode ser
utilizada a 1º lei para regime permanente.
A variação na energia potencial específica desaparece de acordo com a hipótese 3, e m se
cancela formando:
23
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
0 = ( he -hs ) + ( V2e /2 – V2s / 2 )
resolvendo para hs
hs = he + (V2e /2 – V2s / 2 )
pela tabela he = 3213,6 KJ/Kg
hs = 3213,6 + ( 102/2000 – 6652/2000) = 3213,6 – 221,1 = 2992,5 KJ/Kg
Finalmente para P2 = 15 bar e com hs = 2992,5 KJ/Kg, o volume específico na saída é v2 =
0,1627 m3/Kg. A área de saída é então calculada como
As = mv2/ V2
As = (2 Kg/s)(0,1627 m3/Kg ) / 665m/s = 4,89 x10-4 m2
1.18.3 TURBINAS
Uma turbina é um dispositivo que produz trabalho em função da passagem de um gás ou
líquido que escoam através de pás fixadas num eixo que pode girar livremente. A variação da
energia potencial é normalmente desprezível e quando a velocidade de entrada do fluido for
menor que 20m/s, também poderemos desprezar a energia cinética.
Figura 1.8 Turbina a vapor
24
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Exemplo:
Vapor de água entra numa turbina operando em regime permanente com um fluxo de
massa de 4600 Kg/h. A turbina desenvolve uma potência de 1000 KW. Na entrada, a pressão é
60 bar, a temperatura é 400ºC e a velocidade é 10m/s. Na saída, a pressão é 0,1bar, o título é 0,9
e a velocidade é 50m/s. Calcule a taxa de transferência de calor entre a turbina e as vizinhanças
em KW.
Hipóteses:
• O regime é permanente
• A variação da energia potencial entre a entrada e saída pode ser abandonada.
• Como a velocidade na entrada é considerada baixa, podemos desprezar a energia cinética.
Pela 1º lei temos
Abandonando a energia potencial e cinética e resolvendo para Qvc
25
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Onde
Para Pe = 60 bar e Te = 400ºC
he = 3177,2 KJ/Kg
O estado na saída é uma mistura de duas fases líquido-vapor, assim com os dados da tabela e
com o título fornecido
hs = hf + x ( hg – hf) = 191,83 + 0,9(2392,8) = 2345,4 KJ/Kg
Assim retornando a expressão de Qvc
Qvc = 1000 + 1,277 ( 2345,4 – 3177,2 ) = - 62,2 KW
1.18.4 COMPRESSORES E BOMBAS
Compressores são máquinas que elevam a pressão de um determinado volume de ar,
desde a pressão atmosférica ambiente até a pressão necessária desejada. Se o fluido
incompressível cede energia à máquina que transforma essa energia em trabalho mecânico, a
máquina é então motora. Ex. turbina, roda d’água, moinho de vento. A máquina cede energia
mecânica ao fluido incompressível que a atravessa resultando um aumento de energia do fluido.
A máquina é então geradora. Ex. bombas, ventiladoras, etc.
Figura 1.8 Compressor
Exemplo:
Ar é admitido em um compressor operando em regime permanente com uma pressão de
1bar, temperatura de 290 K e uma velocidade de 6m/s através de uma entrada de diâmetro da
tubulação de 13cm. Na saída a pressão é 7bar, a temperatura é 450 K e a velocidade é 2m/s. A
26
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
transferência de calor para suas vizinhanças ocorre a uma taxa de 180 KJ/min. Empregando o
modelo de gás ideal, calcule a potência do compressor em KW.
Hipóteses:
• O regime é permanente
• A variação da energia potencial entre a entrada e saída pode ser abandonada.
• O modelo de gás ideal se aplica para o ar
Para calcular a potência do compressor, faça um balanço de energia para o volume de
controle em regime permanente com uma entrada e uma saída.
Resolvendo para Wvc
m = Ae Ve / ve
m = Ae Ve Pe/ (R/M)Te =(0,1m2)(6m/s)(105 N/m2) / 8314 Nm/ 28,97 KgK)(290 K) = 0,72 Kg/s
As entalpias de entrada e saída são encontradas via tabelas
Para 290 K, he = 290,16 KJ/Kg
Para 450 K, hs = 451,8 KJ/Kg
Substituindo na expressão para a potência temos
Wvc = (-180 KJ/60s) + 0,72 Kg/s (290,16 KJ/Kg + 62/2000) - 0,72 Kg/s (451,8 KJ/Kg +
22/2000) = -119,4 KW
1.19 APLICAÇÕES DA 1º LEI PARA REGIME TRANSIENTE
Agora temos aplicações onde o sistema pode mudar as suas propriedades ao longo do
tempo, elas não permanecem mais as mesmas. Como exemplos temos um tanque enchendo com
um líquido, ou vapor sendo perdido por uma válvula de controle, etc. aqui vale a Eq. 1.35
Exemplo:
Um tanque com volume inicial de 0,85m3 contém água em uma mistura de duas fases a
260ºC e com um título de 0,7. O vapor de água saturado a 260ºC é lentamente retirado através
de uma válvula reguladora de pressão à medida que calor é introduzido nesse tanque, de modo a
manter sua pressão constante. Este processo continua até que o tanque esteja cheio de vapor
saturado a 260ºC. Determine a quantidade de calor transferido. Desconsidere os efeitos de
energia potencial e cinética.
27
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Hipóteses:
• O regime é transiente
• A variação da energia potencial e cinética são abandonadas.
• Não existe trabalho de eixo
Como existe somente uma saída e nenhuma entrada, o balanço de massa vale:
dmvc /dt = - ms
O balanço de energia fica:
dUvc /dt = Qvc - mshs
Combinando os balanços de massa e energia temos:
dUvc /dt = Qvc + hs dmvc /dt
Integrando
ΔUvc = Qvc + hsΔmvc
Resolvendo para Qvc
Qvc = ΔUvc - hsΔmvc
Qvc = ( m2u2 – m1u1) - ( m2 – m1)
Onde m2 e m1 são as quantidades inicial e final de massa no tanque.
Os termos m1 e u1 podem ser avaliados como valores de propriedades para 260ºC e com o valor
do título fornecido pela tabela.
u1 = uf + x1( ug – uf ) = 1128,4 + (0,7)(2599 – 1128,4) = 2157,8 KJ/Kg
v1 = vf + x1( vg – vf ) =1,2755x10-3+(0,7)(0,04221-1,2755x10-3) = 29,3x10-3m3 /Kg
A massa inicial é
m1 = V / v1 = 0,85 /29,3x10-3 = 28,4 Kg
O estado final da massa no tanque é vapor saturado a 260ºC, assim a tabela fornece
u2 = 2599 KJ/Kg
v2 = 0,04221m3 /Kg
A massa contida no interior do tanque ao final do processo é
m2 = V / v2 = 0,85 /0,04221= 20,14 Kg
A mesma tabela fornece hs = 2796,6 KJ/Kg
Substituindo na expressão para o calor, tem-se
Qvc = [(20,14)(2599) – (28,4)(2157,8)] – 2796,6(20,14 –28,4) = 14,162 KJ
28
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
EXERCÍCIOS RESOLVIDOS DO CAPÍTULO
1) Se 3Kg de ar sofre um processo isotérmico quase estático, qual é a pressão final, se a pressão
e volume iniciais são 5,16x105 N/m2 e 0,3m3, e executa-se um trabalho de 3,2x104 J?
Solução
P1 = 5,16x105 N/m2
V1 = 0,3 m3
W = 3,2x104 J
W = PdV
3,2x104 = 5,16x105 (V2 – V1 )
3,2x104 = 5,16x105 V2 – 5,16x105 0,3
V2 = 0,36 m3
Como o processo é isotérmico então
P1 V1 = P2V2
5,16x105 0,3 = P2.0,36
P2 = 4,3x105 N/m2
2) Uma quantidade de vapor d`água é admitida ao cilindro de uma máquina a vapor à pressão
constante de 2x106 N/m2. O diâmetro do cilindro é 0,2m e o curso do êmbolo 0,3m. Qual o
trabalho realizado por cilindrada em cada percurso do êmbolo?
Solução
Cálculo da área do cilindro:
A = d2/4
A = .(0,2)2 /4 = 0,0314 m2
Cálculo do volume:
V = A .x = 0,0314.0,3 = 0,00942 m3
Cálculo do trabalho:
W = PdV = 2x106 N/m2 . 0,00942 m3
W = 1,89x104 Nm = 1,89x104 J
3) Uma tubulação de distribuição de gás, com diâmetro de 0,3m, transporta gás metano a 200
Kpa e 275 K.A velocidade média do escoamento foi medida experimentalmente e vale 5,5m/s.
Determine os valores extremos da vazão em massa de gás na tubulação.
Solução
Através da tabela o volume específico do gás metano superaquecido a 200 Kpa e 275 K vale
0,21 m3/Kg.
Cálculo da vazão mássica:
m = A v / m = .(0,5)2 /4.5,5 / 0,21 = 5,14 Kg/s
4) Um tanque com volume de 1m3 contém ar a 1 MPa a 400K. O tanque está conectado a uma
linha de ar comprimido como indica a figura E4. A válvula é então aberta e o ar escoa para o
29
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
tanque até que a pressão alcance 5MPa. Nesta condição a válvula é fechada e a temperatura do
ar no tanque é 450K.Qual a massa de ar antes e depois do processo de enchimento? Se a
temperatura do ar no tanque carregado cair para 300 K, qual será a pressão do ar neste novo
estado?
Figura E4
Solução
Usando a equação do gás ideal temos
P V/m = R/M T
Rar = 0,287 KJ/KgK
Estado 1:
P11 = Rar T1
1031 = 0,287.400
1 = 0,1148 m3/Kg
m1 = V/1 = 1 /0,1148 = 8,71 Kg
Estado 2:
P22 = Rar T2
5x105 2 = 0,287.450
2 = 0,02583 m3/Kg
m2 = V/2 = 1/0,02583 = 38,71 Kg
Como o processo ocorreu a volume constante temos
P1 / T1 = P2/ T2
5x105 /450 = P2/300
P2 = 3,3 Mpa
5) Em um cilindro provido de pistão da figura E5 se encontra oxigênio que está inicialmente a
pressão de 3,5 Kgf/cm2, na temperatura de 60ºC e volume de 0,06 m3. Realiza-se sobre o
sistema um trabalho por meio de pás a pressão constante atingindo uma temperatura de 125ºC.
O calor transferido do sistema para as vizinhanças é 10% do trabalho fornecido ao sistema.
Calcule:
a)
O trabalho realizado pelas pás
b)
O trabalho realizado pelo gás contra a atmosfera
30
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Figura E5
Solução
Hipóteses
a) O oxigênio é o sistema fechado
b) As variações de energia cinética e potencial são nulas.
Cálculo de RO2:
RO2 = 8,314 KJ/Kmolk/32 Kg/Kmol = 0,26 KJ/KgK
Cálculo da massa de oxigênio contida no cilindro:
P1V1 = m2 RO2T1
343,245 Kpa.0,06 m3 = m.0,26 KJ/KgK . 333K
m = 0,23 Kg
Balanço de Energia (1a lei da Termodinâmica para Sistemas Fechados)
E = K + T + U = Q – W
U = Q – W
mas Q = 0,1 Wpás
Wpistão = P ( V2 - V1 )
Como a pressão é cte temos
V1 / T1 = V2/ T2
0,06/333 = V2/398
V2 = 0,0717 m3
Wpistão = 343,245 ( 0,0717 – 0,06) = 4000 Pa m3 = 4000 N/ m2. m3 = 4000 Nm = 4000J
A variação de energia interna para um gás ideal é:
U = mc v (T2 – T1 )
o calor específico do oxigênio a volume cte pela tabela vale 0,6618 KJ/KgK então
U = 0,23 .0,6618 ( 398 – 333) = 9,89 KJ
W = Wpás + Wpistão
U = Q - Wpás - Wpistão
Wpás = - U + Q - Wpistão
31
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Wpás = - 9,89 KJ +0,1 Wpás – 4 KJ
Wpás - 0,1Wpás = - 13,89 KJ
0,9Wpás = - 13,89 KJ
Wpás = - 15,43 KJ
Q = 0,1 Wpás
Q = - 1,543 KJ
A análise pode ser sumarizada em termos de energia, da seguinte forma:
Entrada (kJ)
15,43 (Trabalho da hélice)
Total: 15,43
Saída (kJ)
4 (pistão)
1,543 (calor transferido)
5,543
Energia que entra no sistema = variação da energia interna + energia que sai do sistema
15,43 = 9,88 + 5,543
A energia permaneceu constante
6) Considere 5 Kg de vapor d'água contidos dentro de um conjunto pistão-cilindro como indica
a figura E6. O vapor passa por uma expansão a partir do estado 1 , onde a sua energia específica
interna u1 = 2709,9 kJ/kg, até o estado 2 onde u2 = 2659,6 kJ/kg Durante o processo ocorre
transferência de 80 kJ de energia na forma de calor, para o vapor. Ocorre também a
transferência de 18,5 kJ na forma de trabalho, através de uma hélice. Não
há
variação
significativa de energia cinética e potencial do vapor.Determine o trabalho realizado pelo vapor
sobre o pistão, durante o processo.
Figura E6
Hipóteses
a) O vapor é o sistema fechado
b) As variações de energia cinética e potencial são nulas.
32
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Solução
Análise
Balanço de Energia (1a lei da Termodinâmica para Sistemas Fechados)
E = K + T + U = Q – W
U = m (u2 - u1) = Q - W
W = Wpás + Wpistão
U = Q - Wpás - Wpistão
Wpistão = - U + Q - Wpás
Wpistão = -m (u2 - u1) + Q - Wpás
Wpistão = - 5 (Kg) (2659,6 - 2709,9) kJ/kg + 80 kJ - (-18,5 kJ)
Wpistão= -(-251,5) + 80 - (-18,5)
Wpistão = + 350 kJ
A análise pode ser sumarizada em termos de energia, da seguinte forma:
Entrada (kJ)
18,5 (Trabalho da hélice)
80,0 (calor transferido)
Total: 98,5
Saída (kJ)
350 (pistão)
350
A saída total de energia excede a energia de entrada, conseqüentemente a energia do sistema
diminui de U = (98,5 -350) = -251,5 KJ
7) Determine a velocidade que um corpo adquire ao cair de uma altura h, conhecida a partir do
repouso. Figura E7
Figura E7
33
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Solução
Em A:
EmA = KA + TA = TA = mgh
Em B:
EmB = KB + TB = KB = m v2B/2
Pela conservação da energia mecânica teremos
EmA = Em B
mgh = m v2B/2
EXERCÍCIOS COMPLEMENTARES
1) Qual é o trabalho executado quando 0,6m3 de ar, a pressão de 1,05x105 N/m2 e a
temperatura de 7ºC, sofre um aumento de pressão até 4,20x105, permanecendo a volume
constante? R. W = 0
2) Quanto calor é fornecido no problema anterior? Qual foi a variação de energia interna?
R. U = Q = 11,5Kcal
3) Qual é o trabalho executado quando se evaporam 5Kg de água a pressão atmosférica,
até que ela ocupe um volume de 8,16m3? R. W = 32000J
4) 1,25Kg de oxigênio ocupa um volume de 0,85 m3 a temperatura de 300K. calcule o
trabalho necessário para fazer decrescer o volume até a metade. Considere R ar =
260J/KmolK
a) A pressão constante; R. -48750J
b) A temperatura constante; R. -67582J
c) Qual a temperatura no final do processo?R. 150K
d) Qual a pressão no fim do processo? R. 229411,6 N/m2
5) Um cilindro em degrau provido de um êmbolo sem atrito contém ar. A seção transversal
de maior área tem 0,0093 m2, enquanto que a menor tem 0,00697 m2. Com o êmbolo na
posição indicada o ar está a 3,52 Kgf/ cm2 e 426ºC. O ar é então resfriado como
resultado da transferência de calor para a vizinhança.
a) Qual a temperatura do ar quando o êmbolo atinge o degrau? R. 420K
b) Se o ar for resfriado até 21ºC, qual é a pressão neste estado? R. 242151,7N/m2
6) Calcule os seguintes volumes específicos:
a) amônia, 50ºF, 80% de título R. 2,640 pes3/lbm
b) freon 12, 20ºF, 15% R. 0,17 pes3/lbm
34
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
7) É comum os estudantes pensarem que há 1Kg de água líquida ocupando 1litro para
qualquer temperatura e pressão. Sendo assim, usando as tabelas de vapor, determinar o
volume e densidade real da água em Kg/ m3 nos seguintes estados:
a) líquido saturado a 60ºF;
b) líquido saturado a 100Psi;
c) líquido saturado a 500ºF.
8) Uma turbina é alimentada com 5 m3/s de vapor d’água a 3MPa e 400ºC. A turbina
apresenta uma extração intermediária de vapor. A temperatura e a pressão do vapor na
tubulação de extração são iguais a 200ºC e 600KPa. Já a pressão e o título na tubulação de
descarga principal da turbina são iguais a 20KPa e 90%. Sabendo que a vazão em massa na
extração é igual a 15% da vazão em massa na seção de alimentação da turbina e que a
velocidade na tubulação de descarga principal da turbina é 20m/s, determine:
a) a vazão em volume na tubulação de extração; R.2,65m3/s
b) o diâmetro de descarga principal da turbina; R. 4,93m
c) a potência gerada na turbina. R. 21609KW
9) Um tubo com diâmetro de 30mm localizado num gerador de vapor é alimentado
com uma vazão de 3litros/s de água a 30ºC e 10MPa. Sabendo que a temperatura e
a pressão da água na seção de descarga do tubo são 400ºC e 9MPa, determine a
taxa de transferência de calor para a água. R. 298,3KW
10) Um bocal convergente é alimentado com nitrogênio a 200KPa e 400K. o
escoamento na seção de descarga do bocal tem temperatura e pressão de 330K e
100KPa. Sabendo que a velocidade do nitrogênio na seção de alimentação do bocal
é pequena e que o bocal é adiabático. Determine a velocidade do escoamento na
seção de descarga do bocal. R 381,7m/s
11) Ar inicialmente a 0,1MPa e 23ºC é comprimido para 0,5MPa e 227ºC. a
potência fornecida ao compressor é de 3,7KW e a perda de calor para o ambiente é
estimada em 8KJ/Kg. Determine a vazão mássica do compressor. Considere o ar
como gás ideal, Rar = 287J/KGK, cp = 1,016J/KgK R. 1,03Kg/min.
12 ) Um aquecedor de água operando em regime permanente possui duas entradas e
uma saída. Na entrada 1, o vapor d’água entra a 7bar e 200ºC com uma vazão de
40Kg/s. Na entrada 2, água líquida a 7bar e 40ºC entra através de uma área de
25cm2 . líquido saturado a 7bar sai em 3 com uma vazão de 0,06m3/s. Determine:
a) a vazão mássica na saída; R. 54,15Kg/s
b) a vazão mássica na entrada 2; R. 14,15Kg/s
c) a velocidade na entrada 2. R. 5,7m/s
35
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
13) Um trocador de calor é alimentado com 1Kg/s de água a 300ºC e 10KPa pela
entrada 1 e descarrega líquido saturado a 10KPa pela saída 2. ele é resfriado com
água obtida num rio que entra por 3 a 20ºC e sai em 4 a 30ºC. desprezando-se a
perda de calor do equipamento, calcule a vazão da água de resfriamento. R.
68,96Kg/s
14) A vazão em massa de vapor d’água que entra numa turbina é 1,5Kg/s. são
conhecidas as seguintes informações:
Pressão (MPa)
Temperatura (ºC)
Velocidade (m/s)
Cota em relação ao plano
de referência (m)
Entrada
2
350
50
6
Saída
0,1
100
3
Sabendo-se que a turbina perde 8,5KW de calor, determine:
a) a potência produzida pela turbina. R. 678,2 KW
b) os diâmetros das tubulações de entrada e saída da turbina R. 73mm e
179mm
15) Uma turbina é alimentada com 100Kg/s de vapor d’água a 15MPa e 600ºC.
num estágio intermediário, onde a pressão é 2MPa e a temperatura é de 350ºC, é
realizada uma extração de 20Kg/s. na seção final de descarga, a pressão e o título
são respectivamente iguais a 75KPa e 95%. Admitindo que a turbina seja
adiabática e que as variações de energia potencial e cinética sejam desprezíveis,
determine a potência da turbina. R. 91946 W
16) Uma turbina é alimentada com 2Kg/s de vapor a 1MPa e 350ºC. o vapor é
descarregado da turbina como vapor saturado a 100KPa. Sabendo que a velocidade
na seção de alimentação da turbina é desprezível e que a velocidade na descarga é
50m/s, determine o trabalho específico e a potência gerada pela turbina.
36
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
CAPÍTULO 2
2º LEI DA TERMODINÂMICA
2.1 INTRODUÇÃO A 2ºLEI DA TERMODINÂMICA
Na prática todos sabem que certas coisas só podem acontecer em um sentido. Por
exemplo:
- A queima de combustível produz o movimento em um carro, mas o contrário, o
movimento desse mesmo carro produzir combustível é impossível.
- Um objeto cai no chão do alto de um prédio, mas nunca retorna do chão para o prédio.
- Um copo d`água é derramado, você já viu a água retornando para o copo novamente?
A 2ºlei da termodinâmica trata dos processos que caminham em um único sentido. Um
sistema tende a passar de:
- Um estado mais ordenado para um mais desordenado.
- Um estado com muita informação para um com menos informação.
- Um estado com energia mais nobre para energia menos nobre.
2.2 DOIS ENUNCIADOS IMPORTANTES
2.2.1
O enunciado de Clausius
“ È impossível para qualquer sistema operar de maneira que o único resultado seria
a transferência de energia térmica de um corpo mais frio para um corpo mais quente”.
2.2.2
O enunciado de Kelvin-Planck
“È impossível para qualquer sistema que opere em um ciclo termodinâmico
fornecer uma quantidade líquida de trabalho para suas vizinhanças enquanto recebe
energia por transferência de calor de um único reservatório térmico”.
Ambos os enunciados proíbem algo, e lidam com dispositivos que operam em um ciclo.
Essa exigência cíclica é necessária para dispositivos de ação contínua. Os dois
dispositivos são ilustrados nas figuras 2.1 e 2.2.
37
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Figura 2.1 Enunciado de Clausius
Figura 2.2 Enunciado de Kelvin-Planck
Restrição da 1ºlei: Wciclo = Qciclo (regime permanente) que diz que o trabalho líquido
realizado sobre ou pelo sistema quando este está executando um ciclo é igual ao calor
líquido transferido durante o ciclo.
Figura 2.3 Ciclo de potência
De acordo com a figura 2.3 para Kelvin-Planck a 1ºlei fica
Qentra = Wciclo + Qsai
Wciclo = Qentra - Qsai
Considerando como Qe o calor que entra e QS como o calor que sai
A eficiência é
38
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
= energia pretendida / energia fornecida
= Wciclo / Qe
= 1 – (QS / Qe )
2.1
Exemplo 1:
Uma grande central de potência produz 1000 MW de potência elétrica operando
com uma eficiência térmica de 40%. Qual a taxa em que o calor é rejeitado para o
ambiente?
= Wciclo / Qe
0,40 = 1000 MW / Qe
Qe = 2500 MW
1000 = 2500 - QS
QS = 1500 MW
Figura 2.4 Ciclo de refrigeração
Para uma geladeira:
QS é o calor do condensador que é transferido para o ambiente
Qe é o calor que entra na geladeira que corresponde à temperatura baixa interna da
câmara.
Para Clausius temos a 1º lei como
W = Qsai – Qentra
Aqui temos o coeficiente de desempenho COP que é dado por
39
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Baixa
temperatura
COP = energia pretendida / energia fornecida = Qe / W
COP = Qe / (QS - Qe)
2.2
Exemplo 2:
Um refrigerador mantém o congelador a –5ºC quando a temperatura ambiente é de
22ºC. A taxa de transferência de calor entre o congelador e o refrigerante que circula é de
8000 KJ/h e a potência de entrada necessária para funcionar o compressor é de 3200
KJ/h.Determine o coeficiente de performance do refrigerador.
COP = energia pretendida / energia fornecida = Qe / W
COP = 8000 / 3200 = 2,5
Figura 2.5 Esquema de bomba de calor para aquecimento de piscina
40
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Figura 2.6 Ciclo de bomba de calor
Para uma bomba de calor
Qe é o calor transferido para a água com temperatura elevada
QS é o calor retirado para o ambiente com temperatura baixa
Novamente temos a 1º lei como
W = Qsai – Qentra
Aqui temos também o coeficiente de desempenho COP que é dado por
Alta
temperatura
COP = energia pretendida / energia fornecida = Qe / W
COP = Qe / (Qs - Qe)
2.4
2.3 ENUNCIADO PRINCIPAL DA 2º LEI
No século XVIII a máquina a vapor foi utilizada em várias aplicações como já foi
comentado na introdução desse livro. Mas, uma grande questão na época era como avaliar
a quantidade máxima de trabalho que poderia ser obtida a partir de uma dada quantidade
de combustível. Um jovem engenheiro francês resolveu a questão formulando
matematicamente o seguinte enunciado:
A eficiência máxima de uma máquina térmica operando em ciclo entre T e e TS onde:
Te > TS é:
máx. = 1 – Ts /Te
2.5
41
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Como explicar esse enunciado?
Bem, a eficiência de uma máquina térmica reversível foi definida como:
Qe – QS/Qe = 1 – Qs/Qe < 1. Ora, é fácil perceber que o calor Qe e Qs dependem
exclusivamente das temperaturas Te e TS sendo assim podemos afirmar que a eficiência
de uma máquina térmica reversível deve portanto, ser uma função somente das
temperaturas desses reservatórios, pois a temperatura é a única propriedade relevante de
um reservatório. Assim sendo,
máx. = 1 – Ts /Te = f1 (Ts ,Te)
ou
Qe/ QS = f2 (Ts ,Te)
Para um ciclo reversível, pode ser demonstrado que a razão Qe/QS é igual à razão
TS /Te. Isto é,
(Qe / QS)ciclo = (Ts /Te)ciclo
Se a integral de Q/T ao redor do ciclo para uma máquina de Carnot for calculada,
obtém-se:
Q/T = Qe/QS - Ts /Te
Mas pela equação anterior
Qe/QS = Ts /Te portanto
Q/T = 0
A análise de ciclos irreversíveis mostra que:
(Q/T)irrev < 0 de tal forma que uma equação geral para ciclos termodinâmicos pode ser
escrita
(Q/T) ≤ 0
2.7
Essa equação é conhecida como desigualdade de Clausius onde a igualdade vale
quando não existem irreversibilidades no interior do sistema e a desigualdade é válida
quando irreversibilidades estão presentes. Para um refrigerador o COP máximo será
COPmáx = Te / (Ts – Te)
COPmáx = TFF / (TFQ – TFF)
2.8
E para uma bomba de calor
COPmáx = TFQ / (TFF – TFQ)
2.9
2.4 O NASCIMENTO DA ENTROPIA
O enunciado de Carnot visto na seção 2.3 é basicamente o surgimento da entropia.A
entropia é o que nos informa o que pode ou não pode acontecer no mundo real, ou seja, é
uma propriedade do sistema, assim como a energia interna. Da mesma forma que
medimos U para uma transformação, medimos também a variação da entropia S.
42
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Quando um sistema vai do estado 1 para o estado 2, encontramos U através da 1º lei. De
forma semelhante, a mudança de entropia do estado 1 para o estado 2 pode ser encontrada
por
2
Ssistema =
dQ
2.10
rev. / Tsistema
1
Onde T é a temperatura absoluta e Qrev. é quando todas as transformações de energia
ocorrem de forma reversível, sem atrito.
2.5 CAMINHOS REVERSÍVEIS E IRREVERSÍVEIS
Sempre há vários caminhos para se ir do estado 1 para o estado 2. Para determinar
U não faz nenhuma diferença utilizar este ou aquele caminho, porque entre os dois a
diferença de W é compensada pela diferença de Q. em todos os casos U é o mesmo, Por
exemplo:
Para aquecer água de 20ºC a 30ºC podemos:
Colocar 50 J de calor, U = Q – W = 50 – 0 = 50
Colocar 50 J de trabalho mecânico, U = Q – W = 0 – ( -50) = 50
Colocar 70 J de trabalho e retirar 20 J de calor, U = Q – W = -20- (-70) = 50
Em todos os casos U é o mesmo.
Caminho reversível é quando podemos retornar para as condições iniciais. No exemplo
anterior podemos tanto aquecer a água como resfriá-la. Já o irreversível é quando o sistema e
todas as partes de sua vizinhança não conseguem voltar ao estado inicial.Um sistema que passa
por um processo irreversível não está impedido de retornar ao seu estado inicial. No entanto se
o sistema retornar ao estado inicial não será possível fazer o mesmo com sua vizinhança.
. No caso de S o caminho faz diferença quando precisamos medi-lo.As etapas a seguir
são importantes para a resolução de alguns problemas:
-
-
Defina o estado final e o inicial e calcule a quantidade de calor recebida ou cedida
pelo sistema, Qreal .
Se não houver interferências de efeitos mecânicos como K, T, expansão ou
contração, atrito ou outro efeito qualquer, Qreal = Qrev portanto use diretamente
na equação 2.10.
Se as mudanças de energia mecânica envolvem atrito (irreversibilidades) devemos
considerar um caminho como reversível para as mudanças de energia mecânica
que estão acontecendo. Calcule Qrev e depois S para esse caminho a partir do
estado inicial para o estado final.
Dessa forma para qualquer mudança reversível temos
Para tudo:
sistema e
arredores
S = 0
43
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
e para mudanças irreversíveis,
Para tudo:
sistema e
arredores
S>0
Isso quer dizer que a entropia total de um sistema isolado não pode diminuir, ou seja,
Stotal 0 ou
Suniverso = Ssistema + Svizinhança
0
2.11
2.6 IRREVERSIBILIDADES
Os processos espontâneos que ocorrem na realidade são todos irreversíveis tais
como atrito, resistência elétrica, deformação inelástica, transferência de calor etc.O
termos irreversibilidade é utilizado para identificar qualquer destes efeitos. A medida que
um sistema sofre um processo, podem ser encontradas irreversibilidades dentro do
sistema, bem como em suas vizinhanças assim é importante definirmos irreversibilidades
internas aquelas que ocorrem dentro do sistema e externas a que ocorrem na vizinhança.
2.7 BALANÇO DE ENTROPIA PARA SISTEMAS FECHADOS
A equação 2.7 pode ser escrita de forma alternativa como
(Q/T) = - ciclo
2.12
Onde ciclo pode ser associado à “intensidade” da desigualdade.O valor de ciclo é
positivo quando irreversibilidades internas estão presentes, zero quando irreversibilidades
internas não estão presentes e nunca pode ser negativo.Considere um ciclo executado por
um sistema fechado, percorre um caminho no qual irreversibilidades internas estão
presentes, seguido por outro caminho internamente reversível. Para esse ciclo, a Eq. 2.12
toma a forma:
1
1
(Q/T) + (Q /T)
2
int rev
= -
2.13
2
A segunda integral pode ser expressa por:
1
S1 – S2 =
(Q /T)
int rev
2
Com essa relação obtemos:
44
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
1
(Q/T)
+ (S1 – S2 ) = -
2
Finalmente rearranjando a última equação, o balanço de entropia para um sistema fechado
é:
Transferência
de entropia
Variação
de
entropia
Geração de
entropia
2
S2 – S1
=
(Q/T)
+
2.14
1
A segunda lei determina que a geração de entropia possua valores positivos ou nulos
:
0 irreversibilidades estão presentes no interior do sistema
= 0 irreversibilidades não estão presentes no interior do sistema
2.15
O valor da geração de entropia não pode ser negativo. Por outro lado, a variação de
entropia de um sistema pode ser positiva, negativa ou nula:
0
=0
0
S2 – S1:
2.16
A segunda lei pode ser interpretada como obrigando que a entropia seja gerada por
irreversibilidades e conservada somente no limite em que as irreversibilidades sejam
reduzidas a zero.
Na forma de taxa a Eq. 2.14 se transforma em:
2
dS/dt =
(Q/T)
+
2.17
1
2.8 BALANÇO DE ENTROPIA PARA ESCOAMENTO DE FLUIDOS
No capítulo 1 quando vimos a primeira lei para escoamento de fluidos chegamos as
Eqs. 1.35 e 1.36 e da mesma forma para a segunda lei faremos o balanço de entropia que
como massa e energia também pode ser transferida para o interior ou o exterior do
volume de controle por escoamento de matéria. Seguindo a Eq.2.14 o resultado é
45
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Taxas de
transferência de
entropia
dSvc /dt = Q/T + me se - ms ss
Taxa de
geração de
entropia
+
2.18
Se o regime for permanente a equação anterior fica
0 = Q/T + me se - ms ss +
2.19
2.9 EXERGIA OU DISPONIBILIDADE (E)
Exergia ou disponibilidade está relacionado com o máximo de trabalho que se pode
extrair, ou o menor dispêndio necessário para uma transformação que ocorre. O trabalho
basicamente depende do estado inicial e final do sistema, mais o estado do ambiente. Um
objetivo na análise da exergia é a identificação de locais onde a destruição de exergia e as
perdas aconteçam de modo que sejam mínimas na operação de um sistema. De acordo
com a 2º Lei, a destruição de exergia é positiva quando as irreversibilidades estão
presentes no interior do sistema durante o processo e desaparecem quando não existem
irreversibilidades. Portanto,
E:
0 irreversibilidades estão presentes no interior do sistema
= 0 irreversibilidades não estão presentes no interior do sistema
2.20
O valor da destruição da exergia não pode ser negativo, mas sua variação pode ser:
E2 – E1:
0
=0
0
2.21
2.10 BALANÇO DE EXERGIA PARA ESCOAMENTO DE FLUIDOS
Em regime permanente teremos:
0 = (1 –T0/Ti)Qi - Wvc +meefe - ms efs - Ed
2.22
Já a exergia de fluxo vale:
efs - efe = h s – he – T0( ss – se ) + (Vs2/2 - Ve2/2) + g(zs -z e )
Em geral T0 vale 293K
46
2.23
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Finalizando o capítulo podemos afirmar que
- A entropia de um sistema pode aumentar somente de duas formas, por adição de
calor ou pela presença de uma irreversibilidade.
- A entropia de um sistema pode diminuir somente de uma única maneira, que é por
remoção de calor.
- A entropia de um sistema não pode diminuir durante um processo adiabático.
EXERCÍCIOS RESOLVIDOS DO CAPÍTULO
1) Um objeto de 20 Kg cai de uma altura de 50m, sendo que os arredores se
encontram a 20ºC. Responda:
a) Qual o S do objeto?
b) Qual o S dos arredores?
c) Qual o S do universo?
solução
Vamos escolher o objeto como o sistema e o universo como arredores ou vizinhança.
Apesar de algum calor ter sido gerado por atrito quando o objeto atingiu o solo, esse calor
provavelmente deve ter sido dissipado nos arredores e o objeto retornado à sua
temperatura inicial que é a do ambiente. Vamos então adotar como estado 1 o objeto a
20ºC, a 50 m de altura e, como estado 2, o mesmo objeto à mesma temperatura, no solo.
Para esse objeto o calor realmente perdido para a vizinhança pode ser calculado pela 1º
lei
U + K + T = Q – W mas
U = 0 pois a temperatura não variou
K = 0 sem velocidade antes e depois
Perdido
W = 0 não houve trabalho realizado
pelo objeto
Então teremos
e recebido
pela
vizinhança
Qreal = T = mg ( Z2 – Z1 ) = 20 Kg . 9,8m/s2 (0 – 50m) = -9800 J
Será que algum efeito mecânico foi envolvido nesse processo? A resposta é sim, para o
objeto, uma vez que ele perdeu energia potencial, e não para os arredores, uma vez que os
arredores apenas ganharam calor.
a) Para o sistema (objeto), a queda é tipicamente um processo mecânico irreversível;
então imaginemos um processo reversível para levá-lo do alto até o chão. Podemos
utilizar por exemplo um dispositivo tipo roldana onde pode ser controlada a queda do
objeto.O calor necessário para levar o objeto ao solo reversivelmente é zero. Então pela
Eq.2.10
47
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Ssistema =
dQ
rev.
/ Tsistema
=0
b) Para a vizinhança ocorrem apenas efeitos térmicos. Depois que o objeto atinge o chão,
a vizinhança recebeu 9800 J e permaneceu a 20ºC; portanto
Sviz =
c)
dQ
rev.
/ Tsistema
= 9800 / 293 = 33,5 J/K
Suniverso = Ssistema +Svizinhança
=0
Suniverso = 0 + 33,5 = 33,5 J/K
2) Um congelador doméstico opera numa sala onde a temperatura é 20ºC. Para manter a
temperatura do espaço refrigerado em –30ºC é necessário uma taxa de transferência de calor, do
espaço refrigerado igual a 2 KW. Qual a mínima potência necessária para operar esse
congelador?
solução
A potência mínima de acionamento da máquina é dada se admitirmos que o equipamento
opera segundo um ciclo de Carnot. De acordo com a figura 2.4 pelo ciclo de refrigeração
calculamos o COP como
COP = calor retirado/energia consumida = Qe/W
COP = Qe / (QS - Qe) = Te / (Ts – Te)
COP = 273 – 30 / (273+20) – (273-30) = 4,86
A potência de acionamento é
W = Qe/COP = 2 / 4,86 = 0,41 KW
3) Propõe-se aquecer uma residência usando uma bomba de calor. A temperatura da
residência deve ser mantida a 20ºC, estima-se que quando a temperatura externa cai a –
10ºC, a taxa de transferência de calor da residência para o exterior é igual a 25KW. Qual
é a mínima potência elétrica necessária para acionar essa bomba de calor?
solução
COP = energia pretendida / energia fornecida = Qe / W
COP = Qe / (QS - Qe )
COPmáx = Te / (Ts – Te)
Ts = -10ºC = 263K
Te = 20ºC = 293K
COP = 293 /( 293 – 263) = 9,7
A potência de acionamento é
W = Qe /COP = 25 /9,7 = 2,57 KW
48
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
4) Você é encarregado de projetar um motor movido a energia solar para produzir 75KW.
O coletor solar deverá operar a 115ºC com uma temperatura ambiente de 15ºC, se o fluxo
de energia absorvido pelos coletores é de 950 W/m 2, calcule a área mínima necessária
para esse coletor solar.
solução
A eficiência de Carnot é dada por
= 1 – fonte fria/ fonte quente = 1 - (15+273)/(115+273) = 25% ( eficiência máxima)
= W/ Q
0,25 = 75 W/ Q Q = 300 KW
Área mínima é dada por
A = Q/q = 300 KW / 950x10-3KW m2
= 315 m2
5) Um inventor afirma ter desenvolvido um ciclo de potência capaz de fornecer um
trabalho de 410 KJ através de uma entrada de energia por transferência de calor de
1000KJ. O sistema percorrendo o ciclo recebe o calor de gases quentes à temperatura de
500K e descarrega para a atmosfera energia térmica a 300K. Avalie essa afirmação.
solução
A eficiência térmica do ciclo é
= energia pretendida / energia fornecida = 410 KJ/1000 KJ = 41%
A eficiência térmica máxima que qualquer ciclo de potência pode ter enquanto opera
entre reservatórios a Te = 500 K e TS = 300 K é
máx. = 1 – TS /Te = 1 - 300 K / 500 K = 40%
Uma vez que a eficiência térmica do ciclo real excede o valor máximo teórico, a
afirmação não pode ser válida.
6) Um congelador de um refrigerador está a –5ºC enquanto que o ar exterior se encontra a
22ºC. A taxa de transferência de calor entre o congelador e o refrigerante é de 2,2 KW e a
potência de entrada necessária para acionar o compressor é de 0,88 KW. Determine o
COP do refrigerador e compare com o COP de um ciclo de refrigeração reversível.
Solução
COP = energia pretendida / energia fornecida = Qe / W = 2,2 / 0,88 = 2,5
O COP que opera entre reservatórios a Te = 268 K e Ts = 295 K de um ciclo de
refrigeração reversível é
COPmáx = Te / (Ts – Te) = 268 / (295-268) = 9,9
49
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Como o COP real é muito inferior comparado com o teórico é possível que possa
haver algumas melhorias para se aumentar o desempenho termodinâmico desse
ciclo.Porém, o objetivo deve ser estudado com cuidado, pois uma melhora no
desempenho pode exigir aumentos no tamanho, complexidade e custo.
7) Água, inicialmente como líquido saturado a 100ºC, está contida em um conjunto
cilindro-pistão. A água é submetida a um processo que a leva ao estado correspondente de
vapor saturado, durante o qual o pistão se move livremente ao longo do cilindro. Não
ocorre transferência de calor para a vizinhança. Se a mudança de estado acontece pela
ação mecânica de um agitador, determine o trabalho líquido por unidade de massa, em
KJ/Kg, e a quantidade de entropia produzida por unidade de massa, em KJ/KgK.
solução
Hipóteses:
a) A água no conjunto cilindro-pistão constitui um sistema fechado.
b) Não ocorre troca de calor com a vizinhança.
c) Não ocorre variações de energia cinética e potencial
A 1ºlei é utilizada para se determinar o trabalho líquido
U + K + T = Q – W
Por unidade de massa, o balanço de energia se reduz a
W/m = - (ug – uf)
Com valores da energia interna específica da tabela a 100ºC fica
W/m = - ( 2506,5 – 418,94) = - 2087,56 KJ/Kg
O sinal negativo indica que o trabalho fornecido pelo agitador é maior que o trabalho
realizado pela água à medida que está se expande.
A quantidade de entropia gerada é calculada pela aplicação do balanço de entropia. Uma
vez que não ocorre transferência de calor, o termo relacionado à transferência de entropia
se anula
2
S2 – S1 =
(Q/T)
+
1
por unidade de massa, essa expressão se torna
/m = Sg – Sf
Com valores de entropia específica da tabela a 100ºC
/m = 7,3549 – 1,3069 = 6,048 KJ/Kg K
Nesse exemplo efeitos de atrito estão presentes no fluido durante o processo, e a
quantidade de entropia gerada assume valor positivo ( irreversibilidades presentes no
interior do sistema).
50
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
8) Vapor d’ água é admitido em uma turbina a uma pressão de 30bar, a uma temperatura
de 400°C e a uma velocidade de 160m/s. vapor saturado a 100ºC é descarregado a uma
velocidade de 100m/s. em regime permanente, a turbina produz uma quantidade de
trabalho igual a 540 KJ/Kg de vapor escoando através da turbina. Ocorre transferência de
calor entre a turbina e sua vizinhança a uma temperatura média da superfície externa igual
a 350K. Determine a taxa de geração de entropia no interior da turbina. Despreze a
variação da energia potencial entre a admissão e a descarga.
Aplicando a 1º lei para regime permanente temos:
me(h + v2/2) – ms(h + v2/2) + Q – W = 0 dividindo por m
he + v2e/2 - hs - v2s/2 + Q/m – W/m = 0
Q/m = W/m + (hs - he) + (v2s/2 - v2e/2 )
Q/m = 540 + ( 2676,1- 3230,9) + ( 1002/2000 – 1602/2000)
Q/m = 22,6KJ/Kg
Pelo balanço de entropia em regime permanente fica:
0 = Q/T + me se - ms ss + dividindo por m
Q/m/T + se - ss + /m = 0
/m = - Q/m/T + (ss - se )
/m = - 22,6 /350 + ( 7,3549 – 6,9212) = 0,4983 KJ/KgK
EXERCÍCIOS COMPLEMENTARES
1) O motor térmico reversível representado na figura abaixo, durante um ciclo de
operação recebe 1200KJ do reservatório que se encontra a 720K e produz 200KJ de
trabalho. Calcule a quantidade e o sentido das interações de calor com os outros
reservatórios. R. Q1 = 200,7 KJ e Q2 = -1200,7KJ
51
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
2) Uma máquina térmica operando em regime permanente conforme a figura abaixo,
recebe 580KW de uma fonte quente e produz uma potência de 191,36KW. Determine:
a) o fluxo de calor transferido para a fonte fria. R. 388,64KW
b) o rendimento térmico da máquina. R. 33%
c) a variação de entropia que ocorre na fonte fria e na fonte quente, para temperaturas
respectivamente 50ºC e 400ºC. R. 1,2KW/K
d) verifique se é uma máquina de Carnot. R. sim
3) Verificar por meio da desigualdade de Clausius, se é possível existir uma máquina
térmica que receba 8360KJ a temperatura de 470ºC e produza um trabalho de 2926KJ. A
máquina fornece para a fonte fria uma determinada quantidade de calor a temperatura de
70ºC.
52
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
CAPÍTULO 3
ESTUDO DOS CICLOS TERMODINÂMICOS
3.1 CICLO DE CARNOT
É o ciclo executado pela Maquina de Carnot, idealizada pelo engenheiro francês
Carnot e que tem funcionamento apenas teórico (ainda não conseguiram criar uma Maquina
de Carnot).
Funcionando entre duas transformações isotérmicas e duas adiabáticas alternadamente,
permite menor perda de energia (Calor) para o meio externo (fonte fria).
Figura 3.1 Ciclo de Carnot
O ciclo de Carnot na prática apresenta grande dificuldade devido a mistura líquido/vapor
de água que sai do condensador e é comprimida para entrar na caldeira. A dificuldade consiste
na compressão de vapor e do líquido separadamente. Além disso, a energia gasta na compressão
de vapor é muita maior do que a energia gasta para consumir a mesma quantidade de líquido.
Portanto, é muito mais prático um ciclo que tenha somente líquido na entrada da bomba. Esse
ciclo está representado na figura abaixo. O ciclo de Rankine é então aquele que se obtém
quando o ponto 3’ é deslocado para a linha de líquido saturado. Podemos então definir um ciclo
ideal de Rankine como aquele que tem dois processos adiabáticos (bomba e turbina) e dois
processos isobáricos ( caldeira e condensador), sendo todos eles reversíveis.
53
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
3.1 O CICLO DE POTÊNCIA DE RANKINE
Muito empregado em usinas termoelétricas, esse ciclo tem como característica principal a
utilização do vapor d`água como fluido de trabalho. A fonte térmica é em geral, a combustão
de carvão, óleo, gás natural ou a fissão do urânio235. A caldeira é o local onde a água é
transformada em vapor a alta temperatura e alta pressão. Esse vapor expande-se e resfria-se ao
passar por uma turbina, convertendo energia térmica em mecânica de rotação de um eixo. O
condensador resfria o vapor e reduz a sua pressão.
Figura 3.1 Ciclo de Rankine
Turbina
O vapor na caldeira no estado 1, tendo uma pressão e temperatura elevadas, se expande
através da turbina para produzir trabalho e então é descarregado no condensador no estado 2
com uma pressão relativamente baixa. Desprezando a transferência de calor com as
vizinhanças, os efeitos da energia cinética e potencial, os balanços de massa e energia sob a
forma de taxa para um volume de controle envolvendo a turbina simplificam-se no regime
permanente a
54
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Condensador
No condensador há transferência de calor do vapor para a água de resfriamento que escoa
por sua tubulação. O vapor é condensado e a água de resfriamento aumenta de temperatura. Em
regime permanente, os balanços de massa e energia desprezando os efeitos da energia cinética e
potencial, trabalho no eixo sob a forma de taxa para um volume de controle envolvendo o
condensador simplificam-se
Bomba
O líquido condensado que deixa o condensador em 3 é bombeado para a caldeira que se
encontra a uma pressão mais elevada. Para um volume de controle envolvendo a bomba e
desprezando-se os efeitos da energia potencial e cinética e a troca de calor com as vizinhanças,
os balanços de massa e de energia sob a forma de taxa fornecem:
Uma forma alternativa para se determinar o trabalho da bomba pode ser
Caldeira
O fluido de trabalho completa um ciclo ao deixar a bomba em 4, esse fluido já no estado
líquido é aquecido até a saturação e evaporação na caldeira. Tomando-se um volume de
controle envolvendo os dutos e tubulações da caldeira e desprezando-se novamente a energia
potencial e cinética e também trabalho no eixo, os balanços de massa e de energia sob a forma
de taxa fornecem
Parâmetros de Desempenho
A eficiência térmica do ciclo de potência é dada por
η = (h1 – h2 ) – (h4 – h3 ) / (h1 – h4 )
3.7
55
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Desde que os estados 1 a 4 sejam determinados as equações anteriores são aplicadas tanto
ao desempenho real, quando irreversibilidades estão presentes, quanto ao desempenho
idealizado, na ausência destes efeitos. É importante considerar um ciclo ideal no qual as
irreversibilidades estão ausentes, uma vez que este ciclo estabelece um limite superior para o
desempenho do ciclo de Rankine.
Figura 3.2 Ciclo ideal
Analisando a figura 3.2 o fluido de trabalho sofre os seguintes processos internamente
reversíveis:
Processo 1-2: Expansão isentrópica do fluido de trabalho através da turbina de vapor saturado
no estado 1 até a pressão do condensador.
Processo 2-3: transferência de calor do fluido de trabalho à medida que ele escoa a pressão
constante através do condensador com líquido saturado no estado 3.
Processo 3-4: compressão isentrópica na bomba até o estado 4 na região de líquido comprimido.
Processo 4-1: transferência de calor para fluido de trabalho à medida que ele escoa a pressão
constante através da caldeira para completar o ciclo.
Exemplo 1
Considere a central de potência que opera com vapor de água com os seguintes dados:
Saída do gerador de vapor
Entrada da turbina
Saída da turbina, entrada
do condensador
Saída do condensador.,
entrada da bomba
Trabalho da bomba =
4KJ/Kg
Pressão
2MPa
1,9MPa
15KPa
Temperatura ou título
300ºC
290ºC
90%
14KPa
45ºC
56
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Determine:
a)
b)
c)
d)
e)
O calor transferido na linha de vapor entre o gerador e a turbina
O trabalho da turbina
O calor transferido no condensador
O calor transferido no gerador de vapor
A eficiência do ciclo
Das tabelas de vapor d’água encontramos:
h1 = 3023,5 KJ/Kg
h2 = 3002,5 KJ/Kg
h3 = 226 + 0,9(2373,1) = 2361,8KJ/Kg
h4 = 188,5KJ/Kg
Q = 3002,5 – 3023,5 = -21KJ/Kg
a) 0 = h1 - h2 + Q
b) h2 = W + h3
c) h3 = Q + h4
W = 3002,5 – 2361,8 = 640,7KJ/Kg
Q = 2361,8 – 188,5 = 2173,3KJ/Kg
d) h4 + W = h5
h5 = 188,5 + 4 = 192,5KJ/Kg
h5 + Q = h1 Q = 3023,5 – 192,5 = 2831KJ/Kg
e) pela 2º Lei a eficiência vale
= Wciclo - Wb / Qe
= 640,7 – 4 / 2831 = 22,4%
3.2 EFEITOS DA PRESSÃO DA CALDEIRA E DO CONDENSADOR
Como o ciclo de Rankine ideal consiste em processos internamente reversíveis, pode-se
obter uma expressão para a eficiência térmica em termos de temperaturas médias da caldeira e
do condensador. Essa expressão é definida como
ηideal = 1- Tsai / Tent
3.8
57
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A Eq. 3.8 pode ser empregada no estudo dos efeitos de variações nas pressões da caldeira
e do condensador sobre o desempenho. Esses resultados funcionam também em ciclos reais.
Essa equação é similar a de Carnot, porém, observando-se a fig. 3.3 o ciclo de Rankine ideal 12-3-4`-1 possui uma eficiência térmica menor do que o ciclo de Carnot 1-2-3`-4`-1 que possui a
mesma temperatura máxima TH e a mesma temperatura mínima TC, porque a temperatura média
entre 4 e 4`é menor do que TH.
Figura 3.3 Comparação entre o ciclo de Carnot e o ciclo de Rankine ideal
Irreversibilidades e perdas estão associadas a cada um dos componentes do ciclo de
Rankine. Na turbina, a principal irreversibilidade experimentada pelo fluido de trabalho está
associada à expansão através da turbina. A transferência de calor através da turbina para as
vizinhanças representa uma perda que pode ser desprezada.
3.3 EFICIÊNCIA ISOENTRÓPICA
É o tipo de eficiência que envolve a comparação entre o desempenho real e o desempenho
ideal. O estado do fluido que está sendo admitido na turbina e a pressão de saída são fixos. Uma
vez que o estado 1 é fixo, a entalpia específica h1 é conhecida. Assim o trabalho depende
somente da entalpia específica h2 e aumenta à medida que h2 é reduzida. O valor máximo para o
trabalho da turbina corresponde ao menor valor possível para a entalpia específica na saída da
turbina. Os estados possíveis na saída estão restringidos por:
Uma vez que a geração de entropia não pode ser negativa, estados como s 2 < s1 não são
possíveis em uma expansão adiabática. Os únicos estados possíveis são aqueles com s 2 > s1. O
estado indicado por 2s na figura 3.4 seria atingido somente no limite de ausência de
irreversibilidades internas. Isso corresponde a uma expansão isoentrópica através da turbina.
Para uma pressão de saída fixa, a entalpia específica h2 diminui a medida que a entropia
específica s2 diminui. Então, o menor valor possível para h2 corresponde ao estado 2s , e o valor
máximo do trabalho da turbina é
58
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Assim a eficiência isoentrópica pode ser encontrada por
ηiso = h1 - h2 / h1 – h2s
3.11
Figura 3.4 Comparação entre uma expansão real e uma expansão isoentrópica de turbinas.
3.4 MELHORANDO O DESEMPENHO DO CICLO DE RANKINE
Na prática observou-se que um aumento da pressão da caldeira ou uma diminuição
da pressão no condensador pode resultar numa redução do título de vapor na saída da
turbina. É comum procurar manter um título de no mínimo de 90% na saída para que não
ocorra a condensação nas pás da turbina causando assim corrosões e mais manutenção
nessa turbina. Para isso é necessária a criação de um superaquecimento e um
reaquecimento no ciclo.
Superaquecimento
Considere a figura 3.5 que mostra vapor superaquecido na entrada da turbina: o
ciclo 1`-2`-3-4-1`.Esse ciclo possui uma temperatura média de adição de calor maior do
que o ciclo sem superaquecimento (ciclo 1-2-3-4-1) e, portanto, a eficiência térmica é
maior. Também, o título no estado 2`na saída da turbina é maior do que no estado 2, que
seria a saída da turbina sem superaquecimento. Assim o superaquecimento evita que se
tenha título baixo na saída da turbina.
59
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Figura 3.5 Ciclo Rankine com superaquecimento
Reaquecimento
Com o reaquecimento a pressão da caldeira é maior e também proporciona um título
baixo na saída da turbina. Nesse caso é preciso que tenha dois estágios para a turbina
como indica a figura 3.6. O reaquecimento permite a presença de um vapor mais seco na
saída da segunda turbina.
Figura 3.6 Ciclo de reaquecimento
60
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Exemplo 2
Calcular o rendimento de um ciclo de Rankine conhecendo-se a pressão da caldeira,
P1 =50bar, e a do condensador, P2 = 0,5bar. Sabe-se que o vapor entra saturado na turbina
e que a água que sai do condensador está saturada.
= 1 – Qcond./ Qcald.
Qcond = m ( h2 - h3 )
Qcald. = m ( h1 - h4 )
= 1 – ( h2 - h3 )/ ( h1 - h4 )
Cálculo das entalpias
Ponto 1: pelas tabelas para P1 =50bar e x1 = 1,0
h1 = 2794,3 KJ/Kg
s1 = 5,9734 KJ/KgK
Ponto 2: também através da tabela para s2 = s1(turbina ideal) e P2 = 0,5bar
s2 = 5,9734KJ/KgK
s2 = sf + x2s
x2 = (s2 - sf )/s
sf = 1,0910KJ/KgK
sg = 7,5939KJ/KgK
x2 = (5,9734- 1,0910 )/ 7,5939 – 1,0910
= 0,75
hf = 340,49KJ/Kg
hg = 2645,9KJ/Kg
h2 = hf + x2h = 340,49 + 0,75 ( 2645,9 - 340,49) = 2069,5 KJ/Kg
Ponto 3: para P2 =0,5bar e x3 = 0
h3 = 340,49KJ/Kg
61
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Ponto 4: a entalpia no ponto 4 é a soma da entalpia do ponto 3 com a variação de entalpia
provocada pela bomba.
h4 = h3 + v( P4- P3) = 340,49 + 0,001( 50x105-0,5x105) = 345,44KJ/KgK
= 1 – ( h2 - h3 )/ ( h1 - h4 ) = 1 – (2069,5 - 340,49) / (2794,3 -345,44) = 29%
Exemplo 3
Calcular o rendimento do ciclo do problema anterior adotando agora o vapor
superaquecido na entrada da turbina a 500ºC, com as demais condições mantidas.
Para P1’ = 50bar e T1’ = 500ºC a través da tabela de vapor superaquecido encontramos
h1’ = 3433,75 KJ/Kg
s1’ = 6,98565 KJ/KgK
Ponto 2’: também através da tabela para s2’ = s1’ e P2’ = 0,5bar
s2’ = 6,98565KJ/KgK
s2’ = sf + x2s
x2 = (s2 - sf )/s
sf = 1,0910KJ/KgK
sg = 7,5939KJ/KgK
x2 = (6,98565- 1,0910 )/ 7,5939 – 1,0910 = 0,90
h2’ = hf + x2h = 340,49 + 0,90 (2645,9 - 340,49) = 2415,35 KJ/Kg
Ponto 3: para P2 =0,5bar e x3 = 0
h3 = 340,49KJ/Kg
Ponto 4 é o mesmo do problema anterior
h4 = 345,44KJ/KgK
= 1 – ( h2’ - h3 )/ ( h1’ - h4 ) = 1 – (2415,35 - 340,49) / (3433,75 -345,44) = 32,8%
Conclusão: o rendimento aumentou de 29% para 32,8% devido ao uso de vapor
superaquecido em lugar de vapor saturado
62
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Exemplo 4
Suponha agora um ciclo de Rankine como indica a figura 3.6 com reaquecimento do
vapor que passa pela turbina do problema anterior na pressão de 40bar. Calcular o
rendimento deste novo ciclo supondo que a temperatura de reaquecimento seja também
500ºC e que P1 = 60bar e P4 = 0,5bar
Ponto 1:
Para P1 = 60bar e T1 = 500ºC a través da tabela de vapor superaquecido encontramos
h1 = 3422,2 KJ/Kg
s1 = 6,8803 KJ/KgK
Ponto 2: também através da tabela para s2 = s1 e P2 = 40bar
h2 = 3213,6KJ/Kg
Ponto 3:
P3 = 40bar
T3 = 500ºC
h3 = 3445,3KJ/Kg
s3 = 7,0901KJ/KgK
Ponto 4:
P4 = 0,5bar
s4 = s3
s4 = 7,0901KJ/KgK
s4 = sf + x4s
x4 = (s4 - sf )/s
sf = 1,0910KJ/KgK
sg = 7,5939KJ/KgK
x4 = (7,0901- 1,0910 )/ 7,5939 – 1,0910 = 0,92
h4 = hf + x4h = 340,49 + 0,92 (2645,9 - 340,49) = 2461,46 KJ/Kg
Ponto 5:
P5 = 0,5bar
x5 = 0
h5 = 340,49KJ/Kg
63
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Ponto 6 é igual ao ponto 4 do problema anterior
h6 = 345,44KJ/KgK
= 1 – ( h4 - h5 )/ ( h1 - h6 )+( h3 - h2 )
= 1 – (2461,46-340,49)/ (3422,2- 345,44)+( 3445,3-3213,6) = 36%
3.5 CICLO OTTO
Os motores de combustão interna, tem por objetivo transformar energia térmica em
energia mecânica. Após a mistura combustível/ar ser comprimida na câmara de
combustão de cada cilindro, inicia-se uma queima, a qual produz uma força contra a
cabeça do pistão, forçando este se mover contra o eixo de manivelas. A biela transmite a
força atuante do pistão ao eixo de manivelas, fazendo com que este gire, convertendo
assim o movimento alternativo dos pistões em movimento rotativo do eixo de manivelas.
Figura 3.7 Motor de combustão interna
64
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Figura 3.8 Esquema de funcionamento
3..5.1 CILINDRADA
É o volume total deslocado pelo pistão entre o ponto morto inferior (PMI) e o ponto
morto superior (PMS), multiplicado pelo número de cilindros do motor. É indicada em
cm3 ou em litros.
Figura 3.9 Cilindrada
65
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A cilindrada é determinada por
C = πd Sn / 4
Onde
d = diâmetro do cilindro
S = curso do pistão
n = número de cilindros
3.12
3.5.2 TAXA DE COMPRESSÃO
É a relação entre o volume da mistura no cilindro antes e depois da compressão. Se
por exemplo a mistura for reduzida a um nono do seu volume, a taxa de compressão será
de 9:1. Essa taxa é determinada por
Tc = C + Vc / Vc
Onde
C = cilindrada
Vc = volume da câmara de combustão
3.13
Se essa taxa de compressão for muito elevada, a combustão não será progressiva. A
parte da mistura que se encontrar mais afastada da vela de ignição inflamarse-á
violentamente ou detonará. Quando tal sucede, diz-se que o motor está adiantado. Esta
detonação poderá causar um aquecimento excessivo, podendo danificar o motor caso não
seja corrigida. Os combustíveis formulados com chumbo tetraetila são resistentes a autoignição e assim permitem razões de compressão relativamente altas. A gasolina sem
chumbo que é utilizada atualmente, limita as taxas de compressão de motores de
combustão por centelha em torno de 9. Taxas de compressão mais elevadas podem ser
obtidas em motores de ignição por compressão típicas na faixa de 12 a 20 caso dos
motores Diesel.
3..5.3 EFICIÊNCIA X TAXA DE COMPRESSÃO
A eficiência de um motor de combustão está diretamente relacionada com a taxa de
compressão, quanto mais alta for essa taxa maior será a eficiência. Ela é dada por
η = 1- (1 / Tck-1)
onde
k = razão entre os calores específicos ( cp /cv )
3.14
66
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Figura 3.10 Diagrama p-v para o ciclo Otto
O ciclo Otto consiste em dois processos nos quais há trabalho, mas não há
transferência de calor, os processos 1-2 e 3-4 e em dois processos nos quais há
transferência de calor, mas não há trabalho, os processos 2-3 e 4-1. O processo 1-2 é uma
compressão isentrópica do ar conforme o pistão se move do ponto morto inferior para o
ponto morto superior. O processo 2-3 é uma transferência de calor a volume constante
para o ar. O processo 3-4 é uma expansão isentrópica ( curso de potência). No processo 41 o ciclo é completado com uma transferência de calor a volume constante do ar. No
diagrama p-v a área mais escura representa o trabalho fornecido por unidade de massa
durante o processo de compressão, e as duas regiões do diagrama representa o trabalho
executado por unidade de massa no processo de expansão.
O trabalho líquido do ciclo é expresso por
Wciclo /m = W34/m – W12/m = ( u3 - u2 ) – ( u4 - u1 )
3.15
Ou
Calor
adicionado
Calor
rejeitado
Wciclo /m = Q23/m – Q41/m = ( u3 - u2 ) – ( u4 - u1 )
3.16
3.6 CICLO DIESEL
Esse ciclo ideal considera que a adição de calor ocorre durante um processo a
pressão constante, que se inicia com o pistão no ponto morto superior. O ciclo Diesel é
mostrado na figura 3.11, ele consiste em quatro processos internamente reversíveis onde
no processo 1-2 é o mesmo que no ciclo Otto: uma compressão isentrópica. Porém, o
67
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
calor não é transferido para o fluido de trabalho a volume constante como no ciclo Otto.
Aqui, o calor é transferido para o fluido de trabalho a pressão constante. O processo 2-3
também constitui a primeira parte do curso de potência. A expansão isentrópica do estado
2 para o estado 3 é o restante do curso de potência. Como no ciclo otto, o ciclo é
completado pelo processo 4-1 a volume constante, no qual o calor é rejeitado do ar
enquanto o pistão está no ponto morto inferior. No diagrama p-v, a área mais escura é o
trabalho fornecido por unidade de massa durante o processo de compressão. A área total é
o trabalho executado por unidade de massa conforme o pistão se move do ponto morto
superior para o ponto morto inferior.
Figura 3.11 Ciclo Diesel
Da mesma forma que no ciclo Otto, a eficiência térmica do ciclo Diesel aumenta
com a taxa de compressão. Como a adição do calor ocorre a pressão constante, o processo
2-3 envolve tanto trabalho quanto calor. O trabalho é dado por
3
W23 /m = ∫ Pdv = P2 ( v3 - v2 )
3.17
2
O calor adicionado no processo 2-3 pode ser encontrado aplicando-se o balanço de
energia para sistema fechado.
m( u3 - u2 ) = Q23 - W23
3.18
Da mesma forma que no ciclo Otto a eficiência á dada por
η = 1 – (1/ Tck-1 )[ rck – 1/ k(rc – 1)]
onde
rc = razão de corte (V3/V2 )
3.19
68
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
3.7 TURBINAS A GÁS (CICLO BRAYTON)
As turbinas a gás podem operar tanto no modo aberto como fechado. O modo aberto
é o mais utilizado onde o ar atmosférico é admitido no compressor indo para o combustor
que é misturado com o combustível onde ocorre uma combustão com grande elevação de
temperatura. Os produtos da combustão se expandem na turbina e são, em seguida
liberados nas vizinhanças. Parte do trabalho produzido é usado para acionar o
compressor, o restante utiliza-se para a geração de eletricidade ou para impulsionar um
veículo. O modo aberto é ilustrado na figura 3.12
Figura 3.12 Sistema aberto
No sistema fechado, o fluido de trabalho recebe um acréscimo de energia por
transferência de calor de uma fonte externa, o gás que deixa a turbina passa por um
trocador de calor, onde é resfriado antes de entrar novamente no compressor.
Figura 3.13 Sistema fechado
No ciclo Brayton da figura 3.13 é feito uma análise de ar-padrão considerando o ar
como fluido de trabalho que se comporta como gás ideal. Essa análise de ar-padrão,
69
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
simplifica consideravelmente o estudo do ciclo evitando a complexidade do processo de
combustão.
Cálculo das transferências de calor e trabalhos
Turbina
Supondo-se que a turbina opera adiabaticamente e com efeitos desprezíveis de
energia cinética e potencial, o trabalho produzido por unidade de massa é
Compressor
Com as mesmas hipóteses, o trabalho do compressor é
Calor adicionado
Calor rejeitado
Eficiência térmica do ciclo
70
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
3.8 SISTEMAS DE REFRIGERAÇÃO
3.8.1 SISTEMAS DE REFRIGERAÇÃO A VAPOR
Sabe-se que para uma substância passar do estado líquido para o estado de vapor é
necessário fornecer-lhe calor durante um certo tempo, até atingir a temperatura de
evaporação da substância. Esse é o princípio básico da refrigeração, ou seja, toda
substância ao evaporar rouba calor. O fluxo de calor sempre ocorre de uma fonte quente
para uma mais fria, e nunca ao contrário, de acordo com os princípios da 2º lei da
termodinâmica. Sendo assim, quanto maior for à diferença de temperatura entre essas
duas fontes, maior será o fluxo de calor. Em refrigeração, é de grande importância que
esse transporte de calor ocorra de modo eficiente, ou seja, sem perdas. Agora, como
conseguir alcançar um diferencial de temperatura muito alto? Considere que a fonte
quente esteja a 25ºC e que sejam utilizados os alimentos de um refrigerador comum. Se
usarmos, por exemplo, a água como indica a tabela 3.1, conseguiremos provocar um
fluxo de calor dos alimentos para a água? Evidentemente que não. Sendo assim,
precisamos de uma substância que evapore em baixas temperaturas. Qual você escolheria
da tabela 3.1?
Tabela 3.1 Ponto de ebulição de algumas substâncias
Substância
Água
Butano
Propano
Diclorodifluormetano
Monoclorodifluormetano
Amônia
Dióxido de enxofre
Ebulição (ºC ao nível do mar)
100
-0,4
-42,3
-29,8
-40,8
-28
-10
Agentes de Refrigeração
Em qualquer processo de refrigeração a substância empregada como absorvente de calor
ou agente de esfriamento é chamada de refrigerante. Na tabela 3.1 os mais empregados são o
CFC 12 (diclorodifluormetano), CFC 22 (monoclorodifluormetano) e amônia. Elaborada em
meados de 1920, a famíla CFC inovou completamente o campo da refrigeração pelo simples
fato de atingir um ponto de ebulição extremamente baixo e de não ser tóxica e inflamável.
Atualmente a família CFC está sendo banida do mercado devido à constatação de ser
considerado um gás estufa que agride a camada de ozônio da atmosfera. As temperaturas de
evaporação e condensação constituem parâmetros que determinam o tipo de refrigerantes
adequado à instalação. Refrigerantes de baixa temperatura crítica ou baixa temperatura de
ebulição, normal, devem ser utilizados em aplicações de baixa temperatura de evaporação. Por
outro lado, refrigerantes de elevada temperatura crítica são recomendados para aplicações de
alta temperatura de evaporação.
71
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Tabela 3.2 Propriedades físicas de diversos refrigerantes
72
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Continuação da tabela 3.2
Tabela 3.3 Relação de refrigerantes utilizados atualmente
73
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Continuação da tabela 3.3
3.8.2 O CICLO DE REFRIGERAÇÃO DE CARNOT
As figuras 3.14 e 3.15 ilustram o ciclo de refrigeração de Carnot que corresponde como já
foi visto o ciclo cujo rendimento é máximo.
74
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Figuras 3.14
Figura 3.15
Exemplo
Considere um ciclo de Carnot que apresenta os seguintes valores:
T2 = T3 = 250K
T1 = T4 = 300K
s1 = s2 = 0,9 KJ/KgK
s3 = s4 = 1,2 KJ/KgK
O calor absorvido da fonte fria é a área sob a linha 2-3 dada por:
Qa = T3 (s3 - s2 ) = 250 ( 1,2 - 0,9) = 75KJ/Kg
Enquanto que o calor rejeitado no condensador é:
Qr = T4 (s4 - s1 ) = 300 ( 1,2 - 0,9) = 90KJ/Kg
Através da 1º Lei podemos obter o trabalho líquido no compressor que vale:
Qa + Wliq. = Qr
Wliq = Qr - Qa = 90 – 75 = 15 KJ/Kg
O COP de Carnot pode ser calculado por:
COPcarnot = Qa / Wliq = T3 (s3 - s2 ) / (T4 - T3 ) (s3 - s2 ) = T3 / T4 - T3
COPcarnot = 250 / 300 -250 = 5
75
3.25
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
3.8.3 CONDIÇÕES PARA COP ELEVADO EM CICLOS DE CARNOT
Pela Eq. 3.25 observa-se se reduzirmos a temperatura de condensação T4 , implica numa
elevação do COP. Por outro lado o mesmo efeito poderia ser obtido por elevação da
temperatura de evaporação T3. O ciclo da figura 3.16 remove calor de um ambiente a baixa
temperatura (-20ºC), rejeitando para uma fonte quente que se encontra em alta temperatura
(35ºC). Nessas condições a temperatura de evaporação deve ser inferior a do ambiente frio,
permitindo que haja uma troca de calor da fonte quente para a fonte fria através de um T. por
outro lado, a fim de que o calor possa ser rejeitado, a temperatura externa deve ser inferior à
temperatura de condensação. Percebe-se que o COP do ciclo está relacionado as diferenças de
temperaturas entre o espaço refrigerado e o evaporador e entre o condensador e o ambiente
externo. Assim os T devem ser mínimos, uma vez que nesse caso, a temperatura de
condensação será a menor possível, ao mesmo tempo em que a temperatura de evaporação
assumirá seu valor máximo. Entretanto, uma redução no T implica num fator de área de troca
de calor no limite, um T nulo exigirá um trocador de calor de área infinita.
Figura 3.16
Apesar do ciclo de refrigeração de Carnot representar um COP máximo, na prática que é
uma condição mais realista ele será modificado resultando no chamado ciclo de compressão de
vapor. O ciclo de Carnot o processo de compressão se dá com o refrigerante no ponto 3 que é
uma mistura líquido-vapor que não é interessante para o compressor, pois o mesmo correrá o
risco de que entre refrigerante líquido na camisa do compressor, causando nele vários
problemas como erosão das válvulas, diluição do óleo de lubrificação na porção líquida. Assim
para esse novo ciclo o ponto 3 é afastado para a região da vapor saturado onde ocorre a garantia
teórica de que todo o líquido após passar pelo evaporador esteja no estado de vapor.
A figura 3.17 ilustra o ciclo básico de refrigeração por compressão de vapor muito
utilizado atualmente no mundo todo.
76
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Figura 3.17 Ciclo básico de refrigeração por compressão de vapor
De acordo com a figura 3.17 o ciclo pode ser acompanhado, começando com o
refrigerante que é comprimido no compressor no estado de vapor, tendo sua pressão e sua
temperatura aumentadas e seguindo diretamente para o condensador. Aqui, o calor retirado da
câmara é rejeitado para as vizinhanças, causando dessa forma a mudança de estado para a forma
líquida, indo agora para o dispositivo de controle (tubo capilar ou válvula de expansão). Esse
dispositivo provoca uma queda de pressão consequentemente caindo também a temperatura que
tem que ser a temperatura de evaporação do refrigerante no congelador. Em seguida o
refrigerante, entrando no evaporador, está em estado de evaporação na temperatura desejada do
projeto, ocorrendo assim o que chamamos de efeito refrigerante. Esse calor é transportado
pelo refrigerante que está sempre em circulação indo diretamente em seguida para o
compressor, iniciando novamente mais um ciclo. O estado 1 é referente ao líquido saturado na
temperatura do condensador e o estado 3 é vapor saturado correspondente à temperatura do
evaporador. O processo 1-2 se dá através de uma expansão adiabática onde a entalpia
permanece constante que ocorre no dispositivo de controle. No processo 3-4 a entropia
permanece constante, em razão do refrigerante sofrer uma compressão adiabática reversível no
compressor. O calor é rejeitado à pressão constante no processo 4-1 com o refrigerante saindo
do condensador como líquido saturado. Em 2-3, após sofrer o estrangulamento, o fluido de
trabalho é então vaporizado à pressão constante finalizando o ciclo.
3.8.4 O CICLO IDEAL
Se as irreversibilidades no evaporador e no condensador forem ignoradas, não existe
queda de pressão por atrito e o refrigerante escoa com pressão constante nos dois trocadores de
calor. Se a compressão ocorrer sem irreversibilidade e a transferência de calor perdida para as
77
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
vizinhanças for também ignorada, o processo de compressão será isentrópico. Com essas
considerações, tem-se o ciclo como indica as figuras 3.18 e 3.19
Figura 3.18 Diagrama temperatura x entropia
Figura 3.19 Diagrama pressão x entalpia
Cálculo das transferências de calor e trabalho
Desprezando-se as energias cinética e potencial. Os balanços de massa e energia
simplificam-se fornecendo
Compressor
O trabalho do compressor é
78
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Calor adicionado
A taxa de calor transferido é conhecida como a capacidade frigorífica. No sistema
de unidades SI, ela é normalmente expressa em kW. No sistema inglês de unidades, a
capacidade frigorífica é expressa em Btu/h. Uma outra unidade muito utilizada é a
tonelada de refrigeração, que é igual a 200 Btu/min, ou 211 kJ/min, ou também 3,517
kW.
Calor rejeitado
Coeficiente de desempenho
Válvula de expansão
Na válvula de expansão, considera-se que o processo de estrangulamento ocorre em
regime permanente, que o volume de controle é adiabático e sem trabalho, e que as
variações de energia cinética e potencial são desprezíveis. Apesar de haver uma pequena
variação na velocidade entre os estados 1 e 2, as velocidades são relativamente baixas e a
variação de energia cinética é muito pequena. Aplicando a 1º lei a equação se reduz a
h2 = h1
3.30
Exemplo 1
Refrigerante 134a é utilizado como fluido de trabalho em um ciclo de compressão de
vapor onde o vapor saturado entra no compressor a 0ºC e o líquido saturado deixa o
condensador a 26ºC. A vazão mássica do refrigerante é 0,08 Kg/s, sabendo que a temperatura
do compartimento frio é de 0ºC e do compartimento quente é de 26ºC, determine
a) a potência do compressor em KW
b) a capacidade frigorífica em TR
c) o COP
d) o coeficiente de desempenho de um ciclo de refrigeração de Carnot operando
nas respectivas temperaturas.
79
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Uma tabela pode ser elaborada com os seguintes dados
Estado
1
2
3
4*
T ºC
26
0
0
30
P bar
6,86
2,93
2,93
6,86
h kJ/Kg
85,75
85,75
247,2
265,3
s kJ/KgK
0,320
0,3269
0,919
0,919
x
0
0,18
1
Situação
Líquido saturado
Líquido vapor
Vapor saturado
Vapor
superaquecido
h2 = hf + x2h
85,75 = 50,02 + x2 ( 247,23 – 50,02)
x2 = 0,18
s2’ = sf + x2s
s2’ = 0,1970 + 0,18. (0,9190 – 0,1970) = 0,3269
* O estado 4 determina-se pela pressão e entropia constante
Os diagramas obtidos são:
a)
wc = 0,08 ( 265,3 – 247,2 ) = 1,44 kW
b)
Qentra = 0,08 ( 247,2 – 85,75 ) = 12,9 kW = 3,6 TR
c)
80
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
COP = 12,9 kW / 1,44 kW = 8,9
d) de acordo com a Eq. 2.8 temos
COPmáx = Te / (Ts – Te) = 273 / ( 299 – 273 ) = 10,5
3.8.4 DIMINUINDO A TEMPERATURA DE EVAPORAÇÃO OU AUMENTANDO A DE
CONDENSAÇÃO
Nas situações onde a temperatura de evaporação diminui e a temperatura de condensação
aumenta verifica-se na prática, efeitos não vantajosos para um sistema de refrigeração. O
exemplo 2 ilustra esse fato.
Exemplo 2
Para o exercício anterior considere que o vapor saturado que sai do evaporador entra no
compressor a –12ºC e o líquido saturado sai a uma pressão de 9bar do condensador. Determine
os mesmos parâmetros para essa nova situação.
Montando novamente a tabela temos
Estado
1
2
3
4
T ºC
35,5
-12
-12
40
P bar
9,0
1,85
1,85
9,0
h kJ/Kg
99,56
99,56
240,15
271,25
s kJ/KgK
0,3656
0,336
0,9267
0,9267
x
0
1
a)
wc = 0,08 ( 271,25 – 240,15 ) = 2,48 kW
b)
Qentra = 0,08 (240,15 – 99,56) = 11,25 kW = 3,19 TR
c)
81
Situação
Líquido saturado
Líquido-vapor
Vapor saturado
Vapor superaquecido
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
COP = 11,25 kW / 2,48 kW = 4,53
d) de acordo com a Eq. 2.8 temos
COPmáx = Te / (Ts – Te) = 261 / ( 308,5 – 261 ) = 5,49
Nesse exemplo nota-se que diminuindo a temperatura de evaporação implica no
aumento do trabalho requerido no compressor, a diminuição do efeito de refrigeração e a
diminuição do coeficiente de performance.
3.8 O CICLO REAL
No ciclo real de refrigeração por compressão de vapor, as transferências de calor
entre o refrigerante e as regiões quente e fria não são realizadas de maneira reversível: a
temperatura do refrigerante no evaporador é menor do que a temperatura T C da região
fria, e a temperatura do refrigerante no condensador é maior do que a temperatura T H da
região quente.
Figura 3.20 Ciclo real de refrigeração por compressão de vapor
Na compressão que corresponde o processo 3-4’, ocorre irreversibilidades causando um
aumento da entropia associada a uma compressão adiabática irreversível. Comparando o ciclo
1’-2-3-4’ com o ciclo 1’-2-3-4, a capacidade frigorífica é a mesma para os dois ciclos, mas a
potência de acionamento é maior para o caso da compressão irreversível quando comparada ao
ciclo ideal. Consequentemente o coeficiente de performance é menor no ciclo real do que no
ciclo ideal. O efeito da compressão irreversível é observada usando-se a eficiência isentrópica
do compressor que é dada por:
η = h4 – h3 / h4’ – h3
3.31
82
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Outros efeitos que ocorrem no ciclo real são os efeitos de atrito que causam quedas de
pressão na passagem do refrigerante pelo sistema, e os efeitos de superaquecimento e
subresfriamento que são as condições do vapor superaquecido na saída do evaporador ( estado
3), o que difere da condição de vapor saturado no ciclo ideal e o estado subresfriado na saída do
condensador (estado 1’ ), o que difere da condição de líquido saturado no ciclo ideal.
Exemplo 3
Reconsidere o ciclo de refrigeração do exemplo 2, mas inclua uma eficiência do
compressor de 80% e que a temperatura do líquido que deixa o compressor seja de 30ºC. Para
esse ciclo, determine os mesmos parâmetros.
Nesse exemplo nota-se a diminuição da temperatura de condensação que passou de 35,5ºC para
30ºC, ou seja, ocorrência de subresfriamento na saída do condensador.
Hipóteses
• não existem quedas de pressão no evaporador e no condensador.
• O compressor opera adiabaticamente e com uma eficiência de 80%.
• Os efeitos de energia potencial e cinética são desprezíveis.
Assim, podemos construir mais uma tabela das propriedades termodinâmicas do ciclo.
Estado
1
2
3
4
1’
T ºC
35,5
-12
-12
41,5
30
P bar
9,0
1,85
1,85
9,0
9,0
h kJ/Kg
99,56
99,56
240,15
271,25
99,56
s kJ/KgK
0,3656
0,9267
0,9267
0,3396
Condição
Líq.saturado
Líquido-vapor
Vapor saturado
Vapor superaq.
Líq. subresfriado
4’*
49
9,0
279
0,958
Vapor superaq.
* o estado 4’ na saída do compressor pode ser determinado utilizando-se sua eficiência
η = h4 – h3 / h4’ – h3
0,8 = 271,25 – 240,15 / h4’ - 240,15
h4’ = 279 kJ/Kg
interpolando na tabela a entropia é de 0,958 kJ/KgK
A expansão ao longo da válvula é um processo de estrangulamento, logo h 2 = h1’. O título e a
entropia no estado 2 são respectivamente
x2 = h2 - hf / hg – hf = 99,56 – 34,39 / 240,15-34,39 = 65,17 / 205,76 = 0,3167
s4 = sf + x4 (sg - sf ) = 0,1388 + 0,3167( 0,9267 – 0,1388) = 0,3883 kJ/KgK
a) Wc = m (h4’ – h3 ) = 0,08 (279 - 240,15 ) = 3,1 kW
b) Qentra = m(h3 - h2 ) = 0,08 (240,15 - 99,56) = 11,24 kW = 3,19TR
83
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
c)
COP = 11,24 / 3,1 = 3,6
d) COPmáx = Te / (Ts – Te) = 261 / ( 303 – 261 ) = 6,2
4) Um ciclo real de refrigeração opera com os seguintes parâmetros:
Pressão de descarga: 883KP
Pressão de sucção: 200KPa
Vazão mássica de refrigerante: 2,48Kg/s
Superaquecimento: 14ºC
Determinar:
1) a temperatura de condensação
2) a temperatura de evaporação
3) a potência mínima necessária para operar esse ciclo
4) a capacidade de refrigeração em TR
5) o COP
6) o EER
Resolver o problema utilizando os seguintes refrigerantes:
a) R22
b) R12
c) amônia
d) R134a
84
Estado
1
2
3
4
4'
R22
T(ºC)
P(Kpa)
h(KJ/Kg)
s(KJ/KgK)
Vazão
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
18,91
883
67,75
2,48
-25,43
198
67,75
hiso
14,00
198
265,50
1,0660
0,8
87,00
883
309,60
1,0660
101,00
883
320,63
1,10
T(ºC)
36,63
-12,79
14,00
72,14
82,43
P(Kpa)
883
198
198
883
883
R12
h(KJ/Kg)
71,18
71,18
198,60
228,50
235,98
Estado
1
2
3
4
4'
T(ºC)
20,92
-19,00
14,00
129,40
154,40
P(Kpa)
883
198
198
883
883
Amônia
h(KJ/Kg)
278,60
278,60
1496,00
1739,00
1799,75
Estado
1
2
3
4
4'
T(ºC)
34,84
-10,30
14,00
63,00
71,50
P(Kpa)
883
198
198
883
883
R134a
h(KJ/Kg)
98,55
98,55
262,50
297,20
305,88
Estado
1
2
3
4
4'
R22
R12
amônia
R134a
s(KJ/KgK)
0,7644
0,7644
0,7858
s(KJ/KgK)
5,883
5,883
6,03
s(KJ/KgK)
1,003
1,003
1,028
1
2
3
4
5
6
Resultados
18,91
-25,43
136,71 KW
490,42 KW
3,59
0,98
KW/TR
Vazão
2,48
hiso
0,8
1
2
3
4
5
6
Resultados
36,63
-12,79
92,69
KW
316,00 KW
3,41
1,03
KW/TR
Vazão
2,48
hiso
0,8
1
2
3
4
5
6
Resultados
20,92
-19
753,3
KW
3019,15 KW
4,01
0,88
KW/TR
Vazão
2,48
hiso
0,8
1
2
3
4
5
6
Resultados
34,84
-10,3
107,57 KW
406,60 KW
3,78
0,93
KW/TR
Resultado geral
Tevap(ºC) Tcond.(ºC) Wcomp.(KW) Qevap.(TR) EER(KW/TR) COP
-25,43
18,91
136,71
139,32
0,98
3,59
-12,79
-19
-10,3
36,63
20,92
34,84
92,69
753,30
107,57
89,77
857,71
115,51
1,03
0,88
0,93
85
3,41
4,01
3,78
139,32 TR
89,77 TR
857,71 TR
115,51 TR
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
3.9 DIMENSIONAMENTO DE TUBULAÇÃO EM REFRIGERAÇÃO
Em sistemas de refrigeração também temos o estudo da mecânica dos fluidos
onde podemos determinar os diâmetros adequados das tubulações utilizadas nos
equipamentos. O objetivo nesse caso é dimensionar corretamente a linhas de sucção, a
linha de líquido e a linha de descarga como indica a figura 3.21. Para isso é preciso
determinar as perdas de carga em cada linha como também a diminuição de
temperatura máxima permitida em cada uma.
86
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Figura 3.21 Sistema de refrigeração comercial de um estágio
Figura 3.22 Circuito comercial com controles
87
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
LINHAS DE SUCÇÃO
Nas linhas de sucção que transporta basicamente vapor refrigerante do
evaporador para o compressor, deve-se ter uma velocidade relativamente alta para
conduzir o óleo de volta para o compressor, ao mesmo tempo a queda de pressão deve
ser mínima para evitar quedas de capacidade e aumento de potência do compressor.
As linhas de sucção são dimensionadas de forma que a perda de carga total não
exceda o equivalente a 2,2ºC de queda da temperatura de saturação para fluidos
halogenados e 1,1ºC para a amônia. A velocidade máxima recomendada é de 16m/s.
LINHAS DE LÍQUIDO
É a linha que transporta o refrigerante do compressor até o evaporador. A queda
de pressão nesse caso deve fazer variar no máximo 1,1ºC a temperatura na linha. A
boa prática também recomenda uma velocidade abaixo de 1,5m/s devido a golpes de
líquido, vibração e ruídos resultantes da ação das válvulas solenóides ou outras
válvulas de ação rápida.
LINHAS DE DESCARGA DE GÁS
A queda de pressão nessa linha aumenta a taxa de compressão e
conseqüentemente a potência necessária para acionar o compressor, esse aumento faz
com que a eficiência volumétrica diminua causando uma redução da capacidade do
compressor. Recomenda-se assim, que as linhas de descarga podem ser
dimensionadas para uma queda de pressão tal que a redução de temperatura
equivalente não seja superior a 1,1ºC. a velocidade máxima recomendada é de 16m/s
baseadas em considerações de ruídos.
Para se determinar o diâmetro das tubulações, é necessário determinar a vazão
volumétrica de refrigerante em cada uma das linhas do sistema. Esta vazão é
determinada a partir do volume específico do fluido refrigerante em cada uma das
linhas e da vazão mássica. O volume específico nas linhas de sucção e de líquido
pode ser determinado através das tabelas de propriedades dos fluidos refrigerantes,
porém o volume específico na descarga do compressor depende do tipo do
compressor e da sua eficiência. Em geral, este volume específico pode ser estimado
pela seguinte equação:
Vdesc = Vsuc (Psuc / Pdesc) . 1,2
3.31
88
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
3.10 SISTEMAS MULTIPRESSÃO
Sistemas multipressão auxiliam na diminuição do consumo de energia, indicados em
situações onde a temperatura de evaporação é muito baixa ( inferior a -20ºC) ou em
situações onde existem temperaturas de evaporação diferentes como por exemplo um
supermercado que apresenta câmaras de resfriados e congelados. A pressão intermediária
que é a pressão entre os dois estágios de compressão é dada por:
Pint. = Paspiração.Pdescarga
3.32
Exemplo
Considere um sistema de refrigeração que funcione com o refrigerante amônia como
indica o diagrama abaixo, cuja capacidade de refrigeração do evaporador seja de 250W a 25ºC. o sistema utiliza compressão de dois estágios com resfriador intermediário (flash). A
temperatura de condensação é de 35ºC. Determine a potência requerida pelos dois
compressores utilizados nesse sistema.
Estado
1
2
3
4
5
6
7
8
T ºC
-25
------35
-------
PKPa
152
453
453
1352
1352
453
453
152
h kJ/Kg
468
580
500
650
-595
-595
-755
-755
s kJ/KgK
0
Pressão intermediária:
Pint. = 1352 .152
x
1
--1
--0
= 453 KPa
89
Situação
Vapor saturado
Vapor superaquecido
Vapor saturado
Vapor superaquecido
Líquido saturado
Líquido-vapor
Líquido saturado
Líquido-vapor
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Diagrama Px h
Cálculo da vazão mássica do compressor de baixa
Qevap. = m1 ( h1 – h8 )
250 = m1 (468 +755)
m1 = 0,20 Kg/s
Balanço de energia no “flash”:
m1h2 + m2h6 = m1h7 + m2h6 = 0,20.580 + m2 (-595) = 0,20(-755) + m2.500
m2 = 0,24Kg/s
Cálculo da potência do compressor 1
W1 = m1 (h2 – h1 ) = 0,20. (580 – 468) = 22,85 KW
Cálculo da potência do compressor 2
W2 = m2 (h4 – h3 ) = 0,24. (650 – 500) = 37,35 KW
Potência total = W1+ W2 = 22,85 + 37,35 = 60,2 KW
Exemplo 2
Compare o exemplo anterior caso fosse utilizado compressão de um estágio.
Estado
1
2
3
4
T ºC P KPa
35
1352
-25
152
-25
152
135 1352
h kJ/Kg
346,8
346,8
1411
1742
s kJ/KgK
1,278
1,403
5,691
5,691
90
x
0
0,20
1
Situação
Líquido saturado
Líquido-vapor
Vapor saturado
Vapor
superaquecido
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Diagrama Pxh
Qevap. = m ( h3 – h2 )
250 = m ( 1411 – 346,8)
m = 0,23
W = m (h4 – h3 ) = 0,23. (1742 – 1411) = 76 KW
3.10 CICLO DE REFRIGERAÇÃO POR ABSORÇÃO
A figura 3.23 diferencia o ciclo de refrigeração por compressão de vapor e o ciclo de
refrigeração por absorção. A finalidade nos dois ciclos é a mesma, que é a retirada de
calor de um compartimento fechado. A diferença básica está em que, na refrigeração por
compressão utiliza-se um compressor para a circulação do fluido refrigerante e na
refrigeração por absorção utilizam-se para o mesmo fim, o absorvedor(A), o gerador(G), o
retificador(R), o condensador de refluxo(CR) e a bomba(B) da mistura líquida, para a
circulação do par refrigerante. Ao invés de se comprimir mecanicamente o vapor entre o
evaporador e o condensador, o refrigerante de um sistema de absorção é absorvido por
uma substância secundária, chamada absorvente, de modo a formar uma solução líquida.
Essa solução líquida é em seguida, bombeada para uma pressão mais elevada no gerador,
onde o vapor é liberado pela solução por fornecimento de calor. Como o volume
específico médio da solução líquida é muito menor que o do vapor do refrigerante, uma
quantidade bem menor de trabalho é requerida no bombeamento em comparação ao
sistema de compressão de vapor. Desta forma, o consumo de energia elétrica dos sistemas
91
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
de absorção é bem inferior ao dos sistemas de compressão de mesmo porte, substituído
por fornecimento de calor a temperaturas não necessariamente elevadas.
Figura 3.23 Ciclo por compressão de vapor e absorção água-amônia
Um sistema de absorção utiliza vários pares de refrigerante absorvente, sendo os mais
utilizados a amônia-água, água-brometo de lítio. Em sistemas de água-amônia, o fluído
refrigerante é a amônia e o absorvente a água. O ciclo básico de absorção se inicia com o
vapor de amônia a baixa pressão vindo do evaporador que vai para o absorvedor onde é
absorvido por uma solução com baixa concentração de refrigerante denominada de solução
pobre criando uma solução de alta concentração de refrigerante denominada de solução rica.
A solução rica é bombeada para o gerador onde ocorre à separação entre a solução pobre e a
solução rica em alta pressão. A solução pobre retorna ao absorvedor sendo a pressão
diminuída através de uma válvula redutora de pressão. O vapor de amônia a alta pressão vai
para o condensador onde se liquefaz cedendo calor para o ambiente, seguindo para o
evaporador após ter sua pressão reduzida através de uma válvula de expansão(Ve). No
evaporador o fluido refrigerante troca calor com o meio indo novamente para o absorvedor.
Nos sistemas contendo água-amônia, a água absorvente possui grande afinidade com o
vapor de amônia e os dois são conjuntamente solúveis. Como o absorvente é muito volátil o
vapor de amônia que sai do gerador, carrega uma quantidade de vapor de água que acaba
indo para o evaporador diminuindo assim o efeito refrigerante. Para evitar esse problema, o
ciclo incorpora os componentes condensador de refluxo(CR) e o retificador(R).
92
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Já na figura 3.24 o modelo ganha mais dois recuperadores de calor. Como a amônia
líquida sai do condensador a uma temperatura elevada ela é agora introduzida no primeiro
recuperador (T1) antes da válvula de expansão em contracorrente ao vapor de amônia em
baixa temperatura proporcionando que o fluido refrigerante chegue mais frio ao evaporador.
O segundo recuperador (T2) pré-aquece a solução rica que vai do condensador ao gerador,
pré-resfriando a solução pobre que vai em sentido inverso.
Figura 3.24 Ciclo água-amônia com dois recuperadores de calor
EXERCÍCIOS RESOLVIDOS DO CAPÍTULO
1) Refrigerante R22 é admitido no compressor a -5ºC, 3,5 bar e é comprimido adiabaticamente
até 75ºC, 14 bar. Do compressor, o refrigerante passa através do condensador onde é
condensado a líquido a 28ºC, 14 bar. O refrigerante então é expandido através de uma válvula
de expansão até 3,5 bar. Ar de retorno da residência é admitido no condensador a 20ºC, 1bar, a
uma vazão volumétrica de 0,42m3/s e é descarregado a 50ºC com uma perda de carga
desprezível. Utilizando o modelo de gás ideal para o ar e desprezando efeitos de energia
cinética e potencial, determine as taxas de geração de entropia para volumes de controle
envolvendo o condensador, o compressor e a válvula de expansão.
93
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Uma tabela pode ser elaborada com os seguintes dados
Estado
1
2
3
4
T ºC
28
-5
-5
75
P bar
14
3,5
3,5
14
h kJ/Kg
79,05
79,05
249,75
294
s kJ/KgK
0,2936
0,3078
0,9572
0,9822
x
0
0,216
1
Situação
Líquido saturado
Líquido vapor
Vapor saturado
Vapor
superaquecido
h2 = hf + x2h
79,05 = 33,09 + x2 ( 212,91)
x2 = 0,216
s2’ = sf + x2s
s2’ = 0,1328 + 0,216 (0,9431 – 0,1328) = 0,3078
Condensador
pelo balanço de entropia temos:
0 = Q/T + me se - ms ss +
0 = me se - ms ss +
0 = mcond (s4- s1) + mar (s5- s6) +
Adotando cpar = 1,005 KJ/Kg.K podemos encontrar a vazão mássica de ar
mar = v/ var
Pv = RgásT
var = Rar T/ P
var = 287 J/Kg K . 293K
105 N/m2
var = 0,84091 m3/Kg
94
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
mar = v/ var
mar = 0,42 m3/s / 0,84091 m3/Kg = 0,5Kg/s
a vazão mássica do refrigerante(mr) é determinada através de um balanço de energia para
o volume de controle envolvendo o condensador, de forma a obter:
meh - msh = 0
(mr h4 + mar h5) - (mr h1 + mar h6) = 0
mr( h4- h1 ) + mar( h6 - h5) = 0
mr = mar( h6 - h5) / ( h4- h1 )
h6 - h5 = cpar(T6 - T5) = 1,005 ( 323 – 293 ) = 30,15 KJ/Kg
mr = 0,5 . 30,15 / (294 – 79,05) = 0,07Kg/s
A variação da entropia específica do ar pode ser determinada por:
s6 - s5 = cpar ln T6 / T5 - Rln P5/ P6
s6 - s5 = 1,005 ln 323/293 – 0 = 0,098 KJ/Kg.K
Assim, a entropia gerada no condensador fica:
= mar (s6- s5) + mr (s1- s4)
= 0,5.0,098 + 0,07.( 0,2936 - 0,9822) = 7,98x10-4 KW/K
Compressor
0 = mr (s3- s4) +
= mr (s4- s3)
= 0,07.( 0,9822 - 0,9572) = 17,5x10-4 KW/K
Válvula
0 = mr (s1- s2) +
= mr (s2- s1)
= 0,07.( 0,3078 - 0,2936) = 9,94x10-4 KW/K
2) Para o problema anterior, determine a potência, a eficiência isoentrópica, e a eficiência
exergética do compressor.
95
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Wvc = mr ( h3 – h4) = 0,07.( 249,75 - 294) = -3,1KW
E a eficiência isoentrópica fica:
= trabalho ideal/ trabalho real = ( h4s – h3)/ ( h4 – h3)
mas s4s = s3 = 0,9572 KJ/Kg.K
Através das tabelas de vapor superaquecido para o R22 com e 14bar e s4s = 0,9572 KJ/Kg.K
encontramos:
h4s = 285,58 KJ/Kg, substituindo valores,
= ( h4s – h3)/ ( h4 – h3) = (285,58 – 249,75)/( 294 – 249,75) = 0,81 = 81%
A eficiência exergética é:
= efs - efe / trabalho real = efs – efe /( h4 – h3)
para o ambiente consideramos T0= 273K (0ºC)
efs - efe = hs – he – T0( ss – se ) + (Vs2/2 - Ve2/2) + g(zs -ze ) desprezando-se a energia potencial
e cinética obtemos:
efs - efe = 294 –249,75 – 273(0,9822 – 0,9572 ) = 37,425 KJ/Kg
= 37,425 / (294 -249,75) = 0,845 = 84,5%
3) Determine os custos diários de destruição de exergia do problema anterior. Considere T0 =
273K e o custo de exergia de R$0,2872 por KWh considere também que o equipamento
trabalhe durante 8 horas por dia.
As taxas de destruição de exergia podem ser determinadas por:
Ed = T0
Edcomp. = 273. 17,5x10-4 = 0,478KW
Edvál.= 273. 9,94x10-4 = 0,271KW
Edcond. = 273. 7,95x10-4 = 0,217KW
Os custos de destruição de exergia são respectivamente:
Custos do compressor = 0,478 . 0,2872 . 8 = R$1,098
Custos do condensador = 0,217 . 0,2872 . 8 = R$0,5
96
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Custos da válvula = 0,271 . 0,2872 . 8 = R$0,62
O custo diário de energia elétrica do compressor é:
Custo diário = 3,1KW. 0,2872 = R$7,12
Como o compressor possui perdas com custo diário de R$1,098 avaliando mensalmente
teríamos: R$32,94
4) Considere um sistema frigorífico operando com R22 com capacidade de 352KW,
temperatura de evaporação de -5ºC e de condensação de 40ºC. A linha de sucção tem
um comprimento de 25m e é dotada de duas válvulas angulares, uma válvula de
retenção e três cotovelos. A linha de descarga tem um comprimento de 30m, sendo
dotada de uma válvula globo, uma válvula de retenção e três cotovelos. A linha de
líquido tem um comprimento de 55m, duas válvulas angulares e três cotovelos.
Determine o diâmetro ideal dessas tubulações.
Da tabela A27, tem –se m = 0,00636 Kg/s.KW ou m = 2,24Kg/s
Dos diagramas de propriedades temos:
vsuc = 0,05534 m3/Kg
vliq = 0,000884 m3/Kg
Pdesc = 1534 Kpa
Psuc = 422 Kpa
Vazão volumétrica na sucção = 2,24Kg/s . 0,05534 m3/Kg = 0,124 m3 /s
Vazão volumétrica na linha de líquido = 2,24Kg/s . 0,000884 m3/Kg = 0,00198 m3 /s
Vazão volumétrica na linha de descarga:
Vdesc = 0,124. (422/1534). 1,2 = 0,0409 m3 /s
Linha de sucção: admitindo-se inicialmente um diâmetro de 105mm, tem-se:
Comprimento:
2 válvulas angulares:
1 válvula retenção:
3 cotovelos(90º):
total:
25m
2x14,8m
1x12,6m
3x2,2m
73,8m
Da tabela A19 tem-se: capacidade = 527,8KW , T = 0,04K/m, P = 572Pa/m
Cálculo da queda de temperatura:
T = 0,04. 73,8/1,0 (352/527,8)1,85 = 1,4ºC (< 2,2ºC )
Cálculo da queda de pressão:
P =572. 73,8/1,0 (352/527,8) = 28,1KPa
Da tabela A22, a capacidade mínima requerida para ocorrer transporte adequado
do óleo é de 115,24 KW. Como T =1,4ºC calculado é menor que o máximo
97
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
recomendado (2,2ºC), e a capacidade é maior que a mínima requerida, o diâmetro
adotado pode ser utilizado.
Verificação da velocidade:
V = A. v
v = V/A = 0,124 m3 /s / 0,00865m2 = 14,33m/s como a velocidade recomendada é de
16m/s então o valor encontrado está dentro da especificação.
Linha de descarga: admitindo-se inicialmente um diâmetro de 80mm, tem-se:
Comprimento:
1 válvula globo:
1 válvula retenção:
3 cotovelos(90º):
total:
30m
1x 26m
1x 9,1m
3x 2,3 m
72m
Da tabela A19 tem-se: capacidade = 476,3KW , T = 0,02K/m, P = 749Pa/m
Cálculo da queda de temperatura:
T = 0,02. 72/1,0 (352/476,3)1,85 =0,82ºC (< 1,1ºC )
Cálculo da queda de pressão:
P =749. 72 /1,0 (352 / 476,3) = 39,8KPa
Da tabela A24, a capacidade mínima requerida para ocorrer transporte adequado
do óleo é de 88,73KW. Como T= 0,82ºC calculado é menor que o máximo
recomendado (1,1ºC), e a capacidade é maior que a mínima requerida, o diâmetro
adotado pode ser utilizado.
Verificação da velocidade:
V = A. v
v = V/A = 0,0409m3 /s / 0,005024 m2 = 8,14 m/s como a velocidade recomendada é
de 16m/s então o valor encontrado está dentro da especificação.
Linha de líquido: admitindo-se inicialmente um diâmetro de 54mm, tem-se:
Comprimento:
2 válvulas angulares:
3 cotovelos(90º):
total:
55m
2x7,7m
3x1,6m
75,2m
98
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Da tabela A19 tem-se: capacidade = 794,2KW , T = 0,02K/m, P = 749Pa/m
Cálculo da queda de temperatura:
T = 0,02. 75,2/1,0 (352/794,2)1,85 =0,33ºC (< 1,1ºC )
Cálculo da queda de pressão:
P =749. 75,2 /1,0 (352 / 794,2) = 24,9 KPa
Como T= 0,33ºC calculado é menor que o máximo recomendado (1,1ºC), o
diâmetro adotado pode ser utilizado.
Verificação da velocidade:
V = A. v
v = V/A = 0,000198m3 /s / 0,002289 m2 = 0,086m/s como a velocidade recomendada
é de 1,5m/s então o valor encontrado está dentro da especificação.
99
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
EXERCÍCIOS COMPLEMENTARES
1)Um ciclo de potência como indica a figura, possui uma vazão de vapor d’água de
25Kg/s, considerando que os diâmetros dos tubos de entrada e saída da turbina são
respectivamente 200m e 150mm, determinar:
a) a potência gerada na turbina;
b) a taxa de calor no condensador;
c) a taxa de calor na caldeira;
d) as velocidades na entrada e saída da turbina.
Ponto
Pressão (MPa)
Temperatura (ºC)
1
5,5
490
2
0,01
3
0,009
40
4
4
40
2) Considere um ciclo ideal de refrigeração que apresenta temperatura no condensador e no
evaporador, respectivamente, iguais a 45ºC e -15ºC. Determine o COP para ciclos que utilizam
R-12 e amônia como fluido de trabalho. R. 3,06 e 3,22
3) Um ciclo de refrigeração por compressão, utilizando R22, desenvolve 50KW de refrigeração,
operando a uma temperatura de condensação de 36ºC e uma temperatura de evaporação de 10ºC. Determine:
a) a vazão de refrigerante em, Kg/s R. 0,32Kg/s
b) o efeito de refrigeração, em KJ/Kg R. 156,86KJ/Kg
c) a potência do compressor em KW R. 11KW
d) o COP R. 4,5
4) Um ciclo de refrigeração por compressão de vapor ideal opera usando refrigerante 134ª como
fluido de trabalho. O vapor saturado entra no compressor a -12ºC e o líquido saturado deixa o
condensador a 28ºC e a vazão em massa é de 5Kg/min. Determine:
a) a potência do compressor, em KW R. 1,98KW
b) a capacidade frigorífica, em TR R. 3,5TR
c) o coeficiente de desempenho R. 6,3
100
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
5) A figura apresenta um ciclo de Carnot cuja potência produzida é de 11038,5KW
s2 = s1
s4 = s3
Calcule:
a) A vazão de vapor em Kg/s R. 15,86Kg/s
b) A potência de compressão utilizada pela bomba. R. 1541,5Kw
c) O fluxo de calor trocado na caldeira. R. 31961KW
d) O calor transmitido pelo condensador. R. 22464KW
e) O rendimento térmico do ciclo. R. 29,7%
6) Verifique se os resultados obtidos no problema anterior estão de acordo:
a) com a 1º Lei da termodinâmica;
b) com a 2º Lei da termodinâmica.
7) Em uma máquina cíclica, o vapor se forma a pressão de 10bar e se condensa a 0,1bar.
De acordo com os dados abaixo verificar:
a) se a máquina é irreversível.
b) Em que parte do ciclo se processa a irreversibilidade?
c) Qual a quantidade de calor perdida por causa da irreversibilidade?
d) Qual a potência perdida por causa da irreversibilidade?
101
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
BIBLIOGRAFIA
•
•
•
•
•
•
Sonntag.R.E & Borgnakke.C Introdução à Termodinâmica para Engenharia, LTC Editora,
2003.
Schmidt. F. W, Henderson. R. E & Wolgemuth. C.H Introdução as Ciências Térmicas.
Editora Edgar Blucher Ltda, 1996.
Moran.M.J & Shapiro.H.N Princípios de termodinâmica para Engenharia. LTC Editora,
2003.
Kuehn, T.H., Ramsey, J.W, Threlkeld, J.L. Thermal Environmental Engineering.
3.ed. In: Absorption Refrigeration , 1999, cap. 5, pp. 114-150.
Dossat, R.J., Princípios de refrigeração. In: princípios de refrigeração por absorção,
1980, cap. 20, pp. 717-752.
Anderson, E.P., Palmquist, R.E. Refrigeration: Home and Commercial. 4.ed. In:
Absorption Refrigeration, 1994, cap. 26, pp. 559-577.
102
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
APÊNDICE
A1 TRABALHANDO COM TABELAS DAS PROPRIEDADES TEMODINÂMICAS
Existem três tipos de tabelas: a primeira é para as propriedades do líquido
comprimido(sub-resfriado), a Segunda para as propriedades da mistura líquido e vapor e a
terceira para o vapor superaquecido. Como a pressão e a temperatura na região de mistura são
dependentes, é comum o uso de duas tabelas para a região de mistura, uma contendo a
temperatura e outra contendo a pressão como dado de entrada. Na região de líquido
comprimido, pressão e temperatura são independentes e definem o estado termodinâmico. A
prática mostra que as propriedades do líquido comprimido são muito próximas das propriedades
do líquido saturado na mesma temperatura.
A2 INTERPOLAÇÃO LINEAR SIMPLES
Há situações em que os dados das tabelas não contém valores numéricos que as vezes
necessitamos.Vamos supor que seja necessário conhecer o volume específico da água a 198ºC
com título de 50%. Como na informação aparece o título, a conclusão é que estamos lidando
com mistura de líquido vapor. Consultando uma tabela como indicada abaixo, notamos que
temos informações na temperatura de 195 e 200ºC, assim, devemos proceder à uma
interpolação linear simples.
Nesse caso, determinaremos os valores da pressão, o volume específico do líquido
saturado e vapor saturado a 198ºC montando a seguinte tabela:
Da interpolação linear temos
Com isso, podemos obter os resultados
103
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A3 INTERPOLAÇÃO LINEAR DUPLA
Nesse caso é necessário realizarmos duas interpolações simples. Vamos supor que seja
necessário conhecer o volume específico do vapor superaquecido a 190ºC e pressão de 35 kPa.
Consultando a tabela obtemos
Ou seja, sem informações a 190ºC e nem a 35 kPa. Se estivéssemos a 10 kPa e depois a 50
kPa, as informações para a temperatura de 190ºC seriam
E pela interpolação simples obteríamos
O valor de z para essa interpolação é de v = 10,675 m 3/Kg. Valores mais exatos poderiam ser
obtidos através de um programa de computador.
104
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A4 Propriedades da água saturada (líquido-vapor) tabela de temperatura
Volume específico m3/Kg
Energia int.KJ/Kg
Entapia KJ/Kg
Entropia KJ/KgK
líq. Sat.
vap. Sat.
líq. Sat.
vap. Sat. líq. Sat.
Evap.
vap. Sat. líq. Sat.
vap. Sat.
Temp. Pressão
ºC
bar
4 0,00813
6 0,00935
8 0,01072
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
38
40
45
50
55
60
65
70
75
80
0,0123
0,0131
0,014
0,015
0,016
0,0171
0,0182
0,0194
0,0206
0,022
0,0234
0,0249
0,0265
0,0282
0,0299
0,0317
0,0336
0,0357
0,0378
0,0401
0,0425
0,045
0,0476
0,0503
0,0532
0,0563
0,0595
0,0663
0,0738
0,0959
0,1235
0,1576
0,1994
0,2503
0,3119
0,3858
0,4739
vf x103
vg
uf
ug
hf
hfg
hg
sf
sg
1,0001
1,0001
1,0002
1,0004
1,0004
1,0005
1,0007
1,0008
1,0009
1,0011
1,0012
1,0014
1,0016
1,0018
1,002
1,0022
1,0024
1,0027
1,0029
1,0032
1,0035
1,0037
1,004
1,0043
1,0046
1,005
1,0053
1,0056
1,006
1,0063
1,0071
1,0078
1,0099
1,0121
1,0146
1,0172
1,0199
1,0228
1,0259
1,0291
157,232
137,734
120,917
106,379
99,857
93,784
88,124
82,848
77,926
73,333
69,044
65,038
61,293
57,791
54,514
51,447
48,574
45,833
43,36
40,994
38,774
36,69
34,733
32,894
31,165
29,54
28,011
26,571
25,216
36,94
21,602
19,523
15,258
12,032
9,568
7,671
6,197
5,042
4,131
3,407
16,77
25,19
33,59
42
46,2
50,41
54,6
58,79
62,99
67,18
71,38
75,57
79,76
83,95
88,14
92,32
96,51
100,7
104,88
109,06
113,25
117,42
121,6
125,78
129,96
134,14
138,32
142,5
146,67
150,85
159,2
167,56
188,44
209,32
230,21
251,11
272,02
292,95
313,9
334,86
2380,9
2383,6
2386,4
2389,2
2390,5
2391,9
2393,3
2394,7
2396,1
2397,4
2398,8
2400,2
2401,6
2402,9
2404,3
2405,7
2407
2408,4
2409,8
2411,1
2412,5
2413,9
2415,2
2416,6
2418
2419,3
2420,7
2422
2423,4
2424,7
2427,4
2430,1
2436,8
2443,5
2450,1
2456,6
2463,1
2469,6
2475,9
2482,2
16,78
25,2
33,6
42,01
46,2
50,41
54,6
58,8
62,99
67,19
71,38
75,58
79,77
83,96
88,14
92,33
96,52
100,7
104,89
109,07
113,25
117,43
121,61
125,79
129,97
134,15
138,33
142,5
146,68
150,86
159,21
167,57
188,45
209,33
230,23
251,13
272,06
292,98
313,93
334,91
2491,9
2487,2
2482,5
2477,7
2475,4
2473
2470,7
2468,3
2465,9
2463,6
2461,2
2458,8
2456,5
2454,1
2451,8
2449,4
2447
2444,7
2442,3
2439,9
2437,6
2435,2
2432,8
2430,5
2428,1
2425,7
2423,4
2421
2418,6
2416,2
2411,5
2406,7
2394,8
2382,7
2370,7
2358,5
2346,2
2333,8
2312,4
2308,8
2508,7
2512,4
2516,1
2519,8
2521,6
2523,4
2525,3
2527,1
2528,9
2530,8
2532,6
2534,4
2536,2
2538,1
2539,9
2541,7
2543,5
2545,4
2547,2
2549
2550,8
2552,6
2554,5
2556,3
2558,1
2559,9
2561,7
2563,5
2565,3
2567,1
2570,7
2574,3
2583,2
2592,1
2600,9
2609,6
2618,3
2626,8
2635,3
2643,7
0,061
0,0912
0,1212
0,151
0,1658
0,1806
0,1953
0,2099
0,2245
0,239
0,2535
0,2679
0,2823
0,2966
0,3109
0,3251
0,3393
0,3531
0,3674
0,3814
0,3954
0,4093
0,4231
0,4369
0,4507
0,4644
0,4781
0,4917
0,5053
0,5188
0,5458
0,5725
0,6387
0,7038
0,7679
0,8312
0,8935
0,9549
1,0155
1,0753
9,0514
9,0003
8,9501
8,9008
8,8765
8,8524
8,8285
8,8048
8,7814
8,7582
8,7351
8,7123
8,6897
8,6672
8,645
8,6229
8,6011
8,5794
8,558
8,5367
8,5156
8,4946
8,4739
8,4533
8,4329
8,4127
8,3927
8,3728
8,3531
8,3336
8,295
8,257
8,1648
8,0763
7,9913
7,9096
7,831
7,7553
7,6824
7,6122
105
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Continuação
Volume específico m3/Kg
líq. Sat.
vap. Sat.
Energia int.KJ/Kg
líq. Sat.
vap. Sat.
líq. Sat.
Entapia KJ/Kg
Entropia KJ/KgK
Evap.
vap. Sat. líq. Sat.
vap. Sat.
Temp.
ºC
Pressão
bar
vf x103
vg
uf
ug
hf
hfg
hg
sf
sg
85
90
95
100
110
120
130
140
150
160
170
180
190
200
0,5783
0,7014
0,8455
1,014
1,433
1,985
2,701
3,613
4,758
6,178
7,917
10,02
12,54
15,54
1,0325
1,0361
1,0397
1,0435
1,0516
1,0603
1,0697
1,0797
1,0905
1,102
1,1143
1,1274
1,1414
1,1565
2,828
2,361
1,982
1,673
1,211
0,8919
0,6685
0,5089
0,3928
0,3071
0,2428
0,1941
0,1565
0,1274
355,84
376,85
397,88
418,94
461,14
503,5
546,02
588,74
631,68
674,86
718,33
762,09
806,19
850,65
2488,2
2494,5
2500,6
2506,5
2518,1
2529,3
2539,9
2550
2559,5
2568,4
2576,5
2583,7
2590
2593,3
355,9
376,92
397,96
419,04
461,3
503,71
546,31
589,13
632,2
675,55
719,21
763,22
807,62
852,45
2296
2283,2
2270,2
2257
2230,2
2202,6
2174,2
2144,7
2114,3
2082,6
2049,5
2015
1978,8
1940,7
2651,9
2660,1
2668,1
2676,1
2691,5
2706,3
2720,5
2733,9
2746,5
2758,1
2768,7
2778,2
2786,4
2793,2
1,1343
1,1925
1,25
1,3069
1,4185
1,5276
1,6344
1,7391
1,8418
1,9427
2,0419
2,1396
2,2359
2,3309
7,5445
7,4791
7,4159
7,3549
7,2387
7,1296
7,0269
6,9299
6,8379
6,7502
6,6663
6,5857
6,5079
6,4323
106
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A5 Propriedades da água saturada (líquido-vapor) tabela de pressão
3
Volume específ. m /Kg
líq. Sat.
vap. Sat.
Pressão
Temp.
bar
0,04
0,06
0,08
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1
1,5
2
2,5
3
4
5
6
7
8
9
10
15
20
25
30
35
40
45
50
60
70
80
90
100
110
120
130
140
150
160
170
ºC
28,96
36,16
41,5
45,81
60
69
75,8
81,3
85,9
89,95
93,5
96,7
99,63
111
120
127
133,6
143,6
152
159
165
170
175,4
180
198
212
224
234
243
250
257,5
264
275,6
285,7
295
303
311
318
325
331
337
342
347,5
352,5
vf x10-3
1,004
1,0064
1,0084
1,0102
1,0172
1,0223
1,0265
1,03
1,0331
1,036
1,038
1,041
1,0432
1,0528
1,0605
1,0647
1,0732
1,0836
1,0629
1,1006
1,108
1,1148
1,1212
1,1273
1,1539
1,1767
1,1973
1,2165
1,2347
1,2522
1,2692
1,2859
1,3187
1,3513
1,3842
1,4178
1,4524
1,4886
1,5267
1,5671
1,6107
1,6581
1,7107
1,7702
vg
34,8001
23,739
18,103
14,674
7,649
5,229
3,993
3,24
2,732
2,365
2,087
1,869
1,694
1,159
0,8857
0,7187
0,6058
0,4625
0,3749
0,3157
0,2729
0,2409
0,2152
0,1944
0,1318
0,09963
0,07998
0,06668
0,05707
0,04978
0,04406
0,03944
0,03245
0,02737
0,02352
0,02048
0,01803
0,01599
0,01426
0,01278
0,01149
0,01034
0,009305
0,008365
Energia int.KJ/Kg
líq. Sat.
vap. Sat.
uf
121,45
151,53
173,87
191,82
251,38
289,21
317,53
340,44
359,79
376,63
391,58
405,06
417,36
466,94
504,49
535,1
561,15
604,31
639,68
670
696,5
720
741,85
761,68
843,19
906,45
959
1004,8
1045
1082
1116
1148
1205,5
1257,6
1305,6
1350,5
1393
1433,7
1473
1511
1548,6
1585,5
1622,7
1660
107
ug
2415
2425
2432
2438
2456,6
2468,5
2477
2484
2489,5
2494,5
2498
2502
2506
2519,7
2529,5
2537
2543,5
2553,6
2561
2567,4
2572,5
2576,8
2580,5
2583,6
2594,5
2600
2603
2604
2603,7
2602
2600
2597
2589,7
2580,5
2569,8
2557,8
2544,5
2529,8
2513,7
2496,1
2476,8
2455,5
2431,7
2405
Entapia KJ/Kg
Entropia KJ/KgK
líq. Sat.
Evap.
vap. Sat. líq. Sat. vap. Sat.
hf
121,45
151,53
173,88
191,83
251,45
289,23
317,58
340,51
359,86
376,71
391,66
405,15
417,46
467,11
504,71
535,37
561,47
604,75
640,23
670,56
997,22
721,11
742,83
762,81
844,84
908,79
962,11
1008,4
1049,8
1087,3
1121,9
1154
1213
1267
1316,6
1363,4
1407,6
1450
1491,5
1531,5
1571
1610,5
1650
1690
hfg
2433
2416
2403
2393
2358
2336
2319
2305,5
2293,6
2283,4
2274
2266
2258
2226,5
2202
2181,5
2164
2134
2108,5
2086
2066
2048
2031
2015
1947
1890,7
1841
1795,7
1754
1714
1676,5
1640
1571
1505
1441,4
1379
1317
1255,5
1193,6
1130,7
1066,5
1000
930,6
857
hg
2554,5
2567,4
2577
2584,7
2610
2625
2637
2646
2653,5
2660
2666
2671
2675,5
2693,6
2706,7
2717
2725
2738
2749
2757
2763,5
2769
2774
2778
2792
2799,5
2803
2804
2803
2801
2798
2794
2784
2772
2758
2742
2725
2705,6
2685
2662
2638
2610,5
2580,6
2547
sf
0,4226
0,521
0,5926
0,6493
0,832
0,9439
1,0259
1,0911
1,1453
1,1919
1,2329
1,2695
1,3029
1,4336
1,5301
1,6072
1,6718
1,7766
1,8607
1,9312
1,9922
2,0462
2,0946
2,1387
2,3151
2,4474
2,5547
2,6457
2,7253
2,7964
2,8611
2,9202
3,0264
3,1211
3,2068
3,2858
3,3596
3,4295
3,4962
3,5606
3,6232
3,6848
3,7461
3,8079
sg
8,4746
8,3304
8,2287
8,1502
7,9085
7,7686
7,67
7,5939
7,5321
7,4797
7,4346
7,3949
7,3594
7,2233
7,1271
7,0527
6,9919
6,8959
6,8212
6,7611
6,708
6,6628
6,6226
6,5863
6,4448
6,3409
6,2575
6,1869
6,1253
6,0701
6,0199
5,9734
5,8892
5,8133
5,7432
5,6772
5,6141
5,5527
5,4924
5,4323
5,3717
5,3098
5,2455
5,1777
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A6 Propriedades do vapor d’água superaquecido
T (ºC)
v (m3/Kg)
u(KJ/Kg)
h (KJ/Kg)
s(KJ/KgK)
100
120
160
200
240
280
320
360
400
440
500
1,696
1,793
1,984
2,172
2,359
2,546
2,732
2,917
3,103
2,288
3,564
P = 1,0 bar
2506,7
2537,3
2597,8
2658,1
2,718,5
2,779,6
2841,5
2904,2
2968
3032,6
3131,6
2676
2716,6
2796,2
2875,5
2957,5
3034
3114,6
3196
3278
3361,5
3488
7,3614
7,4668
7,6597
7,8343
7,9949
8,1445
8,2849
8,4175
8,5435
8,6636
8,8342
T (ºC)
v (m3/Kg)
u(KJ/Kg)
h (KJ/Kg)
s(KJ/KgK)
100
120
160
200
240
280
320
360
400
440
500
1,088
1,188
1,317
1,444
1,571
1,695
1,819
1,943
2,067
2,191
2,376
P = 1,5 bar
2521
2533
2595
2656
2717
2778,6
2840,6
2903,5
2967
3032
3131
2692,4
2711,5
2792,7
2873
2953
3033
3113,5
3195
3277
3360,7
3704
7,2123
7,2993
7,4665
7,6433
7,8052
7,9555
8,0964
8,2293
8,3555
8,4757
8,6466
T (ºC)
v (m3/Kg)
u(KJ/Kg)
h (KJ/Kg)
s(KJ/KgK)
100
120
160
200
240
280
320
360
400
440
500
0,493
0,623
0,651
0,716
0,781
0,844
0,907
0,969
1,032
1,094
1,187
P = 3 bar
2453,5
2521,6
2587
2650,7
2713
2775,4
2838
2901,4
2965,5
3030,6
3300,8
2705,6
2752,4
2782,8
2865,5
2947,4
3028,6
3110
3192
3275
3359
3486
6,7455
7,0895
7,1276
7,3115
7,4774
7,6299
7,7722
7,9061
8,033
8,1539
8,3251
108
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
109
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
110
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A7 PROPRIEDADES DA ÁGUA SATURADA
TºC
0
5
10
15
20
25
30
35
40
45
50
55
60
65
70
75
80
85
90
95
100
cp KJ/KgºC
4,218
4,203
4,193
4,187
4,182
4,180
4,180
4,179
4,179
4,182
4,182
4,184
4,186
4,187
4,191
4,191
4,195
4,201
4,203
4,120
4,215
Kg/m3
999,8
1000,0
999,8
999,2
998,3
997,1
995,7
994,1
992,3
990,2
998,0
985,7
983,1
980,5
977,7
974,7
971,6
968,4
965,1
961,7
958,1
A8 ENERGIA E TRABALHO
J
Kwh
Kgf.m
Cvh
Kcal
Btu
J
1
3,6x106
9,80665
2,648x106
4.185,8
1.055
Kwh
277,8x10-9
1
2,724x10-6
0,7355
1,163x10-3
293x10-6
Kgf.m
0,101197
367x103
1
270x103
427
107,6
Cvh
377,5x10-9
1,36
3,704x10-6
1
1,581x10-3
398,5x10-6
Kcal
238,8x10-6
859,8
2,342x10-3
632,4
1
0,252
Joule = 1N.m
A9 POTÊNCIA MECÂNICA E TÉRMICA
W
KW
Kgfm/s
Cv
Kcal/h
W
1
103
9,807
7,355x102
1,163
Kw
10-3
1
9,807x10-3
7,355x10-1
1,163x10-3
Kgfm/s
1,02x10-1
1,02x102
1
75
1,186x10-1
Cv
1,36x10-3
1,36
1,333x10-2
1
1,582x10-3
Kcal/h
8,598x10-1
8,598x102
8,432
6,322x102
1
1BTU = 3,927x10-4 CV = 0,2931 W = 0,2162 lb.pé/s = 2,712 Kcal/h
1Kcal/h = 1,162 W
1 KW = 56,92 BTU/min = 4,42x104 lb.pé/min = 14,34 Kcal/min
1W = 3,4123 BTU/h = 1J/s = 0,01433Kcal/min = 44,26 lb.pé/min
111
Btu
948x10-6
3,412
9,294x10-3
2,509
3,968
1
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A10 MEDIDAS LINEARES
mm
m
pol(inch)
pé(foot)
jarda
mm
1
103
25,4
304,8
914,4
m
10-3
1
0,0254
0,3048
0,9144
pol
0,0394
39,4
1
12
36
pé
0,0033
3,28
0,0833
1
3
jarda
0,001094
1,094
0,0278
0,3333
1
A11 MEDIDAS DE SUPERFÍCIE
mm2
cm2
m2
pol2
pé2
mm2
1
102
108
6,452x102
9,290x104
cm2
10-2
1
104
6,452
9,290x102
m2
10-6
10-4
1
6,452x10-4
0,0929
pol2
1,55x10-3
0,155
1,55x103
1
1,44x102
pé2
1,076x10-5
1,076x10-3
10,76
5,944x10-3
1
A12 MEDIDAS DE CAPACIDADE
cm3
m3
litro
pol3
pé3
cm3
1
106
1000
16,39
28,32x103
m3
10-6
1
0,001
16,39x10-6
0,0283
pol3
0,061
61,123
61,02
1
1,728
pé3
0,035x10-3
35,31
0,0353
5,787x10-4
1
A13 MEDIDAS DE PRESSÃO
Pa
Bar
Kg/cm2
atm
mmHg
mm H2O
Pa
Bar
Kg/cm2
atm
mmHg (Torr)
1
105
9,807x104
1,013x105
1,33x102
9,807
10-6
1
9,807x10-1
1,013
1,33x10-3
9,807x10-5
1,02x10-5
1,02
1
1,033
1,36x10-3
103
9,689x10-6
9,689x10-1
9,678x10-1
1
1,316x10-3
9,678x10-5
7,501x10-3
7,501x102
7,356x102
7,6x102
1
7,356x10-2
mmH2O
Kgf/m2
1,02x10-1
1,02x104
104
1,033x104
13,6
1
1Pa = 1N/m2
1Pé de coluna d’água = 62,425 libras por pé quadrado = 0,4335 Psi = 0,0295 atm =0,8826
Pol.Hg
1Psi = 2,307 pés de coluna d’água = 0,0703 Kgf/cm2 = 4,882 Kgf/m2
1Pol de Hg = 345,3 Kgf/m2 = 0,03453 Kgf/cm2 = 70,73 lb/pé = 0,4912 Psi =1,133 pé de coluna
d’água
1atm = 14,7 Psi = 29,92 Pol de Hg a 32ºF = 33,947 pés de água a 62ºF = 101,3 Kpa = 2116,8
lb/pé2
112
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A14 UNIDADES DERIVADAS, NO SI
Área: metro quadrado, m2
Volume: metro cúbico,m3
Ângulo plano: radiano, rad
Ângulo sólido: esterradiano, sr
Freqüência: hertz, Hz
Velocidade: metro por segundo, m/s
Velocidade angular: radiano por segundo, rad/s
Aceleração: metro por segundo, por segundo, m/s2
Aceleração angular: radiano por segundo, por segundo, rad/s2
Massa específica: quilograma por metro cúbico, Kg/m3
Vazão: metro cúbico por segundo, m3/s
Fluxo de massa: quilograma por segundo, Kg/s
Momento de inércia: quilograma.metro quadrado, Kgm2
Momento linear: quilograma.metro por segundo, Kgm/s
Força: Newton,N
Momento de uma força, torque: Newton.metro,Nm
Pressão: pascal, Pa
Viscosidade dinâmica: pascal.segundo, Pás
Trabalho, energia, quantidade de calor: joule,J
Potência, fluxo de energia: watt, W
Densidade de fluxo energético: watt por metro quadrado, W/m2
1N é a força necessária para colocar um corpo de 1 Kg de massa a uma aceleração de 1m/s2
1N = Kgm/ s2
A15 CONSTANTES FÍSICAS
Velocidade da luz no vácuo
Carga elementar
Massa do elétron
Massa do próton
Nº do avogrado
Boltzmann, k
Plank, h
Stefan-boltzmann,
Cte molar dos gases,R
Volume molar do gás ideal CNTP
Gravitacional, G
Permissividade do vácuo
3x108 m/s
1,6x10-19 C
9,11x10-31 Kg
1,67x10-27 Kg
6,02x1023 moléc./mol
1,38x10-23 J/Kmoléc.
6,625x10-34 J.s/molec.
-8
4,87x10 Kcal/m2K,5,67x10-8W/m2K4, 0,1714x10-8
BTU/hpé2 ºR4
8,31 KJ/molK,1,986 BTU/lbmolºR,0,082atm.l/molK
2,24x10-2 m3/mol
6,67x10-11 m3/s2 Kg
8,85x10-12 F/m
113
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A16 ALFABETO GREGO
A
B
∆
E
Z
H
I
K
M
N
O
II
P
T
Y
X
,
114
alfa
beta
gama
delta
epsilon
zeta
eta
teta
iota
kapa
lambda
mu
nu
ksi
ômicron
pi
ro
sigma
tau
úpsilon
fi
chi
psi
ômega
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Tabela A17 Capacidades para linhas de sucção, descarga e líquido (amônia), em KW
115
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Tabela A18 Capacidades para linhas de sucção, descarga e líquido (R134a), em KW
116
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Tabela A19 Capacidades para linhas de sucção, descarga e líquido (R22), em KW
Tabela A20 Comprimento equivalente de válvulas e acessórios (m)
117
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
118
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Tabela A21 Capacidade de refrigeração mínima em KW – linha de sucção (R134a) para
uma temperatura de condensação de 40°C
119
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Tabela A22 Capacidade de refrigeração mínima em KW – linha de sucção (R22 e R502)
para uma temperatura de condensação de 40°C
120
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Tabela A23 Capacidade de refrigeração mínima em KW – linha de descarga (R134a) para
uma temperatura de evaporação de -5°C
121
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Tabela A24 Capacidade de refrigeração mínima em KW – linha de descarga (R22 e R502)
para uma temperatura de evaporação de -5°C
122
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
Tabela A25 Correções para as capacidades das linhas de sucção
Refrigerante
R134a
R22
R502
Temperatura da linha de líquido (ºC)
20
30
50
1,2
1,1
0,89
1,17
1,08
0,91
1,26
1,12
0,86
Tabela A26 Correções para as capacidades das linhas de descarga
Refrigerante
R22
R502
R134a
Temperatura de sucção (ºC)
-50
-40
-30
0,87
0,9
0,93
0,77
0,83
0,88
Temperatura de sucção (ºC)
0
5
1,02
1,04
-20
0,96
0,93
Tabela A27 Vazão mássica de refrigerante em Kg/s por KW
123
5
1,02
11,04
10
1,06
Sistemas Térmicos Profº. Mestre André R. Quinteros Panesi
A28 Diagrama de Mollier para o R22
124