Revista Faculdade Montes Belos (FMB), v. 7, n° 1, 2014, p (109-120), 2014 ISSN 18088597
Estudo de estabilidade físico-química e microbiológica de dipirona
em gotas armazenadas em residências do município
de São Luis de Montes Belos-GO¹
Bruna Cristina de A. Ferreira², Elizângela B. de Novais² ,Raquel Barbosa C. Ribeiro²,
Cristiane Karla Caetano Fernandes³.
1
Trabalho realizado na Faculdade Montes Belos (FMB) para obtenção do título de Bacharel em Farmácia
Discentes do Curso de Farmácia da FMB.
3
Orientadora Professora da Faculdade Montes Belos
2
*email: farmá[email protected]
Resumo: - A dipirona é um dos medicamentos mais utilizados pela população brasileira,
devido sua acessibilidade e baixo custo. Para assegurar a qualidade dos medicamentos a
Agência Nacional de Vigilância Sanitária (ANVISA) requer no processo de fabricação a
garantia da qualidade destes produtos, sendo essencial que sejam mantidos em condições
ideais de armazenamento após dispensação ao consumidor, pois estas também influenciam na
manutenção da qualidade do produto. O objetivo deste trabalho é verificar alterações na
estabilidade físico-química e microbiológica na dipirona solução oral armazenadas nas
residências do município de São Luís Montes Belos e avaliar as condições e locais de
armazenamento. Foram coletadas 53 amostras de dipirona solução oral, e realizados testes
físicos químicos: análise do pH, identificação, doseamento e análise microbiológicas de
coliformes totais. Os resultados obtidos demonstram que mais de 80% dos residentes
armazenam a dipirona no armário, local que não apresenta segurança quanto a sua qualidade
físico-química pela variação de pH e teor de principio ativo. Pelos resultados que apontam 19
amostras reprovadas não atenderam os requisitos ordenados pelo compêndio oficial brasileiro
levando ao comprometimento da eficácia terapêutica, no teste de identificação. Todas as
amostras foram aprovadas na análise microbiológica por observar ausência de coliformes
totais indicando condições sanitárias adequadas, sendo indicativo o cumprimento das Boas
Práticas de Fabricação por parte das indústrias farmacêuticas.
Palavras chaves: Armazenamento. Controle de qualidade. Metamizol. Solução oral.
Abstract- Dipyrone is one of the drugs most commonly used by the population due to its
accessibility and low cost. Tp ensure the quality of medicines the National Health
Surveillance Agency (ANVISA) requires the manufacturing process to guarantee the product
quality. This process is essential because diryrone must be kept in ideal storage conditions
after dispensing to consumers due to the maintenance influence and product quality. The
objective of this work is to verify changes in physical, chemical stability and microbiological
activity of oral dipyrone solution stored in San Luis Montes Belos homes including assess
conditions and storage locations. To realize the study 53 samples of oral dipyrone solution
were collected. Chemical and physical tests performed as pH analysis, assay and
microbiological analysis of total coliforms. Based on the results, over 80% of resident
dipyrone stored in closet do not have security as their physical and chemical quality by
varying the pH and the active principle results indicate that 19 samples were reproved not
meeting the text book requirements text ordered by Brazilian officer leading to impairment of
therapeutic efficacy in the identification test. All samples were approved through
microbiological analysis observing absence of coliforms indicating adequate sanitation as
indicative of compliance with Good Manufacturing Practices by the pharmaceutical industry.
Key words: Metamizole. Oral solution. Quality control. Storage.
A ação analgésica da dipirona
1 Introdução
ocorre
A
dipirona
ou
metamizol,
quimicamente identificada como ácido 1fenil-2,3-dimetil-5-pirazolona-4é
um
derivado 5-pirazolônico que foi sintetizado
na Alemanha pelo laboratório Hoechst AG
prostaglandinas,
neuralgias
e
dores
para
cefaléias,
reumáticas,
pós-
operatórias, convulsões febris em crianças,
tratamento dos sintomas da dengue e para
febres causadas por quadros onde não e
possível
a
utilização
do
ácido
acetilsalicílico (AAS) (LUCCHETTI et al.,
2010 ; KNAPPMANN; MELO, 2010).
Considerado
um
ser
comercializada,
comprada,
solicitada, fornecida, dispensada ou doada
sem a necessidade de apresentação de
prescrição médica ou odontológica (KISHI
et al. 2010).
dipirona representa 31,8% do mercado.
Além de ser também o analgésico de
preferência em 50% dos usuários de
hospitais públicos em São Paulo e a grande
parte das vendas (em torno de 80%) ocorre
prescrição
prostaciclinas
de
e
isoformas 1 e 2, atuando no sistema
nervoso central e no sistema nervoso
periférico (KNAPPMANN; MELO, 2010).
As reações adversas da dipirona são
náuseas, vômitos, edema, anemia aplásica,
anemia hemolítica, tremores, hemorragia
gastrointestinal, anúria trambocitopenia,
reações alérgicas como asma e angiodema,
pode
aumentar
a
hipoprotombinemia,
agranulocitose fatal púrpura.Sendo que a
agranulocitose foi um dos efeitos adversos
a dipirona deixasse de ser comercializada
nos
países
como
Austrália,
Canadá,
Dinamarca, Estados Unidos da América EUA, Noruega, Reino Unido, Suécia, entre
outros (DIOGO, 2003; SILVA, 2010).
A dipirona em gotas é uma solução
oral, sendo que esta formulação por ser
No mercado global de analgésicos a
sem
síntese
que teve repercussão mundial fazendo que
Medicamento
Isento de Prescrição (MIP), a dipirona
pode
da
tromboxanos, e pela inibição irreversível
em 1920. É um potente analgésico e
indicado
inibição
da enzima ciclo-oxigenase (COX) em suas
metilaminometanossulfônico,
antipirético,
pela
médica,
ou
seja,
automedicação (LUCCHETTI et al. 2010).
líquida proporciona condições favoráveis a
reações químicas de deterioração dos
ingredientes ativos veiculados, tais como
hidrólise,
oxidação,
complexação
polimerização.
As
instabilidades
formulações
farmacêuticas
e
das
podem
desencadear alterações das propriedades
organolépticas, que são detectadas somente
por análise química (SERAFIM et al.
quantidades apropriadas (YOKAICHIYA
2007).
et al. 2003).
As
líquidas
soluções
que
são
contém
formulações
mais
medicamento é necessário para avaliação
substâncias dissolvidas em um solvente
das características físicas, químicas e
adequado ou em uma mistura de solventes
microbiológicas
mutuamente miscíveis. A administração de
embalagens, produtos em processo e
fármacos na forma de solução geralmente
produtos acabados. A averiguação de
implica
acordo com as especificações é um
em
gastrointestinal
uma
ou
O Controle de qualidade desse
absorção
e
no
requisito necessário para a garantia da
circulação sistêmica, tendo como vantagem
qualidade, segurança e eficácia do produto
que na forma farmacêutica líquida não há
para então chegar às farmácias e drogarias
necessidade de passar pelo processo de
para
desintegração e dissolução do fármaco
(ANVISA, 2008).
comparado
sólidas
que
com
passam
para
matérias-primas,
a
quando
liberação
trato
das
formulações
por
estes
dois
processos (DE PAULA, 2010).
para
a
consumidor
ter
acesso
Dentre os testes de controle de
qualidade a estabilidade é de extrema
importância a fim de garantir a integridade
Os medicamentos são produtos
importantes
então
manutenção
da
química, física, microbiológica, terapêutica
e toxicológica do fármaco e da forma
qualidade de vida da população. A
farmacêutica
preservação da sua qualidade deve ser
especificados, pela influência dos fatores
garantida desde sua fabricação até a
ambientais em função do tempo. Os
dispensação ao paciente. Sendo assim, as
principais fatores que podem afetar a
condições de estocagem, distribuição e
estabilidade das
transporte
papel
líquidas são: hidrólise, pH, oxidação
dos
aumento de temperatura e contaminação
padrões de qualidade dos medicamentos. O
microbiológica (SILVA et al., 2009.; GIL,
ciclo logístico da Assistência Farmacêutica
2010).
desempenham
fundamental para a
manutenção
(aquisição, programação, armazenamento,
dentro
dos
formas
limites
farmacêuticas
A estabilidade do fármaco pode ser
distribuição e dispensação) deve apresentar
comprometida
pela
a qualidade e a racionalidade necessárias,
microbiológica
levando
para disponibilização de medicamentos
estabilidade da formulação, alterando as
seguros e eficazes, no momento certo e nas
características
físicas
contaminação
à
e
quebra
aparência
da
e
causando a inativação dos princípios ativos
e excipientes da formulação além de
nos ensaios de aspecto, determinação de
agravar quadros clínicos de pacientes já
pH, teor de dipirona e análise de rotulagem
alquebrados pela doença (YAMAMOTO et
reforçando a importância do controle de
al., 2004).
qualidade
O
armazenamento
de
(SERAFIM
et
al.
2007;
CAMARGO et al., 2011).
medicamentos é um fator importante na
A forma correta de utilização
preservação de seus componentes, então ao
dipirona em gotas deve ser observada,
serem
sendo que deve se gotejar em posição
dispensados
precisam
de
ao
consumidor
cuidados
em
seu
vertical, pois a mudança da posição
armazenamento, a fim de garantir a sua
vertical para a inclinada (45°) do conta-
ação farmacológica esperada, e para que
gotas pode reduzir o tamanho da gota em
suas propriedades não sejam alteradas. Os
até 30%, ocorrendo uma diminuição de até
medicamentos devem ser armazenados em
30% da dosagem administrada, com-
locais protegidos da luz, da umidade, calor,
prometendo deste modo o tratamento
radiação e do alcance das crianças; Não
terapêutico (DOBLINSKI et al., 2006).
deixá-los em locais como pias, banheiros,
A atenção farmacêutica tem papel
armários próximos a janelas, fogões ou a
relevante no que se diz respeito às
fornos de micro-ondas; Lavar bem as mãos
orientações prestadas aos pacientes, pois
antes
com
através destas o farmacêutico fornecerá ao
medicamentos; Não deve deixar frascos
paciente, informações quanto a forma
abertos no intuito de evitar contaminação
correta de administração de medicamento e
microbiológica ou degradação (SERAFIM,
cuidados em relação ao armazenamento,
et al., 2007 ; BRASIL, 2009).
no intuito de prevenir possíveis processos
de
No
qualquer
Brasil,
manuseio
estudos
a
de degradação do fármaco tais como:
qualidade da dipirona armazenadas em
fotólise, hidrólise e oxidação, além de
residências foram feitos no estado de São
orientar
Paulo em Araraquara e os resultados
microbiológica que pode ocorrer durante a
mostraram
fármaco
utilização da medicação, por falta de
alteradas e contaminação microbiológica,
higiene ou por exposição do medicamento
apesar de estarem dentro de seus prazos de
ao ambiente (YAMAMOTO, et al,. 2004;
validade. Entre os anos de 2006 a 2011,
DOBLINSKI et al., 2006).
quantidades
de
sobre
sobre
possível
contaminação
alguns lotes de medicamentos contendo
Este trabalho tem como objetivo
dipirona foram recolhidos pela ANVISA,
verificar alterações na estabilidade físico-
por apresentarem resultados insatisfatórios
química e microbiológica de dipirona em
gotas durante o
prazo
de validade,
seguida
a
metodologia
descrita
na
armazenadas em residências do município
Farmacopéia Brasileira 5ª edição. As
de São Luís de Montes Belos.
amostras foram submetidas á uma diluição
1:10 em água destilada para realização da
2 Material e Métodos
A pesquisa foi realizada com
aplicação de questionários aos residentes
de São Luís de Montes Belos em bairros
diferentes abrangendo diferentes classes
sociais, a fim de saber qual o local de
armazenamento da dipirona em gotas. Foi
recolhido o frasco de dipirona do residente
e entregue um novo frasco. Foram inclusos
na pesquisa residentes na faixa etária
acima de 20 anos de idade que utilizem ou
guardem em casa dipirona solução oral,
ficaram excluídos residentes na faixa etária
abaixo dos 20 anos de idade e aqueles que
não fizerem uso de dipirona solução oral.
O número de habitantes de São Luís de
Montes Belos segundo o IBGE é 30.034
habitantes, desses calculou n amostral que
foi 53 que foi o número de amostras
coletadas.
O projeto foi aprovado pelo Comitê
de Ética em Pesquisa da FUG, conforme
parecer consubstanciado n° 075/2012-2,
sendo que para os participantes da pesquisa
se precedeu a leitura do Termo de
Consentimento Livre e Esclarecido, o qual
foi posteriormente assinado .
Para a determinação do pH das
amostras de dipirona solução oral foi
leitura e o processo foi realizado em
triplicata (Farm. Brasileira, 5ª Edição –
BRASIL, 2010)
Na identificação das amostras foi
utilizada a metodologia proposta pela
Farmacopeia Brasileira 5 ed. No teste A,
foram adicionados 2 mL de peróxido de
hidrogênio 30% (p/p) em 2 mL da solução
oral. No teste B, foram adicionados 2 mL
de persulfato de potássio 10% (p/v) em 2
mL da solução oral.
Para o doseamento da utilizou – se
o teste de iodometria. Dissolveu 0,2 g da
amostra em 5 ml de água; adicionou 5,0 ml
de Ácido Clorídrico 0,02 N; e titulou com
solução de iodo 0,1 N, em temperatura
abaixo de 20º. Cada ml da solução de iodo
0,1 N equivale a 16,67 mg de dipirona. Os
experimentos
foram
realizados
em
triplicata. A determinação quantitativa foi
realizada
segundo
a
Farmacopeia
Brasileira 3 ed. (1976)
Para determinação da qualidade
microbiológica
dos
medicamentos
foi
realizada pesquisa coliformes totais. Foram
colocados 9 ml do meio de caldo lactosado
em tubos de ensaio e dentro destes tubos
foi colocados tubos de Durhan invertidos e
foram para autoclave para esterilização.
Após o resfriamento, adicionou-se uma
alíquota de dipirona solução oral em cada
orientação
tubo e incubou por 48 horas a temperatura
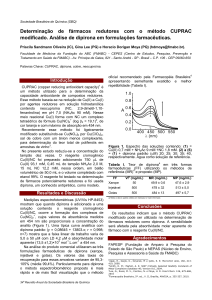
armazenamento (Figura 1).
de 35° C para verifica a presença de
coliformes totais.
Todo
quanto
ao
correto
medicamento
possui
propriedades físicas e químicas e é de
extrema importância a conservação das
suas
3 Resultado e Discussão
propriedades,
que
depende
da
estabilidade, sendo que a perda desta pode
Do
total
das
53
entrevistas
ser ocasionada pela temperatura, presença
realizadas nos domicílios, o local de
de oxigênio, luz solar e umidade tornando
armazenamento mais utilizado, cerca de 80
imprescindíveis as orientações quanto ao
% é no armário da cozinha, 9 % no quarto
armazenamento em residências.
no guarda-roupa, 4 % em cima da
geladeira, 4 % caixa de sapato 2 % na pia
ou armário do banheiro. A pesquisa
demonstrou que a falta de informação e
Guarda-roupa
5
Caixa de sapato
2
No banheiro(pia)
1
Em cima da geladeira
Figura 1: Local de armazenamento dos
medicamentos relatados pelos
entrevistados.
Colunas2
2
Armário
43
0
10
20
30
40
50
Através do estudo realizado foi
com o medicamento e de utensílios
demonstrado que o armário da cozinha foi
domésticos como colheres para medida de
o lugar mais utilizado pela população para
líquidos que são encontrados na cozinha
o armazenamento, por causa da maior
(TÓTOLI et al. 2011). Embora seja um
acessibilidade e pela presença de líquidos
local não apropriado, pois não deve
que podem ser ingeridos conjuntamente
armazenar medicamentos juntamente com
alimentos e também por que na cozinha
devem ser armazenados ao abrigo da luz,
são preparadas refeições, o que causa um
calor e em ambiente seco como afirma
aumento da temperatura, sendo que o
Ferreira (2005) em estudo realizado em
aumento de 10° C na temperatura provoca
Divinópolis (MG) .
aumento de duas a cinco vezes na
Na análise de pH 53 amostras
degradação de fármacos (BUENO et al.
comerciais foram analisadas, destas 9
2009).
amostras foram consideradas reprovadas:
O guarda –roupa e o segundo local
amostra 5 (pH=5.22), 6 (pH=5,48), 11
utilizado pelo fácil acesso, porém algumas
(pH=5.25), 17 (pH=5.34), 20 (pH=5.44),
pessoas armazenavam na gaveta sem
37 (pH=5,01),48 (pH=5,42), 49 (pH=5,11)
tranca facilitando o alcance das crianças
e 51 (pH=5,43) por apresentarem valores
mas em algumas residências os moradores
fora
afirmaram armazenar em gaveta com
Farmacopéia Brasileira, que delimita um
chave o que segundo SILVA et al. 2010
intervalo de pH entre 5,5 e 7,0.
seria um dos locais mais apropriados e
outras
pessoas
armazenavam
dos
limites
especificados
pela
A determinação do pH, é essencial
seus
no ensaio de qualidade de medicamentos,
medicamentos dentro da caixa de sapato
sendo que erros em seu ajuste durante o
em cima do guarda roupa ou da estante da
processo
sala.
determinação
podem
decomposição
do
fácil acesso, o que de acordo com SILVA
prejudicar
atividade
et al. 2010 permite o alcance das crianças
(KNAPPMANN; MELO, 2010).
A pia do banheiro é um local de
consumi
-
los
formulação
e
em
sua
favorecer
a
princípio
ativo
e
terapêutica
consequentemente,
A alteração do pH ( Tabela 1 ) de
desenvolverem uma intoxicação, além de
em uma unidade poderá diminuir a
estar
micro-
estabilidade de um fármaco na ordem de
organismos que degradam a substância
um fator 10 ou ainda maior pois um pH
ativa de forma direta sob a molécula do
impróprio com aumento da temperatura
fármaco, ou de forma indireta, alterando o
acarretará danos significativos do teor e da
pH
atividade
exposto
eleito
e,
de
a
e,
umidade
e
consequentemente,
terapêutica
do
fármaco,
dissociando a molécula (SERAFIM et al,
resultantes da sua degradação por hidrolise
2007).
ou oxidação. O pH fora do limite
Outro
local
utilizado
embora
especificado pode estar relacionado ao não
inadequado é em cima da geladeira pelo
ajuste ou ajuste inadequado ou a variação
aquecimento do motor sendo que estes
do mesmo ao longo do tempo, devido a
ausência de um sistema tampão eficiente
(FERREIRA, 2008).
Tabela 1: Resultado da variação de pH
Amostra
1
2
3
4
5
6
7
8
9
10
11
12
13
14
pH
6,48
6,06
5,5
6,42
5,22
5,48
6,95
5,62
6,22
5,91
5,25
5,98
5,96
6,06
Amostra
15
16
17
18
19
20
21
22
23
24
25
26
27
28
pH
6,22
5,64
5,34
6,68
5,57
5,44
5,66
5,79
5,93
6,02
6,02
5,54
6,05
5,94
No teste de identificação, não
Amostra
29
30
31
32
33
34
35
36
37
38
39
40
41
42
Ph
6,60
5,99
6,63
5,94
5,96
5,97
5,74
5,79
5,01
6,14
5,77
5,81
5,65
5,71
Amostra
43
44
45
46
47
48
49
50
51
52
53
pH
5,90
5,92
5,61
5,72
5,53
5,42
5,11
5,55
5,43
5,72
5,91
confirmatórios, mas são eliminatórios, pelo
houve nenhuma irregularidade que foi
fato
comprovada
coloração
apresentar grupos funcionais em comum.
desenvolvida nos teste realizados, o que
As principais vantagens são a redução do
confirma a presença do ingrediente ativo,
custo com instrumentação, no entanto,
que é um quesito fundamental na garantia
apresentam menor sensibilidade e não
da eficácia e segurança do produto. A
podem ser
aplicados a
presença do ingrediente ativo, que é um
fármacos
com
quesito fundamental na garantia da eficácia
(SALGADO; MORENO, 2010).
através
da
que
várias
substâncias
podem
misturas de
grupos
comuns
e segurança do produto. As reações
O doseamento de fármacos e de
químicas úteis em ensaios clássicos de
grande importância para avaliação da
identificação devem ser perceptíveis a olho
qualidade dos produtos farmacêuticos, que
nu, podendo ser através da mudança de
determina a quantidade de princípio ativo
cor, formação de precipitado ou produção
presente
de gás (GIL et al, 2010; SALGADO &
ZARBIELLI et al., 2007 afirma que o
MORENO,2010).
medicamento armazenado pode conter
Os
métodos
de
na
formulação.
Sendo
que
identificação
teores abaixo dos valores estabelecidos,
fundamentado em reações químicas de
embora dentro do prazo de validade, não
grupos funcionais importantes, não são
promovendo
a
atividade
terapêutica
esperada.
quantidade declarada de dipirona solução
oral. Geralmente ensaios para determinação
A partir dos resultados obtidos, que
demonstram
especificações
de
teor,
do teor da dipirona são realizados pelo
método
de
titulação
direta
fazendo
indicaram que os parâmetros de qualidade
empregando soluções padronizadas de iodo
exigidos não foram cumpridos, sendo que
de
35.8% das amostras foram reprovadas que
denominadas
segundo a Farmacopéia Brasileira 5ª
abrangem reações de oxirredução. (Tabela
edição (2010), no qual deve compreender o
2).
intervalo
de
95,0%
a
110,0%
acordo
com
VOGEL,2002
titulações
iodimétricas
são
e
da
Tabela 2.- Resultados das determinações do teor de dipirona obtidos de amostras coletadas em vários
bairros do município de São Luís Montes Belos –GO.
Amostra Teor
Amostra Teor
Amostra
90,2%
87,5%
1
15
29
60,4%
95,8%
2
16
30
83,3%
102,1% 31
3
17
104,1%
88,7%
4
18
32
62,5%
97,9%
5
19
33
116,6%
103,3% 34
6
20
93,7%
7
21
35
84,6%
97,9%
8
22
36
86,4%
100,0% 37
9
23
104,8%
10
24
38
102,1%
104,1% 39
11
25
81,2%
101,2% 40
12
26
100,0%
96,4%
13
27
41
100,0%
14
28
42
Teor
100,0%
72,9%
98,5%
94,3%
100,0%
81,0%
95,0%
102,1%
101,2%
100,0%
97,1%
78,33%
89,6%
73,5%
Amostra
43
44
45
46
47
48
49
50
51
52
53
Teor
99,1%
112,5%
95,8%
89,6%
102,1%
98,5%
95,8%
100,0%
77,0%
99,1%
98,5%
Nota:
Total de medicamentos aprovados: 31
Total de medicamentos reprovados: 19
Total de medicamentos com amostra insuficiente: 03
Total de medicamentos analisados: 50
Estudos realizados por Camargo et
as especificações de teor adequadas,
al. (2011) afirmam que os medicamentos
indicam que os parâmetros de qualidade
devem apresentar um padrão de qualidade
determinados são cumpridos.
satisfatório, uma vez que os medicamentos
Os produtos não-estéreis sofrem a
industrializados devem ser aprovados pelo
influência de fatores como manuseio, falta
departamento
de higiene, armazenamento e tempo de
o
da
Garantia
da
Qualidade
provenientes da indústria de origem sendo
exposição do produto aberto torna possível
a
suscetibilidade
de
contaminação
microbiológica, já que os produtos que
armazenamento
dos
medicamentos
apresentam veículo aquoso e diversas
(FARINA; ROMANO-LIEBER, 2009).
fontes orgânicas de carbono, hidrogênio e
oxigênio, representadas pelos componentes
4 Conclusão
a base de açúcares, gomas e outros. O
fechamento inadequado do frasco pode
Através dos resultados obtidos,
tornar-se uma via de entrada de novos
pode-se concluir que nem todas as
micro-organismos vindos do ambiente e
amostras apresentam segurança quanto a
devido à perda de escamas da pele por
sua qualidade físico-química pela variação
parte
diversos
de pH e teor de principio ativo fora dos
microrganismos podem estar presentes em
parâmetros especificados pela farmacopeia
função dos seus hábitos de higiene
Brasileira, já na análise de identificação,
(SERAFIM et al ., 2007).
tanto o teste A quanto teste B, todas as
de
diversos
Apesar
usuários,
análise
amostras foram consideradas aprovadas de
microbiológica nenhuma das amostras
acordo com a Farmacopeia Brasileira e a
analisadas, apresentou desenvolvimento de
análise microbiológica a ausência de
coliformes totais, sendo um indicativo do
coliformes
cumprimento
sanitárias adequadas.
Fabricação
disso,
das
por
Boas
parte
na
Práticas
das
de
totais
indicam
condições
indústrias
farmacêuticas e consumidores.
Referência Bibliográfica
No Brasil, o principal serviço
prestado nas farmácias e drogarias é a
dispensação
de
medicamentos
que
geralmente é realizada sem a presença do
farmacêutico que por sua vez é responsável
pelas orientações sobre a medicação e
armazenamento, os medicamentos podem
perder sua eficácia por reações químicas
ocasionadas
pelo
armazenamento
inadequado. Em vista disto, são realizados
ensaios de qualidade físico-químicos e
microbiológicos que fornecem indicativos
quanto as condições de produção e
BRASIL. Agência Nacional de Vigilância
Sanitária. ANVISA. Guia de controle de
qualidade de produtos cosméticos. 2 ed.
Brasília. Brasil, 2008.
BRASIL. Ministério da Saúde. Secretaria
de Ciência, Tecnologia e Insumos
Estratégicos. Departamento de Assistência
Farmacêutica e Insumos Estratégicos.
Diretrizes
para
estruturação
de
farmácias no âmbito do Sistema Único
de Saúde / Ministério da Saúde, Secretaria
de Ciência, Tecnologia e Insumos
Estratégicos, Departamento de Assistência
Farmacêutica e Insumos Estratégicos. –
Brasília, 2009 , p.1-43.
BUENO, C. S.; WEBER, D.; OLIVEIRA,
K. R. Farmácia caseira e descarte de
medicamentos no bairro Luiz Fogliatto do
município de Ijuí – RS. Revista Ciência
Farmácia Básica Aplicada., v.30, n.2,
p,203-210. 2009.
CAMARGO, C. F. A; DE SÁ, V B;
NOGUEIRA, L G. Estudo comparativo
de dipirona gotas entre medicamentos
de referência, genérico e similar
comercializado na cidade de Trindade –
GO. p. 1-16, 2011. p. 1 16.
DIOGO, A. N. M. Dipirona: segurança
do uso e monitoramento da qualidade de
comprimidos orais. 2003. p.1 86
DOBLINSKI, P. M. F; FORLIN, J;
FLORENCE, G. M. V; MORANDI, F;
MELLO, J C P; DELAPORTE, R. H.
Assistência farmacêutica domiciliar na vila
Boa Esperança do município de Toledo.
Infarma, v.18, n. 9/10, p.7-11, 2006.
FARINA, S S.; ROMANO-LIEBER, N. S.
Atenção Farmacêutica em Farmácias e
Drogarias: existe um processo de
mudança?. Saúde Soc. São Paulo, v.18,
n.1, p.7-18, 2009.
FARMACOPÉIA Brasileira, Prefácio...
3.ed. São Paulo: Org. Andrei, 1976. p.406408.
FARMACOPÉIA Brasileira, Prefácio... 5
ed. São Paulo: Org. Andrei, 2010. p. 122914.
FERREIRA, W A; SILVA, M. E. S. T; DE
PAULA, C. C. F. F ; RESENDE ,C. A. M.
B. Avaliação de farmácia caseira no
município de Divinópolis (MG) por
estudantes do curso de farmácia da
Unifenas. Infarma, v.17, n. 7/9, 2005.
FERREIRA, Anderson de Oliveira. Guia
prático da Farmácia Magistral. v. 2, 3
ed.
São Paulo:Pharmabooks. 2008 .p.241-242.
GIL,E.S; MATIAS.R; ORLANDO,R. M.
Controle de qualidade físico-químico de
qualidade de medicamentos. Métodos de
identificação
3
ed.
São
Paulo:
Pharmabooks, 2010. p. 155-156.
KNAPPMANN, A. L.; MELO, E. B.
Qualidade de medicamentos isentos de
prescrição: um estudo com marcas de
dipirona comercializadas em uma drogaria
de Cascavel. Ciência & Saúde Coletiva.
Paraná-PR. v.15, Sup. 3, p.3467-3476,
2010.
MORENO, A. H., SALGADO, H. R. N.
Desenvolvimento
de
metodologia
qualitativa
para
identificação
de
ceftazidima.
Revista
de
Ciências
Farmacêuticas Básica Aplicada. v.31,
n.3, p.165-173; 2010.
PAULA, D. J. Desenvolvimento de
formulação na forma de solução oral de
sildenafil para uso na disfunção erétil.
2010. p. 1-99.
SERAFIM, E. O. P.; DEL VECCHIO, A.;
GOMES J; MIRANDA, A.; MORENO, A.
H.; LOFFREDO, L. M. C.; SALGADO, H.
R. N.; CHUNG, M. C. Qualidade dos
medicamentos
contendo
dipirona
encontrados nas residências de Araraquara
e sua relação com a atenção farmacêutica.
Revista
Brasileira
de
Ciências
Farmacêuticas. v. 43, n. 1, p.127-135,
2007.
SILVA, K. E. R.; ALVES, L. D. S.;
SOARES, M. F. R.; PASSOS, R. C. S.;
FARIA A. R.; ROLIM NETO Modelos de
Avaliação da Estabilidade de Fármacos e
Medicamentos
para
a
Indústria
Farmacêutica.
Revista
Ciências
Farmacêutica Básica Aplicada. p.1-8,
.2009.
SILVA,
P.,
Farmacologia
em:
CARVALHO, W.A (org) Farmacologia
Integrada. 8 ed. Rio de Janeiro:
Guanabara Koogan, 2010. p. 447.
TÓTOLI, E. G; STAIN, S. N. SALGADO,
Hérida R. N. MORENO, A H. Verificação
da
qualidade
microbiológica
de
medicamentos
contendo
paracetamol
encontrados em algumas residências de
Américo Brasiliense/SP. Revista uniara,
v.14, n.2, dez. 2011.
YAMAMOTO, C. H; PINTO, T. J A;
MEURER, V. M; CARVALHO; R, P. R.
Controle de Qualidade Microbiológico
de Produtos Farmacêuticos, Cosméticos
e Fitoterápicos Produzidos na Zona da
Mata, MG. 2004. 1-6 p.
YOKAICHIYA, C, M; MARQUES, D. C;
VIEIRA, F. S; JEREMIAS, S. A; ILKIU,
S; OLIVEIRA, V. C. Manual de
Estruturação de Almoxarifados de
Medicamentos e Produtos para a Saúde
e de Boas Práticas de Armazenamento e
Distribuição. CEFOR – SMS: São Paulo
2003. p.3.
ZARBIELLI, M. G; MACEDO, S;
MENDEZ, A. L. Controle de qualidade de
cápsulas de piroxicam manipuladas em
farmácias do município de Erechim (RS).
Infarma, v.19, n 1/2, 2007.
VOGEL, A.; MENDHAM, J.; DENNEY,
R. C.; BARNES, J. D.; THOMAS, M.
Análise Química Quantitativa, 6 ed. Rio
de Janeiro: LTC, 2002.