CALOR
1
ENERGIA: É a capacidade de se realizar um trabalho. Ela se apresenta sob várias formas: cinética (de movimento),
gravitacional, elástica (de molas), elétrica, térmica, radiante e outras. Mede-se em Joules, mas as companhias
elétricas medem em kWh e a energia térmica se mede em Calorias.
ENERGIA TÉRMICA: A Energia Térmica de um corpo é a energia cinética de suas moléculas e corresponde à sua
temperatura.
CALOR: É a energia térmica que se transfere de um corpo mais quente para outro mais frio. Dois corpos na mesma
temperatura não trocam energia e são ditos em equilíbrio térmico. O Calor se mede em calorias - cal. Ela vale 4,186
Joules. Uma caloria é a quantidade de energia necessária para esquentar um grama de água de um grau Celsius.
TROCAS DE CALOR: Quando dois corpos com temperaturas diferentes são postos em contacto, um cede calor para o
outro. Se não houver perdas o calor ganho é igual e contrário ao calor perdido.
QG = Calor ganho é positivo.
QP = Calor perdido é negativo.
QG + QP = 0
Dois corpos na mesma temperatura não trocam calor.
AQUECIMENTO OU RESFRIAMENTO DE UM CORPO: Coloquemos 100g de gelo à temperatura de -20o C em uma
panela fechada. Esquentemos a panela fornecendo-lhe mil calorias por minuto. Vamos supor que a energia não se
perde indo toda para o gelo. Há cinco etapas:
I: Inicialmente o gelo esquenta a vinte graus por minuto. Depois de um minuto o gelo chega a zero grau.
II: Então, o gelo para de esquentar e
começa a fundir transformando-se em
água. A cada minuto 12,5 g de gelo
tornam-se água. Em 8 minutos todo
gelo se funde e temos somente água.
III: A água começa a aquecer. Ela
aquece a dez graus por minuto. Em
dez minutos ela chega a cem graus.
IV: Neste ponto a água para de
esquentar e começa a ferver
transformando-se em vapor. Depois
de 54 minutos toda a água torna-se
vapor.
V: Finalmente, o vapor começa a
esquentar a dez graus por minuto.
Depois de dois minutos o vapor chega
a 120 oC.
CALOR SENSÍVEL: Quando um corpo recebe calor e aumenta a temperatura, ou perde calor e a temperatura diminui,
este calor chama-se Calor Sensível.
CALOR LATENTE: Quando um corpo recebe ou perde calor e não muda de temperatura, mas muda de fase, este
calor chama-se Calor Latente.
Equação fundamental da Calorimetria (para calor sensível):
Q = calor trocado em calorias,
m = massa do corpo em gramas,
∆T = mudança de temperatura em graus Celsius ou Kelvin,
c = calor específico do material.
Se ∆T > 0, Q > 0, isto significa calor recebido.
Se ∆T < 0, Q < 0, isto significa calor cedido.
2
Q = m c ∆T
Cada material tem o seu calor específico. Veja alguns valores na tabela abaixo.
Calores específicos em cal/g.oC = cal/g.K
Chumbo:
0,0305
Latão:
0,092
Tungstênio: 0,0321
Alumínio: 0,215
Prata:
0,0564
Mercúrio: 0,033
Ouro:
0,032
Granito:
0,19
Cobre:
0,0923
Vidro:
0,20
Capacidade Térmica:
C = mc
→
Álcool:
Água do mar:
Água doce:
Gelo(-10oC)
0,58
0,93
1,00
0,53
Q = C ∆T
Equação do Calor Latente (para mudança de fase):
Q= mL
Q = calor trocado em calorias, m = massa da substância em gramas,
L = calor latente da substância em cal/g
sólido → líquido ou líquido → gasoso; L > 0, Q > 0
líquido → sólido ou gasoso → líquido; L < 0, Q < 0
A tabela a seguir mostra o valor de Calor Latente de algumas substâncias:
Calor Latente de algumas substâncias em cal/g
na ebulição
na fusão
Hidrogênio:
13,9
109
Oxigênio:
3,3
51
Mercúrio:
2,7
71
Água:
80,0
540
Chumbo:
5,6
205
Prata:
25,1
559
Cobre:
49,5
1132
MUDANÇAS DE FASE:
Solidificação
SÓLIDO
Condensação
GASOSO
LÍQUIDO
Fusão
Vaporização
Sublimação ou Cristalização
Sublimação
Sólidos têm formas e volumes bem definidos. Líquidos têm volumes definidos e formas indefinidas.
Gases não têm nem volumes nem formas definidas.
EXERCÍCIOS DE VESTIBULAR
UFF – 2010 – primeira fase. Uma bola de ferro e uma bola de madeira, ambas
com a mesma massa e a mesma temperatura, são retiradas de um forno quente
e colocadas sobre blocos de gelo.
Marque a opção que descreve o que acontece a seguir.
(A) A bola de metal esfria mais rápido e derrete mais gelo.
(B) A bola de madeira esfria mais rápido e derrete menos gelo.
(C) A bola de metal esfria mais rápido e derrete menos gelo.
(D) A bola de metal esfria mais rápido e ambas derretem a mesma quantidade de gelo.
(E) Ambas levam o mesmo tempo para esfriar e derretem a mesma quantidade de gelo.
3
Solução: Q = m∙c∙∆T, as massas e as temperaturas são iguais, o que varia é o calor específico. O calor específico dos
metais é baixo então a bola de metal gera menos calor que a de madeira e derrete menos água. O metal é bom
condutor e esquenta e esfria mais rápido que a madeira. (C).
UFRJ- 2010. O gráfico a seguir assinala a média das temperaturas mínimas e máximas nas capitais de alguns países
europeus, medidas em graus Celsius.
Considere a necessidade de aquecer 500 g de água de 0 oC até a temperatura média máxima de cada uma das
capitais. Determine em quantas dessas capitais são necessárias mais de 12 kcal para esse aquecimento.
Solução: Q = m∙c∙∆T → 12000 = 500∙1∙∆T → ∆T = 12000/500 = 24, a temperatura final deve ser maior que 24º,
isto ocorre nas capitais F, G, H, J e K.
PUC – 2010 – grupo 2. Uma quantidade de água líquida de massa m = 200 g, a uma temperatura de 30 oC, é colocada
em uma calorímetro junto a 150 g de gelo a 0 oC. Após atingir o equilíbrio, dado que o calor específico da água é ca =
1,0 cal/(g . oC) e o calor latente de fusão do gelo é L = 80 cal/g, calcule a temperatura final da mistura gelo + água.
Solução: Calor necessário para todo gelo derreter: Q = m∙L = 150∙80 = 12000 cal,
Calor perdido pela água para chegar a zero grau: Q = m∙c∙∆T = 200∙1∙(-30) = -6000 cal
A água não tem calor suficiente para derreter todo o gelo, então a temperatura final é 0 oC.
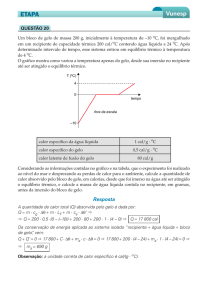
PUC – 2010 – grupo 3. Um cubo de gelo dentro de um copo com água resfria o seu conteúdo. Se o cubo tem 10 g e
o copo com água tem 200 ml e suas respectivas temperaturas iniciais são 0 oC e 24 oC, quantos cubos de gelo devem
ser colocados para baixar a temperatura da água para 20 oC? Considere que o calor específico da água é c = 1,0 cal/(g
o
C), o calor latente de fusão do gelo L = 80 cal/g, e = 1 g/ml.
Solução: Calor perdido pela água: Q = 200∙1∙(20-24) = -800 cal. Calor ganho por um cubo de gelo: Q = m∙L + m∙c∙∆T
= 10∙80 + 10∙1∙20 = 800 + 200 = 1000 cal. Um cubo é mais que suficiente.
UERJ – 2010 – segunda prova. Considere os seguintes valores:
- calor específico da água: 1,0 cal.g-1 oC-1
- densidade absoluta da água: 1,0 g/cm3
- 1 cal = 4,2 J - custo de 1 kWh = R$0,50
No inverno, um aquecedor elétrico é utilizado para elevar a temperatura de 120 litros de água em 30 oC. Durante 30
dias do inverno, o gasto total com este dispositivo, em reais, é cerca de:
Solução: Q = m∙c∙∆T, 120 litros = 120 kg, Q = 120.000∙1∙30 = 3.600.000 cal por dia =
3.600.000 x 30 cal em 30 dias = 3.600.000 x 30 / 4,2 J = 3.600.000 x 30 / 4,2 / 3.600.000 KWh =
30/4,2 = 7 kWh → R$3,50.
4
DIAGRAMA DE FASES
O estado de um corpo depende das condições de pressão e de temperatura. Podemos representar estes estados em
um gráfico de pressão x temperatura que mostra os estados sólido, líquido e gasoso. Este gráfico é o Diagrama de
Fases
Vemos a seguir dois Diagramas de Fases, o da esquerda é o do CO2 e o da direita é o da água. Neles vemos três
curvas que separam os estados sólido, líquido e gasoso. A curva 1 é a curva de fusão ou solidificação. A curva 2 é a
curva de vaporização ou condensação. A curva 3 é a curva de sublimação. As três curvas se encontram em um ponto
que é chamado ponto triplo ou ponto tríplice. Para a água o ponto tríplice ocorre na pressão de 4,58 mm Hg ou
0,006 atm e na temperatura de 0,01oC. Nesta situação há gelo, água e vapor d’água juntos. Para o CO2 este ponto se
dá a 5atm e a –56,6oC.
P
P
1
1
Líquido
Sólido
Líquido
2
Sólido
2
3
Gasoso
3
Gasoso
T
T
5
Resolva:
UERJ – 2005 – discursiva. O supermercado necessita diariamente de gelo em escamas. A potência P dissipada pela
máquina empregada para fabricá-lo é de 360 cal/s. Sabendo que a temperatura da água ao entrar na máquina é de
20o C, determine:
A) o calor liberado por 150 kg de água ao ser transformada integralmente em gelo a -3o C;
B) a energia dissipada pela máquina, em joules, em 5 h de funcionamento.
Dados: calor específico do gelo = 0,5 cal/g oC; calor específico da água = 1,0 cal/g oC; calor latente de solidificação da
água = 80 cal/g; Uma caloria = 4 J.
UFF – 2005 – segunda fase. Um sistema básico de aquecimento de água por
energia solar está esquematizado na figura abaixo. A água flui do reservatório
térmico para as tubulações de cobre existentes no interior das placas coletoras e,
após captar a energia solar, volta ao reservatório pelo outro trecho do
encanamento. A caixa de água fria alimenta o reservatório, mantendo-o sempre
cheio. Suponha que em um determinado instante o reservatório tenha em seu
interior 200 litros de água em equilíbrio térmico. Dados: massa especifica da
água: r = 1,0 kg/litro; calor específico da água: c = 1,0 cal/goC; 1,0 cal = 4,2 J
Determine a quantidade de calor absorvida por esse volume de água para que sua
temperatura aumente 200 C, supondo que não haja renovação da água do
reservatório.
UFRJ – 2004 – não especifica. Em um calorímetro de capacidade térmica desprezível há 200 g de gelo a -200C.
Introduz-se, no calorímetro, água a 200 C. O calor latente de solidificação da água é 80 cal/g e os calores específicos
do gelo e da água (liquida) valem, respectivamente, 0,50 cal/goC e 1,0 cal/goC. Calcule o valor máximo da massa da
água introduzida, a fim de que, ao ser atingido o equilíbrio térmico, haja apenas gelo no calorímetro.
PUC – 2003 – grupo 1. Um cubo de gelo de massa m = 100 g e temperatura de 0° C é colocado num copo contendo
200 ml de água. (Despreze a capacidade térmica do copo e as trocas de calor com o ambiente).
a) Se a temperatura inicial da água é de 10° C e apenas ¼ do gelo derreteu, qual a temperatura final de equilíbrio da
mistura?
b) Se as temperaturas inicial e final da água são, respectivamente, de 40 °C e 0 °C, qual a fração do gelo derretida?
Dados: densidade da água ρ = 1 g/cm3 ; calor latente de fusão do gelo L = 80 cal/g, calor específico da água c =
1cal/g°C , g = 10 m/s2.
6