Projeto de Recuperação Semestral - 2ª Série (EM)
QUÍMICA 1
MATÉRIA A SER ESTUDADA
Nome do Fascículo
Aula
Exercícios
Equilíbrio Químico
33
Equilíbrio Químico
34
Equilíbrio Químico
35
Equilíbrio Químico
36
Equilíbrio Químico
37
Equilíbrio Químico
38
Equilíbrio Químico
40
Equilíbrio Químico
41
Equilíbrio Químico
42
Equilíbrio Químico
44
Hidrólise Salina
45
Pg. 31: De fixação: 1, 2 ,3, 4 e 5
De aprofundamento: 7
Hidrólise Salina
46
Pg. 32: De fixação: 1,2,3 e 4
Hidrólise Salina
47
Pg. 33: DE fixação: 1
De aprofundamento: 5
Hidrólise Salina
48
Pg. 34: De fixação: 1 e 2
Pg. 31: De fixação: 1,2,3,4 e 5.
De aprofundamento: 6.
Pg.32: De fixação:;2;3;4 e 5
De aprofundamento: 6
Pg . 33: De fixação: 1; 3 e 4
De aprofundamento:5 e 6
Pg .34: De fixação: todos;
De aprofundamento: todos
Pg .35: De fixação: Todos;
De aprofundamento: 6
Pg 36:De fixação: 2 e 3
DE aprofundamento: 4 e 5
Pg. 38: De fixação: 1,3 e 4
De aprofundamento: 5 e 6
Pg. 39: De fixação: 2 e3
De aprofundamento: 4
Pg. 40: De fixação: 1, 2 ,3 e 5
De aprofundamento: 6
Pg. 42: De fixação: 3 e 4
LISTA DE EXERCÍCIOS QUE DEVERÁ SER ENTREGUE MANUSCRITA, NUMA FOLHA A4, SEM LINHAS E
GRAMPEADAS. A APRESENTAÇÃO DA LISTA TAMBÉM SERÁ LEVADA EM CONSIDERAÇÃO. COLOQUE
O NOME COMPLETO, UNIDADE E SÉRIE.
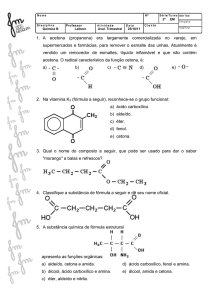
1. A obtenção de ferro metálico a partir de um minério envolve a etapa de equilíbrio representada pela equação:
Fe2O3(s) + 3CO(g) ⇄ 2Fe(s) + 3CO2(g)
Escreva a expressão da constante de equilíbrio da reação.
2. São colocados 8,0 mols de amônia num recipiente fechado de 5,0 litros de capacidade. Acima de 450°C,
estabelece-se, após algum tempo, o equilíbrio:
2NH3(g) ⇄ 3H2(g) + N2(g)
Sabendo que a variação do número de mols dos participantes está registrada no gráfico, podemos afirmar que,
nestas condições, a constante de equilíbrio, Kc, é igual a:
a) 27,00
b) 5,40
c) 1,08
d) 2,16
3. O CoCl2 é um sal de cor azul que se hidrata facilmente, passando a CoCl 2. 2H2O, de cor rosa. Enfeites como
"gatinhos", "galinhos" e outros bibelôs são recobertos com esse sal e mudam de cor em função da umidade do ar.
a) Escreva a equação química que representa o equilíbrio entre o sal anidro e o hidratado.
b) Indique qual a cor dos bibelôs em função do tempo úmido ou seco. Justifique.
4. Num determinado ambiente encontrava-se um frasco fechado contendo os gases NO2(castanho) e N2O4incolor),
que apresentam o equilíbrio assim equacionado:
2NO2(g) ⇄ N2O4(g)
∆H < 0
Esse frasco, a seguir, foi colocado num segundo ambiente, observando-se uma diminuição da coloração
castanha.
a) Escreva a expressão da constante de equilíbrio em função das pressões parciais dos gases envolvidos.
b) O que se pode afirmar com relação às temperaturas dos dois ambientes em que esteve o
frasco? Justifique sua afirmação.
5.Considerar o equilíbrio
Fe3O4(s) + 4H2(g) ⇄ 3Fe(s) + 4H2O(g)
a 150°C em recipiente fechado.
Escrever a expressão da constante de equilíbrio da reação.
Prever qual será o efeito da adição ao sistema em equilíbrio de:
a) mais H2(g);
b) mais Fe(s);
c) um catalisador.
6.A uma certa temperatura, 2 mols de NH3 estão 20% dissociados em N2 e H2. Sabendo que o recipiente é igual a
1L, determine o Kc para o equilíbrio :
2NH3(g) ⇄
N2(g) + 3H2(g)
7. A reação de combustão de monóxido de carbono a dióxido de carbono é um processo de equilíbrio químico
homogêneo gasoso.
a) Escreva a equação química balanceada do equilíbrio químico.
b) O que podemos fazer para aumentarmos a produção de dióxido de carbono?
8. Ácido benzóico é usado como conservante de alimentos que contêm água, pois inibe o crescimento de
microorganismos. Foi verificado que, quanto menor o pH do alimento a ser conservado, menor é a concentração
de ácido benzóico necessária para a ação conservante.
a) Escreva a equação que representa a ionização do ácido benzóico em água.
b) Proponha uma explicação para a dependência da concentração de ácido benzóico com o pH do alimento,
indicando qual a espécie (ácido benzóico não dissociado ou íon benzoato) responsável pela ação conservante.
9. Calcule o pH das soluções a seguir:
-3
a) 5.10 mol/L de H2SO4
-3
b) 10 mol/L de KOH
4-
c) 10 mol/L de HCN(α=10%)
10. Ácido adípico e málico são usados para controlar o pH de refrigerantes. Mostre qual dos dois ácidos, ao ser
adicionado até a concentração de 0,5 grama por litro de refrigerante, acarretará pH resultante mais baixo. A
resposta pode ser justificada sem cálculos.
11. Uma solução aquosa de ácido etanóico (ou acético) de concentração molar 0,001 mol/L (de grau de ionização
igual a 10,0%) é colocada em tubos de ensaios contendo alguns indicadores de pH. Qual o valor do pH e a
coloração da solução resultante, no tubo de ensaio contendo alaranjado de metila ou heliantina?
a) pH = 3 - róseo
b) pH = 4 - róseo
c) pH = 5 - incolor
d) pH = 3 - amarelo
e) pH = 4 – alaranjado
12. Do repolho roxo pode-se extrair, por fervura com água, uma substância que é responsável pela sua coloração
característica. Esta substância é um ânion de um ácido fraco cuja dissociação pode ser escrita como:
HR
(amarelo)
⇄
+
-
H + R
(roxo)
Utilizando este equilíbrio, explique por que a adição de vinagre ou limão (ácidos) a este extrato faz com que ele
mude de cor.
13. Uma área agrícola foi adubada com amônia, nitrato e fosfato de amônio. Na amostra das águas residuais da
-5
irrigação dessa área verifica-se que a concentração de íons OH (aq) é igual a 8×10 mol/L, a 25°C. Pode-se
afirmar que a amostra tem pH igual a
Dados:
log 8 = 0,90
+
-14
Kw = [ H ] [ H ] = 1×10 a 25°C
a) 9,9
b) 8,5
c) 7,0
d) 6,9
e) 3,9
14. Os solos argilosos são neutros ou levemente ácidos. Os solos calcários são básicos, e os solos arenosos são
ácidos ou neutros. Hortênsias plantadas em solo de pH inferior a 7 são rosas e azuis em pH superior a 7. Tendo
em vista as informações dadas, é INCORRETO afirmar que:
a) as hortênsias podem ser utilizadas como indicadoras de pH de um solo.
b) em solos arenosos, as hortênsias são rosas.
c) em solos calcários, as hortênsias são azuis.
d) em solos argilosos, as hortênsias são azuis e rosas.
15. Dadas três soluções aquosas a 25 °C: NaCl (solução I), NaF (solução II) e NH 4Cl (solução III).
a) Apresente a ordem crescente de acidez para estas três soluções.
b) Justifique sua resposta para o item a através do uso de equações químicas.
16. Complete as equações abaixo e classifique as soluções resultantes como ácida, básica ou neutra. Justifique
sua resposta.
a) NaCl (s) + H2O
b) H3CCOONa (s) + H2O
c) NH4Cl (s) + H2O
d) Na (s) + H2O
17. Sabe-se que: "A constante de hidrólise de um sal derivado de ácido forte e de base fraca é igual à razão entre
a constante de ionização da água (constante da autoprotólise) e a constante de ionização da base fraca, a uma
dada temperatura."
Em particular, considere uma solução de cloreto de amônio (NH4Cl) 0,10M, admitindo que tal cloreto esteja
-5
completamente dissociado (α=1) e que Kb=1,0.10 . Neste caso, a solução do sal terá caráter:
a) básico, devido à hidrólise do ânion
b) neutro, devido à hidrólise do cátion
c) básico, devido à hidrólise do cátion
d) ácido, devido à hidrólise do ânion
e) ácido, devido à hidrólise do cátion
18. Em uma solução de ácido acético temos o seguinte equilíbrio: HAc (l) ⇄ H
+
(aq) +
Ac
(aq)
+
Se adicionarmos acetato de sódio a essa solução, o que ocorrerá com a concentração de H ?Justifique.
Bom trabalho!!!
“Se o vento soprar de uma única direção, a árvore crescerá inclinada”
QUÍMICA 2
MATÉRIA A SER ESTUDADA
Fasciculo: Química Orgânica I:
Capítulo 1 Nomenclatura de hidrocarbonetos de cadeias normais – pg 30
Capítulo 2 Nomenclatura de hidrocarbonetos de cadeias normais e ramificadas – pg 31 a 33
Capítulo 3 Hidrocarbonetos pg 35 e 36.
Fascículo: Química Orgânica II:
Capítulo 1 –> Funções Oxigenadas pg 36 a 42
Capítulo 2 Funções Nitrogenadas e halogenadas pg 43 a 44
Capítulo 3 Isomeria plana pg 45 a 47
Para a perfeita compreensão dos conteúdos propostos nos exercícios é indispensável uma boa leitura nos
conceitos teóricos e anotações de caderno e sempre que necessário, busque ajuda nos plantões de dúvidas e nas
aulas de recuperação.
Bom Estudo.
LISTA DE EXERCÍCIOS PARA ENTREGAR
Atenção: As questões devem ser resolvidas, justifique a alternativa escolhida.
Química Frente II – Lista de Exercícios – Recuperação – 2ºSemestre de 2014
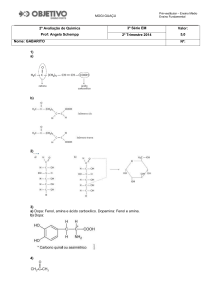
1) Dar o nome oficial para os seguintes hidrocarbonetos:
2) Escreva o nome proposto pela IUPAC para os seguintes compostos:
3) Com relação ao composto abaixo, dê os nomes dos radicais ligados ao carbono terciário
4) Dar o nome oficial (IUPAC) dos hidrocarbonetos representados pelas fórmulas:
a)
b)
5) Faça as fórmulas abaixo
I. 2,3-dimetil-hexan-2-ol
II. 2,4-dimetil-fenol
III. penta-cloro-fenol
IV. 3-metil-penten-2-ol-1
6) Dê os nomes dos compostos ou faça as fórmulas:
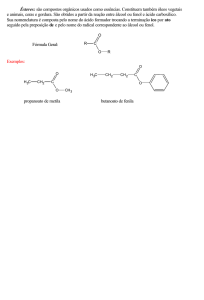
7) O aroma natural da baunilha, encontrado em doces e sorvetes, deve-se ao composto de nome vanilina, cuja
fórmula estrutural está reproduzida abaixo.
Em relação à molécula da vanilina, é correto afirmar que as funções químicas encontradas são:
8) Assinale o que for correto.
(01) Um composto, com fórmula molecular C 3H8O, pode ser um ácido carboxílico ou um álcool.
(02) A cachaça contém etanol.
(04) O composto H3C - CH2 - O - CH3 é um éster.
(08) O hexanal apresenta fórmula molecular C6H12O.
(16) A propanoma pode ser utilizada na remoção de esmalte de unha.
(32) O fenol é representado pela estrutura
e o tolueno(metilbenzeno), pela estrutura
Soma (
)
9) Na coluna, estão relacionadas as estruturas de algumas substâncias químicas e, na coluna de baixo, suas
aplicações.
1. CH3 – CO – CH3
2. C2H5 – O – C2H5
3. HCOH
4. CH3 – CH2 – OH
5. CH3 – COO – C2H5
( ) O etanoato de etila é empregado como essência artificial de maçã.
( ) O éter comum é usado como anestésico.
( ) A acetona ou propanona é usada como solvente de tinta e vernizes.
Relacionando-se a coluna de cima com a de baixo, obtêm-se os números na sequência:
a) 5 – 2 – 1
b) 2 – 3 – 1
c) 3 – 4 – 5
d) 4 – 2 – 3
e) 5 – 3 – 2
10) Os praticantes de esportes considerados “radicais”, frequentemente empregam a expressão: “é muita
adrenalina”, como significado de grande satisfação. Sabe-se que o aumento de concentração do hormônio
adrenalina no sangue é acompanhado dos aumentos de pressão sanguínea e do ritmo cardíaco, sensações
comuns em situações de risco.
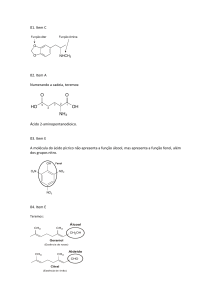
Indique os grupos funcionais presentes na molécula adrenalina.
a) Álcool, éster e amina.
b) Álcool, fenol e amida.
c) Fenol, álcool e amina.
d) Aldeído, cetona e fenol
e) Fenol, aldeído e amina.
11) Dê os nomes dos compostos:
12) Escreva a fórmula estrutural e dê o nome oficial de:
a) uma cetona, de cadeia carbônica ramificada saturada, com o total de 7 átomos de carbono.
b) um aminoácido, com 4 átomos de carbono.
13) Durante a Guerra do Vietnã, o chamado agente-laranja, que atuava como desfolhante nas árvores da floresta,
foi destaque, pois essa substância é altamente cancerígena.
As funções presentes na molécula deste composto são:
a) éster, ácido carboxílico e hidrocarboneto.
b) éter, haleto orgânico e ácido carboxílico.
c) tiocomposto, cetona e álcool.
d) amina, ácido carboxílico e amida.
e) ácido carboxílico, éter e nitrocomposto.
14) Dê os nomes ou faça a fórmula estrutural dos compostos:
15) Escreva os nomes e as funções orgânicas das substâncias de fórmulas:
16) Complete com palavras da alternativa correta: "Quando o grupo hidroxila estiver ligado diretamente a um
carbono saturado, teremos um _____________ e quando estiver ligado diretamente a um carbono insaturado do
anel benzênico, teremos um _________".
a) Álcool e Enol
b) Fenol e Álcool
c) Álcool e Fenol
d) Álcool e Ácido carboxílico
e) Ácido carboxílico e Álcool
17) Você já sentiu o ardido de pimenta na boca? Pois bem, a substância responsável pela sensação picante na
língua é a capsaicina, substância ativa das pimentas. Sua fórmula estrutural está representada a seguir.
Os grupos funcionais característicos na capsaicina são:
a) Cetona, álcool e amina.
b) Ácido carboxílico, amina e cetona.
c) Amida, éter e fenol.
d) Cetona, amida, éster e fenol.
e) Cetona, amina, éter e fenol.
18) Feromônios são substâncias químicas usadas na comunicação entre indivíduos de uma mesma espécie. A
mensagem química tem como objetivo provocar respostas comportamentais relativas à agregação, colaboração
na obtenção de alimentos, defesa, acasalamento, etc. Há uma variedade de substâncias que exercem o papel de
feromônios, como o CH3(CH2)3CH2OH (sinal de alerta) e o CH3CH2CO(CH2)5CH3 (preparar para a luta). Uma
mariposa chamada "Bombyx disparate" segrega um feromônio sexual capaz de atrair os machos da espécie numa
distância de até 800 metros. Tal substância apresenta, na molécula, a função epóxi. Um fragmento de uma
molécula desse feromônio, contendo apenas o principal grupo funcional, pode ser representado simplificadamente
como -CHOCH-.
a) Copie as duas fórmulas das substâncias citadas acima. Em cada uma delas, marque e dê o nome de uma
função química presente.
b) Escreva o nome químico da substância referente ao sinal de alerta.
19) Para responder à questão a seguir, numere a coluna B, que contém alguns nomes de compostos orgânicos,
de acordo com a coluna A, na qual estão citadas funções orgânicas.
A sequência CORRETA dos números da coluna B, de cima para baixo, é:
a) 2 - 1 - 3 - 5 - 4.
b) 3 - 1 - 2 - 4 - 5.
c) 4 - 3 - 2 - 1 - 5.
d) 3 - 2 - 5 - 1 - 4.
e) 2 - 4 - 5 - 1 - 3.
20) O composto tetracloretano é uma das substâncias usadas na chamada “lavagem química”, ou “lavagem a
seco” de roupas. Sua fórmula molecular é:
a) CCℓ4
b) CHCℓ3
c) C2H2Cℓ4
d) C3H2Cℓ4
e) CH2Cℓ4
21) Relativamente ao álcool secundário, de fórmula molecular C3H7OH, é incorreto afirmar que:
a) tem fórmula estrutural H3C - CH2 - CH2 - OH.
b) é o propan-2-ol.
c) é isômero de posição do propan-1-ol.
d) é isômero de função do metóxi-etano.
e) não possui isômero de cadeia.
22) A fórmula simplificada representa um hidrocarboneto saturado.
a) Escreva a fórmula estrutural do hidrocarboneto e dê seu nome oficial.
b) Escreva a fórmula estrutural e dê o nome de um hidrocarboneto de cadeia linear, isômero do hidrocarboneto
dado.
23) Considere as afirmações:
I. Propanal é um isômero da propanona.
II. Etil-metil-éter é um isômero do propan-2-ol.
III. Propan-1-ol é um isômero do propan-2-ol.
IV. Propilamina é um isômero da trimetilamina.
Estão corretas:
a) Todas.
b) Apenas I, II e III.
c) Apenas I e II.
d) Apenas II e IV.
e) Apenas III e IV.
24) Associe os pares de compostos dos dois grupos com o tipo de isomeria existente entre eles.
A alternativa que apresenta uma associação correta é:
a) I-3; II-2; III-4; IV-1
b) I-3; II-2; III-1; IV-4
c) I-2; II-3; III-1; IV-4
d) I-2; II-3; III-4; IV-1
e) I-1; II-2; III-3; IV-4
25) A, B, C têm a mesma fórmula molecular C3H8O. A tem 1 hidrogênio em C secundário e é isômero de posição
de B. Tanto A como B são isômeros de função de C.
Escreva a fórmula estrutural e os nomes de A, B e C.