PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA INORGÂNICA - 2ª SÉRIE - ENSINO MÉDIO
=============================================================================================
01- Evapora-se completamente a água de 40g de solução de nitrato de prata, saturada, sem corpo de fundo, e obtêm-se
15g de resíduo sólido. O coeficiente de solubilidade do nitrato de prata para 100g de água na temperatura da solução
inicial é:
(A) 25g.
(C) 60g.
(E) 45g.
(B) 30g.
(D) 15g.
02- Uma solução saturada de nitrato de potássio (KNO3) constituída, além do sal, por 100g de água, está à temperatura de
70°C. Essa solução é resfriada a 40°C, ocorrendo precipitação de parte do sal dissolvido.
Dado: solubilidade do nitrato de potássio em função da temperatura:
70°C = 140g/100g H2O
40°C = 80g/100g H2O
Calcule:
a) a massa do sal que precipitou.
b) a massa do sal que permaneceu em solução.
03- Sabendo que a solubilidade do NaCl a 100°C é de 39g/100g de H2O e, a 20°C, é de 36g/100g de H2O, calcule qual é a
massa de água necessária para dissolver 780g de NaCl a 100°C e qual é a massa de NaCl que permanecerá
dissolvida quando essa solução for resfriada até 20°C.
04- Sabendo que uma solução aquosa de sulfato de sódio (Na2SO4) contém 71g desse sal, dissolvidos em 250mL de
solução, calcule a concentração desta, em mol/L. (Dados: Na = 23; S = 32; O = 16)
05- Determine as massas, respectivamente, de H2C2O4 e H2O, que devem ser misturadas para preparar 1000g de solução
a 5% de H2C2O4.
MCS/0803/BANCO DE QUESTOES/QUIMICA INORGANICA/QUIMICA INORGANIA - 2a SERIE - ENSINO MEDIO - 2a ETAPA - 2008 - PARTE 1.DOC
Página 1 de 1 - 30/06/2008 - 11:59
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA INORGÂNICA - 2ª SÉRIE - ENSINO MÉDIO
=============================================================================================
01- Que tipo de concentração de soluções é mencionada no
texto:
(A) concentração comum
(B) densidade
(C) título em massa
(D) molaridade
02- Sabendo que a densidade do sangue é de 1,05g/mL e o
volume de sangue de um homem adulto é de,
aproximadamente, 7 litros, qual a massa de álcool em um
homem intoxicado, segundo o texto:
(A) 7,35 g
(C) 735 g
Álcool: um estimulante?
Já sabemos que o álcool é um depressivo do
sistema nervoso central e não estimulante.
A falsa sensação de estímulo ocorre devido à
ação do álcool em áreas do cérebro responsável pela
coordenação motora, pelo raciocínio e discernimento.
A curto ou em longo prazo, a redução dessas
capacidades põe em risco a vida dos usuários.
Em muitos países, uma concentração de álcool
no sangue igual a 0,1% é evidência de intoxicação e
pode causar complicações jurídicas ao responsável.
(B) 7,35 Kg
(D) 735 mg
“Lembo – Química, realidade e contexo”
03- Para o bom funcionamento de nosso organismo precisamos ingerir diariamente uma série de íons metálicos.
Observe na tabela, alguns exemplos validos para um adulto:
ÍONS
NECESSIDADE DIÁRIA
Na+
0,23g
Equilíbrio iônico nos íons celulares
FUNÇÃO NO CORPO
Sal de cozinha e alimento enlatados
PRINCIPAIS FONTES
K+
3,90g
Equilíbrio iônico nos íons celulares
Frutas peixes e trigo
++
0,35g
Processos enzimáticos
Chocolate e trigo
++
0,80g
Formação de ossos e dentes
Leite, queijo e brócolis
Mg
Ca
+
a) Sabendo que uma solução apresenta concentração de íons Na igual a 0,01 mol/L determine o volume, em litros,
dessa solução que deve ser ingerido por um homem adulto para suprir totalmente sua necessidade diária em Na+.
++
b) Em 1,0 litro de leite contém 1,2g de íons cálcio (Ca ), calcule o volume de leite, em mL, que deve ser ingerido de
leite por um adulto para suprir totalmente a necessidade diária.
04- Um técnico de laboratório farmacêutico dispõe de 500g de soro glicosado a 15%, mas deseja transformá-lo inteiramente
em soro 5%. Determine a massa de água destilada (água pura) que deve ser adicionada para que isso ocorra.
05- Um frasco com 500mL de solução apresenta dissolvido 1,96g de H2SO4. Determine a concentração em mol/L dessa
solução.
06- Um frasco designado por A, apresenta 100mL de solução 0,24 mol/L de dicromato de potássio, que possui uma
coloração alaranjada. Um outro frasco, designado por B, apresenta 150 mL de solução 0,04mol/L do mesmo soluto.
Determine a concentração em mol/L da solução resultante da mistura dos frascos A e B.
MCS/0803/BANCO DE QUESTOES/QUIMICA INORGANICA/QUIMICA INORGANIA - 2a SERIE - ENSINO MEDIO - 2a ETAPA - 2008 - PARTE 3.DOC
Página 1 de 1 - 30/06/2008 - 11:59
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA INORGÂNICA - 2ª SÉRIE - ENSINO MÉDIO
=============================================================================================
01- Quatro tubos contêm 20mL de água, a 20°C, cada um. Coloca-se nesses tubos dicromato de potássio, K2Cr2O7, nas
seguintes quantidades:
Tubos de ensaio
Massa de sal (em g)
Tubo A
Tubo B
Tubo C
Tubo D
1,0
3,0
5,0
7,0
A solubilidade desse sal é expressa no gráfico abaixo:
Gramas de soluto/100g de água
12,5
Temperatura (°C)
20
Após agitação, em quais dos tubos coexistem, nessa temperatura, solução saturada e precipitado.
02- Um indivíduo que suspeitava estar diabético dirigiu-se a um laboratório de análises clínicas. O laboratório analisou
0,5mL de seu soro sanguíneo e encontrou 0,9mg de glicose (C6H12O6). Sabe-se que o limite de 110mg de glicose por
100mL de soro sanguíneo, o indivíduo é considerado diabético. Com base nesses dados mencionados acima, calcule:
a)
A concentração, em g/L, de glicose no soro sanguíneo do indivíduo e responda se ele pode ou não, ser
considerado diabético. Justifique sua resposta.
b)
A concentração em quantidade de matéria (mol) da glicose por litro de soro sanguíneo do indivíduo.
03- Um dentista precisava obter uma solução aquosa de fluoreto de sódio (NaF) na concentração de 21g/L para ser usada
por um paciente no combate e na prevenção da cárie.
Ele dispunha no consultório de 250mL de uma solução aquosa 1,0M de fluoreto de sódio.
a)
Calcule o volume, em litros, de solução aquosa que pode ser obtida para aplicar no cliente.
b)
Determine a massa, em gramas, de soluto existente na solução que se dispunha no consultório e na solução
obtida.
04- Uma titulação ácido-base foi realizada para o controle de qualidade de um vinagre comercial a 4,2% em massa de
ácido acético (C2H4O2). Para tanto, foi utilizada uma alíquota de 4mL de vinagre com algumas gotas de fenolftaleína.
O ponto de viragem (mudança permanente da coloração para rosa) ocorreu após o consumo de 28mL de NaOH 0,1
molar. Determine a concentração molar do vinagre.
MCS/0803/BANCO DE QUESTOES/QUIMICA INORGANICA/QUIMICA INORGANIA - 2a SERIE - ENSINO MEDIO - 2a ETAPA - 2008 - PARTE 2.DOC
Página 1 de 1 - 30/06/2008 - 11:41
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA – 1ª SÉRIE - ENSINO MÉDIO
================================================================================================
01- Têm-se dois elementos químicos A e B, com números atômicos iguais a 20 e 35, respectivamente.
a) Escreva as configurações eletrônicas dos dois elementos. Com base nessas configurações, diga a que grupo da
Tabela Periódica pertence cada um dos elementos em questão.
b) Qual será a fórmula do composto formado entre os elementos A e B? Que tipo de ligação existirá entre esses
elementos no composto formado? Justifique sua resposta.
02- Um elemento metálico X reage com o cloro, originando um composto de fórmula XCl. Um outro elemento Y, também
metálico, reage com o cloro, originando um composto de fórmula YCl2. As massas atômicas relativas de X e Y são
próximas.
a) Em que família da Tabela Periódica estariam os elementos X e Y?
b) Consulte a Tabela Periódica e dê o símbolo de dois elementos que poderiam corresponder a X e Y.
03- Um elemento E, pertencente ao terceiro período da Tabela Periódica, forma com o hidrogênio um composto de fórmula H2E
e com o sódio um composto de fórmula Na2E.
a) Represente a configuração eletrônica desse elemento.
b) A que família pertence?
04- O elemento químico metálico A combina-se com o flúor formando o composto AF3. O número atômico do metal pode ser:
(A)
(B)
(C)
(D)
(E)
21
20
30
13
37
Página 1 de 3 - 13/06/2006 - 9:54
05- Um elemento M do grupo 2A forma um composto binário iônico com um elemento X do grupo 7A. Assinale, entre as
opções abaixo, a fórmula mínima do respectivo composto:
(A)
(B)
(C)
(D)
(E)
MX.
MX2.
M2X.
M2X7,
M7X2.
06- Sobre os metais, a classificação periódica permite prever que:
I.
II.
III.
IV.
Tendem a perder elétrons.
Tendem a receber elétrons.
Não existem nos grupos representativos.
Tendem a apresentar baixa energia de ionização e baixa afinidade eletrônica.
• Estão corretas somente as previsões:
(A)
(B)
(C)
(D)
(E)
I e IV.
I e III.
II e IV.
II e III.
I, III e IV.
07- Quando retiramos o primeiro elétron de um átomo neutro, no estado gasoso, podemos afirmar que:
(A) Diminui a força de atração do núcleo sobre os elétrons restantes, portanto a primeira energia de ionização é sempre
maior que a segunda.
(B) Diminui a força de atração do núcleo sobre os elétrons restantes, portanto a primeira energia de ionização é sempre
menor que a segunda.
(C) Aumenta a força de atração do núcleo sobre os elétrons restantes, portanto a primeira energia de ionização é sempre
maior que a segunda.
(D) Aumenta a força de atração do núcleo sobre os elétrons restantes, portanto a primeira energia de ionização é sempre
menor que a segunda.
(E) Se o segundo elétron estiver no mesmo nível de energia do primeiro, então a primeira energia de ionização será
sempre igual à segunda.
08- Baseando na localização dos elementos na Tabela Periódica, o químico pode correlacionar os dados referentes aos
elementos e predizer logicamente propriedades e reações.
a) O elemento que é um metal alcalino-terroso e tem a menor eletronegatividade de seu grupo.
b) O elemento que forma composto iônico com os elementos do grupo 1A com fórmula X2Y e tem o menor raio atômico
de seu grupo.
09- Os elementos A(Z=17); B(Z=35) e C(Z=53) apresentam valores dos potenciais de ionização iguais a 300Kcal/mol,
273Kcal/mol e 241Kcal/mol, não necessariamente nessa ordem. Quais são os valores dos potenciais de A, B e C.
10- Escreva a fórmula estrutural das substâncias abaixo:
a) PCl3
b) N2O3
c) SiH4
d) H2S
e) CO2
f) PH3
Página 2 de 3 - 13/06/2006 - 9:54
GABARITO
01- a) 20A 1s2 2s22p6 3s2 3p6 4s2
35B
1s2 2s22p6 3s2 3p6 4s2 3d10 4p5
b) AB2 . Iônico, pois ocorre entre um metal e um ametal por transferência de elétrons
02- a) 1A e 2ª
b) Na e Mg
2
2
6
2
4
03- a) 16S 1s 2s 2p 3s 3p
b) Calcogênios
04- (D)
05- (B)
06- (A)
07- (D)
08- a) Ra
b) O
09- A = 300Kcal/mol ; B=273 Kcal/mol ; C=241Kcal/mol
10-
Cl
a)
O
P
Cl
c)
b)
N
O
N
O
H
H
d)
Si
H
H
S
H
Cl
H
H
e)
f)
O
C
O
H
P
H
FM/0606/BANCO DE QUESTOES/QUIMICA /QUIMICA - 1a SERIE - ENSINO MEDIO - 2a ETAPA - 2006 - PARTE 2.DOC
Página 3 de 3 - 13/06/2006 - 9:54
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA ORGÂNICA – 1ª SÉRIE - ENSINO MÉDIO
================================================================================================
01- Escreva as fórmulas moleculares dos seguintes óxidos:
a) pentóxido de difosforo:
b) óxido de bismuto:
c) óxido de zinco:
d) óxido cuproso:
e) óxido de manganês II:
f) tetróxido de trichumbo:
02- Classifique e dê nomes aos seguintes óxidos:
a) P2O5
b) Rb2O
c) SO2
d) Na2O2
e) MnO
f) As 2O3
g) NO
h) K2O2
i) CO
j) SnO2
k) H 2O2
l) Al 2O 3
m) Sb2O5
n)PbO
Página 1 de 3 - 15/09/2006 - 2:12
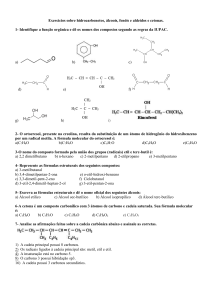
03- No interior do alto-forno de uma usina siderúrgica, ocorrem várias reações químicas; uma das reações é Fe 2O3+CO?
Fe+CO2, com obtenção de ferro metálico. Balanceando a reação acima, os coeficientes da reação serão,
respectivamente:
04- O fósforo branco (P4) é uma substância muito empregada para finalidades bélicas, na confecção de bombas incendiárias e
granadas luminosas. Ele é obtido pelo aquecimento, em forno elétrico, de fosfato de cálcio, areia e coque. A equação
química (não balanceada) é:
Ca3(PO 4)2+SiO2+C? CaSiO3+CO+P4
Os coeficientes estequiométricos da equação, respectivamente serão:
05- A reação abaixo pode representar a reação de neutralização do ácido clorídrico em excesso no suco gástrico pelo
hidróxido de magnésio, quando se ingere o antiácido leite de magnésio.
Mg(OH)2+HCl? MgCl2+H2O
Os coeficientes estequiométricos da equação, respectivamente serão:
06- Dê os produtos das seguintes reações:
a) H 2SO4+2NaOH?
b) H 2SO4+Na2O ?
c) CO2+Ca(OH)2?
d) Cl2O7 + H 2 O ?
e) SO2 + H 2O ?
f) CaO + H 2O ?
g) CO2 + KOH ?
h) FeO + H 2SO4 ?
i) CO2 + NaOH ?
j) Al 2O 3 + H 2SO4 ?
k) MgO + HCl ?
l) FeO + H 3PO4 ?
m) SO3 + Ca(OH)2 ?
Página 2 de 3 - 15/09/2006 - 2:12
n) N 2O5 + H 2O ?
o) Cl2O5 + H 2 O ?
p) CaO + HBr ?
q) SO2 + Mg(OH) 2 ?
r) CuO + HCl ?
s) Cu 2O + H 2O ?
f) CO + NaOH ?
07- Escreva as equações de salificação com neutralização total entre:
a) ácido sulfúrico e hidróxido de potássio
b) ácido clorídrico e hidróxido de sódio
c) ácido fosfórico e hidróxido de alumínio
MCS/0609/BANCO DE QUESTOES/QUIMICA ORGANICA/QUIMICA ORGANCA - 1a SERIE - ENSINO MEDIO - 3a ETAPA - 2006.DOC
Página 3 de 3 - 15/09/2006 - 2:12
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA INORGÂNICA – 2ª SÉRIE - ENSINO MÉDIO
================================================================================================
01- Dado o pH de algumas substâncias utilizadas no dia a dia:
substâncias
pH a 25 °C
Refrigerante
2,5
Vinagre
3,0
Água pura
7,0
Bicarbonato de sódio
8,5
Amoníaco de uso doméstico
12,0
a) Quais substâncias são ácidas e quais são básicas? Justifique sua resposta em função do valor do pH.
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
b) Qual a concentração hidrogeniônica no vinagre e no amoníaco?
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
c) Qual o pOH do refrigerante nesta temperatura?
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
02- Os hidróxidos em geral são substâncias iônicas. Sendo assim, são sólidos nas condições ambientes, tem alto ponto de
fusão e conduzem bem a corrente elétrica quando dissolvidos em água.
O hidróxido de amônio, no entanto, não existe no estado sólido e consiste de uma mistura de gás amoníaco em água que,
por ionização, produz íons em pequenas quantidades, segundo a equação:
NH3 (g) + H2O (l)
NH4 + (aq) + OH - (aq)
• Considere uma solução 0,1 M de NH3, 1% ionizada.
a) Qual o pH dessa solução, a 25 °C?
R.: _______________________________________________________________________________________________
_________________________________________________________________________________________________
b) Qual a expressão matemática da constante de ionização em meio aquoso?
R.: _______________________________________________________________________________________________
_________________________________________________________________________________________________
Página 1 de 2 - 25/10/2006 - 12:52
03- Explique qual o efeito sobre a quantidade de I2, no equilíbrio do sistema: H2 (g) + I2 (g)
seguintes casos:
2 HI (g) em cada um dos
a) Diminuição da pressão do sistema, à temperatura constante;
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
b) Adição de H2(g);
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
c) Adição de Pt, como catalisador, à mistura em equilíbrio.
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
04- A tabela a seguir fornece a concentração hidrogeniônica ou hidroxiliônica a 25 °c, em mol/l, de alguns produtos.
produto
concentração em mol/l de íons H + ou OH-
vinagre
[OH-] = 1,0x10 -11
cafezinho
[H+] = 1,0x10 -5
clara de ovo
[OH-] = 1,0x10 -6
desinfetante com amônia
[H+] = 1,0x10 -12
a) Indique qual destes produtos são ácidos e quais são básicos.
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
b) Calcule o pOH do cafezinho
05- Determine o pH de uma solução 0,050 molar de hidróxido de bário, Ba (OH)2, que se encontra 100% ionizado,
considerando que a constante do produto iônico da água Kw = 1,0 x 10 -14 . (25%)
FM/0610/BANCO DE QUESTOES/QUIMICA INORGANICA/QUIMICA INORGANIA - 2a SERIE - ENSINO MEDIO - 4a ETAPA - 2006.DOC
Página 2 de 2 - 25/10/2006 - 12:52
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA INORGÂNICA – 2ª SÉRIE - ENSINO MÉDIO
================================================================================================
01- O odor de peixe é causado pela presença de aminas (R - NH2) provenientes da decomposição de algumas proteínas do
peixe. Esses compostos orgânicos são básicos e, portanto, para retirar o cheiro desagradável das mãos, basta adicionar
um ácido, como vinagre ou limão.
CH3 – NH2 + H2O
+
CH3 – NH3+ OH
• A adição de água aumenta ou diminui o odor desagradável dos peixes? Justifique sua resposta.
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
02- Considere o equilíbrio: PCl5(g)
deslocado o equilíbrio quando:
PCl3 + Cl2 ∆H = + 39,5Kcal/mol. Em que sentido (direto ou inverso) será
a) Aumentarmos a pressão do sistema - _________________________________________________________________
b) Adicionarmos catalisador ao sistema - _________________________________________________________________
c) Aumentarmos a temperatura do sistema - _____________________________________________________________
03- O suco de laranja, uma fonte de vitamina C, é uma solução aquosa de caráter ácido. Seu pH, que geralmente está situado
na faixa de 2,6 a 3,9 dependendo da variedade de laranja e das condições sob as quais foi cultivada. Considerando que
um suco de laranja tem um pH que equivale a um número inteiro que esta dentro desse intervalo que geralmente é
encontrado nos sucos de laranja.
• Determine a razão da concentração molar de íons H e dos íons OH no suco de laranja considerado.
+
-
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
04- O cianeto de hidrogênio, HCN, é um líquido branco e transparente em temperaturas abaixo de 25,6 °C (que é seu ponto de
ebulição). Possui odor de amêndoas amargas e forma um ácido fraco, conhecido comercialmente por ácido prússico,
extremamente venenoso (é mortal na concentração de 0,3 mg/L de ar). Seu descobridor, Carl Wilhelm Scheele, morreu ao
deixar cair um vidro contendo esse ácido. Já foi muito utilizado nos EUA na câmara de gás para condenados à morte. É
matéria prima para fabricação de plásticos, acrilonitrila e acrilatos. Devido a isso, em um acidente com um avião da VARIG,
em julho de 1973, morreram 126 pessoas por inalação de fumaça de ácido cianídrico, proveniente da combustão de
material plástico, fabricado a partir desse produto. Dada uma solução de ácido cianídrico 0,1 mol/L, a 25°C, cujo grau de
ionização é igual a 8,0.10-3%, responda:
• Dado: log 2 = 0,3
a) Qual a concentração hidrogeniônica, [H+ ], nessa solução, a 25°C?
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
b) Qual o valor da constante de ionização do ácido HCN(aq), a 25°C?
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
Página 1 de 2 - 25/10/2006 - 12:50
c) Qual o valor do pH da solução de HCN, a 25°C?
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
05- Cinco soluções foram testadas para acidez. Considere a tabela abaixo com dados para essas soluções a 25°C:
Solução A
[H+]/ [OH-] = 10-2 M
Solução B
pH/pOH = 1
Solução C
[OH ] = 10 M
Solução D
pOH = 1
Solução E
pH = 7
-
-9
Qual possui caráter básico?
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
FM/0610/BANCO DE QUESTOES/QUIMICA INORGANICA/QUIMICA INORGANIA - 2a SERIE - ENSINO MEDIO - 4a ETAPA - 2006 - PARTE 2.DOC
Página 2 de 2 - 25/10/2006 - 12:50
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA INORGÂNICA – 2ª SÉRIE - ENSINO MÉDIO
================================================================================================
01- Para remover uma mancha de um prato de porcelana, fez-se o seguinte: cobriu-se a mancha com meio copo de água fria,
adicionaram-se algumas gotas de vinagre e deixou-se por um dia. No dia seguinte, a mancha havia clareado levemente.
• Usando apenas água e vinagre, sugira duas alterações no procedimento, de tal modo que a remoção da mancha possa
ocorrer em menor tempo. Justifique sua resposta.
__________________________________________________________________________________________________
__________________________________________________________________________________________________
02- Foram obtidos os seguintes dados experimentais para a reação:
X+Y→Z
Experiências
[X]
[Y]
Velocidade (mol/l.s)
1
0,03
0,15
9,0x10-3
2
0,06
0,15
3,6x10-2
3
0,03
0,30
1,8x10
-2
a) Escreva a expressão Matemática da velocidade, lei de ação das massas, para a reação acima. (é necessária a
realização de cálculos)
b) Calcule o valor de K, na temperatura de experimento.
03- Considere o gráfico de uma reação:
Energia
EY
a
E’
Xa
Z
produtos
Sentido da reação
Página 1 de 5 - 12/09/2006 - 1:24
É fato na química, que uma reação para ocorrer precisa da presença de choques efetivos entre os reagentes envolvidos,
para que esses possam atingir o estado intermediário e conseqüentemente os produtos. Esses choques necessitam de
uma orientação favorável, e de uma quantidade mínima de energia, quantidade essa, que é característica de cada reação.
• Utilizando os conceitos da cinética química, responda as questões abaixo:
a) Qual o significado da variação de energia representada por X, no gráfico acima?
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
b) Qual o significado da variação de energia representada por Y no gráfico acima?
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
c) Qual o significado da variação de energia representada por Z no gráfico acima?
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
d) A reação é endotérmica ou exotérmica? Justifique sua resposta.
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
04- Considere a equação da seguinte reação gasosa elementar:
4NO2 + O2 → 2N2O5
• Admitindo que o consumo de oxigênio molecular tem uma velocidade de 0,05mol/L.s, faça o que se pede:
a) Escreva a expressão matemática da velocidade instantânea.
b) Calcule a massa, em gramas, de NO2 consumida após 1 minuto.
Página 2 de 5 - 12/09/2006 - 1:24
05- O peróxido de hidrogênio, H2O2, comumente chamado de “água oxigenada”, pode reagir com íons I- (iodeto) em solução
aquosa, segundo uma reação de decomposição que se processa em duas etapas:
I – H2O2 + I → H2O + IO (etapa lenta)
II – H2O2 + IO → H2O + O2 + I (etapa rápida)
• Considerando a equação global: 2H2O2 → H2O + O2
a) Escreva a expressão matemática da lei da velocidade para essa reação.
b) Determine a ordem da reação em função da água oxigenada.
c) Qual a função do íon iodeto ( I- ) na decomposição da água oxigenada?
06- Bicarbonato de sódio sólido é usado como fermento químico porque se decompõe termicamente, formando gás carbônico,
de acordo com a reação representada pela equação química:
2 NaHCO3 (s)
Na2CO3 (s) + CO2 (g) + H2O (g)
• Escreva a expressão matemática para constante de equilíbrio em termos de pressão.
07- Calcule o valor da constante de equilíbrio em termos de concentração para o sistema em equilíbrio:
N2(g) + 3H2(g)
2NH3 (g)
• Sabendo que as concentrações no equilíbrio são:
[ N2 ] = 0,5 molar ; [ H2 ] = 1,0 molar e [ NH3 ] = 2 molar
Página 3 de 5 - 12/09/2006 - 1:24
08- Para se descobrir o valor da constante de equilíbrio da reação gasosa:
2HI
H2 + I2
• Foi adicionado a um frasco de volume desconhecido, 2,0mols de HI. Após o equilíbrio ser atingido foi observada a
presença de 0,8mol de I2. Determine o valor de Kc obtido nesse experimento.
09- O acetato de etila, usado como essência artificial de frutas e como solvente para vernizes e lacas, entre outras aplicações,
é preparado a partir do ácido acético e do etanol. A reação para sua obtenção pode ser representada pela equação:
CH3COOH + C2H5OH → CH3COOC2H5OH + H2O.
• Partindo-se de 3 mols de ácido acético e 3 mols de etanol e realizando-se a reação em reator fechado, a 100°C, verifica-se que o equilíbrio é alcançado após reagirem dois mols do ácido.
10- São misturados 2 mols de H2 e 1 mol de O2 num recipiente de 1 litro. A certa temperatura se estabelece o equilíbrio:
2H2(g) + O2
2H2O(g)
• Calcule a constante de equilíbrio Kc, para esse equilíbrio, sabendo que 90% do H2 reagiram.
Página 4 de 5 - 12/09/2006 - 1:24
GABARITO
01- Aquecer a água e aumentar a concentração do vinagre.
02- a) V = K.[X]2.[Y]
b) K = 6.103
03- a) Energia de ativação com catalisador
b) Energia de ativação sem catalisador
c) Variação de entalpia (∆H)
d) Exotérmica, por que Hp < Hr ou seja ∆H < 0
4
04- a) V = K.[NO2] .[O2]
b) m = 552g
-
05- a) V = K.[H2O2].[I ]
b) 1ª ordem
c) catalisador
06- Kc = [CO2].[H2O]
07- Kc = 8 (mol/L)-2
08- Kc = 4
09- Kc = 4
10- Kc = 810
FM/0608/BANCO DE QUESTOES/QUIMICA INORGANICA/QUIMICA INORGANIA - 2a SERIE - ENSINO MEDIO - 3a ETAPA - 2006.DOC
Página 5 de 5 - 12/09/2006 - 1:24
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA INORGÂNICA – 3ª SÉRIE - ENSINO MÉDIO
================================================================================================
9
01- Em 2005 foram consumidos no Brasil, cerca de 164 bilhões (164.10 ) de cigarros. A massa queimada de um cigarro é,
aproximadamente, 0,85 gramas. Considerando que 40% da massa do cigarro seja do elemento carbono, quantas
toneladas de dióxido de carbono os fumantes lançaram na atmosfera no Brasil em 2005.
C + O2 → CO2
02- O solvente acetato de etila (C4H8O2) é obtido pela reação do ácido acético com etanol. Sabendo que o rendimento é de
80%, calcule a massa de ácido acético necessária para a produção de 70,4 Kg de acetato de etila.
C2H4O2 + C2H5OH → C4H8O2 + H2O
03- Uma amostra de 1,225g de KClO3 é decomposta por aquecimento em cloreto de potássio sólido e oxigênio molecular
gasoso. O oxigênio molecular formado na reação ocupou um volume de 0,168L nas CNTP. Calcule o grau de pureza da
amostra.
KClO3 → KCl + O2
04- Na reação CH4 + Cl2 → CH3Cl + HCl, foram adicionados 0,8g de CH4. Determine o volume de Cl2 gasoso, na CNTP,
necessário para reagir com todo CH4 adicionado.
05- A tabela abaixo fornece dados sobre soluções aquosas dos frascos A e B:
SOLUTO
VOLUME DA SOLUÇÃO
SOLVENTE
-2
FRASCO A
5.10 mol de HNO3
H2O
100 ml
FRASCO B
9,8g de H2SO4
6 mols de H2O
a) Determine a molaridade da solução do frasco A.
b) Determine a massa, em gramas, da solução do frasco B.
06- Considere as soluções aquosas:
I- 37,6 g de BaCl2 em q.s.p. 250 mL;
II- 0,82 g de Na2SO4 em q.s.p. 25 mL.
a) Calcule a concentração molar da solução I e a da solução II.
b) Que volume da solução I é necessário para reagir, completamente, com a totalidade da solução II ?
07- Foram misturados e agitados 400g de sulfato de sódio com 750g de água a 18°C, resultando um sistem a heterogêneo. Por
filtração desse sistema foram obtidos 900g de solução saturada. Calcule o Cs do sal a 18°C e a massa do resíduo da
filtração.
MCS/0610/BANCO DE QUESTOES/QUIMICA INORGANICA/QUIMICA INORGANIA - 3A SERIE - ENSINO MEDIO - 4A ETAPA - 2006.DOC
Página 1 de 1 - 25/10/2006 - 12:37
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA ORGÂNICA – 2ª SÉRIE - ENSINO MÉDIO
=============================================================================================
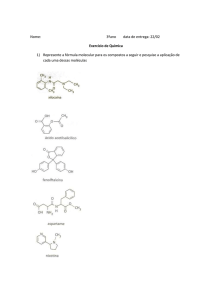
01- Baseado na estrutura do Dicloro-Difenil-Trocloroetano - “DDT” abaixo, julgue os itens em VERDADEIRO (V) ou
FALSO (F):
(
(
(
(
(
) Todos os átomos de carbono da estrutura são secundários e terciários.
) A fórmula molecular do DDT é C14H9Cl5.
) Têm-se seis átomos de hidrogênio ligados a carbonos dos anéis aromáticos.
) Têm-se dez átomos de carbonos secundários.
) Todos os carbonos insaturados são classificados como carbonos secundários.
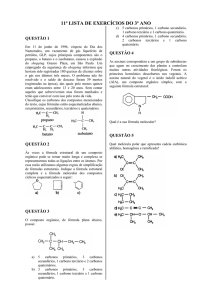
02- Dos compostos orgânicos: eteno, 3,3 – dimetil – 1,4 – pentadieno, propeno, 3,3 – dimetil – 1 – butino, 3,3 – dimetil
– 1 – butino e isobutano, indique através da fórmula estrutural, aquele que apresenta o composto constituído por um
3
carbono hibridizado na forma sp terciário.
03- Ao se fazer um churrasco de carne vermelha, percebe-se, à distância, um aroma característico. Isto se deve, em parte,
à reação de decomposição do glicerol, com formação de acroleína, um líquido de forte odor.
OH OH OH
C H2CH2-CH2
-
Glicerol
O
H2C CH-C
H
+
Acroleína
• Escreva a nomenclatura segundo a IUPAC para os compostos glicerol e acroleína.
Página 1 de 4 - 25/10/2006 - 12:48
H2 O
04- A azadiractina é um composto natural isolado da árvore indiana Azadirachta indica com potente atividade nematicida e
antialimentar para insetos.
O
1
2
O
O
O
OH
O
4
O
O
O
OH
O
O
O
3
Azadiractina
• A partir do composto orgânico descrito acima, identifique as funções orgânicas destacadas acima.
05- Escreva a reação de esterificação e a nomenclatura segundo a IUPAC, para um éster que apresenta as seguintes
características: cadeia aberta, saturada, ramificada, contendo um total de 5 átomos de carbono.
06- O ciclopropano e o éter etílico (etoxi etano) foram muito utilizados, no passado, como anestésicos de inalação. Escreva
a fórmula estrutural e o nome de um álcool terciário que apresenta a mesma fórmula molecular do éter etílico.
Página 2 de 4 - 25/10/2006 - 12:48
07- A depressão é um problema cujo diagnóstico tem crescido de forma alarmante em todo o mundo. Entre as drogas
usadas no tratamento da depressão estão a fluoxetina e a duloxetina, cujas estruturas químicas são representadas
abaixo:
• A partir das substâncias descritas acima, determine: duas funções orgânicas comuns a Fluoxetina e a duloxetina.
Pode-se dizer que os dois compostos são isômeros? Justifique a sua resposta.
R.: ____________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
08- Na tabela abaixo estão caracterizados três dos ácidos carboxílicos presentes em nosso dia-a-dia.
• Escreva a reação de esterificação do ácido com odor de cabras com etanol.
09- A capsaicina (figura abaixo) é o princípio ativo de medicamento extraído da pimenta. Determine as funções químicas
presentes na capsaicina.
Página 3 de 4 - 25/10/2006 - 12:48
GABARITO
01- (F)
(V)
(V)
(V)
(F)
02- CH3-CH- CH3
|
CH3
03- 1, 2, 3- PROPANOTRIOL E PROPENAL
04- 1- ALCENO
2- ÉTER
05- CH3-CH-COOH
|
CH3
3-ÁLCOOL 4- ÉSTER
+ CH3-OH → CH3-CH-COOH
|
CH3
+ H2O
OH
|
06- CH3-C- CH3
|
CH3
07- ÉTER E AMINA
OS COMPOSTOS NÃO SÃO CONSIDERADOS ISÔMEROS, POIS NÃO APRESENTAM A MESMA FÓRMULA
MOLECULAR.
08- CH3-(CH2)6-COOH
+ CH3 CH2-OH → CH3-(CH2)6-COO CH2CH3 + H2O
09- CETONA, FENOL E AMIDA
FM/0610/BANCO DE QUESTOES/QUIMICA ORGANICA/QUIMICA ORGANCA - 2a SERIE - ENSINO MEDIO - 4a ETAPA - 2006.DOC
Página 4 de 4 - 25/10/2006 - 12:48
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA ORGÂNICA – 2ª SÉRIE - ENSINO MÉDIO
===================================================================================================
• CADEIAS CARBÔNICAS
01- Um composto é orgânico quando:
(A) Possui carbono em sua molécula;
(B) Deriva dos seres vivos;
(C) Deriva dos vegetais;
(D) Possui obrigatoriamente carbono e nitrogênio em sua molécula.
02- A química orgânica estuda:
(A) Apenas os compostos produzidos por animais;
(B) Todos os compostos que derivam dos seres vivos;
(C) Apenas compostos que vieram do planeta Marte;
(D) Todos os compostos produzidos por vegetais.
03- Quem lançou a “Teoria da Força Vital”?
(A) Berzelius;
(B) Kekulé;
(C) Wöhler;
(D) Bergman;
(E) Newton.
04- Qual destes constatou a presença de uréia partindo do cianeto de amônio:
(A) Kekulé;
(B) Torricelli;
(C) Vant´Hoff;
(D) Whöler;
(E) Lavoisier.
05- Qual a definição de carbono primário?
(A) é o carbono que está ligado a um átomo de oxigênio e dois de carbono;
(B) é o carbono que está ligado apenas por ligação simples a três carbonos e um oxigênio;
(C) é o carbono que está ligado a apenas a um carbono;
(D) é o carbono que está ligado a um carbono secundário.
06- Carbono secundário é aquele que:
(A) está ligado a dois carbonos;
(B) está ligado a um oxigênio por ligação dupla;
(C) na cadeia carbônica é o segundo da esquerda para s direita;
(D) está ligado a dois átomos de hidrogênio.
07- Analisando a estrutura da molécula de etano é fácil observar que:
(A) os dois carbonos são secundários;
(B) os dois carbonos estão a quatro hidrogênios;
(C) os dois carbonos são terceários;
(D) um carbono é secundário e o outro é primário;
(E) os dois carbonos são primários.
08- Na estrutura da naftalina:
(A) 2 carbonos são secundários e 8 são primários;
(B) 2 carbonos são terceários e 8 são secundários;
(C) todos os carbonos são secundários;
(D) 2 carbonos são quaternários e 8 são secundários;
(E) 1 carbono é quaternário, 1 carbono é terceário e 8 carbonos são secundários.
Página 1 de 3 - 13/06/2006 - 10:08
09- Qual das moléculas abaixo, apresenta cadeia carbônica saturada?
(A) benzeno
(B) C4H10
(C) 3-metil-1-hexeno
(D) C3H6
(E) Naftalina
10- Uma cadeia é saturada quando:
(A)
(B)
(C)
(D)
(E)
os carbonos estão ligados apenas por ligação simples;
a cadeia é constituída apenas por carbonos;
há ligação dupla entre carbonos;
a cadeia possui mais de dez carbonos;
quando há vários heteroátomos na cadeia.
11- No composto CH3CH2CH2CCCH2CH3 existem:
(A)
(B)
(C)
(D)
(E)
duas ligações sigma e quatro pi;
Quinze ligações sigma e três pi;
Dezoito ligações sigma e duas ligações pi;
Quinze ligações sigma e duas ligações pi;
Sete ligações sigma e três ligações pi.
12- Assinale a alternativa que contém a classificação da cadeia do (CH3)2CH-CH2-C(CH3)2CH3
(A)
(B)
(C)
(D)
(E)
Cíclica, insaturada, ramificada;
Acíclica, saturada, normal;
Acíclica, insaturada, ramificada;
Acíclica, saturada, ramificada;
Cíclica, saturada, normal.
13- Assinale a alternativa verdadeira:
(A)
(B)
(C)
(D)
(E)
Cadeia ramificada é aquela que apresenta um heteroátomo ligado a um carbono secundário;
Cadeia normal é aquela que não apresenta ligação dupla entre carbonos;
Cadeia insaturada é aquela que apresenta ligação pi entre carbonos;
Cadeia saturada é aquela em que pelo menos a metade do número de carbonos está ligada a um heteroátomo;
Cadeia cíclica é aquela que não forma um ciclo de carbonos.
14- Considere o composto CH2 = CH – CH2 O – CH3. Qual a classificação de sua cadeia?
(A)
(B)
(C)
(D)
(E)
Cíclica, insaturada, homogênea, normal;
Acíclica, insaturada, heterogênea, normal;
Acíclica, saturada, homogênea, normal;
Acíclica, insaturada, heterogênea, ramificada;
Cíclica, insaturada, heterogênea, normal.
15- Seja a cadeia CH3 – CH2 – CH = O. Podemos afirmar que a cadeia é:
(A)
(B)
(C)
(D)
(E)
Acíclica, ramificada, insaturada, homogênea;
Acíclica, não ramificada, saturada, homogênea;
Acíclica, não ramificada, saturada, heterogênea;
Acíclica, ramificada, saturada, heterogênea;
Acíclica, não ramificada, insaturada, heterogênea.
16- Hidrocarbonetos que apresentam ligação dupla entre os carbonos recebem o nome de:
(A) alcanos
(B) alcenos
(C) alcinos
(D) ciclanos
Página 2 de 3 - 13/06/2006 - 10:08
17- Assinale a alternativa correta:
(A)
(B)
(C)
(D)
(E)
Alcanos são hidrocarbonetos que apresentam apenas ligações duplas;
Alcanos são hidrocarbonetos que apresentam apenas ligações simples;
Alcanos são hidrocarbonetos que apresentam apenas ligações triplas;
Alcenos são hidrocarbonetos que apresentam apenas ligações simples;
Alcenos são hidrocarbonetos que apresentam apenas ligações triplas.
18- No 2-buteno existem ligações σ e π respectivamente em números de:
(A)
(B)
(C)
(D)
(E)
11 e 1
10 e 2
12 e 1
10 e 1
11 e 2
19- Analisando a estrutura do propeno é correto afirmar que:
(A)
(B)
(C)
(D)
(E)
Existe apenas carbono com hibridização sp;
Há apenas um carbono com hibridização sp3;
2
Existem dois carbonos com hibridização sp e outro com estrutura sp ;
Dois carbonos possuem hibridização sp3;
2
Dois carbonos possuem estrutura sp .
20- Na molécula do 1,2- butadieno:
(A)
(B)
(C)
(D)
(E)
Dois carbonos são do tipo sp e os outros dois são do tipo sp2;
2
3
Existem carbonos com hibridização sp, sp e sp ;
Um carbono é do tipo sp, e os outros são do tipo sp3;
3
Existem dois carbonos com hibridização sp ;
2
Apenas um carbono é do tipo sp .
GABARITO
01- (A)
11- (C)
02- (B)
12- (D)
03- (A)
13- (C)
04- (D)
14- (B)
05- (C)
15- (B)
06- (A)
16- (B)
07- (D)
17- (B)
08- (B)
18- (D)
09- (E)
19- (E)
10- (A)
20- (B)
FM/0606/BANCO DE QUESTOES/QUIMICA ORGANICA/QUIMICA ORGANCA - 2a SERIE - ENSINO MEDIO - 2a ETAPA - 2006.DOC
Página 3 de 3 - 13/06/2006 - 10:08
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA ORGÂNICA – 2ª SÉRIE - ENSINO MÉDIO
================================================================================================
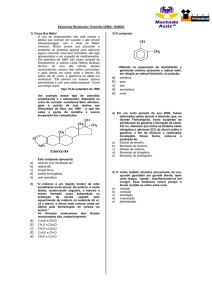
01- Na fórmula do Veronal (um barbitúrico)
• Os números de carbonos primários, secundários, terciários e quaternários
são, respectivamente:
(A) 5, 2, 0, 1
(B) 4, 2, 0, 1
(C) 4, 2, 1, 1
(D) 2, 2, 2, 1
(E) 3, 4, 0 ,0
02- Observe a fórmula ao lado:
• As quantidades totais de átomo de carbono primário, secundário e
terciário são, respectivamente:
(A) 5, 2 e 2
(B) 3, 2 e 2
(C) 3, 3 e 2
(D) 2, 3 e 4
(E) 5, 1 e 3
03- Na estrutura ao lado:
• As quantidades totais de átomo de carbonos primários, secundários,
terciários e quaternários são, respectivamente:
(A) 6, 3, 2, e 2
(B) 6, 2, 2 e 1
(C) 7, 3, 2 e 1
(D) 5, 4, 3 e 2
(E) 5, 3, 3 e 1
04- O que dá gosto amargo característico à cerveja é uma substância chamada Mirceno, proveniente das folhas de lúpulo
adicionados à bebida durante fabricação.
• O número de carbono primários, secundários, terciários e assimétricos, respectivamente, é:
(A) 2, 4, 2, 2
(B) 3, 4, 3, 0
(C) 4, 4, 1, 1
(D) 4, 3, 2, 1
(E) 4, 4, 2, 0
05- O composto orgânico, de fórmula plana ao lado, possui:
(A) 5 carbonos primários, 3 carbonos secundários, 1 carbono terciário
e 2 carbonos quaternários.
(B) 3 carbonos primários, 3 carbonos secundários, 1 carbono terciário
e 1 carbono quaternário.
(C) 5 carbonos primários, 1 carbono secundário, 1 carbono terciário
e 1 carbono quaternário.
(D) 4 carbonos primários, 1 carbono secundário, 2 carbonos terciários
e 1 carbono quaternário.
Página 1 de 2 - 13/06/2006 - 10:58
06- No composto ao lado:
• As quantidades totais de átomo de carbonos primários, secundários e
terciários são respectivamente:
(A) 5, 2 e 3
(B) 5, 1 e 3
(C) 4, 3 e 2
(D) 3, 3 e 3
(E) 2, 1 e 4
07- Na fórmula ao lado:
• As quantidades totais de átomos de carbonos primário, secundário e
terciário são respectivamente:
(A) 5, 1 e 3
(B) 2, 3 e 4
(C) 3, 3 e 2
(D) 2, 4 e 3
(E) 5, 2 e 2
08- O composto de fórmula ao lado:
• Apresenta quantos carbonos primários, secundários, terciários e
quaternários, respectivamente:
(A) 5, 5, 2 e 1
(B) 5, 4, 3 e 1
(C) 7, 4, 1 e 1
(D) 6, 4, 1 e 2
(E) 7, 3, 1 e 2
09-
O composto orgânico
esquematizada ao lado:
que
apresenta
a
fórmula
estrutura
• Possui:
(A) três carbonos terciários.
(B) somente carbonos secundários.
(C) um carbono quaternário.
(D) somente carbonos primários.
(E) somente um carbono terciário.
10- O inseticida dicloro-difenil-tricloroetano (DDT), cuja fórmula estrutural é:
• Apresenta:
(A) um carbono quaternário.
(B) três carbonos terciários.
(C) somente carbonos secundários.
(D) somente um carbono terciário.
(E) somente carbonos primários.
GABARITO
01- (B)
06- (C)
02- (E)
07- (B)
03- (D)
08- (A)
04- (B)
09- (C)
05- (E)
10- (A)
FM/0606/BANCO DE QUESTOES/QUIMICA ORGANICA/QUIMICA ORGANCA - 2a SERIE - ENSINO MEDIO - 2a ETAPA - 2006.DOC
Página 2 de 2 - 13/06/2006 - 10:58
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA ORGÂNICA – 3ª SÉRIE - ENSINO MÉDIO
================================================================================================
01- (UFMG - 1999) Pilhas a combustível são dispositivos eletroquímicos em que a reação de um combustível com oxigênio
produz energia elétrica. O diagrama representa, simplificadamente, uma pilha a combustível, que envolve a reação entre
os gases hidrogênio e oxigênio, conforme a equação.
2H2 (g) + O2 (g) 2 H2O (I)
• Com relação a essa pilha, todas as afirmativas abaixo estão CORRETAS, EXCETO:
(A)
(B)
(C)
(D)
O circuito externo transporta, para o oxigênio, elétrons retirados do hidrogênio.
O transporte de carga através da solução é feito por íons.
A reação torna iguais os números de oxidação do hidrogênio e do oxigênio.
O hidrogênio atua na reação como o agente redutor.
02- (Fuvest - 2002) Considere três metais A, B e C, dos quais apenas A reage com ácido clorídrico diluído, liberando
hidrogênio. Varetas de A, B e C foram espetadas em uma laranja, cujo suco é uma solução aquosa de pH 4 = . A e B
foram ligados externamente por um resistor (formação da pilha 1). Após alguns instantes, removeu-se o resistor, que foi
então utilizado para ligar A e C (formação da pilha 2). Nesse experimento, o pólo positivo e o metal corroído na pilha 1 e o
pólo positivo e o metal corroído na pilha 2 são, respectivamente:
pilha 1
pilha 2
pólo
positivo
metal
corroído
pólo
positivo
metal
corroído
(A)
B
A
A
C
(B)
B
A
C
A
(C)
B
B
C
C
(D)
A
A
C
A
(E)
A
B
A
C
03- (VUNESP - 2001) Em maio de 1800, Alessandro Volta anunciou a invenção da pilha elétrica, a primeira fonte contínua de
eletricidade. O seu uso influenciou fortemente o desenvolvimento da Química nas décadas seguintes. A pilha de Volta era
composta de discos de zinco e de prata sobrepostos e intercalados com material poroso embebido em solução salina,
como mostrado a seguir.
Zinco
Prata
circuito
externo
Zinco
Prata
Zinco
Prata
Página 1 de 9 - 06/09/2006 - 9:55
material poroso
embebido em
salmoura
Com o funcionamento da pilha, observa-se que os discos de zinco sofrem corrosão.
A respeito da pilha de Volta, são feitas as seguintes afirmações:
I. Nos discos de zinco ocorre a semi-reação Zn(s) . Zn2+ + 2eII. Os discos de prata são fontes de elétrons para o circuito externo.
III. O aumento do diâmetro dos discos empregados na montagem não influencia na tensão fornecida pela pilha.
• Das três afirmativas apresentadas,
(A) apenas I é verdadeira.
(C) apenas I e II são verdadeiras.
(E) apenas II e III são verdadeiras.
(B) apenas II é verdadeira
(D) apenas I e III são verdadeiras.
04- (UFSCar - 2000) Filtros de piscinas, construídos em ferro, são muito afetados pela corrosão. No processo de corrosão
ocorre a dissolução lenta do metal, com a formação de íons Fe2+ em solução aquosa. Para a proteção dos filtros são
utilizados os chamados "eletrodos de sacrifício". Estes eletrodos são barras de metais convenientemente escolhidos que,
colocados em contato com o filtro, sofrem corrosão no lugar do fero. Com base nos dados tabelados a seguir
• pode-se prever que são "eletrodos de sacrifício" adequados barras de:
(A) magnésio, apenas.
(C) níquel, apenas.
(E) cobre, níquel e magnésio.
(B) cobre, apenas.
(D) cobre e níquel, apenas.
05- (UNIFESP - 2002) Ferro metálico reage espontaneamente com íons Pb2+, em solução aquosa. Esta reação pode ser
representada por:
Fe + Pb2+ Fe2+ + Pb
Na pilha, representada pela figura,
• Em que ocorre aquela reação global,
(A) os cátions devem migrar para o eletrodo de ferro.
(B) ocorre deposição de chumbo metálico sobre o eletrodo de ferro.
(C) ocorre diminuição da massa do eletrodo de ferro.
(D) os elétrons migram através da ponte salina do ferro para o chumbo.
(E) o eletrodo de chumbo atual como anodo.
Página 2 de 9 - 06/09/2006 - 9:55
06- (FMTM - 2001) Considere a seguinte equação de transmutação nuclear:
249
98 Cf
+
18
8O
→ X + 4n
• O número atômico e o número de massa do elemento X são, respectivamente,
(A) 114 e 279
(C) 104 e 267
(E) 90 e 249
(B) 106 e 263
(D) 90 e 231
07- (PUCSP - 2000) O fenômeno da radioatividade foi descrito pela primeira vez no final do século passado, sendo largamente
estudado no início do século XX. Aplicações desse fenômeno vão desde a diagnóstico e combate de doenças, até a
obtenção de energia ou a fabricação de artefatos bélicos.
Duas emissões radioativas típicas podem ser representadas pelas equações:
238
U
234
Th 234
Th + α
234
Pa + β
• A radiação α é o núcleo do átomo de hélio, possuindo 2 prótons e 2 nêutrons, que se desprende do núcleo do átomo
radioativo. A radiação β é um elétron, proveniente da quebra de um nêutron, formando também um próton, que
238
206
permanece no núcleo. A equação que representa o decaimento radioativo do isótopo U até o isótopo estável Pb é:
(A) U Pb + α + β
238
206
(C) U Pb + 8 α + 6 β
238
206
(E) U Pb + 6 α + 6 β
238
(B) U Pb + 8 α + 4 β
238
206
(D) U Pb + 5 α + 5 β
206
238
206
3
08- (GV - 2001) O isótopo radioativo do hidrogênio, Trício ( H), é muito utilizado em experimentos de marcação isotópica na
química orgânica e na bioquímica. Porém, um dos problemas em utilizá-lo é que sua meia-vida é de 12,3 anos, o que
causa um tempo de espera longo para que se possa descartá-lo no lixo comum. Qual será a taxa de Trício daqui a 98 anos
em uma amostra preparada hoje (100%)?
(A) 0%
(C) 7,97%
(E) 0,78%
(B) 12,55%
(D) 0,39%
09- (UPE - 2001) Entre as alternativas abaixo, relacionadas à Radioatividade, todas estão CORRETAS, EXCETO:
(A) o poder de ionização das partículas alfa é maior que o das partículas beta.
(B) quando um núcleo radioativo emite uma partícula beta, seu número de massa aumenta de uma unidade e o seu
número atômico não se altera.
(C) a radioatividade é a propriedade que os núcleos atômicos instáveis possuem de emitirem partículas e radiações
eletromagnéticas para se transformarem em outros núcleos mais estáveis.
(D) a velocidade de desintegração radiativa é proporcional ao número de átomos radioativos presentes na amostra.
(E) a constante radioativa explicita a fração de átomos de um determinado elemento radioativo que se desintegram na
unidade de tempo.
10- (UERJ 2000) O elemento radioativo tório encontra-se associado às terras raras e ao urânio, sendo o Brasil um dos países
onde seus depósitos ocorrem sob a forma do mineral monazita.
O núcleo do elemento tório sofre uma série de desintegrações radioativas espontâneas até atingir a configuração estável
208
do 82Pb
. A equação nuclear abaixo destaca uma dessas desintegrações:
• Ao compararmos os núcleos dos átomos de Ra e do elemento X, podemos classificá-los corretamente como:
(A) isóbaros
(C) isótopos
Página 3 de 9 - 06/09/2006 - 9:55
(B) isótonos
(D) isoeletrônicos
11- (UERJ 2002) O tipo mais comum de detector de fumaça funciona a partir de uma câmara de ionização de gases
atmosféricos. As moléculas desses gases são ionizadas pelo emissor alfa 241 Am. Quando partículas de fumaça
penetram na câmara, ocorre a neutralização das moléculas, interrompendo a passagem de corrente elétrica e disparando
um alarme sonoro.
241
a) A produção do
Am em reatores nucleares requer seis transformações radioativas , três capturas de nêutron e três
emissões beta -de um determinado nuclídeo.
Represente esse nuclídeo com símbolo, número de massa e número atômico.
b) Calcule a massa, em gramas, de uma amostra de
241
Am que possua 1,2 x 10
24
átomos.
12- (UERJ 2000) As denominações combustível “limpo” e combustível “verde” são empregadas em relação ao hidrogênio, pelo
fato de sua queima provocar baixo impacto ambiental.
Observe a reação química da combustão do hidrogênio, representada abaixo:
2 H2(g) + O2 (g) → 2 H2O (v)
∆H= -116,24 kcal
Utilizando os dados acima e supondo suficiente a quantidade de oxigênio, é possível estabelecer o valor da massa de
hidrogênio que, ao ser queimada, produzirá energia equivalente a 232,48 kcal.
• Esse valor, em gramas, é igual a:
(A) 2,0
(C) 6,0
(B) 4,0
(D) 8,0
+2
13- (UERJ 2000) Em geral, soluções aquosas ácidas de sais do cátion Fe são azul-esverdeadas quando recém-preparadas.
+2
Se expostas ao ar atmosférico, tornam-se amareladas. As soluções de cátion Co , em condições semelhantes às do
+2
cátion Fe , não sofrem alteração da cor rósea original. Essas mudanças de coloração em metais de transição devem-se,
+2
dentre outros fatores, a mudanças em seus estados de oxidação e, no caso dos íons Fe , a alteração é provocada pela
ação do oxigênio do ar atmosférico.
• São fornecidas abaixo as semi-reações de redução, com os respectivos potenciais-padrão:
a) Escreva a equação química completa e equilibrada que representa a oxidação dos íons ferrosos a íons férricos pela
ação do oxigênio.
Página 4 de 9 - 06/09/2006 - 9:55
b) Justifique o fato de as soluções de cobalto serem estáveis frente à ação do oxigênio.
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
14- (UERRJ 2001 / I) O gráfico abaixo representa o consumo de oxigênio de uma pessoa que se exercita, em condições
aeróbicas, numa bicicleta ergométrica. Considere que o organismo libera, em média, 4,8 Kcal para cada litro de oxigênio
absorvido.
• A energia liberada no período entre 5 e 15 minutos, em Kcal, é:
(A) 48,0
(C) 67,2
(B) 52,4
(D) 93,6
15- (UERJ 2000) A gasolina é uma mistura de hidrocarbonetos diversos que apresenta, dentre outros, os seguintes
componentes:
• Os pares de componentes I – II e I – III apresentam isomeria plana, respectivamente, do tipo:
(A) cadeia e cadeia
(C) posição e cadeia
(B) cadeia e posição
(D) posição e posição
16- (UERJ 2000) O principal componente do medicamento Xenical, para controle da obesidade, possui a fórmula estrutural
condensada conforme se representa a seguir.
• Podemos identificar, nesta estrutura, a presença de, pelo menos, um grupo funcional característico da seguinte função
orgânica:
(A) éter
(C) amina
Página 5 de 9 - 06/09/2006 - 9:55
(B) éster
(D) cetona
17- (UERJ 2000) Na fabricação de tecidos de algodão, a adição de compostos do tipo N-haloamina confere a eles
propriedades biocidas, matando até bactérias que produzem mau cheiro.
O grande responsável por tal efeito é o cloro presente nesses compostos.
• A cadeia carbônica da N-haloamina acima representada pode ser classificada como:
(A) homogênea, saturada, normal
(C) heterogênea, saturada, ramificada
(B) heterogênea, insaturada, normal
(D) homogênea, insaturada, ramificada
18- (UERJ 2000) Os hidrocarbonetos insaturados reagem com cloreto de hidrogênio, originando produtos de adição eletrofílica,
tais como os cloretos de alquila.
• O produto previsto, em maior proporção, para a reação entre cloreto de hidrogênio e 2-metil-2-penteno está nomeado
em:
(A) 3-cloro 2-metil pentano
(C) 3-cloro 3-metil pentano
(B) 2-cloro 3-metil pentano
(D) 2-cloro 2-metil pentano
19- (UERJ 2000) A adição de HCN a aldeídos é uma reação reversível, conforme demonstração.
Um dos fatores que interfere nesse processo, deslocando o equilíbrio no sentido 1, é a presença de grupos elétronatraentes no carbono vizinho à carbonila.
Aplique essas informações aos aldeídos nomeados a seguir: 2-metil-propanal, propanal e 2,2-dicloro-propanal.
• Indique:
a) o nome do aldeído que provoca o maior deslocamento no sentido 1 e o número de isômeros de posição que ele
apresenta;
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
b) a fórmula estrutural do aldeído reagente de menor ponto de ebulição, justificando sua escolha.
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
Página 6 de 9 - 06/09/2006 - 9:55
20- (UERJ 2000) Hidrocarbonetos de fórmula geral CnH2n podem ser diferenciados pelo teste de Bayer.
Tal teste consiste na reação desses hidrocarbonetos com solução neutra diluída de permanganato de potássio – KMnO4 –
que possui coloração violeta. Só haverá descoramento da solução se o hidrocarboneto for insaturado.
• Considere hidrocarbonetos contendo 5 átomos de carbono, que se enquadrem na fórmula geral CnH2n.
a) Indique a fórmula estrutural de um hidrocarboneto com cadeia normal que reage positivamente ao teste de Bayer e
justifique sua resposta.
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
b) Dentre os hidrocarbonetos que não reagem ao teste, um apresenta isomeria geométrica e outro possui apenas
carbonos secundários. Cite seus nomes oficiais.
R.: _______________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
21- (UERRJ 2001/I) Os vários componentes do petróleo são separados por um processo denominado destilação fracionada.
Em sua destilação, alguns hidrocarbonetos são separados na ordem indicada no esquema abaixo.
• A ordem de destilação desses componentes do petróleo está justificada pela seguinte afirmação:
(A)
(B)
(C)
(D)
Os alcanos são os hidrocarbonetos mais voláteis.
Os hidrocarbonetos são líquidos de baixo para cima.
O aumento da massa molar dos hidrocarbonetos provoca uma maior volatilidade.
O ponto de ebulição dos hidrocarbonetos aumenta com o aumento da massa molar.
Página 7 de 9 - 06/09/2006 - 9:55
22- (UERJ 2001) O aromatizante artificial antranilato de metila é utilizado por alguns fabricantes de gelatina de uva. Essa
substância deriva do ácido antranílico, que possui as seguintes características:
é um ácido carboxílico aromático;
apresenta um grupo amino na posição orto;
possui fórmula molecular C7H7NO2 .
• Escreva a fórmula estrutural plana desse aromatizante e cite a função química a que ele pertence.
23- (UERJ 2002) Observe a equação química que corresponde ao processo de obtenção descrito no texto.
CH3
CH3
|
|
CH3 – C – CH3 + HCl → CH3 – C – CH3
H2O
|
|
OH
Cl
+
Além do impacto ambiental agudo advindo do derramamento de grandes quantidades de óleo em ambientes aquáticos,
existem problemas a longo prazo associados à presença, no óleo, de algumas substâncias como os hidrocarbonetos
policíclicos aromáticos, mutagênicos e potencialmente carcinogênicos. Essas substâncias são muito estáveis no ambiente e
podem ser encontradas por longo tempo no sedimento do fundo, porque gotículas de óleo, após adsorção por material
particulado em suspensão na água, sofrem processo de decantação.
a) Escreva a fórmula estrutural plana e o nome oficial, segundo a IUPAC, de um álcool que seja isômero plano daquele
utilizado na experiência, e possua atividade ótica.
b) Indique o tipo de mecanismo da reação em função da partícula reagente.
24- (UERJ 2002) Na indústria petroquímica, a expressão adoçar o petróleo corresponde à adição de aminas leves às frações
gasosas do petróleo para eliminação de sua acidez.
• Considerando as aminas isômeras de fórmula molecular C3H9N,
a) indique a fórmula estrutural plana da amina que possui caráter básico mais acentuado;
Página 8 de 9 - 06/09/2006 - 9:55
b) nomeie as aminas que possuem cadeia carbônica classificada como homogênea.
25- (UERJ 2002/I) Um agente mutagênico, com as características estruturais citadas no texto, apresenta a seguinte fórmula:
FM/0608/BANCO DE QUESTOES/QUIMICA ORGANICA/QUIMICA ORGANIA - 3a SERIE - ENSINO MEDIO - 3a ETAPA - 2006.DOC
Página 9 de 9 - 06/09/2006 - 9:55
PROFESSOR: EQUIPE DE QUÍMICA
BANCO DE QUESTÕES - QUÍMICA ORGÂNICA – 3ª SÉRIE - ENSINO MÉDIO
================================================================================================
Página 1 de 7 - 14/06/2006 - 3:35
Página 2 de 7 - 14/06/2006 - 3:35
Página 3 de 7 - 14/06/2006 - 3:35
Página 4 de 7 - 14/06/2006 - 3:35
Página 5 de 7 - 14/06/2006 - 3:35
Página 6 de 7 - 14/06/2006 - 3:35
MCS/0606/BANCO DE QUESTOES/QUIMICA ORGANICA/QUIMICA ORGANIA - 3a SÉRIE - ENSINO MEDIO - 2a ETAPA - 2006.DOC
Página 7 de 7 - 14/06/2006 - 3:35