U S P – E E L - Escola de Engenharia de Lorena
Reatores – Aula 5 – Comparação Dimensional entre Reatores Contínuos
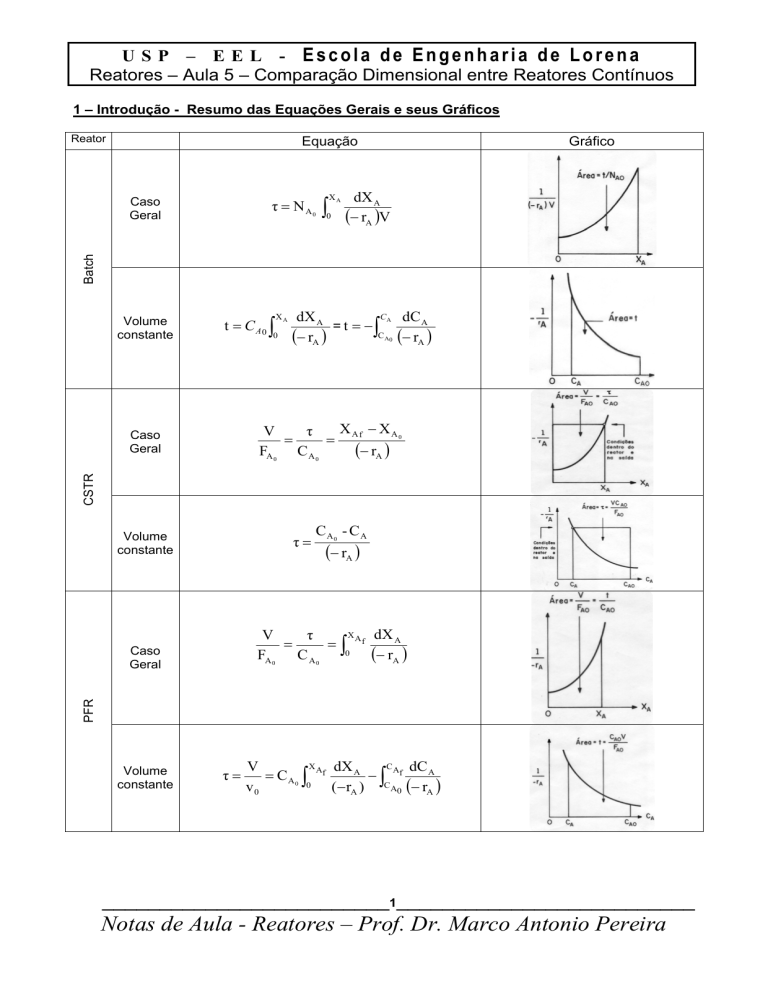
1 – Introdução - Resumo das Equações Gerais e seus Gráficos
Reator
Equação
Caso
Geral
XA
dX A
∫ (− r )V
0
A
Batch
τ = N A0
Gráfico
Volume
constante
t = C A0 ∫
XA
0
CA dC
dX A
A
= t = −∫
C
A0 (− r )
(− rA )
A
X A f − X A0
V
τ
=
=
(− rA )
FA 0 C A 0
CSTR
Caso
Geral
Volume
constante
τ=
CA0 - CA
(− rA )
X A dX
V
τ
A
=
=∫ f
0
(− rA )
FA 0 C A 0
PFR
Caso
Geral
Volume
constante
τ=
X A dX
C A dC
V
A
A
= CA0 ∫ f
−∫ f
0
C
A0 (− rA )
v0
(−rA )
_________________________1__________________________
Notas de Aula - Reatores – Prof. Dr. Marco Antonio Pereira
U S P – E E L - Escola de Engenharia de Lorena
Reatores – Aula 5 – Comparação Dimensional entre Reatores Contínuos
2 – Comparação de Volumes entre os Reatores de Mistura e Tubular
Para uma reação química irreversível a equação de velocidade de forma geral é:
n
− rA = k C A
A análise desta equação de velocidade revela que ela é função da ordem da reação (n), e
sendo assim três situações distintas podem existir:
a – Se n > 0, então a velocidade da reação DIMINUI com o tempo;
b – se n = 0, então a velocidade da reação PERMANECE CONSTANTE com o tempo;
c – se n < 0, então a velocidade da reação AUMENTA com o tempo.
A representação gráfica destas afirmações é abaixo apresentada:
Por outro lado, as equações matemáticas básicas dos reatores isotérmicos ideais de
mistura ou tubular conduzem a gráficos de ⎛⎜ 1 ⎞⎟ versus XA.
⎜−r ⎟
⎝ A⎠
E estes gráficos revelam diferenças na razão entre o volumes de um reator tubular versus
um reator mistura em função das diferentes ordens de reação: positiva, zero e negativa.
Mistura
Tubular
Conclusão
n>0
Vm>VT
n=0
Vm=VT
n<0
Vm<VT
V
τ
1
=
= ΔX A
(− rA )
FA 0 C A 0
XA ⎛ 1 ⎞
V
τ
⎟⎟dX A
=
= ∫ f ⎜⎜
X
FA 0 C A 0
Ai ⎝ − rA ⎠
_________________________2__________________________
Notas de Aula - Reatores – Prof. Dr. Marco Antonio Pereira
U S P – E E L - Escola de Engenharia de Lorena
Reatores – Aula 5 – Comparação Dimensional entre Reatores Contínuos
Conclusões:
1 . Quanto maior o nível de conversão desejado para uma reação química, maior a
diferença entre Vn e VT para ordens >0 ou <0.
2 . Para reações de ordem zero: os volumes sempre serão iguais.
Analisando as equações especificas para um CSTR e um PFR e a equação geral, tem-se:
CSTR
PFR
Equação geral
τn
V
XA
= n =
(I)
C A 0 FA 0 (− rA )
X A dX
τT
V
A
= T =∫
(II)
0
(− rA )
C A 0 FA 0
(-rA ) = k C nA = k
Substituindo a equação de velocidade (III) em (I), tem-se que:
τn
V
X (1ξ X )
= n = An A A n
C A 0 FA 0 kC A 0 (1 − X A )
n
τn C
n −1
A0
Vn C nA 0
=
=
FA 0
C nA 0 (1 − X A ) n
(III)
(1 + ξ A X A )n
X A (1 + ξ A X A )
kC nA 0 (1 − X A )
n
(IV)
n
Substituindo a equação de velocidade (III) em (I), tem-se que:
X A (1 + ξ X )dX
τT
V
A
A
A
= T =∫
0
C A 0 FA 0
k C nA 0 (1 − X A ) n
τT C
Dividindo as equações (IV) e (V), temos:
n −1
A0
=
VT C nA 0
1
=
k
FA 0
∫
XA
0
(1 + ξ A X A )n
n
C nA (1 − X A )
dX A (V)
0
X A (1 + ξ A X A )
n
(
1− XA )
=
(VI)
n
X A X (1 + ξ X )
A
A A
∫0 CnA (1 − X A )n dX A
0
n
(τ C ) (VC
(τ C ) = (VC
n −1
A0 n
n −1
A0 T
Se ξA = 0
Para n ≠ 1
Para n = 1
n
A0
FA0
n
A0
FA0
)
)
n
T
(τ C ) (VC
(τ C ) = (VC
n −1
A0 n
n −1
A0 T
⇒
⇒
⇒
(τ C ) (VC
(τ C ) = (VC
n −1
A0 n
n −1
A0 T
FA0
n
A0
FA0
n
A0
FA0
n
A0
FA0
n
A0
FA0
n
A0
FA0
(τ C ) (VC
(τ C ) = (VC
n −1
A0 n
n −1
A0 T
n
A0
)
)
n
T
)
)
n
T
=
⎡ XA ⎤
⎢
n⎥
⎣ (1 − X A ) ⎦ n
⎡ XA
dX A
⎢ ∫0
n
n
C A0 (1 − X A )
⎢⎣
⎤
⎥
⎥⎦ T
⎡ XA ⎤
⎢
(1 − X A )n ⎥⎦ n
⎣
=
⎡ (1 − X A )1-n − 1 ⎤
⎢
⎥
n -1
⎣
⎦T
) [X (1 − X ) ]
) = [− ln(1 − X ) ]
n
n
T
A
A
A
n
T
A partir da equação (VI), Levenspiel construiu em escala bi-logarítmica um gráfico (Figura
6.1 – página 101 – Livro) que é extremamente útil para comparar capacidades de reatores CSTR
versus PFR.
_________________________3__________________________
Notas de Aula - Reatores – Prof. Dr. Marco Antonio Pereira
U S P – E E L - Escola de Engenharia de Lorena
Reatores – Aula 5 – Comparação Dimensional entre Reatores Contínuos
Exercícios – Parte 1 - Diferentes Tipos de Reatores
1 – (P2 – 2006) - A reação homogênea em fase gasosa: C2H2Cl4 ⇒ C2HCl3 + HCl foi
realizada a 100ºC e a pressão constante de 1 atm num reator descontínuo experimental.
Os dados da tabela abaixo foram obtidos partindo-se de C2H2Cl4 puro.
Suspeita-se que esta seja uma reação de primeira ordem. Confirme esta suspeita e calcule a
equação de velocidade desta reação.
t (min)
0
1
2
3
4
5
6
7
V/Vo
1,00
1,20
1,35
1,48
1,58
1,66
1,72
1,78
t (min)
8
9
10
11
12
13
14
V/Vo
1,82
1,86
1,88
1,91
1,92
1,94
1,95
Esta reação é realizada em reatores contínuos, a 100ºC e 10 atm, a partir de uma alimentação uma
mistura de 50% em peso de C2H2Cl4 e 50% em peso de N2 como inerte.
Qual o volume necessário para uma conversão de 70% de C2H2Cl4, a partir de uma velocidade de
alimentação global de 10 mols/s?
A) em um reator de mistura?
B) em um reator tubular? [V = 10.833 L]
2 – (P1 – 2007) - A reação em fase gasosa: A + B → R + S é de segunda ordem e sua
equação de velocidade é conhecida: (-rA ) = (500 L/mol min)CACB.
Esta reação será realizada em um reator tubular de 100 mL que opera com os seguintes parâmetros
de alimentação: (i) – vazão = 50 mL/min e (ii) - CA0 = CB0 = 0,01 mols/L
A - Qual a conversão obtida neste reator? [XA = 0,909]
Mantidas constantes as condições de alimentação (vazão volumétrica e concentração dos
reagentes):
B) Qual o volume de um reator de mistura para se obter a mesma conversão?
C – Qual a conversão a ser obtida em um reator de mistura de mesmo volume que o reator tubular
inicial 100 mL)? [XA = 0,73]
3 – (P1 – 2006) - A reação
A → 2R + ½S
é realizada em um reator tubular com as
seguintes condições de reação e do reator: :
(i)
Reação = Primeira Ordem
(ii)
Fase da Reação = Gasosa
(iii)
Dimensões do Reator: diâmetro = 50 cm e comprimento = 6 m
(iv) A alimentação é feita a partir da introdução de uma única corrente de alimentação com 60%
em peso de A e 40% em peso de inerte.
(v)
Alimentação Global de 400 mols/hora
(vi) Condições da corrente de alimentação: temperatura de 25 ºC e pressão de 4 atm.
(vii) Temperatura do reator = 200 ºC
(viii) Conversão obtida: 75%
(ix) Pesos Moleculares: Reagente A = 38 g/mol ; inerte = 28 g/mol
Qual o volume de um reator de mistura que opere nas mesmas condições de alimentação do reator
tubular e na mesma conversão. [V = 2.978 L]
_________________________4__________________________
Notas de Aula - Reatores – Prof. Dr. Marco Antonio Pereira
U S P – E E L - Escola de Engenharia de Lorena
Reatores – Aula 5 – Comparação Dimensional entre Reatores Contínuos
4 – (P1 – 2005) - A reação elementar de primeira ordem A → 2R + ½S ocorre em fase gasosa
e será realizada em reatores contínuos com as seguintes condições de alimentação: 200oC e 12 atm e com
uma vazão de alimentação de 10L/min.
A Energia de Ativação da reação é 24.000 cal/mol.
A constante de velocidade da reação a 150oC é 0,00673(min)-1.
Para uma conversão desejada de 80 %, calcule:
A – O volume de um reator de mistura a ser utilizado. (V = 642,3L)
B – O volume de um reator tubular a ser utilizado.
C - Se a alimentação for constituída de 40% molar de inerte, e todas as demais condições forem
mantidas constantes (pressão, temperatura e vazão de alimentação), qual será a conversão a ser obtida no
reator de mistura calculado acima (item A)? (XA = 0,835)
5 – (P1 – 2002) - A reação em fase gasosa entre metano (A) e enxofre (B) é realizada a 600oC e a
pressão atmosférica em um reator tubular, para produzir disulfeto de carbono e sulfeto de hidrogênio. A
reação é de primeira ordem em relação a cada reagente e kB = 12 m3/(mol.h).
As velocidades molares de metano e enxofre são 10 e 20 mols/h, respectivamente e após a reação
a produção obtida de sulfeto de hidrogênio é de 4 mols/h.
A - Calcule a conversão obtida neste reator e o seu volume.
B – Se esta reação fosse realizada em um CSTR com o mesmo volume do reator tubular, qual seria
a conversão?
CH4
+ 2 S2
→
CS2 +
2 H2S
6 – (P1 – 2005) - Existem várias maneiras de se determinar a cinética de uma reação química. Uma
maneira muito utilizada em reações em fase gasosa ocorrendo dentro de reatores fechados de paredes
rígidas é acompanhar a evolução da pressão total do reator ao longo do tempo e em função disto
determinar a evolução da pressão parcial dos reagentes. A reação 2A → R foi estudada através deste
método a temperatura de 400ºC e os dados experimentais obtidos para a sua decomposição em fase
gasosa foram os seguintes:
t (s)
pA (mmHg)
0
760
20
605
40
518
60
425
80
340
100
280
140
190
200
105
Conhecendo-se a cinética desta reação a partir dos dados acima, deseja-se operar esta reação em
reatores contínuos a 400ºC e pressão atmosférica, partir de uma alimentação constituída de 30% em moles
de A e o restante de N2 (inerte).
Para uma conversão desejada de 90%.
A – Qual o volume de um reator de mistura a ser utilizado? (1321,4 L)
B – Qual o volume de um reator tubular a ser utilizado? (335 L)
C – Explique porque esses volumes são iguais ou diferentes.
Dado: vazão = 100 L/min
7 - (Exame 2.000) – A reação elementar em fase gasosa A →
3 R é efetuada em um reator
contínuo operando a 100oC e 10 atm com uma taxa de escoamento molar de 2,5 mol/min e uma conversão
desejada de 80 %.
A – Calcule o volume de um reator de mistura necessário para esta operação.
B – Calcule o volume de um reator tubular necessário para esta operação.
C – Qual será a conversão obtida no reator de mistura (item A), se for introduzido junto um inerte na
proporção de 1:1 mantidas constantes todas as demais condições?
Dados : k = 0,00456 (min)-1 a 50oC e
Ea = 20.300 cal
Respostas: A) Vm = 251 L e B) Vt = 78 L
_________________________5__________________________
Notas de Aula - Reatores – Prof. Dr. Marco Antonio Pereira
U S P – E E L - Escola de Engenharia de Lorena
Reatores – Aula 5 – Comparação Dimensional entre Reatores Contínuos
8 – (P2 – 2005) – (adaptada do Levenspiel 5.19) - Sabe-se que a reação:
C2H5OCl
etileno
cloridrina
+
NaHCO3
bicarbonato
de sódio
⎯→
C2H6O2
etileno
glicol
+
NaCl
+
CO2
é elementar e a sua constante de velocidade é 5,2 L/mol.h a 82ºC. Com base nessas informações,
desejamos construir uma instalação piloto que permita verificar a possibilidade de se produzir etileno glicol a
partir de duas alimentações disponíveis uma solução aquosa de 25% em peso de bicarbonato de sódio e
uma solução aquosa de 40% em peso de etileno cloridrina.
a) Qual o volume de um reator tubular necessário à produção de 30kg/h de etileno glicol com 95%
de conversão, usando quantidades equimolares das alimentações disponíveis? [V = 516,1 L]
b) Quais as dimensões de um reator de mistura que trabalhe nas mesmas condições de
alimentação, conversão e produção do item (a)? [ V = 10.321 L]
Admitir a temperatura de trabalho de 82ºC, em que a massa específica da mistura reagente é igual
a 1,02 g/cm3.
9 - (P2 – 2007) - Um reator tubular de 70 cm de diâmetro e 15,5 m de comprimento foi utilizado para
testes com a reação gasosa de primeira ordem: A → 2R + ½S .
A alimentação utilizada possuía 85% em peso de A (peso Molecular = 60 g/mol) e 15% em peso de
inerte (peso Molecular = 4 g/mol).
Os testes foram realizados a uma pressão total de 2 atm e a uma temperatura de 565ºC.
A alimentação global utilizada neste reator foi de 250 moles/hora e a conversão obtida foi de 45 %
do reagente A em produtos.
Determine o volume de um reator de mistura para operar nas mesmas condições de alimentação e
na mesma conversão.
10 – (P1 – 2003) - A decomposição gasosa de A a alta temperatura ocorre de acordo com a
seguinte equação estequiométrica: A → 3 R
Experimentos foram realizados em um reator batelada ideal, operando isotermicamente e a volume
constante. A seguinte curva de concentração versus tempo foi obtida a partir de uma mistura com 75% em
volume de A e o restante em inertes.
7
6
Conc (M)
5
4
3
2
1
0
0
5
10
15
20
25
30
35
t e m po ( se gu nd os)
_________________________6__________________________
Notas de Aula - Reatores – Prof. Dr. Marco Antonio Pereira
U S P – E E L - Escola de Engenharia de Lorena
Reatores – Aula 5 – Comparação Dimensional entre Reatores Contínuos
Operando com a mesma alimentação, isotermicamente e isobaricamente, um reator tubular, um
reator de mistura e um reator batelada são comparados.
A – Qual o tempo espacial para os reatores contínuos (PFR e CSTR) para uma conversão de 100%
B – Qual o tempo de reação para o reator batelada para uma conversão de 100%?
C – Plote em um único gráfico as curvas de XA (eixo horizontal) versus tempo espacial ou tempo da
reação (eixo vertical) para este caso estudado.
D – Se esta reação for realizada em um reator tubular de volume Vt e em seguida em um reator de
mistura, o que você pode falar do volume Vm do reator de mistura no intervalo de conversão de 0 a 100%?
Explique a sua resposta.
Respostas: A) τm = 30s e τT = 30s
B) t = 18,32 s
11 – (P2 – 2002 – questão extraída integralmente do Levenspiel)
Holmes: Você diz que ele foi visto pela última vez tomando conta deste tanque...
Gerente: Você quer dizer “reator de tanque agitado com transbordamento”, Holmes.
Holmes: Perdoe a minha ignorância no seu jargão técnico, gerente.
Gerente: Está bem; no entanto, você tem de acha-lo, Holmes. Imbibit era um sujeito esquisito; ele
sempre ficava olhando fixamente para o reator, respirando profundamente e lambendo seus
lábios, mas ele era o nosso melhor operador. Desde que ele foi embora, a nossa conversão de
Googliox caiu de 80% para 75%.
Holmes: (batendo no lado da cuba): A propósito, o que está acontecendo no tanque?
Gerente: Somente uma reação elementar de segunda ordem, entre o etanol e o googliox, se você
entende o que eu falo. Naturalmente, nós mantemos um grande excesso de álcool, cerca de
100 para 1 e...
Holmes: (interrompendo): Intrigante; nós checamos cada direção possível da cidade e não encontramos
uma simples pista.
Gerente: ( Enxugando as lágrimas): Nós daremos um aumento ao sujeito – cerca de dois centavos por
semana – somente se ele voltar.
Watson: Perdão, mas permite-me fazer uma pergunta?
Holmes: Certamente, Watson.
Watson: Qual é a capacidade do tanque, gerente?
Gerente: Cem galões Imperiais e sempre o mantemos cheio até a borda. Esta é a razão pela qual o
chamamos de reator de transbordamento. Como você vê, nós o estamos operando na
capacidade máxima – operação lucrativa, você sabe.
Holmes: Bem, meu caro Watson, temos de admitir que estamos diante de um problema difícil, uma vez
que não temos pistas conclusivas.
Watson: Ah, aí é que você está errado, Holmes. (Então, virando-se para o gerente): Imbibit era uma
pessoa grandalhona – cerca de 115 Kg, não era?
Gerente: Sim, como você sabia?
Holmes: (com espanto): Surpreendente, meu caro Watson!
Watson: (Modestamente): Isto é bem elementar, Holmes. Nós temos todas as pistas necessárias para
deduzir o que aconteceu com alegre companheiro. Mas antes de mais nada, alguém poderia
me arrumar fumo para cachimbo?
Com Sherlock Holmes e o gerente impacientemente esperando, o Dr. Watson se encostou sobre o
tanque e lenta e cuidadosamente encheu seu cachimbo e – com um aguçado senso de dramaticidade –
acendeu–o. Aqui, termina a nossa história.
A) Que importante revelação Watson estava planejando fazer e como ele chegou a esta conclusão?
B) Porque ele nunca fez a revelação?
_________________________7__________________________
Notas de Aula - Reatores – Prof. Dr. Marco Antonio Pereira
U S P – E E L - Escola de Engenharia de Lorena
Reatores – Aula 5 – Comparação Dimensional entre Reatores Contínuos
12 - (P2 – 2006) - Você é um engenheiro de projetos de Chemical Word Industry e tem pala frente a
missão de escolher o tipo de reator indicado para a formação do acetato de etila, a partir do álcool etílico e
do ácido acético. Uma série de informações da reação e do reator é apresentada abaixo:
A - Parâmetros da Reação:
A1) – Reação Química: CH3 COOH + C2 H5 OH → CH3COOC2H5 + H2O
A2) - Constante de Velocidade = 8,28 (L/mol.h) a 25º C.
A3) - A reação é de primeira ordem em relação ao álcool etílico e também de primeira ordem em
relação ao ácido acético.
A4) – A reação ocorre em fase líquida à temperatura ambiente.
B - Parâmetros Gerais
B1) – Você deve testar os três tipos básicos de reatores, todos eles com volume de 100 Litros.
B2) - A corrente líquida de alimentação possui uma concentração de álcool etílico de 2 moles/L e
uma concentração de ácido acético de 4 moles/L.
B3) - A conversão desejada em cada um dos reatores é de 60% de álcool etílico.
B4) - Qualquer um dos reatores tem a sua produção diária obtida em 12 horas de trabalho
ininterrupto.
C - Parâmetros Específicos
C1) Reator Batelada: o tempo de carregamento da mistura e o descarregamento dos produtos e
reagentes não convertidos é de um minuto.
C2) Reator Batelada: Tempo de operação é a soma do tempo de reação com o tempo morto.
C3) Reatores Contínuos (mistura ou tubular): tempo de operação é o tempo especial do reator.
C4) - O reator ideal será aquele que possuir menor tempo de operação e, consequentemente a
maior produção diária.
Pergunta-se:
A) Com base em todas as informações dadas acima, qual dos três tipos de reatores você
escolheria? Por quê?
B) Qual a produção diária em kg de acetato de etila obtido no reator escolhido?
13 – (Exame - 2004 / adaptada do Provão 1999) - Ao verificar seu e-mail ao chegar ao trabalho você
encontra a seguinte mensagem:
From: “Marco Antonio Pereira” [email protected]
To: “Alunos da Engenharia Industrial” ... [email protected]
Subject: Possível Questão de Prova
Date: Mon, 21 Jun 2004
Caros Alunos
Considerando que vocês formam uma turma de alunos muito dedicada e que a grande maioria está de
parabéns pela dedicação ao meu curso, proponho-lhes agora o seguinte desafio: analisar efetivamente o
que está ocorrendo na fábrica de polimerização de glicóis da IFT Tecnologia no seu site de São José dos
Campos.
Recebi o seguinte e-mail, de um ex-aluno:
Caro Marquinho
Temos enfrentado sérios problemas com um reator instalado em nossa empresa. O Fabricante nos garantiu
que teríamos uma conversão mínima de 75% se operássemos este reator a 120°C e pressão atmosférica .
Isto efetivamente ocorreu durante os três primeiros meses de operação deste reator.
Estamos tendo problemas desde que elevamos a temperatura para 180°C, pressionados pela necessidade
de aumentar a produção.
Para tentar melhorar a conversão, retiramos o recheio inerte e instalamos um sistema de agitação que
estava disponível em nossa fabrica. Não conseguimos entender como um reator de três metros de
comprimento e 20 cm de diâmetro pode ainda piorar seu desempenho, mesmo depois de instalarmos o
sistema de agitação.
Claro que tratamos de alterar a vazão para manter a razão volume/vazão constante, conforme aprendemos
em suas aulas de reatores na FAENQUIL.
_________________________8__________________________
Notas de Aula - Reatores – Prof. Dr. Marco Antonio Pereira
U S P – E E L - Escola de Engenharia de Lorena
Reatores – Aula 5 – Comparação Dimensional entre Reatores Contínuos
Por favor, você poderia com urgência nos dar o seu parecer do que possa estar ocorrendo.
Meu desafio para vocês:
A) Quais são as possíveis razões envolvidas na diminuição da conversão provocada pelo aumento
da temperatura;
B) Qual a causa da diminuição da conversão após a instalação do sistema de agitação, apesar de
mantida a razão volume/vazão constante..
Apresente suas considerações de forma clara e objetiva. Não escreva um testamento e sim
respostas curtas e objetivas.
14 – (P2 – 2003) - Você começa a trabalhar em uma empresa e em um belo dia de sol claro e
tempo ensolarado, você é chamado para uma reunião onde se analisa um possível equívoco cometido na
compra de um reator. Você permanece quieto e escuta seu gerente ler o relatório que recebeu de seu chefe
de produção:
“Prezado Gerente
Informo que a troca que fizemos do reator de mistura por um reator tubular com o objetivo de
aumentar a conversão não funcionou. Assim como combinado, mantive todas as condições de operação
constante, vazão, concentração de entrada e estou controlando muito bem a temperatura de operação do
novo reator tubular para que ele opere isotermicamente na mesma temperatura do reator de mistura antigo.
Como o novo reator tubular tem exatamente a mesma capacidade do reator de mistura antigo, não consigo
entender o que possa estar acontecendo pois a conversão obtida neste novo reator é exatamente a mesma
do anterior. Já fiz tudo que é possível. Garanto-lhe que não existe contaminação no lote de alimentação e
nem impurezas que possam estar comprometendo o desempenho deste novo reator. Simplesmente, já
repeti a operação várias vezes com absolutamente todas as condições iguais as anteriores e a sua previsão
de que o novo reator tubular iria aumentar a conversão não está funcionando. A conversão permanece a
mesma. Preciso de sua ajuda, pois suponho que algum equivoco foi cometido por nossa equipe de
projetistas. Por favor, o que está acontecendo? O que devo fazer?
Atenciosamente
Chefe de produção
Terminada a leitura, você tem uma opinião formada sobre qual foi o possível equivoco cometido e
começa a falar: “Meu caro Gerente, em minhas aulas de Reatores na Faculdade, tive um professor que
falava que não existe verdade absoluta em nada e estamos diante de um caso destes. Na minha opinião o
erro pode ser o seguinte:......”
Exercícios – Parte 2 - Análise de Reatores a partir de Gráficos Cinéticos
1 – (P1 – 2006) - Análises experimentais em uma reação química em fase liquida do tipo A → R
permitiram encontrar a velocidade da reação em função da concentração molar conforme mostrado na
tabela abaixo onde (-rA) é dado em mols/litro.minutos e CA em mols/litro.
(-rA)
CA
0,05
1
0,1
2
0,2
4
0,33
6
0,25
8
0,125
10
Para um reator tubular, determinar:
A) O volume necessário para uma conversão de 20% a partir de uma alimentação de 10L/min com
CAO = 10 M?
B) A vazão (L/min) utilizada em um reator de 66L, onde se obteve uma conversão de 66,7% a
partir de uma concentração de um CAO = 6 M?
C) A concentração de saída de um reator de 100L, operando a uma vazão de 40 L/min e com CAO
= 10 M? [CA= 9,7M]
D) O volume necessário para diminuir a concentração do reagente de 9M para 1M com uma
vazão de operação de 1 L/min. [V = 51,6 L]
_________________________9__________________________
Notas de Aula - Reatores – Prof. Dr. Marco Antonio Pereira
U S P – E E L - Escola de Engenharia de Lorena
Reatores – Aula 5 – Comparação Dimensional entre Reatores Contínuos
2 – (P1 – 2007) - Análises experimentais em uma reação química do tipo A → R permitiram
encontrar a velocidade da reação em função da concentração molar conforme mostrado na tabela abaixo
onde (-rA) é dado em mols/litro.minutos e CA em mols/litro.
(-rA)
CA
0,44
0,2
0,57
0,4
0,70
0,6
0,80
0,8
0,90
1,0
0,84
1,2
0,80
1,4
0,70
1,6
A partir de um gráfico de (1/-rA) versus CA, deseja-se saber:
A) O tempo da reação em um reator batelada para que CA diminua de 1,0M para 0,5M? [t = 39 s]
B) O volume de um reator tubular para uma conversão de 80% de uma alimentação de 600 mols de
A/hora com CAO = 1,5 M? [V = 9,9L]
C) O volume de um reator de mistura para uma conversão de 80% de uma alimentação de 1200
mols de A/hora com CAO = 1,0M?
D) O volume de um reator de mistura para uma alimentação de 2.000 mols de A/hora com CAo = 2,0
M e CAf = 0,5 M ? [V = 39,5L]
3 – (Exame – 2000) – A reação em fase liquida A → R + S é uma reação auto catalítica e a sua
velocidade em função da concentração molar foi estudada. Os valores obtidos estão na tabela abaixo:
CA (M)
-rA (M-1h-1)
1,5
7,26
CA (M)
-rA (M-1h-1)
1,4
12,94
0,7
28,03
1,3
17,73
0,6
26,66
1,2
21,65
0,5
24,42
1,1
24,68
0,4
21,30
1,0
26,84
0,3
17,29
0,9
28,12
0,2
12,41
0,8
28,51
0,1
8,33
A) Qual o volume de um reator tubular para uma conversão de 80% de uma alimentação de 400
moles A/hora com CAo = 0,5 M ? (V = 21,3 L)
B)
Qual o volume de um reator de mistura para uma conversão de 30 % de uma alimentação
de 1.000 moles de A/hora com CAo = 1,50 M ? (V = 11,7 L)
4 – (Exame 2002) - Determinada reação química A → produtos tem a sua velocidade estudada
cineticamente em função de várias concentrações molares e os resultados encontrados são os seguintes:
CA(mol/L)
-rA (mol/L.min)
0,1
0,09
0,2
0,18
0,4
0,36
0,6
0,54
1,1
0,65
1,4
0,78
1,6
0,98
2,0
1,54
Calcular o volume de um reator de mistura para uma conversão de:
A – 60% de uma alimentação de 400 mols de A/hora com CAO = 0,50 M. [V = 22,2 L]
B – 80% de uma alimentação a 6 L/min e CAO = 2,0 M.
Calcular o volume de um reator tubular para uma conversão de:
C – 60% de uma alimentação de 400 mols de A/hora com CAO = 0,50 M.
D – 80% de uma alimentação a 6 L/min e CAO = 2,0 M. . [V = 13,8 L]
5 - (P1 – 2001) - A reação em fase liquida A → produtos é complexa e o seu estudo foi realizado
em um reator tanque com agitação continua. A sua cinética foi estudada anteriormente e os seguintes
resultados foram obtidos:
CA (M)
-r A (M/min)
0,5
0,01
1
0,02
2
0,04
3
0,09
4
0,16
5
0,25
A – Qual o volume de um reator com uma alimentação de 100 moles de A/hora, concentração molar
de 20 M e operando com 90% de conversão? [V = 37,5]
B – Qual a conversão que ocorre em um reator de 20 Litros, com uma vazão de alimentação de 0,1
L/min e uma concentração inicial de 5 M ?
C – Qual a concentração final do reagente em um reator de 4 Litros, com uma vazão de
alimentação de 0,1 L/min e uma concentração inicial de 5 M? [CA = 2,5 M]
D – Qual a vazão de alimentação de um reator de 1 m3, com concentração inicial de 5 M e
conversão final de 90%? [vo = 2,22 L/min]
_________________________10__________________________
Notas de Aula - Reatores – Prof. Dr. Marco Antonio Pereira










