Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
Catabolismo dos
Aminoácidos Naturais
Os esqueletos aminados e de carbono dos aa são separados na
degradação proteica.
O esqueleto aminado é excretado sobre a forma de ureia.
O esqueleto de carbono vai ser reaproveitado, sendo convertido noutros
metabolitos anfibólicos (glicose ou lipido).
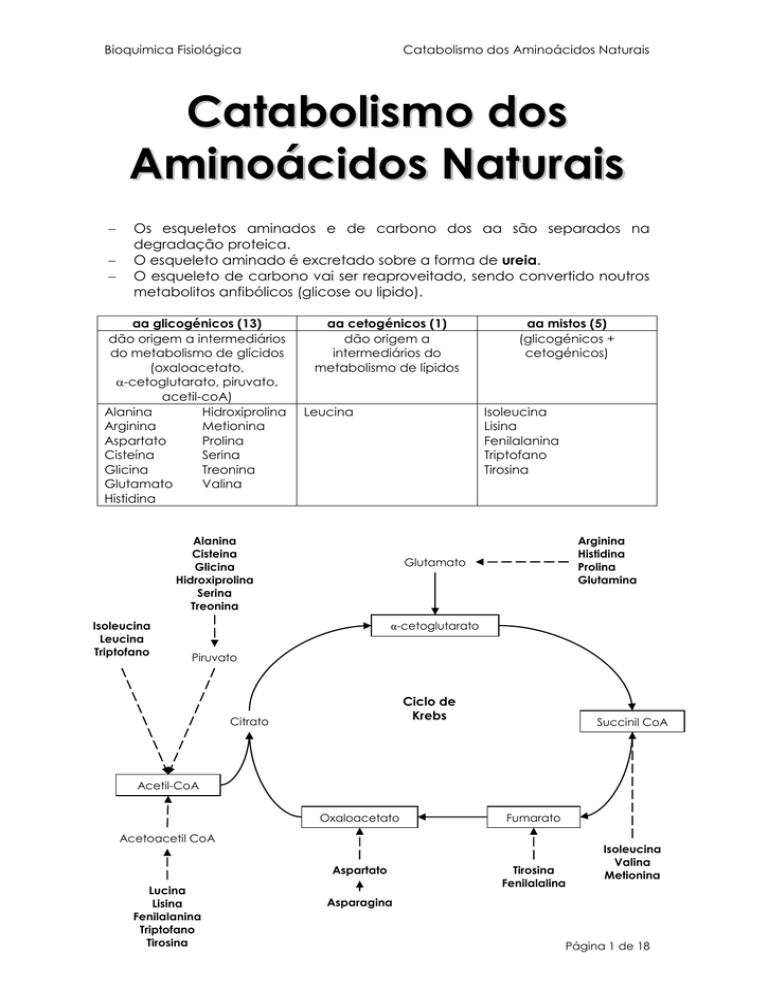
aa glicogénicos (13)
dão origem a intermediários
do metabolismo de glícidos
(oxaloacetato,
-cetoglutarato, piruvato,
acetil-coA)
Alanina
Hidroxiprolina
Arginina
Metionina
Aspartato
Prolina
Cisteína
Serina
Glicina
Treonina
Glutamato
Valina
Histidina
aa cetogénicos (1)
dão origem a
intermediários do
metabolismo de lípidos
Leucina
Isoleucina
Lisina
Fenilalanina
Triptofano
Tirosina
Alanina
Cisteina
Glicina
Hidroxiprolina
Serina
Treonina
Isoleucina
Leucina
Triptofano
aa mistos (5)
(glicogénicos +
cetogénicos)
Arginina
Histidina
Prolina
Glutamina
Glutamato
α-cetoglutarato
Piruvato
Ciclo de
Krebs
Citrato
Succinil CoA
Acetil-CoA
Oxaloacetato
Fumarato
Acetoacetil CoA
Aspartato
Lucina
Lisina
Fenilalanina
Triptofano
Tirosina
Tirosina
Fenilalalina
Isoleucina
Valina
Metionina
Asparagina
Página 1 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
1. Oxaloacetato
1.1 Asparagina e Aspartato
A asparagina e o aspartato originam oxaloacetato, segundo reacções
catalizadas pela asparaginase e transaminase.
Não existem defeitos nos metabolismos do aspartato, porque são
incompatíveis com a vida, dada a importância dessas vias.
Transaminase
Asparaginase
Asparagina
Aspartato
H2O
NH4+
Oxaloacetato
Piruvato Alanina
2. -cetoglutarato
2.1 Glutamina e Glutamato
O catabolismo da glutamina e do glutamato ocorrem paralelamente ao
da asparagina e aspartato, no entanto, formam -cetoglutarato.
A desaminação da glutamina é catalizada pela glutaminase
O aspartato e o glutamato são substractos para a mesma transaminase.
Não existem defeitos nos metabolismos do glutamato, porque são
incompatíveis com a vida, dada a importância dessas vias.
Transaminase
Glutaminase
Glutamina
Glutamato
H2 O
NH4+
α-cetoglutarato
Piruvato Alanina
2.2 Prolina
A prolina é oxidada a pirrolina 5-carboxilato que, por sua vez, adiciona
água para formar glutamato--semialdeído
O glutamato--semialdeído é oxidado a glutamato e transaminado a cetoglutarato
Defeitos metabólicos Hiperprolinémia tipos I e II
a. Hiperprolinémia tipo I defeito na prolina desidrogenase (DH). Não há
defeito associado do catabolismo da hidroxiprolina (Hyp).
b. Hiperprolinémia tipo II defeito na Glu-½-aldeido DH. Uma vez que esta
enzima também funciona no catabolismo da Hyp, tanto a via da Pro
como da Hyp estão afectadas.
Página 2 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
2.3 Arginina
No catabolismo da arginina é necessário retirar um grupo guanidino
(1carbono + 3 azotos), catalizada pela arginase formando ornitina.
A ornitina forma sofre transaminação do seu grupo 5-amino, formando
glutamato--semialdeído, que forma -cetoglutarato.
Defeitos no metabolismo da arginina hiperornitinémias:
a. Atrofia Circular da Retina defeito na ornitina transaminas
doença autossómica recessiva, hereditária
envolve degeneração cório-retinal, com perda progressiva da
visão.
Níveis plasmáticos de ornitina elevados, excreção de ornitina 110mmol/dia.
Terapia envolve restrição da ingesta de arginina.
b. Síndroma de hiperornitinémia-hiperamoniémia defeito no antitransportador ornitina-citrulina
Também considerado um defeito do ciclo da ureia.
Níveis sanguíneos elevados de ornitina e amónia, por bloqueio do
transporte da ornitina para a mitocôndria, que impede a formação
de ureia, originando a hiperamonémia.
Prolina
NAD+
Arginina
Prolina DH
Arginase
H2O
NADH + H+
Ureia
Pirrolina 5-carboxilato
Ornitina
α-KG
H2O
Glu
Transaminase
Glutamato semi-aldeido
NADH
++
H+H++
NADH
CO2
Glu ½ aldeido DH
Transaminase
Glutaminase
Glutamina
Glutamato
H2O
NH4+
α-cetoglutarato
Piruvato Alanina
Página 3 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
2.4 Histidina
A histidina é desaminada pela histidase formando urocanato.
O urocanato é convertido a 4-imidazolona-5-propionato, através da
adição de água e de uma reacção interna de oxirredução, catalizada
pela urocanase.
A hidrólise de 4-imidazolona-5-propionato forma N-formiminoglutamato.
O glutamato é formado, através da transferência do grupo fomimino do
Figlu ao tetrahidrofolato.
A transaminação do glutamato forma -cetoglutarato.
Na ausência de folato, esta reacção é parcial ou totalmente bloqueada
e o Figlu é excretado na urina.
O aumento da excreção da histidina é normal na gravidez, mas
geralmente relaciona-se com uma alteração temporária na função renal.
Histamina
Histidina
Histidase
CO2
NH4+
Urocanato
Urocanase
H2O
4-Imidazolona 5-Propionato
Imidazolona
propionato hidrolase
H2O
Formimino Glutamato
Glutamato Formimino
transferase
H4Folato
Formimino H4Folato
Transaminase
Glutaminase
Glutamina
Glutamato
H2O
NH4+
α-cetoglutarato
Piruvato Alanina
Defeitos metabólicos:
a. Histidinémia defeito na histidase, níveis elevados de histidina no sangue
e na urina.
b. Acidúria Urocânica defeito na urocanase. Elevada excreção de
urocanato.
Página 4 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
3. Piruvato
alanina, glicina, cisteína, serina e treonina (apenas 2 carbonos). O piruvato
pode depois ser convertido a acetil-CoA.
3.1. Glicina
A glicina pode formar piuvato, via conversão inicial a serina, mas a
clivagem é a principal via de catabolismo deste aa.
O complexo glicina sintase (mitocôndria hepática) decompõe a glicina
em CO2 e NH4+, além de formar N5,N10 – metileno tetrahidrofolato, de
modo reversivel.
Defeitos metabólicos:
a. Glicinúria:
excreção urinária de 0,6-1g/dia de glicina
tendência para formar cálculos renais de oxalato
Defeito na reabsorção tubular de glicina a nível do rim.
b. Hiperoxalúria primária:
a excreção de oxalato não está relacionada com a ingestão de
oxalato
A glicina forma glioxalato (oxalato-semialdeído) por desaminação,
que é depois convertido a oxalato, reacção na qual se encontra o
defeito metabólico.
Origina progressiva urolítiase por cálcio e infecção do tracto
urinário, levando à morte por falência renal ou hipertensão.
3.2 Serina
A
degradação
da
serina
resulta
em
glicina,
N5,N10
–
Metilenotetrahidrofolato.
Seguindo a reacção catalisada por hidroximetiltransferase o catabolismo
da serina confunde-se com o da glicina.
CO2 + NH4+
H4Folato
Glicina Sintase
N5N10 metilenoH4Folato
O2
Glicina
N5N10 metilenoH4Folato
NH4+ + H2O2
Oxidase
NAD+ NADH +H+
Glioxalato
DH
Oxalato
Oxalato de Cálcio
Hidroximetiltransferase
H4Folato
α-ca
Serina
NH4+
α-aa
Transaminase
Desidratase
NAD+ NADH +H+
Hidroxipiruvato
DH
ATP
Glicerato
ADP
Cinase
3Pglicerato
Glicose
Piruvato
Página 5 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
3.3 Alanina
Forma piruvato por transaminação directa, que pode ser descarboxilado
a acetil-CoA.
Esta via não possui defeitos → erros não são compatíveis com a vida.
Transaminase
Alanina
Piruvato
α-cetoglutarato Glutamato
3.4 Cisteína
Possui enxofre, sob a forma de um grupo tiol (–SH).
Pode existir no organismo sobre a forma de homodímero cistina
(ligação bissulfito entre as 2 cisteínas).
A cistina necessita de ser clivada por redução, pela cistina redutase, de
modo a ser metabolizada.
Pode ser metabolizada através de 2 processos distintos:
3.4.1) Oxidação directa
A conversão de cistina a sulfinato de cisteína é catalizada pela cisteina
dioxigenase
Esta enzima necessita de ferro e de NAD(P)H.
O sulfinato de cisteína é transaminado a sulfinilpiruvato.
A conversão do sulfinilpiruvato a piruvato e sulfeto é catalizada pela
desulfinase, ocorrendo mesmo na ausência de catálise enzimática.
3.4.2) Transaminação
A conversão da cisteína a 3-mercaptopiruvato ocorre no fígado e no rim,
catalizada pela cisteína transaminase (específica para a reacção) ou
pelas glutamato e aspartato transaminases.
O 3-mercaptopiruvato é reduzido pela L-lactato desidrogenase, formando
3-metacaptolactato (excretada na urina)
O 3-mercaptopiruvato também pode formar piruvato, através de uma
dessulfuração.
Cistina
2 x Cisteína
2NADP + 2H+ + O2
2NADP+ + 2H2O
Hipotaurina
Taurina
α-CA
Dioxigenase
Cisteína Sulfinato
Transaminase
α-aa
α-aa
NADH + H+ NAD+
3 Mercaptopiruvato
2H
α-CA
Sulfinilpiruvato
Ácidos Cólicos
Transaminase
SO32-
H2S
Dessulfinase ou
Espontâneo
3 Mercaptolactato
Excretado na urina
Sulfurtransferase
Piruvato
Ácidos Biliares
Página 6 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
Defeitos metabólicos
a. Cistinúria (Cistina-Lisinúria)
Excreção de cistina na urina que pode ir até 30 vezes o normal,
acompanhada de um aumento também da excreção de lisina,
arginina e ornitina, o que sugere um defeito na reabsorção tubular
deste 4 aa.
Formam-se cristais e cálculos de cistina nos túbulos renais.
b. Cistinose (armazenamento de cistina)
doença lisossómica rara, defeito no transporte mediado de cistina.
Deposição de cristais de cistina em todos os tecidos e órgãos.
Geralmente acompanhada de aminoaciduria generalizada e de
mau funcionamento renal.
c. Homocistinúrias defeitos no metabolismo da metionina
Excreção de homocisteína e, por vezes, de adenosilmetionina (ver
mais adiante – catabolismo da metionina).
Níveis plasmáticos de metionina também elevados.
Tratamento à base de uma dieta pobre em metionina e elevada
em cistina (tipo I).
3.5 Treonina
A treonina é clivada em acetaldeido e glicina pela treonina aldolase.
O acetaldeído é oxidado a acetato, que depois é activado a acetil-CoA
(por isso se diz que apenas 2 carbonos da treonina originam piruvato).
Piruvato
Metilglioxal
NADH +
Succinil CoA
NH4+
NAD+ + H2O
Proprionil CoA
aminoacetona
NADH + H+
CO2
NADH +CO2
NAD+
NH4+
NAD+ + CoA
Treonina
α-amino α-cetobutirato
α-cetobutirato
Aldolase
Glicina
Acetaldeido
NAD+
Aldeido DH
N5N10 metilenoH4Folato
NADH + H+
Hidroximetiltransferase
H4Folato
Serina
Acetato
CoA + ATP
Acetato
tiocinase
AMP + PPi
Acetil-CoA
CO2 + NADH + H+
NH4+
Desidratase
Piruvato
CoASH + NAD+
Página 7 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
3.6 Hidroxiprolina
A hidroxiprolina desidrogenase (uma
desidrogenase mitocrondrial) oxida a
hidroxiprolina a L-1-pirrolina-3-hidroxi-5carboxilato, que está em equilibrio não
enzimático com -hidroxi-L-glutamato semialdeido.
O semialdeido é oxidado a eritro-hidroxi-L-glutamato
e
então,
transaminado
a
-ceto-hidroxiglutarato.
Uma clivagem tipo aldol forma glioxilato
e piruvato.
Hidroxiprolina
2[H]
Hidroxiprolina DH
Pirrolina 3 hidroxi 5 carboxilato
H2O
Espontâneo
HidroxiGlutamato ½ Aldeido
NAD+ + H2O
NADH + H+
DH
Eritro Hidroxiglutamato
α-CA
Defeito Metabólico: hiperhidroxiprolinémia
defeito
na
hidroxiprolina
DH.
Caracterizada
por
níveis
plasmáticos
elevados de hidroxiprolina.
α aa
Transaminase
α-cetohidroxiglutamato
Aldolase
Piruvato
Glioxalato
Página 8 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
4. Acetil-CoA
Todos os aa que formam piruvato dão origem a acetil-CoA (via piruvatodesidrogenase). Para além desses, existem 5 que formam acetil-CoA sem
antes originarem piruvato: fenilalanina, tirosina, triptofano, lisina e leucina.
4.1 Tirosina
A transaminação da tirosina a p-hidroxifenilpiruvato é catalisada pela
tirosina--cetoglutarato transaminase (enzima do figado)
O p-hidroxifenilpiruvato forma homogentisato, tendo como redutor o
ácido ascórbico (vit C).
O homogentisato passa a maleilacetoacetato pela homogentisato
oxidase.
A
isomerização
do
maleilacetoacetato,
catalizada
pela
maleilacetoacetato cis,trans isomerase, forma fumarilacetoacetato.
A hidrólise de fumarilacetoacetato forma fumarato e acetoacetato, pela
fumarilacetoacetato hidrolase.
O acetoacetato forma acetil-CoA e acetato, via reacção catalisada
pela -cetotiolase.
Fenilalanina
Redutase
NADP+
NADPH +
H+
H4Biopterina + O2
H2Biopterina + H2O
Monooxigeanse
α-CA
α aa
Fenilalanina
Hidroxilase
Catecolaminas
DOPA
Tirosina
Melaninas
Transaminase
ρ-hidroxifenilpiruvato
O2
CO2 + H2O
Di-oxigenase
Homogentisato
O2
Di-oxigenase
Maleilacetoacetato
Isomerase
Fumaril acetoacetato
H2O
H+
Fumarato
Hidrolase
Acetil-CoA
Acetoacetato
β-cetotiolase
Acetato
Página 9 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
Defeitos Metabólicos:
a. Tirosinémia tipo I (tirosinose) defeito na fumarilacetoacetato hidrolase
e (possivelmente) na maleilacetoacetato hidrolase.
Aumento ( ) dos níveis sanguíneos de tirosina e metionina
Os metabolitos acumulados afectam o funcionamento de vários
sistemas corporais, dando origem a sintomas dispersos.
Tratamento com base numa dieta pobre em tirosina e fenilalanina,
e, por vezes, em metionina.
b. Tirosinémia tipo II (sindrome de Richner-Hannart) defeito na tirosina
transaminase hepática.
Sintomas: tirosina plasmática, lesões da pele e dos olhos, ligeiro
atraso mental.
A tirosina é o único aa em concentração elevada na urina, mas os
níveis de excreção / reabsorção renais de tirosina estão normais.
A tirosina é excretada sob a forma dos metabolitos
hidroxifenilpiruvato,
hidroxifenilactato,
hidroxifenilacetato,
acetiltirosina e tiramina.
c. Tirosinémia neonatal defeito na hidroxifenilpiruvato hidroxilase.
níveis sanguíneos de tirosina e fenilalanina
níveis urinários de tirosina, hidroxifenilacetato, acetiltirosina e
tiramina.
Tratamento: dieta pobre em proteínas
d. Alcaptonúria defeito na homogentisato oxidase.
Consequências: excreção de homogentisato na urina, que ao
reagir com o ar confere à urina uma tonalidade negra; mais tarde
ocorre acumulação de homogentisato nos tecidos conjuntivos e
aparecimento de artrite.
Degradação alternativa da tirosina
Tirosina
α-CA
α aa
Acetil-CoA
CoA
ρ-hidroxifenilpiruvato
Tiramina
Acetiltirosina
Tiramina
oxidase DH
DH
ρ-hidroxifenillactato
Página 10 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
4.2 Fenilalanina
A fenilalanina é metabolizada através da tirosina, na qual é convertida
por hidroxilação (fenilalanina hidroxilase).
Desse modo, origina os mesmos produtos finais que a tirosina: fumarato,
acetato e acetil-CoA.
Fenilalanina
α-CA
α aa
Fenilpiruvato
NADH +
H+
NAD+
Fenilacetato
NAD+ + H2O
NADH + H+ + CO2
Fenilactato
Glutamina
H2O
Fenilacetilglutamina
Defeitos no catabolismo da fenilalanina:
a. Hiperfenilalaninémia tipo I ou fenilcetonúria clássica (PKU) defeito na
fenilalanina hidroxilase
Consequências: atraso mental (devido ao transporte e metabolismo
reduzidos de outros aa aromáticos no cérebro, dada a competição
com a fenilalanina), eczema, apoplexia, psicose e odor semelhante
a rato, pele e olhos claros (falta de pigmentação devido à
deficiência em tirosina)
Tratamento: dieta pobre em fenilalanina, mas incluindo tirosina, que
pode ser interrompida por volta dos 6 anos.
A hidroxilase é insensível à regulação pela fenilalanina ou encontrase em menor quantidade.
A fenilalanina não é convertida em tirosina, sendo metabolizada
sob as formas fenilacetato (que pode ser convertido em
fenilacetilglutamina), fenilactato e fenilglutamina, que são tóxicas
para o SNC.
Diagnóstico: teste do pezinho (podem ocorrer falsos positivos e
falsos negativos); detecção de fenilpiruvato na urina, através da
reacção com cloreto férrico.
b. Hiperfenilalaninémias tipo II e III defeito na dihidrobiopterina redutase,
é muito mais grave, pois esta enzima é necessária na sintese de
catecolaminas e serotonina (neurotransmissores)
c. Hiperfenilalaninémia tipo IV e V defeito na síntese de
dihidrobiopterina, cujo tratamento inclui a adição deste composto na dieta.
Página 11 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
4.3 Lisina
A lisina forma uma base de Schiff
com o -cetoglutarato, que é
reduzido a sacaropina
então
oxidado
por
uma
2ª
desodrogenase.
A adição de água forma Lglutamato e L--aminoadipato-semialdeido.
As
4
primeiras
reacções
assemelham-se à remoção do
NH2 da lisina por transaminação
(não pode ocorrer directamente
nos mamíferos).
A
transaminação
do
aminoadipato
forma
cetoadipato, seguida de uma
descarboxilação
oxidativa
a
glutaril-CoA,
cujas
vias
no
organismo
não
são
bem
conhecidas. No entanto, sabe-se
que tem um papel glicogénico e
cetogénico.
Defeitos metabólicos:
Lisina
NADPH + H+
NADP+
DH
α-Cetoglutarato
H2O
Sacaropina
NAD+
NADH + H+
Transaminase
H2O
Glutamato
α-aminoadipato ½ aldeido
NAD+
NADH + H+
DH
α-aminoadipato
α-Cetoglutarato
Glutamato
Transaminase
α-cetoadipato
NAD+
NADH + H+
DH
CoA
CO2
Glutaril CoA
FAD
FADH2
DH
Glutaconil CoA
a. Hiperlisinémia periódica
Espontâneo
CO2
Desencadeada
pela
ingesta normal de proteínas.
Crotonil CoA
Os níveis elevados de lisina
no
fígado
inibem
H2O
Hidratase
competitivamente
a
arginase,
causando
3-Hidroxibutiril CoA
hiperamoniémia.
Tratamento: restrição da
NAD+
DH
ingesta
de
lisina,
NADH + H+
administração de fluidos.
Acetoacetil CoA
b. Hiperlisinémia persistente
Doença
autossómica
CoA
Tiolase
recessiva.
Os catabolitos da lisina
2 x Acetil CoA
podem ou não acumular-se
nos fluidos corporais.
Tem como consequência mais evidente o atraso mental.
Não está associada a hiperamoniémia.
Página 12 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
4.4 Triptofano
É catabolizado através da via da
quinurenina-antranilato
(degradação dos carbonos da
cadeia lateral e do anel
aromático), que dá origem a
intermediários anfibólicos.
A triptofano-oxigenase catalisa a
clivagem do anel indol e a
incorporação de 2 átomos do
ocigénio molécular, dando Nformil-quinurenina.
A triptofano-oxigenase é uma
metaloproteína/porfirina férrica,
que é induzida no figado por
triptofano e corticoesteróides
renais. É inibida por derivados do
ácido nicotínico (ex.: NADPH).
A remoção hidrolitica do grupo
formil de N-formil-quinurenina
catalisada
pela
quinureninaformilase do figado,
produz quinurenina.
A
quinurenina
pode
ser
desaminada, resultando em 2amino-3-hidroxibenzoil piruvato,
que perde água e forma ácido
quinúrico.
Em alguns animais a conversão
do triptofano a ácido nicotinico
torna
desnecessário
o
suprimento da vitamenta na
dieta.
Triptofano
O2
Formilquinurenina
H2O
Quinurenato
ATP
Quinurenina
NADPH + H+ + O2
NADP+ + H2O
Xanturenato
Oxigenase
Hidroxiquinurenina
H2O
Alanina
Hidrolase
Hidroxiantranilato
NMN
O2
NAD, NADP
Oxigenase
2 amino 3 carboximuconato 1/2aldeido
CO2
Descarboxilase
Aminomuconato
NAD+
NADH + H+
DH
α-cetoadipato
NAD+
NADH + H+
DH
Glutaril CoA
FAD
FADH2
DH
Glutaconil CoA
CO2
Espontâneo
Crotonil CoA
H2O
Hidratase
3-Hidroxibutiril CoA
NAD+
NADH + H+
DH
Acetoacetil CoA
CoA
Tiolase
2 x Acetil CoA
Página 13 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
Defeitos na via metabólica:
a. Acumulação de xanturenato
a quinurenina e a hidroxiquinurenina são convertidas a
hidroxiantranilato através da quinurenase, que requer fosfato de
piridoxal (vit. B6).
Quando há carência desta vitamina e se ingere triptofano, a
hidroxiquinurenina é convertida em xanturenato, que se acumula
nos fluidos. (reacção representada ao lado)
b. Doença de Hartnup
defeitos no transporte renal e intestinal de aa neutros, entre eles o
triptofano.
Aminoaciduria neutra, excreção aumentada de derivados indólicos,
por degradação do triptofano pelas bactérias do intestino.
A absorção intestinal e reabsorção renal diminuídas de triptofano
limitam a quantidade deste aa disponível para a síntese de niacina,
tendo como consequência os sintomas e sinais de pelagra que se
manifestam na carência desta vitamina.
Nota: o catabolismo da leucina vai ser apresentado mais adiante, juntamente
com o da isoleucina e da valina, com os quais tem reacções em comum.
Página 14 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
5. Succinil-CoA
Originado a partir de 3 aa: metionina, isoleucina e valina. Apenas algumas
porções dos esqueletos de carbono são convertidas a succinil-CoA, não a sua
totalidade. Este metabolito é anfibólico.
5.1 Metionina
A Metionina condensa-se com o ATP, dando
origem a S-adenosilmetionina.
O grupo S-metil, activo, é transferido para uma
grande variedade de compostos aceptores.
Após a remoção do grupo metil, é formada a Sadenosil-homocisteina.
A hidrólise das ligações S-C produz Lhomocisteina e adenosina.
A homocisteina condensa-se com a serina
formando o aa cistationina.
A hidrólise da cistationina forma cisteina e Lhomoserina, de tal forma que o efeito final é a
conversão da homocisteina em homoserina e da
serina em cisteina.
A homoserina é transformada em -cetobutirato
por uma reacção catalisada pela homoserinadesaminase.
A conversão do -cetobutirato a proprionil-CoA
ocorre da maneira usula na descarboxilação dos
-cetoácidos, para originar acil-CoA derivados.
Metionina
Adenosil
transferase
S-Adenosilmetionina
X
X-CH3
Hidrolase
S-Adenosilhomocisteína
H2O
Adenosina
Oxigenase
Homocisteína
Serina
Cistatiotina sintase
Cistatiotina
H 2O
Cisteína
Liase
Homoserina
NH4+
Desaminase
α-cetobutirato
Problemas no Catabolismo do Metilmalonil-CoA
a. Acidúria Metilmalónica provocada por
deficiência
de
vitamina
B12
adenosilcobalamina (coenzima da metilmalonil-CoA
mutase).
b. Acidémia Propiónica deficiência na
propionil-CoA carboxilase propionato soro.
Tratamento: dieta pobre em proteínas, impedimento
da acidose metabólica.
NAD+ + CoASH
NADH + H+ + CO2
DH
Proprionil CoA
HCO3- + ATP
ADP + Pi
DH
D-Metil-Malonil CoA
Isomerase
L-Metil-Malonil CoA
Mutase
Succinil CoA
Página 15 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
5.2 Catabolismo dos aa ramificados
As reacções iniciais são iguais para os 3 aa, sendo realizadas pelas
mesmas enzimas.
A partir daí, cada aa forma metabolitos anfibólicos diferentes, o que
determina que a valina seja glicogénica, a leucina cetogénica e a
isoleucina ambas as coisas.
O metabolismo destes aa ocorre no fígado, rim, músculo, coração e
tecido adiposo.
Passos gerais:
1. Transaminação, catalisada por uma única transaminase
2. Descarboxilação oxidativa dos cetoácidos resultantes, na
mitocôndria
3. Desidrogenação dos tioésteres acil-CoA
4. Produtos resultantes seguem vias catabólicas distintas.
A descarboxilação oxidativa e formação de acil-tioésteres são catalizadas
pelo complexo da -cetoácido ramificado desidrogenase piruvato
desidrogenase / -KG DH.
Subunidades da enzima:
–
-KA descarboxilase
– transacilase
– dihidrolipoil desidrogenase
Regulação:
proteína cinase (fosforilação)
-KA ramificados,
clofibrato, dicloroacetato (hipolipemiantes), moléculas R-CoA
fosfoproteína fosfatase Ca2+-independente (desfosf.)
Acidémia isovalérica ingesta excessiva de proteínas isovalerato
sanguíneo (produto de desacilação do isovaleril-CoA).
Valina, Leucina, Isoleucina
α CG
Glu
Transaminase
α - cetoácidos
NAD+ + CoASH
NADH + H+ + CO2
Descarboxilação
Oxidativa
Acil-Tioésteres
FAD
FADH2
Desidrogenase
Acil tioésteres α,β insaturados
(Valina)
Succinil CoA
(Leucina)
HMG CoA
(Isoleucina)
Succinil CoA + Acetil CoA
Página 16 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
5.2.1 Leucina Reacções Específicas
Leucina
A leucina dá origem a acetil-CoA, pelo que
não se inclui no grupo de aa que origina
succinil-CoA, mas o seu catabolismo é muito
análogo ao dos aa ramificados.
A 4ª reacção da leucina (L4) é a chave para
o facto de a leucina ser cetogénica (fixação
de CO2); requer biotinil CO2 e forma metilglutaconil-CoA
Reacção L5: hidratação de -metilglutaconilCoA
forma
-hidroxi--metilglutaril-CoA
(HMG-CoA), percurssor de corpos cetónicos;
mevalonato colesterol polisoprenóides
Reacção L6: Clivagem do HMG-CoA em
acetil-CoA e acetoacetato, no fígado, rim e
coração, potencia o forte efeito cetogénico
da leucina.
α CG
Glu
Transaminase
α - cetoadipato
NAD+
+ CoASH
NADH + H+ + CO2
DH
Isovaleril CoA
FAD
FADH2
DH
β Metilcrotonil CoA
ATP, CO2
ADP + Pi + H2O
Carboxilase
β Metilglutaconil CoA
H 2O
Hidrolase
β Hidroxi β Metilglutaril CoA
Liase
Acetil CoA
Acetoacetato
5.2.2 Isoleucina
I4: hidratacao catalizada pela crotonase
(análoga à V4)
I5: desidrogenacao análoga à V5
I6: clivagem tiolotica formando acetil-CoA é
cetogénico, propionil-CoA é glicogénico.
Isoleucina
α CG
Glu
Transaminase
α-ceto β-metilvalerato
NAD+
+ CoASH
NADH + H+ + CO2
DH
α-metilbutiril CoA
FAD
FADH2
DH
α -metilcrotonil CoA
H 2O
Hidratase
α-metil β-hidroxivaleril CoA
NAD+
NADH + H+
DH
α-metilacetoacetil CoA
Tiolase
Acetil CoA
Propionil CoA
Succinil CoA
Página 17 de 18
Bioquimica Fisiológica
Catabolismo dos Aminoácidos Naturais
5.2.3 Valina reacções específicas
Valina
V4: hidratação catalizada pela crotonase, que
tem especificidade alargada para os tioésteres
de CoA de 4 a 9 carbonos.
V5: hidrólise da ligação tioéster, importante para
a ocorrência das reacções subsequentes.
V6: oxidação reversível NAD+-dependente
V7: o -aminoisobutirato é um AA normal da
urina.
V8: A formação de metilmalonil-CoA é uma via
alternativa.
V9: isomerização do metilmalonil-CoA a succinilCoA. Metilmalonil mutase tem como coenzima a
adenosilcobalamina (derivado vit.B12).
α CG
Glu
α - cetoisovalerato
NAD+
+ CoASH
NADH + H+ + CO2
DH
Isobutiril CoA
FAD
FADH2
DH
Metilcritil CoA
H 2O
Hidratase
β Hidroxisobutiril CoA
H 2O
CoA
Problemas no catabolismo de aa ramificados
Transaminase
Hidrolase
β Hidroxisobutirato
NAD+
DH
a. Cetonúria de AA ramificados (persistente)
NADH + H+
PP + Pi
(doença da urina de caramelo) defeito da Metilmalonil ½ aldeido
cetoácido descarboxilase
isoleucina, leucina e valina no plasma
NAD+ + CoASH
DH
e na urina
Consequencias: afecta gravemente o
Proprionil CoA
cérebro, mas os mecanismos de
toxicidade são desconhecidos.
O tratamento envolve a exclusão
Succinil CoA
destes 3 aa da dieta até que os seus
níveis nos fluidos voltem ao normal.
A partir de então a sua ingesta deve ser controlada, de modo a que
nunca exceda as necessidades metabólicas para estes AA.
Quando a mutação afecta também a dihidrolipoato redutase,
origina perturbações do metabolismo do piruvato, do -KG e dos
AA ramificados simultaneamente.
b. Cetonúria Intermitente de AA ramificados defeito da -cetoácido
descarboxilase, menos grave que o anterior. Manifesta-se quando a ingesta
de leucina, isoleucina ou valina ultrapassa consideravelmente as
necessidades diárias dos 3 AA.
c. Acidémia Isovalérica perturbação do metabolismo da valina. Defeito
na isovaleril-CoA DH.
Acumulação de isovaleril-CoA, hidrolisado a isovalerato, excretado
na urina e no suor.
Sintomas: fluidos corporais com odor a queijo, vómitos e coma
precipitado pela ingesta excessiva de proteínas.
Página 18 de 18