2- Introdução à Química Orgânica
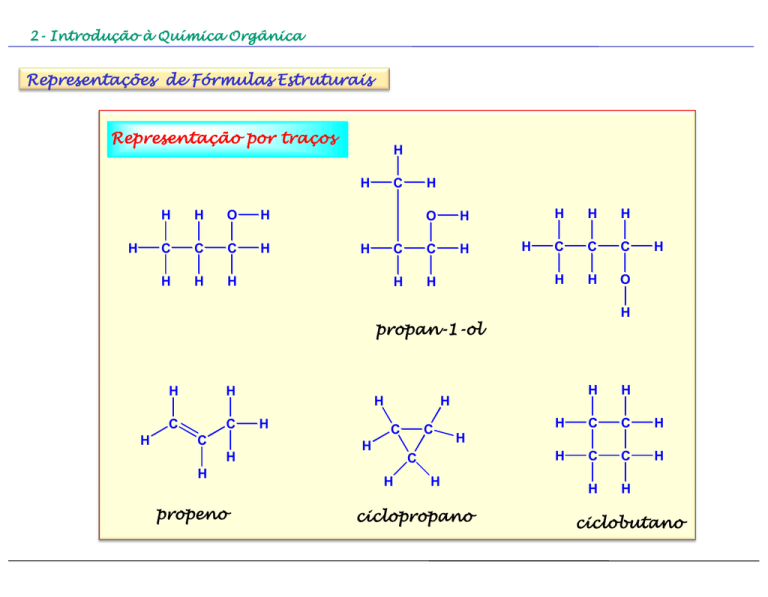
Representações de Fórmulas Estruturais
Representação por traços
H
H
H
H
H
O
H
C
C
C
H
H
H
H
C
H
H
O
H
C
C
H
H
H
H
H
H
H
C
C
C
H
H
O
H
propan-1-ol
H
H
H
C
C
C
H
H
propeno
H
H
H
H
H
C
C
H
H
C
C
H
H
H
H
C
H
C
H
C
H
H
H
ciclopropano
ciclobutano
2- Introdução à Química Orgânica
Representações de Fórmulas Estruturais
Formas condensadas
H
propan-2-ol
H
O
OH
H
CH 3CHCH 3
H
propeno
C
C
C
H
H
H
H
H
C
C
H
H
(CH 3)2CHOH
CH 3CHOHCH 3
H
C
CH 3CH(OH)CH 3
CH2CHCH3
H
H
ciclopropano
H
H
C
H
C
C
H
H
H2C
CH 2
CH 2
H
2- Introdução à Química Orgânica
Representações de Fórmulas Estruturais
H2 C
CH
CH2
CH3
•FÓRMULAS DE LIGAÇÕES EM LINHA
CH2CHBrCH2CH3
Br
Br
2-bromobutano
CH
H2 C
OH
CH2
prop-2-eno-1-ol
H2
C
H2 C
H2 C
CH2
CH2
ciclobutano
CH2CHCH2OH
OH
2- Introdução à Química Orgânica
Representações de Fórmulas Estruturais
FÓRMULAS TRIDIMENSIONAIS
H
H
H
H
C
C
H
H
H
H
H
H
C
C
H
Metano
H
H
C
H
H
Etano
H
H
H
Cl
C
C
Cl
Cl
H
H
H
Clorometano
H
H
C
H
H
H
H
H
C
H
2- Introdução à Química Orgânica
Grupos Funcionais
Alcanos
Etano
Metano
CH4
H
H C H
H H
C2H6
H C C H
H H
H
Hibr idação sp3
Geometr ia tetraédrica
Ângulos de 109,5°
ligação
2- Introdução à Química Orgânica
Grupos Funcionais
Alcenos
Propeno
Eteno
C2H4
H
H
C C
H
C3H6
H
C C
H
H
H
H
C
H
2
Hibr idação sp
Geometr ia tr iangular plana
Ângulos de 120°
ligação
H
ligação
2- Introdução à Química Orgânica
Grupos Funcionais
Iso m e ris m o
cis-tra ns
H
C
H
Cl
C
Cl
cis-1,2-dicloroeteno
H
C
Cl
Cl
C
H
trans-1,2-dicloroeteno
Ester eois óm er os
: m esm a fór m u la m o lecular
m es m a co ne ctividad e
d ifer en te arr anjo esp acial dos áto m o s
2- Introdução à Química Orgânica
Grupos Funcionais
Alcinos
Propino
2 ligações
Etino
C2H2
H C C
H
C3H4
H
H C C C
H
H
Hibr idação sp
Geometr ia linear
Ângulos de 180°
ligação
2- Introdução à Química Orgânica
Grupos Funcionais
Com pos tos ar om áticos
H
H
H
H
H
H
Todos os átomos de car bono
2
têm hibr idação sp
H
H
H
H
H
H
electrões em orbitais p
C6H6
ligações
2- Introdução à Química Orgânica
Grupos alquilo - terminação -ilo
Grupos Funcionais
rem oção de um H
alcano
grupo alquilo
H
RH (alcano)
H
H
C
rem oção de um H
H
H
H
H
metilo
metano
R (grupo alquilo)
H
H
C
C
H
H
H
rem oção de um H
H
H
rem oção
de um H
H
H
H
C
C
C
H
H
H
H
C
C
H
H
ou CH3CH2
etilo
etano
H
ou CH3
C
H
propano
H
H
H
H
C
C
C
H
H
H
ou CH3CH2CH2
propilo
H
rem oção
de um H
H
H
H
H
C
C
C
H
H
isopropilo
H
ou CH3CH CH3
2- Introdução à Química Orgânica
HALETOS DE ALQUILO
Grupos Funcionais
Substituição de um átomo de H por
F, Cl, Br, ou I
alcano
átomo de hidrogénio
terciário (3º)
1º
1º
CH
3
H
H3C
1º
C
átomos de hidrogénio
primários (1º)
1º
H
C
C
H
H
H
H
2º
CH2
3º
CH
H3C
H
2ºCH
1º
CH3
haleto de alquilo
H
H
C
C
H
H
carbono 1º
Br ou CH3 CH2 Br
1-bromoetano
etano
2
H
H3C
H
haleto de alquilo
prim ário
H
carbono 2º
H
átomos de hidrogénio
secundários (2º)
H
H
H
H
C
C
C
H
H
C
C
C
H
Br
H
H ou CH3 CHBrCH3
2-bromopropano
H
H
H
H
C
C
C
H
H
H
H
H
propano
Br ou CH3 CH2 CH2 Br
carbono 1º
1-bromopropano
CH3
H3 C
haleto de alquilo
secundário
C
haleto de alquilo
prim ário
CH3
H
CH3
2-m etilpropano
H3 C
C
Br ou (CH3)3 CBr
CH3
2-bromo-2-m etilpropano
carbono 3º
haleto de alquilo
terciário
2- Introdução à Química Orgânica
HALETOS DE ALQUILO
Grupos Funcionais
Substituição de um átomo de H por
F, Cl, Br, ou I
alcano
H
H
H
C
C
H
H
H
H
haleto de alquilo
H
H
C
C
H
H
carbono 1º
Br ou CH3 CH2 Br
1-bromoetano
etano
H
H
haleto de alquilo
prim ário
H
carbono 2º
H
H
H
H
H
C
C
C
H
H
C
C
C
H
Br
H
H ou CH3 CHBrCH3
2-bromopropano
H
H
H
H
C
C
C
H
H
H
H
H
propano
Br ou CH3 CH2 CH2 Br
carbono 1º
1-bromopropano
CH3
H3 C
haleto de alquilo
secundário
C
haleto de alquilo
prim ário
CH3
H
CH3
2-m etilpropano
H3 C
C
Br ou (CH3)3 CBr
CH3
2-bromo-2-m etilpropano
carbono 3º
haleto de alquilo
terciário
2- Introdução à Química Orgânica
Grupos Funcionais
Isóm e ros constitucionais - mesma fórmula mo lecular
- diferente conectividade
C4H9Br
H H H H
H
C C C C Br
H H H H
H H H H
H
C C C C H
H H
H
H
H
Br H
H
C
H
H
C
H
H H H H
Br
C C C C H
H H H H
H
H
H
H
C
Br
C C H
H
H
C
H
H
H H H H
H C C C C H
H Br H H
H
C C Br
H
haleto de alquilo
terciário
haleto de alquilo
secundário
haleto de alquilo
primário
2- Introdução à Química Orgânica
Grupos Funcionais
ÁLCOOIS
ROH
CH3 OH - metanol ou álcool metílico
sp 3
CH3 CH2 OH - etanol ou álcool etílico
H
H
H
H
H
C
C
C
C
H
H
H
H
álcool primário
(butan-1-ol)
OH
carbono 1º
H
H
H
H
H
C
C
C
C
H
H
OH
H
álcool secundário
(butan-2-ol)
CH 3
H
carbono 2º
H3C
C
CH 3
OH
carbono 3º
álcool terciário
(2-metilpropan-2-ol)
ter-butanol
2- Introdução à Química Orgânica
Grupos Funcionais
ÉTERES
R OR o u ROR´
CH3 OCH3 - éter dimetílico
H3C
O
CH3
CH3 CH2 OCH2CH3 - éter dietílico
éteres cíclicos
O
óxido de etileno
O
tetra-hidrofurano (THF)
2- Introdução à Química Orgânica
Grupos Funcionais
H
AMINAS
N
H
H
N
R
H
H
H
amina 1ª
H
N
CH3
H
N
´´R
R
metilamina
R
R´
R´
amina 2ª
amina 3ª
N
H3 CH2 C
CH3
N
CH2 CH3
CH2 CH3
CH2 CH3
H
N
N-etilmetilamina
trietilamina
H
NH2
N
amina
aromática
amina cíclica
anilina
H
H3 C C
H
N
CH3
H
isopropilamina
piperidina
N - hibridação sp 3
geometria pirâmide
trigonal tal como o NH 3
2- Introdução à Química Orgânica
Grupos Funcionais
ALDEÍDOS E CETON AS
R
O
O
C
C
R
R´
cetona
aldeído
R=R´ou R°R ´
grupos alq uilo ou arilo
O
H
H
C
C C
H
H
H
H
propan-2-ona
(dimetilcetona)
H
R= H ou alquilo ou arilo
O
sp3 - s
sp2-sp3
sp2 -sp2
p-p
C
H3C
H
etanal
(acetaldeído)
2- Introdução à Química Orgânica
Grupos Funcionais
ÁCID OS CARB OXÍLIC OS
O
C
R
O
(RC OOH )
H
R= H ou alquilo ou arilo
sp2
O
H
H
C
sp3 - s
C O
2
3
sp
-sp
H
2
2
sp
-sp
H
sp3
p-p
ácido etanóico
(ácido acético)
O
C
O
OH
C
H
OH
ácido fórmico
HO
ácido p-hidroxibenzóico
2- Introdução à Química Orgânica
Grupos Funcionais
ÉSTERES
O
R
C
O
R´
Fórmula
(RC OOR ´)
ar oma/sabor
C3H7-COO-C2H5
ananás
C3H7-COO-C5H11
alperce
CH3-COO-C8H15
laranja
C3H7COOCH3
maça
CH3-COO-C5H11
banana
2- Introdução à Química Orgânica
Grupos Funcionais
AMIDAS
O
C
R
N
R´
R´´
RC ONH R´
Amida secundária
RC ONR ´R´´
Amida terciária
O
O
H 3C
Amida primária
RC ONH2
O
C
C
N
H
N
H
H
acetamida
(etanamida)
acetanilida
CH3
H3C
C
N
CH3
CH3
N,N-dim etilacetamida
(N,N-dim etiletanamida)
2- Introdução à Química Orgânica
Grupos Funcionais
fenol
éter
HO
anel
de benzeno
O
N
HO
álcool
secundário
CH3
amina terciária
amina primária
alceno
Morfina
NH2
fenol
H
N
S
O
HO
N
O
CO2H
amida
secundária
ácido
carboxílico
amida
terciária cíclica
(lactama)
Amoxilina
2- Introdução à Química Orgânica
Propriedades Físicas e Estrutura Molecular
Forças intermoleculares - forças atractivas responsáveis pelas propriedades dos
gases e dos estados condensados da matéria (líquido e gasoso).
As temperaturas de ebulição e de fusão reflectem, normalmente, a
intensidade das forças existentes entre as moléculas.
Tipos de forças intermoleculares
• Forças dipolo-dipolo
• Ligação de hidrogénio
• Forças ião-dipolo
• Forças de dispersão
2- Introdução à Química Orgânica
Propriedades Físicas e Estrutura Molecular
Forças dipolo-dipolo - forças que ocorrem entre moléculas polares.
+
-
+
-
+
-
-
+
-
+
-
+
+
-
+
-
+
-
dependem: • momento dipolar
• tamanho das moléculas
2- Introdução à Química Orgânica
Propriedades Físicas e Estrutura Molecular
Ligação de hidrogénio - tipo especial de força dipolo-dipolo, particularmente
forte, entre o átomo de H numa ligação polar, tal como N-H, O-H ou F-H e um
átomo electronegativo de O, N ou F
H
H
O
H
H
H
F
O
H
H
H
O
H
H
N
H
H
O
H
O
H
H
H
H
H
H
N
H
H
N
H
H
N
H
N
H
H
H
depende: • força atractiva entre os pares isolados do átomo
electronegativo e núcleo do átomo de H.
F
2- Introdução à Química Orgânica
Propriedades Físicas e Estrutura Molecular
Forças ião-dipolo - forças que ocorrem entre um ião e uma molécula polar.
+
+
Na
+
Br-
dependem: • carga e tamanho do ião
• momento dipolar e tamanho da molécula
-
2- Introdução à Química Orgânica
Propriedades Físicas e Estrutura Molecular
Forças de dispersão - forças atractivas que surgem como resultado de dipolos
temporários induzidos nos átomos ou moléculas.
átomo neutro
+
+
+
-
dipolo
interacção ião-dipolo induzido
dipolo-induzido
-
anião
-
-
interacção dipolo-dipolo induzido
dipolo-induzido
dependem: • carga do ião ou intensidade do dipolo
• polarizabilidade do átomo ou molécula neutra, isto é, da facilidade
com que a nuvem electrónica de um átomo neutro ou molécula pode
ser distorcida.
2- Introdução à Química Orgânica
Propriedades Físicas e Estrutura Molecular
• A força de dispersão é proporcional à polarizabilidade e esta aumenta, em geral,
com a massa molar.
• Em alguns casos as forças de dispersão são comparáveis ou até maiores do que
as interacções dipolo-dipolo em moléculas polares.
Temp. fusão
Temp. fusão
CH4
-182,5°C
CH3F (m= 1,8D)
-141,8°C
CBr4
-90,0°C
CCl4 (m= 0)
-23,0°C
O
pentano
éter dimetílico
OH
butan-1-ol