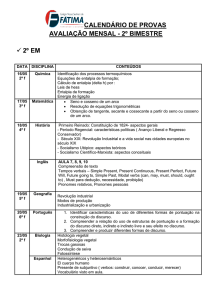
Atividade 4 - Investigando o comportamento exotérmico e endotérmico de
reações com mesmos reagentes
Já discutimos aspectos de reações endotérmicas e exotérmicas com diferentes
substâncias, de formas separadas. A energia envolvida na transformação é
analisada pela observação do estado inicial e do estado final do processo, e
relacionada com a variação de temperatura do conjunto. Vimos que, ao
favorecer o contato entre duas substâncias, ocorre uma variação da
temperatura do sistema, como um todo, a qual é utilizada para analisarmos a
perda ou o ganho de energia na transformação em estudo. Agora vamos
investigar a absorção e a liberação de energia em diferentes transformações
utilizando reagentes iguais para as duas situações diferentes.
Questões iniciais
1. Em sua opinião, o contato entre dois reagentes específicos, sempre
apresentará um comportamento energético constante?
2. Se conhecermos a reação entre compostos genéricos A e B como
exotérmica, poderemos afirmar que em qualquer situação, os reagentes A e B
provocarão a elevação da temperatura do sistema?
Vamos investigar no experimento a seguir.
Experimento: “Quebra-Cabeça Termoquímico”
Material
100 g de água líquidaa 0º C;
200 mL de ácido sulfúrico (H2SO4) 9 mol/L;
Béquer de 500 mL;
2 copos de isopor grandes;
100 g de geloa 0º C;
2 termômetros.
Tenha cuidado!
Esta atividade deve ser realizada com a supervisão de seu professor.
Cuidado ao manipular o ácido sulfúrico, pois ele é um produto
corrosivo. Em contato com a pele, lavar com água em abundância.
Caso haja, ingestão, não induzir o vômito. Fornecer bastante água e
providenciar socorro médico imediatamente. No caso de inalação,
observe as condições respiratórias. Ocorrendo parada respiratória,
aplicar respiração artificial e procurar um médico.
Procedimentos
I. Coloque o gelo dentro de um copo de isopor e a água líquida dentro de outro
copo;
.
II. Confira as temperaturas utilizando termômetros.
III. Coloque cuidadosamente 100 mL de ácido sulfúrico no copo contendo gelo
e 100 mL no copo contendo água líquida.
IV. Observe a variação de temperatura.
Questões para discussão:
1. Descreva o que você observou em cada um dos copos de isopor do
experimento antes e depois da adição do ácido sulfúrico.
2. Descreva qual é o sistema obtido após a adição de ácido sulfúrico à água
líquida e ao gelo.
3. Na adição de ácido à água líquida, você pode observar que ocorreu o
aumento de temperatura. Considerando os aspectos energéticos, que tipo de
transformação foi observada?
4. Na adição de ácido ao gelo você pode observar que ocorreu uma diminuição
de
temperatura.
Considerando
aspectos
energéticos,
que
tipo
de
transformação foi observada?
5. Represente a fusão do gelo por meio de uma equação química utilizando os
símbolos abaixo:
H2O (l)
H2O (s)
energia
+
6. Pensando na energia envolvida no processo de fusão do gelo, descrita na
questão anterior, explique o fenômeno que deve ter ocorrido no copo de isopor
contendo inicialmente apenas gelo.
7. Em um sistema químico, a energia total é chamada entalpia, representada
por H, e quando falamos de energia presente nos produtos e energia presente
nos reagentes chamamos respectivamente de Entalpia dos produtos e Entalpia
dos reagentes.
Para discutirmos a energia envolvida em uma reação, analisamos a variação
de entalpia, ΔH, que é a diferença entre a entalpia dos produtos e a entalpia
dos reagentes. (ΔH = HProdutos - HReagentes).
a) Represente a dissolução do ácido H2SO4 quando colocado em contato com
a água líquida, H2O(l).
b) Na dissolução do ácido em água, a entalpia dos produtos é maior, menor ou
igual à entalpia dos reagentes?
c) Discuta se o ΔH será positivo ou negativo.
d) Represente as energias dos sistemas inicial e final envolvidos na dissolução
do ácido sulfúrico na água líquida. Faça sua representação utilizando os eixos
para os valores de entalpia em função do caminho da reação.
H
Caminho da reação
e) Represente as energias dos sistemas inicial e final envolvidos na dissolução
do ácido sulfúrico na água sólida - gelo. Faça sua representação utilizando os
eixos para os valoresde entalpia em função do caminho da reação.
H
Caminho da reação
f) Utilizando um mesmo sistema de eixos coordenados represente as energias
dos sistemas inicial e final envolvidos nos dois processos. Faça sua
representação utilizando os eixos para os valores de entalpia em função do
caminho da reação.
H
Caminho da reação
8. Discuta agora o motivo das diferenças de temperaturas observadas em cada
situação sabendo que nos dois casos há dissolução do ácido em água, para
uma solução final de ácido sulfúrico.
Este material foi desenvolvido por Andresa Vicente Amante, em parceria com a equipe
do portal pontociência (http://pontociencia.org.br), como parte do projeto Portal do
Professor e Banco Internacional de Recursos Multimídia. O portal pontociência permite
copiar, distribuir, exibir e executar as obras, desde que mencionado o autor, sendo
proibido utilizar esta obra com finalidades comerciais. Para cada novo uso ou
distribuição, deve-se deixar claras as licenças de uso desta obra. Você pode adaptar
este material para finalidades educacionais sem fins comerciais.