Vestibular Comentado - UVA/2011.1
Conhecimentos Específicos
QUÍMICA
Comentários: Profs. Bibil e Tupinambá
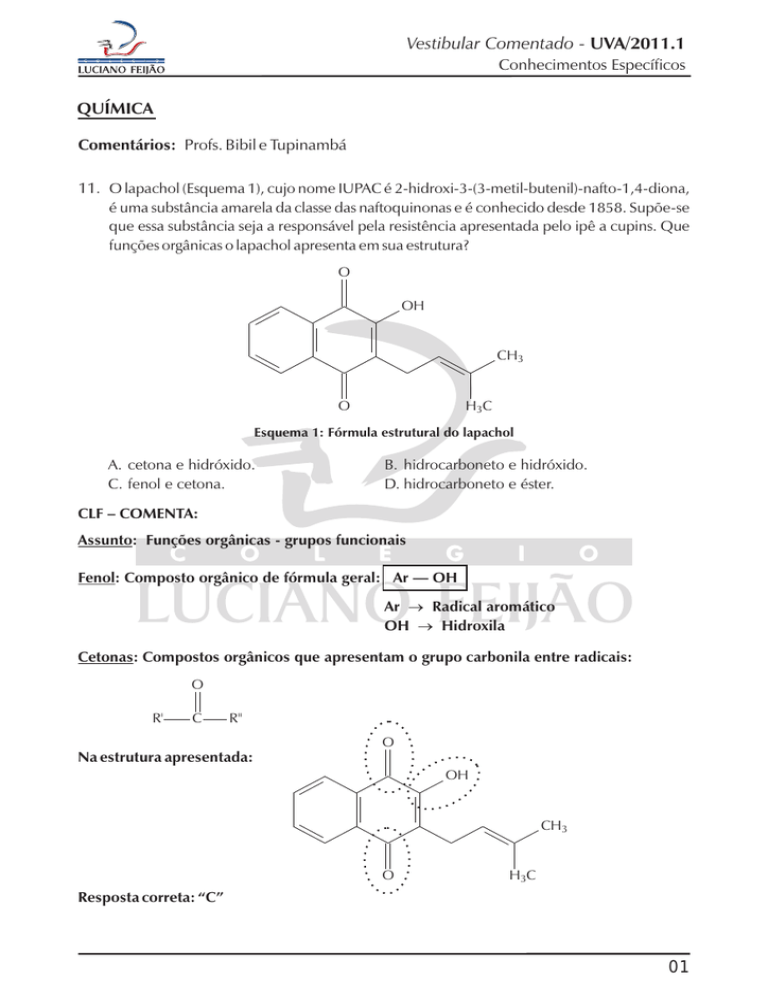
11. O lapachol (Esquema 1), cujo nome IUPAC é 2-hidroxi-3-(3-metil-butenil)-nafto-1,4-diona,
é uma substância amarela da classe das naftoquinonas e é conhecido desde 1858. Supõe-se
que essa substância seja a responsável pela resistência apresentada pelo ipê a cupins. Que
funções orgânicas o lapachol apresenta em sua estrutura?
O
OH
CH3
O
H3C
Esquema 1: Fórmula estrutural do lapachol
A. cetona e hidróxido.
C. fenol e cetona.
B. hidrocarboneto e hidróxido.
D. hidrocarboneto e éster.
CLF – COMENTA:
Assunto: Funções orgânicas - grupos funcionais
Fenol: Composto orgânico de fórmula geral: Ar — OH
Ar ®
Radical aromático
OH ®
Hidroxila
Cetonas: Compostos orgânicos que apresentam o grupo carbonila entre radicais:
O
R'
C
R''
O
Na estrutura apresentada:
OH
CH3
O
H3C
Resposta correta: “C”
01
Vestibular Comentado - UVA/2011.1
Conhecimentos Específicos
+
–
12. O fator determinante para a formação da ligação iônica entre os íons Na e Cl
no NaCl
é:
A. a transferência de um elétron do átomo de Na para o átomo de Cl
, a fim de que os
mesmos possam atingir a configuração do gás nobre mais próximo.
+
–
B. a energia liberada pela atração eletrostática dos íons Na e Cl
dando origem ao par
+
–
iônico Na Cl
.
C. o compartilhamento de um par de elétrons entre os átomos de Na e de Cl
.
D. o fato do Na ser um metal e o Cl
ser um não-metal.
CLF – COMENTA:
Assunto: Ligações químicas
Ligação iônica é um tipo de ligação baseada na energia liberada na atração eletrostática
entre dois íons carregados com cargas opostas. Na formação da ligação iônica, um metal
doa elétron devido a sua baixa eletronegatividade formando um íon positivo ou um cátion.
+
–
Na formação do sal de cozinha (NaCl
), as ligações entre os íons de sódio (Na ) e cloreto (Cl
)
são iônicas.
+
–
Os íons se atraem devido as forças eletrostáticas: Na + Cl
®
NaCl
Resposta correta: “B”
13. A quantidade de etanol presente na gasolina deve respeitar os limites estabelecidos pela
Agência Nacional do Petróleo - ANP (teor entre 22% e 26% em volume). A falta ou excesso
de álcool em relação aos limites estabelecidos pela ANP compromete a qualidade do
produto que chega aos consumidores brasileiros. Baseado nos dados apresentados na tabela
abaixo, referentes à quantidade de álcool presente em 4 diferentes amostras de gasolina
coletadas em postos de gasolina da cidade de Sobral, calcule o teor de álcool de acordo com
a equação: d = 1,000 – 0,00219 x T; onde d = densidade (em g/mL) e T o teor de álcool (%
em volume) e assinale a alternativa que apresenta a amostra de gasolina contendo o teor de
etanol de acordo com as normas estabelecidas pela ANP.
Gasolina 1
Gasolina 2
Gasolina 3
Gasolina 4
Volume de etanol (mL)
20,0
25,0
30,0
32,0
Massa de etanol (g)
19,0
23,4
28,8
30,0
A. Gasolina 1.
B. Gasolina 2.
C. Gasolina 3.
D. Gasolina 4.
02
Vestibular Comentado - UVA/2011.1
Conhecimentos Específicos
CLF – COMENTA:
Assunto: Concentrações das soluções
A questão aborda uma relação entre densidade e título.
Densidades
m
19
d=
=
= 0,950 g/mL
Gasolina 1 Þ
v
20
m
23,4
Gasolina 2 Þ
d=
=
= 0,936 g/mL
v
25
m
28,8
Gasolina 3 Þ
d=
=
= 0,960 g/mL
v
30
m
30
Gasolina 4 Þ
d=
=
= 0,938 g/mL
v
32
Títulos
d = 1,00 – 0,00219 x T
ou
T=
1–d
0,00219
1 – 0,950
T=
= 22,83%
Gasolina 1 Þ
0,00219
1 – 0,936
Gasolina 2 Þ
T=
= 29,22%
0,00219
1 – 0,960
Gasolina 3 Þ
T=
= 18,26%
0,00219
1 – 0,938
T=
= 28,54%
Gasolina 4 Þ
0,00219
Resposta correta: “A”
14. O ácido fosfórico é um dos produtos químicos mais produzidos no mundo. Sua aplicação
mais importante é a produção de fertilizantes, sendo também utilizado em detergentes e na
indústria alimentícia. O ácido fosfórico pode ser produzido pelo método do forno elétrico.
Neste método, queima-se o fósforo elementar ao ar, obtendo-se decóxido de pentafósforo,
que reage com água, formando o produto desejado. Assinale a alternativa que contempla
corretamente o tipo de reação que ocorre no método de obtenção do H3PO4.
A. Reação de neutralização.
B. Reação de análise.
C. Reação de precipitação.
D. Reação redox.
03
Vestibular Comentado - UVA/2011.1
Conhecimentos Específicos
CLF – COMENTA:
Assunto: Reações Inorgânicas - Oxidorredução
Na produção do ácido fosfórico pelo método do forno elétrico, como mencionado na
questão, ocorre em uma de suas etapas de obtenção, uma reação de síntese com presença
de uma substância simples, o que justifica a variação dos estados de oxidação das
substâncias envolvidas, nesse processo. Ocorrendo uma reação de redox.
Resposta correta: “D”
15. A queima excessiva dos combustíveis fósseis tem causado efeitos nocivos ao meio ambiente.
Na queima desses combustíveis são liberados alguns gases que, combinados com O2,
formam novos gases. Entre eles estão o SO2 e o CO2que causam, respectivamente.
A. efeito estufa e chuva ácida.
B. chuva ácida e efeito estufa.
C. alteração da camada de ozônio e chuva ácida.
D. alteração da camada de ozônio e efeito estufa.
CLF – COMENTA:
Assunto: Óxidos
Chuva ácida é a designação dada à chuva ou qualquer forma de precipitação atmosférica,
cuja acidez seja substancialmente maior que a resultante da dissociação do dióxido de
carbono (CO2) ou de compostos do enxofre (SO2 ou SO3),
CO2 + H2O ®
H2CO3
SO2 + H2O
®
H2SO3
SO3 + H2O
®
H2SO4
O efeito estufa é um processo que ocorre quando uma parte da radiação solar refletida pela
superfície terrestre é absorvida por determinados gases presentes na atmosfera, como o
dióxido de carbono (CO2), em elevadas concentrações.
Resposta correta: “B”
16. Os estados formais de oxidação do elemento oxigênio, representados pelos algarismos I, II,
III e IV, presentes nas substâncias envolvidas na reação de formação de gás oxigênio
(Esquema 2) são respectivamente:
–
OCl
+ H2O2
I
II
–
Cl
+ H2O + O2
III
IV
Esquema 2: Reação de formação de gás oxigênio
A. – 1; – 1; – 2 e – 2
C. – 2; – 1; – 2 e 0
B. – 1; – 1; – 2 e 0.
D. – 2; – 2; – 2 e 0.
04
Vestibular Comentado - UVA/2011.1
Conhecimentos Específicos
CLF – COMENTA:
Assunto: Número de oxidação (Nox)
Nox é a carga real ou aparente que um átomo possui após perder ou ganhar elétrons.
–
OCl
+ H2O2
– 2 +1
x
+1
+1
–
®
Cl
+ H2O + O2
–1
–
+1 – 2
0
+1 x
(O Cl
)
H2O2
x+1=–1
x=–1–1
+ 2 + 2x = 0
2x = – 2
x=–2
x=–1
Nox do O = – 2
Nox do O = – 1
+1 x
H2O
+2 + x = 0
O2
Nox do O = zero
x=–2
Nox do O = – 2
Resposta correta: “C”
17. Thomas Graham, estudando a velocidade de movimentação dos gases, realizou diversas
experiências onde dois gases se encontravam e reagiam, no interior de um tubo
transparente. A distância entre o ponto de encontro dos gases e as extremidades revelava a
relação entre as velocidades. Deste estudo nasceu a lei de Graham para as velocidades de
difusão dos gases. Abaixo vemos um exemplo da experiência realizada por Graham com os
gases NH3 e HCl
que seriam emanados de dois algodões embebidos em soluções
concentradas das substâncias indicadas.
lado A
NH3 (conc.)
lado B
NCl
(conc.)
Sobre o experimento podemos afirmar que:
A. A reação observada é a da síntese total do NH4Cl
.
B. O cloreto de amônio obtido é um sal que, diferencialmente do NaCl
por exemplo, só
existe na ausência de água.
C. O encontro deve ocorrer mais próximo da solução de soluto mais volátil.
D. Graham concluiu que a velocidade de difusão de um gás seria inversamente
proporcional à sua massa molecular.
05
Vestibular Comentado - UVA/2011.1
Conhecimentos Específicos
CLF – COMENTA:
Assunto: Difusão e efusão dos gases
Lei de Graham é a velocidade de difusão de um gás, que é INVERSAMENTE proporcional a
raiz quadrada de sua densidade. Foi de fundamental importância para a evolução das
teorias posteriores sobre a matéria.
Resposta correta: “D”
18. Em uma prática da disciplina de Química Orgânica II, os alunos da UVA preparam o ácido
acetilsalicílico (AAS) através de uma reação do Esquema 3. O AAS é o componente ativo da
aspirina. A reação é feita em excesso de anidrido acético, para garantir que todo o ácido
salicílico seja consumido, durante a reação. Uma equipe partiu de 13,8 g do ácido salicílico.
Após a etapa de purificação, essa equipe obteve 10,8 g de AAS. Assinale a alternativa que
apresenta o rendimento experimental desta reação.
CH3
OH
O
O
OH
+
H3C
H+
O
O
O
O
+ H3C
O
H3C
OH
OH
O
ácido salicílico
ácido acético
anidrido acético
AAS
Esquema 3: Reação de acetilação do ácido salicílico
A. 50%
B. 55%
C. 60%
D. 70%
CLF – COMENTA:
Assunto: Cálculos estequiométricos - Rendimento e grau de pureza
C7H6O3 + C4H6O3 ®
C9H8O4 + C2H4O2
138 g
13,8 g
0,1 ¸
180 g
x
x = 0,1 . 180 = 18 g
18 g de C9H8O4
100%
10,8 g de C9H8O4
10,8 . 100
x=
=
18
x
60%
Resposta correta: “C”
06
Vestibular Comentado - UVA/2011.1
Conhecimentos Específicos
19. Nos carros movidos a etanol (álcool etílico), a combustão completa de 1 mol de etanol
produz:
A. 2 mols de CO2 e 6 mols de H2.
B. 2 mols de CO2 e 3 mols de água.
C. 2 mols de monóxido de carbono e 3 mols de água.
D. 3 mols de etanal e 1 mol de metano.
CLF – COMENTA:
Assunto: Reações de combustão de substâncias orgânicas
Reações de combustão são reações de queima onde temos um combustível (substância a ser
queimada) e um comburente (oxigênio do ar).
A combustão do etanol pode ser completa ou incompleta.
Combustão completa do etanol:
ETANOL: C2H5OH(l
combustível
) Þ
O2(g) Þ
comburente
REAÇÃO: C2H5OH(l
) + 3O2(g)
®
2CO2(g) + 3H2O(l
)
Resposta correta: “B”
20. Dentre os símbolos dos elementos químicos a seguir, participam da constituição de
fórmulas de ácidos e bases, segundo Arrhenius, respectivamente:
A. N e Ca.
B. Na e S.
C. P e C.
D. B e F.
CLF – COMENTA:
Assunto: Funções Inorgânicas - Ácidos e Bases
ÁCIDOS (segundo Arrhenius): substâncias moleculares que no meio aquoso sofrem
+
ionização liberando cátions H ou formando o hidrônio: H3O
H
+
+
Ex.: HNO3 + H2O
+
–
®
H3O + NO3 .
BASES (segundo Arrhenius): substâncias sólidas e iônicas que se dissociam no meio aquoso
–
liberando o ânion OH (hidróxido).
2+
Ex.: Ca(OH)2 (aq) ®
Ca (aq) + 2OH
–
(aq)
Resposta correta: “A”
07












