Interações intermoleculares
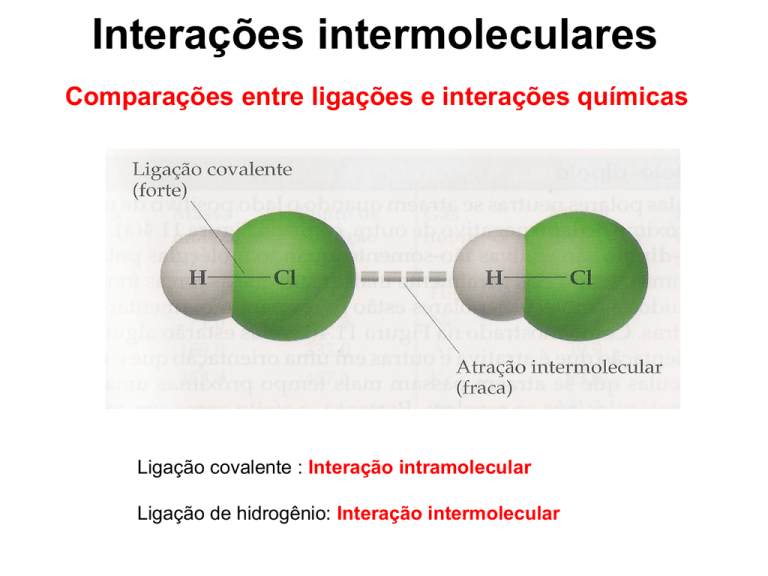
Comparações entre ligações e interações químicas
Ligação covalente : Interação intramolecular
Ligação de hidrogênio: Interação intermolecular
Interações intermoleculares
Forças íon-dipolo
Existem entre um íon e a carga parcial em certo lado de
uma molécula polar, as quais são dipolos, tendo um lado
positivo e outro negativo. O HCl é uma molécula polar,
porque as eletronegatividades do H e do Cl são diferentes. A
magnitude da atração aumenta com o aumento da carga
do íon ou a magnitude do dipolo.
Interações intermoleculares
Forças dipolo-dipolo
Existem quando moléculas polares neutras se atraem quando o lado
positivo de uma molécula está próximo do lado negativo de outra. Elas
são, geralmente, mais fracas do que as forças íon-dipolo. Em líquidos, as
moléculas encontram-se em posições de atração ou repulsão umas às outras.
Para moléculas de massas e tamanhos aproximadamente iguais, a força das
atrações intermoleculares aumenta com o aumento da polaridade.
Interações intermoleculares
Forças dipolo-dipolo
Interações intermoleculares
Forças de dispersão de London
Fritz London identificou que o movimento de elétrons em um
átomo ou molécula pode criar um momento de dipolo
instantâneo. Se pudéssemos congelar o movimento dos e- em
um átomo em determinado instante, teríamos um momento de
dipolo induzido. As forças de dispersão tendem a aumentar
em intensidade com o aumento da massa molecular.
Interações intermoleculares
Forças de dispersão de London
A facilidade com que a distribuição de cargas em uma
molécula pode ser distorcida por um campo elétrico externo é
chamada
POLARIZABILIDADE.
Quanto
maior
a
polarizabilidade, maior será a distorção da nuvem eletrônica
de um átomo ou íon, e maior será o dipolo momentâneo. Os
pontos de ebulição dos halogêneos e dos gases nobres
aumentam com o aumento da massa molecular.
Interações intermoleculares
Forças de dispersão de London - Influência
da forma molecular
Forças de van der Waals
As interações interatômicas mais fracas, isto é, com menor energia de
ligação, são as chamadas forças de van der Waals. Elas ocorrem
átomos neutros, átomos de gases nobres (He,Ne,Ar,Kr,Xe,Rn), entre
moléculas não-polare e, de forma geral, nos líquidos e sólidos. Entretanto,
ela somente tem importância quando não existem outros tipos de
ligações químicas presentes.
As ligações de van der Waals dipolo são ligações de dipolos flutuantes.
Uma ligação de van der Waals aparece porque, num instante qualquer,
há um pouco mais de elétrons de um lado do núcleo do que do outro lado;
os centros das cargas positivas e negativas não coincidem e, nesse
momento, surge um dipolo fraco.
Interações intermoleculares
Ligações de hidrogênio
É um tipo especial de atração intermolecular entre o H em uma ligação
polar e um par de e- não compartilhado em um íon ou átomo pequeno e
eletronegativo que esteja próximo. As ligações de H podem ser
consideradas atrações dipolo-dipolo. Como o H apresenta apenas 1 e-, ele
pode interagir fortemente com o átomo mais eletronegativo. Assim, as L.H.
são mais fortes do que as forças dipolo-dipolo e as dispersões de
London.
Interações intermoleculares
Ligações de hidrogênio
Interações intermoleculares
Ligações de hidrogênio - Comparações
Para uma L.H. genérica entre X-H e o par de e- não compartilhado de um
átomo Y, a força da L.H. deverá aumentar à proporção que o dipolo da
ligação X-H aumentar.
Portanto, para um mesmo Y, deveríamos esperar que a força da L.H.
aumente na série:
+δ -δ
N – H ... :Y
<
+δ
-δ
O - H ... :Y
<
+δ -δ
F - H ... :Y
Isso de fato é observado.
Mas qual a propriedade de Y que determina a força da L.H. ?
Interações intermoleculares
Ligações de hidrogênio - Comparações
Para ocorrer uma L.H forte entre H e Y, o par de e- livres de Y não pode
estar muito difuso no espaço. Para isso, as L.H. realizadas com N, O ou F
são especialmente fortes. Entre esses elementos, a L.H. é mais forte
quando o par de e- não é atraído também fortemente por seu próprio
núcleo. Assim, comparativamente, a eletronegatividade do N é menor do que
a do O. Assim, o N é melhor doador de e- para a ligação X-H. A L.H.
aumenta na ordem:
X - H...F
<X-H O<X-H
...
...N
Quando X e Y são os mesmos, a energia da L.H. aumenta na ordem:
N - H...N
<O-H O<F-H
...
...F
Quando o átomo de Y carrega uma carga negativa, o par de e- é capaz de
formar L.H. especialmente fortes. A L.H. no íon F _ H...F- está entre as mais
fortes conhecidas.
Estrutura do DNA












