Aula 00
Química p/ INMETRO - Técnico (Cargo 10)
Professor: Wagner Bertolini
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
AULA 00: Apresentação do curso
SUMÁRIO
PÁGINA
1.
Saudação e Apresentação do professor
01
2.
Breve apresentação do curso
02
3.
Cronograma das Aulas
03
4.
Ácidos
04
5.
Questões Propostas
27
1.
Saudação e apresentação do professor
Olá meus novos amigos(as),
É com grande satisfação que apresento a vocês este curso de QUÍMICA,
projetado especialmente para atender às necessidades daqueles que se preparam
para o concurso de Técnico(a) do INMETRO, CARGO 10, que será realizado pela
IDECAN.
Permitam-me fazer uma breve apresentação de minha trajetória acadêmica e
profissional:
-graduado pela Faculdade de Ciências Farmacêuticas pela USP-RP, em 1990;
- Mestre em síntese de complexos bioinorgânicos de Rutênio, com liberação de
óxido nítrico, pela Faculdade de Ciências Farmacêuticas USP-RP;
- Doutor em farmacotécnica, estudando o efeito de promotores de absorção
cutânea visando a terapia fotodinâmica para o câncer de pele, Faculdade de Ciências
Farmacêuticas pela USP-RP;
00000000000
- Especialista em espectrometria de massas, pela Faculdade de Química, USPRP;
- professor de Química em ensino Médio e pré-vestibulares (Anglo, Objetivo,
COC) desde 1992.
- professor de Química (Orgânica, Geral, Analítica, Físico-Química e Inorgânica)
em cursos de graduação;
- Professor de Química Farmacêutica, em curso de graduação em Farmácia;
- Professor de Pós-Graduação em Biotecnologia (controle de produtos e
processos biotecnológicos);
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 1 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
- Analista Químico em indústria farmacêutica, AKZO do Brasil, em São PauloSP.
2.
- Breve apresentação do curso
Seguem abaixo comentários acerca do conteúdo e da metodologia do nosso
curso:
A proposta do curso é facilitar o seu trabalho e reunir toda a teoria e inúmeros
exercícios, no que tange aos assuntos do Edital, em um só material.
Nosso curso será completo (teoria detalhada e mais de 300 questões) e
com dezenas de questões resolvidas.
Ao mesmo tempo, não exigirá conhecimentos prévios. Portanto, se você
está iniciando seus estudos em QUÍMICA fique tranquilo, pois, nosso curso atenderá
aos seus anseios perfeitamente
Se você já estudou os temas, e apenas quer revisá-los, o curso também será
bastante útil, pela quantidade de exercícios que teremos e pelo rigor no tratamento
da matéria, o que lhe permitirá uma excelente revisão do conteúdo.
Em relação aos exercícios, serão no mínimo 300 questões gabaritadas e/ou
resolvidas, com um mínimo de 40 questões por aula.
A Aula Demonstrativa visa apresentar a didática e a metodologia do
professor. Em suma: este curso trará toda matéria completa durante o seu transcorrer.
As aulas do curso terão entre 40 (quarenta) e 100 (cem) páginas,
aproximadamente. O número de questões em cada aula será variável, pois alguns
assuntos são rotineiramente exigidos nos concursos e outros aparecem com menor
frequência.
00000000000
Serão disponibilizadas várias vídeo-aulas que serão disponibilizadas conforme
a programação.
Você encontrará vários comentários sobre o que é importante ou o que
não cai nas provas. Não se assuste. É só para direcionar seu tempo sobre os
tópicos que realmente são importantes e não perder tempo com “fagulhas”.
Serão disponibilizadas muitas questões de diversas banca dos concursos mais
recentes, para que você se familiarize com o estilo das perguntas. Isto é muito
importante, pois, permite a você uma maior segurança e tranquilidade no momento
da prova.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 2 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Buscarei fazer uma lista de questões só com questões da banca.
PRESTE SEMPRE MUITA ATENÇÃO QUANDO APARECER A CORUJINHA.
AO LADO APARECE UMA DELAS. Estas corujinhas serão empregadas para chamar
a sua atenção para vários aspectos dentro do
nosso curso.
OLHO NELAS!!!!!
Esperamos contribuir muito para que você consiga alcançar seu objetivo (e por
sinal o objetivo de milhares de brasileiros) que á a aprovação em um concurso público.
Principalmente em se tratando de uma empresa da reputação da Petrobrás, uma
empresa de projeção mundial. Portanto, mãos à obra e muita atenção, dedicação e
sucesso!!!!
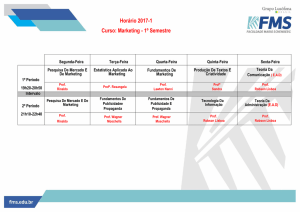
3. PROGRAMAÇÃO DO CURSO
AULA
CONTEÚDO
Vídeos
DATA
Vídeo
- Apresentação do curso
- ácidos
Aula 00
apresentação e
17 novembro
2.1 (só parte 2)
2.1 video parte
Aula 01
Funções inorgânicas:
ácidos (parte 2); bases sais
óxidos
Aula 02
1
2.2.; 2.3; 2.4
00000000000
4.1 e 4.2
Classificação periódica
Aula 03
Ligações químicas
DEZEMBRO
12 dezembro
5
19 dezembro
6
27 dezembro
Reações químicas;
estequiometria;
Cinética e equilíbrio
Aula 05
químico
Eletroquímica
Aula 06
Soluções e propriedades
coligativas
Prof. Wagner Luiz
05
3 (2 videos)
Aula 04
Aula 07
25 novembro
05 janeiro
12 janeiro
www.estrategiaconcursos.com.br Página 3 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Concentração de íons
Aula 08
19janeiro
hidrogênio; estudos de
gases.
Aula 09
1.1; 1.2
26 janeiro
Funções orgânicas.
Observação importante:
Este curso é protegido por direitos autorais (copyright), nos
termos da Lei 9.610/98, que altera, atualiza e consolida a legislação
sobre direitos autorais e dá outras providências.
Grupos de rateio e pirataria são clandestinos, violam a lei e
prejudicam os professores que elaboram os cursos. Valorize o
trabalho
de
nossa
equipe adquirindo os cursos honestamente
através do site Estratégia Concursos ;-)
Conte comigo para sanar suas dúvidas. Sempre busco atende-lo de uma forma
bem tempestiva.
Sempre que você tiver alguma dúvida, ao recorrer ao fórum
indique a aula, página e número da questão, se for o caso.
3. Ácidos
00000000000
Hoje estudaremos as funções inorgânicas. Recomendo que guarde as
características de cada função e treine, treine muito.
Observe e memorize as dicas dadas sobre as características de cada função.
Caso você queira tirar alguma dúvida no fórum peço que indique a aula, a página
e o exercício, bem como sua dúvida sobre este. Ou sobre a teoria ou outras dúvidas.
Isto agiliza a minha resposta para você, sem demorar muito, sem correr o risco de
responder a questão errada, etc.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 4 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Propriedades funcionais são propriedades comuns a determinados grupos de
matérias, identificados pela função que desempenham, e são tais grupos
denominados de funções químicas.
As funções químicas são um conjunto de substâncias com propriedades químicas
semelhantes, que podem ser divididas em orgânicas e inorgânicas.
Funções orgânicas: são aquelas constituídas pelo elemento carbono, estudada
pela química orgânica. A química orgânica estuda os compostos que contêm carbono
e a propriedade típica do carbono é a formação de cadeias. É chamada de orgânica
porque inicialmente os cientistas pensavam que eles só podiam ser encontrados nos
seres vivos ou fósseis. Hoje um grande número de compostos de carbono pode ser
produzido em laboratório para utilização na indústria. Certos medicamentos, plásticos
e pesticidas, por exemplo, são substâncias orgânicas sintéticas.
Existem algumas substâncias que possuem átomo de carbono, mas que fogem a
este critério de classificação, por possuírem propriedades de compostos inorgânicos,
dentre as quais se destacam: CO (monóxido de carbono), CO2 (dióxido de carbono),
KCN (cianeto de potássio), CaCO3 (carbonato de cálcio), Na2CO3 (carbonato de
sódio), H2CO3 (ácido carbônico), entre outros.
Funções inorgânicas: são aquelas constituídas por todos os demais elementos
químicos que constituem os ácidos, bases, sais e óxidos, estudados pela Química
Inorgânica. Atualmente o conceito de substâncias inorgânicas e orgânicas pode
seguir a seguinte definição:
00000000000
Com isso, por questões didáticas puramente, estudaremos estes dois ramos
importantes de estudo da Química, a Química Inorgânica e a Química Orgânica, que
também são subdivididas em outros grupos. As principais funções químicas
inorgânicas – ácidos, bases, sais e óxidos – são encontradas em nosso cotidiano e
também em nosso organismo. Por exemplo: o ácido clorídrico é um dos constituintes
do suco gástrico, encontrado no estômago; a soda cáustica é constituinte de produto
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 5 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
de uso doméstico para desentupir pias e utilizada para fabricar o sabão; o sal de
cozinha é constituído pelo cloreto de sódio e a cal viva, utilizado na construção civil e
também na culinária, é constituída pelo óxido de cálcio.
Para definir estas substâncias existem vários critérios de classificação. Nós
utilizaremos os critérios da condutividade elétrica, segundo Arrhenius, e o teste com
indicadores ácido-base para caracterizar semelhança nas propriedades químicas
dessas substâncias.
ÁCIDOS
Ácidos no cotidiano: ácido acético (vinagre) e ácido cítrico (frutas cítricas).
Introdução
Desde os tempos dos alquimistas, observou-se que certas substâncias
apresentavam comportamentos peculiares quando dissolvidos na água. Entre tais
propriedades destacavam-se:
- o sabor azedo facilmente identificado em frutas cítricas, como limão, laranja,
00000000000
etc (a palavra ácido é proveniente do latim acidus - azedo, picante);
- formar soluções aquosas condutoras de eletricidade;
- provocar efervescência, quando em contato com o calcário;
- produzir mudança de cor nos indicadores ácido-base.
Essas substâncias foram denominadas ácidos.
Os ácidos estão presentes em nosso dia-a-dia, como por exemplo: a laranja, o
limão e as demais frutas cítricas contém ácido cítrico; a bateria de um automóvel
contém ácido sulfúrico; o vinagre contém ácido acético; o ácido clorídrico é
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 6 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
constituinte do suco gástrico no estômago; o ácido nítrico é utilizado para produzir
explosivos como o TNT (dinamite).
De um modo geral os ácidos são tóxicos e corrosivos, portanto, deve-se evitar o
contato com a pele, ingeri-los ou inalá-los.
O estudo da função ácido é a parte mais complexa das funções inorgânicas. Por
isto é de extrema importância que você domine os principais tópicos como:
formulação e nomenclatura. As demais funções são bem mais simples, se
comparadas a ácidos.
Definição Segundo Arrhenius
Ácido é todo composto molecular que, em solução aquosa, se ioniza, produzindo
exclusivamente como cátion o H3O+ (hidroxônio).
HCl + H2O
HCN + H2O
H3O+ + Cl–
H3O+ + CN–
Simplificadamente, o cátion hidroxônio (H 3O+) pode ser representado por H+ e a
presença da água está representada pelo (aq) ao lado direito da fórmula do composto
(ou mesmo nem aparecer, subentendendo-se a presença de meio aquoso, por
definição):
HCl(aq)
HCN
H+ + Cl–
H+ + CN–
Resumindo:
00000000000
Classificação dos Ácidos
- Quanto à natureza do ácido
Orgânicos - são compostos que contém em sua estrutura o grupamento carboxila,
composto por um átomo de carbono ligado a um átomo de oxigênio por ligação dupla
( C= O) e a um grupo hidroxila (-OH), por ligação simples:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 7 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
carboxila
O grupo carboxila também pode ser representado apenas por: -COOH
O hidrogênio ligado ao átomo de oxigênio do grupo carboxila é considerado o
hidrogênio ionizável do ácido. Desta forma na sua ionização, teremos:
R-COOH
H+ + R-COO-
Entre os milhares de ácidos orgânicos conhecidos, alguns são de enorme
importância para o homem, como por exemplo:
- HCOOH é o ácido fórmico (fórmico, pois foi descoberto nas formigas, mas
sintético atualmente)
- CH3COOH = ácido acético (presente no vinagre, acetum – azedo)
Inorgânicos ou minerais - são de origem mineral e dividem-se em hidrácidos e
oxiácidos.
Ex.: HCl, HF, HCN, H2SO4, H3PO4, etc
- Quanto à presença de oxigênio na molécula
a) Hidrácidos – não possuem oxigênio em suas moléculas
Exemplos: HCl, HCN, HF, HI, HBr, H2S, etc.
b) Oxiácidos – possuem oxigênio em suas moléculas
Exemplos: HNO3 , HClO3 , H2SO4, H3PO4, etc.
00000000000
- Quanto ao número de hidrogênios ionizáveis
Monoácidos (ou monopróticos) – apresentam um hidrogênio ionizável.
Exemplos: HCl, HBr, HNO3 , H3PO2 (exceção).
Diácidos (ou dipróticos) – apresentam dois hidrogênios ionizáveis.
Exemplos: H2S, H2SO4 , H3PO3 (exceção).
Triácidos – apresentam três hidrogênios ionizáveis.
Exemplos: H3PO4 , H3BO3.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 8 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Tetrácidos – apresentam quatro hidrogênios ionizáveis.
Exemplos: H4SiO4 , H4P2O7.
- Quanto ao número de elementos químicos
Binário: dois elementos químicos diferentes.
Exemplos: HCl, H2S, HBr.
Ternário – três elementos químicos diferentes.
Exemplos: HCN, HNO3 , H2SO4
Quaternário – quatro elementos químicos diferentes.
Exemplos: HCNO, HSCN
- Quanto à volatilidade (baixo ponto de ebulição, facilidade em formar
vapores)
Observação: Por que se deixarmos um recipiente aberto contendo éter em pouco
tempo, observa-se que o éter desaparecerá?
O éter é um líquido que possui baixo ponto de ebulição e evapora com facilidade à
temperatura ambiente. Dizemos neste caso que o éter é uma substância volátil.
Outro exemplo comum ocorre com o vinagre, o qual possui um odor bastante
pronunciado devido à volatilidade do ácido acético, seu principal constituinte.
Ácidos voláteis - ácidos com baixo ponto de ebulição (PE).
Ex.: todos os hidrácidos (HCl, HF, HI, HBr, HCN, H 2S), HNO3, HCOOH e
00000000000
CH3COOH.
Ácidos fixos - ácidos com elevado ponto de ebulição (PE).
Ex.: H2SO4 (PE = 340ºC), H3PO4 (PE = 213ºC) e H3BO3 (PE = 185ºC).
- Quanto ao grau de ionização (força de um ácido)
OBS.: tal cálculo não exige que você conheça a fórmula do ácido e nem a sua
estrutura química.
Ácidos fortes: possuem
Prof. Wagner Luiz
> 50%
www.estrategiaconcursos.com.br Página 9 de 32
00000000000 - DEMO
Ácidos moderados: 5%
Ácidos fracos:
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
50%
< 5%
Como se calcula o valor de
(alfa)?
quantidade de moléculas que ionizaram
X
quantidade de moléculas dissolvidas
Regra Prática para Determinação da Força de um Ácido (conhecendo-se a fórmula
molecular do ácido e, se necessário, sua estrutura molecular):
- Hidrácidos:
Ácidos fortes: HI > HBr > HCl.
Ácido moderado: HF.
Ácidos fracos: demais.
- Oxiácidos
Sendo HxEzOy a fórmula de um ácido de um elemento E qualquer, temos
M=y-x
em que:
y = número de átomos de oxigênio
x = número de átomos de hidrogênios
se:
m=3
ácido muito forte
Exemplos: HClO4 , HMnO4...
m=2
ácido forte
Exemplos: HNO3 , H2SO4...
00000000000
m=1
ácido moderado
Exemplos: H3PO4 , H2SO3 , H3PO3 (2 H+), H3PO2 (1 H+)
m=0
ácido fraco
Exemplos: HClO, H3BO3
Observação:
1º) O ácido carbônico (H2CO3) é uma exceção pois é um ácido fraco ( =0,18%),
embora o valor de m = 1
2º) Todos os ácidos carboxílicos são fracos.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 10 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Fórmula Estrutural
I. Hidrácidos ( HxE)
Cada hidrogênio está ligado ao elemento por um traço (–) que representa a ligação
covalente simples.
Exemplos
Oxiácidos (HxEzOy)
Para escrever a fórmula estrutural dos oxiácidos, devemos proceder da seguinte
maneira:
1) escrever o símbolo do elemento central;
2) distribuir ao redor deste elemento todos os oxigênios da fórmula mencionada.
3) distribuir ao redor dos oxigênios os átomos de hidrogênio que sejam ionizáveis.
Se tiver H não ionizável (o que ocorre com ácidos do elemento fósforo), os hidrogênios
não ionizáveis devem ser colocados ao lado do elemento central.
4) Ligar os hidrogênios ionizáveis aos átomos de oxigênio vizinhos, formando
grupinhos H-O) e ligar o elemento central a tantos grupos – OH quantos forem os
hidrogênios ionizáveis. Caso haja H sem ligar, fazer uma ligação simples deste(s) H
00000000000
com o átomo central.
5) (passo circunstancial, pois, depende de ter ou não oxigênio sem ligar): ligar o
elemento central ao(s) oxigênio(s) restante(s) através de ligação dativa (geralmente)
ou de uma dupla ligação (ocorre tal dupla com os elementos carbono e nitrogênio).
SABER fazer a fórmula estrutural é um conhecimento de grande valia.
Através dela você poderá entender melhor quais são os hidrogênios que se
ionizam (somente os ligados DIRETAMENTE ao átomo de oxigênio) e também,
perceber a estrutura de um ânion com ionização parcial ou total.
Portanto, veja que são passos bem simples e de fácil compreensão.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 11 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Capriche e faça alguns ácidos que você conheça as fórmulas, para treinar.
Exemplos
Cuidado com os ácidos oxigenados do elemento fósforo (P). Vejam os H não
ionizáveis:
00000000000
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 12 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Observação
Duas exceções importantes, por apresentarem hidrogênios não-ionizáveis, são:
(observe nas estruturas acima que os hidrogênios que não ionizam se ligam
diretamente ao átomo central e não há ionização devido à pequena diferença de
eletronegatividade entre os elementos H e P).
00000000000
Formulação e Nomenclatura
Formulação
O ácido é formado pelo cátion H+ e um ânion qualquer (Ax-). Portanto, podemos
representar sua fórmula da seguinte maneira:
H+Ax-
HxA
Nomenclatura
Hidrácidos (HxE)
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 13 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
O nome de um ácido é feito basicamente da seguinte forma:
1o) escreve-se a palavra ácido;
2o) nome do elemento, com origem em latim;
3o) terminação ídrico
Exemplos
HCl
ácido clorídrico
HBr
ácido bromídrico
HCN
ácido cianídrico
H2S
HI
ácido sulfídrico
ácido iodídrico
Oxiácidos (HxEzOy)
Neste caso, como o mesmo elemento pode formar vários oxiácidos,
estabelecemos um oxiácido padrão a partir do qual daremos nomes aos demais.•
Oxiácido padrão
ácido nome de E ico
00000000000
Regra geral para elementos que formam 2 ou mais oxiácidos:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 14 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Como vemos na tabela acima, todo oxiácido padrão tem terminação ico. Se
tivermos um ácido com:
a) um oxigênio a mais que o padrão, acrescentamos o prefixo per;
b) um oxigênio a menos que o padrão, a terminação muda para oso;
c) dois oxigênios a menos que o padrão, a terminação continua oso e
acrescentamos o prefixo hipo.
Resumindo temos:
Aplicando esta regra, ficamos com:
00000000000
Caem pouco em provas os casos abaixo
OBS.: Quando varia o grau de hidratação (ocorre retirada de uma molécula de água
de uma ou duas moléculas de dado ácido). Não são ácidos muito comuns de
aparecerem em provas de concursos, mas, existem. Portanto:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 15 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Resumindo temos:
Exemplos
00000000000
Ionização dos Ácidos
A ionização de um ácido, como já vimos anteriormente na própria definição de
ácido de Arrhenius, é a reação do ácido com a molécula de água, produzindo o cátion
H3O+.
Se um ácido possui dois ou mais hidrogênios ionizáveis (poliácido), a ionização
ocorre em etapas.
Exemplos
a)
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 16 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
b)
c)
d)
e)
Nomenclatura dos Ânions
Podemos considerar que os ânions são provenientes dos ácidos.
Assim, temos as seguintes terminações (sufixos) a serem empregados:
00000000000
HF = ácido fluorídrico
F- = fluoreto
HCl = ácido clorídrico
Cl- = ânion cloreto
HBr = ácido bromídrico
HI = ácido iodídrico
Prof. Wagner Luiz
Br- = ânion brometo
I- = ânion iodeto
www.estrategiaconcursos.com.br Página 17 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
CN- = ânion cianeto
HCN = ácido cianídrico
HNO3 = ácido nítrico
NO3- = ânion nitrato
HNO2 = ácido nitroso
NO2- = ânion nitrito
HClO3 = ácido clórico
ClO3- = ânion clorato
ClO4- = ânion perclorato
HClO4 = ácido perclórico
ClO2- = ânion clorito
HClO2 = ácido cloroso
HClO = ácido hipocloroso
CH3COOH = ácido acético
ClO- = ânion hipoclorito
CH3COO- = ânion acetato
OBS: Caem pouco em provas os casos abaixo
HIDROGENO ÂNIONS
São ânions que possuem um ou mais hidrogênios ionizáveis em sua fórmula. Sua
nomenclatura segue a seguinte regra:
Mono, di ou tri (nº de H ionizáveis) + hidrogeno + nome do ânion normal
Ou ainda:
Nome do ânion normal + mono, di ou tri (nº de H ionizáveis) + ácido
Observações:
1º) A colocação do prefixo mono é opcional;
2º) Os hidrogeno ânions provenientes de diácidos, o nome pode ser formado
acrescentando-se o prefixo BI.
Exemplo 1:
H2S
H+ + HS-
HS-
H+ + S200000000000
Desta forma, teremos:
H2S
HS-
S2-
Ácido
(Mono)Hidrogeno sulfeto ou
Sulfeto
sulfídrico
Sulfeto (mono)ácido ou
Bissulfeto
Exemplo 2:
H2SO4
H+ + HSO4-
HSO4-
H+ + SO42-
Desta forma, teremos:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 18 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
SO42-
H2SO4
HSO4-
Ácido
(Mono)Hidrogeno sulfato ou
sulfúrico
Sulfato
Sulfato (mono)ácido ou
Bissulfato
Exemplo 3:
H3PO4
H+ + H2PO4-
H2PO4-
H+ + HPO42-
HPO42-
H+ + PO43-
Desta forma, teremos:
H3PO4
H2PO4-
HPO42- (*)
PO43-
Ácido
Di-hidrogeno
(Mono)Hidrogeno
Fosfato
Fosfórico
fosfato ou
fosfato ou
Fosfato diácido
Fosfato (mono)ácido
(*) Observe que para o hidrogeno fosfato não foi utilizado o prefixo BI, pois o ânion
é proveniente de um triácido.
Exemplo 4:
H2CO3
H+ + HCO3-
HCO3-
H+ + CO32-
Desta forma, teremos:
H2CO3
HCO3-
CO32-
Ácido
(Mono)Hidrogeno carbonato
Carbonato
carbônico
ou
Carbonato (mono)ácido ou
00000000000
Bicarbonato
Apesar de esses ânions apresentarem hidrogênios, estes não são ionizáveis
APLICAÇÕES DOS PRINCIPAIS ÁCIDOS DO COTIDIANO
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 19 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Ácido clorídrico (HCl)
O ácido impuro (técnico) é vendido no comércio com o nome de ácido muriático;
Recipiente contendo ácido muriático
É encontrado no suco gástrico, produzido pelas células parietais, responsável pela
acidez estomacal;
Esquema representativo do estômago contendo suco gástrico (HCl)
- É um reagente muito usado na indústria e no laboratório;
- É usado na limpeza de pisos após a caiação das paredes (cal hidratada Ca(OH) 2),
para remover os respingos de cal;
HCl(aq) + Ca(OH)2(s)
CaCl2(aq) + 2 H2O
00000000000
- É usado na limpeza de superfícies metálicas antes da soldagem dos respectivos
metais.
Ácido fluorídrico (HF)
Tem a particularidade de corroer o vidro, devendo ser guardado em frascos de
plástico, por esta razão é usado para fazer gravações sobre o vidro.
Ácido cianídrico (HCN)
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 20 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
O HCN é o gás de ação venenosa mais rápida que se conhece: uma concentração
de 0,3 mg por litro de ar é imediatamente mortal;
É o gás usado nos estados americanos do norte que adotam a pena de morte por
câmara de gás;
A primeira vítima do HCN foi seu descobridor, Carl Wihelm Scheele, que morreu
ao deixar cair um vidro contendo solução de HCN.
Câmara de gás utilizado em execuções.
Ácido sulfídrico (H2S)
O H2S é um gás incolor, mais pesado do que o ar e inflamável com um forte odor
desagradável de ovos podres. Esse gás é algumas vezes referido como "gás de cano
de esgoto". Em pequenas concentrações ele pode irritar os olhos e atuar como
depressivo; em elevadas concentrações ele pode provocar irritação do sistema
respiratório superior e, durante longas exposições, edema pulmonar. Sendo mais
denso que o ar, o H2S pode acumular-se em depressões e cavernas.
00000000000
Aquecendo as mãos no gêiser (deserto chileno nos Andes) que elimina H 2S com
odor de ovo podre.
Ácido sulfúrico (H2SO4)
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 21 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
É o ácido mais utilizado e importante nas indústrias e nos laboratórios, conhecido
como “burro de carga”. O poder econômico de um país pode ser avaliado pela
quantidade de ácido sulfúrico que ele fabrica e consome;
O maior consumo de ácido sulfúrico é na fabricação de fertilizantes, como os
superfosfatos e o sulfato de amônio;
É o ácido dos acumuladores de chumbo (baterias) usados nos automóveis;
É consumido em enormes quantidades em inúmeros processos industriais, como
processos da indústria petroquímica, fabricação de papel, corantes, etc;
O ácido sulfúrico concentrado é um dos desidratantes mais enérgicos. Assim, ele
carboniza os hidratos de carbono como os açúcares, amido e celulose; a
carbonização é devido à desidratação desses materiais;
Adição de ácido. sulfúrico ao açúcar com desidratação e formação de carvão com
expansão de massa.
O ácido sulfúrico "destrói" o papel, o tecido de algodão, a madeira, o açúcar e
outros materiais devido à sua enérgica ação desidratante;
00000000000
O ácido sulfúrico concentrado tem ação corrosiva sobre os tecidos dos organismos
vivos também devido à sua ação desidratante. Produz sérias queimaduras na pele.
Por isso, é necessário extremo cuidado ao manusear esse ácido;
As chuvas ácidas em ambiente poluídos com dióxido de enxofre contêm H 2SO4 e
causam grande impacto ambiental.
S + O2(g)
Prof. Wagner Luiz
SO2(g) + 1/2 O2(g)
SO3(g) + H2O(l)
H2SO4(aq)
www.estrategiaconcursos.com.br Página 22 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Efeitos da chuva ácida: estátua antes e depois da exposição à chuva ácida, floresta
negra na Alemanha em 1970 e 1983 depois da exposição à chuva ácida.
Ácido nítrico (HNO3)
Depois do sulfúrico, é o ácido mais fabricado e mais consumido na indústria. Seu
maior consumo é na fabricação de explosivos, como nitroglicerina (dinamite),
trinitrotolueno (TNT), tri nitrocelulose (algodão pólvora) e ácido pícrico e picrato de
amônio;
00000000000
É usado na fabricação do salitre (NaNO3, KNO3) e da pólvora negra (salitre +
carvão + enxofre);
Pólvora negra: (Salitre - KNO3 + Carvão - C + Enxofre - S)
As chuvas ácidas em ambientes poluídos com óxidos do nitrogênio contém HNO 3
e causam sério impacto ambiental. Em ambientes não poluídos, mas na presença de
raios e relâmpagos, a chuva também contém HNO 3, mas em proporção mínima;
N2(g) + O2(g)
Prof. Wagner Luiz
2 NO(g) + O2(g)
2 NO2(g) + H2O(l)
HNO2 + HNO3
www.estrategiaconcursos.com.br Página 23 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
O ácido nítrico concentrado é um líquido muito volátil; seus vapores são muito
tóxicos. É um ácido muito corrosivo e, assim como o ácido sulfúrico, é necessário
muito cuidado ao manuseá-lo.
Explosão realizada através do uso do TNT obtido a partir do HNO 3
Ácido fosfórico (H3PO4)
Os seus sais (fosfatos) têm grande aplicação como fertilizantes na agricultura;
É usado como aditivo (acidulante) em refrigerantes como a Coca-Cola.
00000000000
Refrigerante contendo H3PO4 como acidulante
Ácido carbônico (H2CO3)
É o ácido das águas minerais gaseificadas e dos refrigerantes. Forma-se na reação
do gás carbônico com a água: CO2 + H2O à H2CO3
Responsável pelo processo de formação da chuva ácida em ambientes não
poluídos na ausência de descargas elétricas.
CO2(g) + H2O(l) Û H2CO3(aq) Û H+(aq) + HCO31-(aq)
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 24 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Bebidas contendo ácido carbônico (H2CO3)
Ácido acético (H3C-COOH)
É o ácido constituinte do vinagre, utilizado com condimento na culinária;
O vinagre é uma solução aquosa contendo de 3 a 7% de ácido acético.
Vinagre contendo 3% a 7% de ácido acético
OBS: é ácido orgânico.
Achou complicado? Então vou dar uma força:
Professor: tem algum esquema pra ajudar a fazer mais fácil?
Para você fazer a maior parte dos ácidos (fórmula ou nome) basta que você
memorize o esquema abaixo e treine algumas vezes como usar o esquema.
Vou passar o esquema e dar algumas explicações:
3B3
2C3
3P4
2S4
00000000000
1N3
1Cl3
Percebeu que os números da esquerda do símbolo estão decrescentes em
todos os casos (3,2,1) ?
Percebeu que os números da direita do símbolo estão repetidos em cima (3)
e quase todos estão repetidos embaixo (4)?
O que significam estes números? Os da esquerda representam os
hidrogênios e os da direita os oxigênios presentes na molécula.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 25 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Informações a serem seguidas:
1) todos desta tabela e com estes valores os nomes terminam em ico
2) se diminuir 1 átomo de oxigênio então os nomes terminam em oso
3) se diminuírem 2 átomos de oxigênio então os nomes terminam em oso,
mas deve-se colocar o prefixo hipo antes do nome.
4) se aumentar 1 átomo de oxigênio então os nomes terminam em ico, mas
deve-se colocar o prefixo per antes do nome.
Memorizem assim: o que difere um ácido oxigenado do outro, tendo o mesmo
elemento central é a quantidade de átomos de oxigênio. Pense, então, que seria
uma “escadinha” de oxigênio. E descer uma escada é gostOSO, mas, subir é
um PERICO.
Exemplos:
Procure na tabelinha que passei onde está o cloro. Veja o numero que está à
direita dele, Você deve ter achado o número 3. Portanto, o cloro com 3 átomos
de oxigênio ao lado terá terminação ICO.
HClO
ácido hipoCLORoso
HClO2
ácido CLORoso
HClO3
ácido CLÓRICO
HClO4
valores da tabelinha dada
ácido PERCLÓRICO
Exemplo 2: qual a fórmula do ácido fosfórico?
00000000000
Você observa que o nome está terminando em ico. Então, consulte na tabela
os valores que estão à direita e à esquerda da letra P (símbolo do fósforo) e
monte a fórmula H3PO4.
E se fosse ácido fosforoso? Bastaria diminuir um átomo de oxigênio da
fórmula do ácido fosfórico. Ficaria:
H3PO3.
Treine um pouco o suo, porque é muito útil. OBS.: não pode mudar a ordem dos
símbolos. E o iodo e o bromo você pode fazer usando os valores do cloro
Até a próxima aula !!!!!!!!!!
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 26 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
QUESTÕES RESOLVIDAS
01. O ácido clórico é um ácido forte, utilizado como catalisador em reações de
polimerização e como agente oxidante. Soluções aquosas desse ácido pode causar
grande irritação na pele e nas mucosas. Represente a fórmula estrutural do ácido
clórico.
GAB
02. Escreva :
a) as fórmulas moleculares do ácido hipoiodoso e do ácido perbrômico.
b) os nomes dos compostos de fórmulas H2SO3 e H3PO4.
Gab:
a) HIO e HBrO4
b) ácido sulfuroso e ácido fosfórico
03. A queima do enxofre presente na gasolina e no óleo diesel gera dois anidridos
que, combinados com a água da chuva, formam seus ácidos correspondentes.
Escreva a fórmula desses ácidos e indique o ácido mais forte. Justifique sua
indicação.
RESOLUÇÃO:
H2SO3 e H2SO4
O ácido mais forte é o H2SO4, pois a diferença entre o número de átomos de
oxigênio e o número de átomos de Hidrogênio ácido é igual a 2, enquanto no
00000000000
H2SO3 essa diferença é igual a 1.
04. Sabe-se que a chuva ácida é formada pela dissolução, na água da chuva, de
óxidos ácidos presentes na atmosfera. Entre os pares de óxidos relacionados, qual é
constituído apenas por óxidos que provocam a chuva ácida?
a) Na2O e NO2
b) CO2 e MgO
c) CO2 e SO3
d) CO e NO2
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 27 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
e) CO e NO
Alternativa ‘C’.
O CO2 reage com a água formando solução ácida e é responsável pela acidez
natural da chuva em ambientes não poluídos. O SO 3 reage com a água formando
ácido sulfúrico e é um dos principais responsáveis por diminuir o pH da chuva
a níveis perigosos para o ambiente.
05. Ao se dissolverem 5 mol de um ácido HX, em quantidade suficiente de água,
constatou-se que 4 mol do soluto se ionizaram. Pedem-se:
a) o grau de ionização de HX;
b) o número de íons existentes na solução obtida.
RESOLUÇÃO:
a) 80%
o valor de alfa se calcula através da seguinte relação:
= (numero de mol ionizados/ número de mol dissolvidos) *100
Logo, teremos
=(4/5)*100 = 80%
b) Se o ácido é do tipo HX ele se ioniza da seguinte maneira:
HX
H+
X-
+
Se 4 mol ionizam serão formados 4 mol de cada íon.
Logo, teremos
HX
H+
+
4 mol
X4mol
00000000000
Total de íons= 8 mol
Então, 8x6x1023 íons = 48x1023 íons = 4,8x1024 íons
06. Os ácidos podem ser classificados quanto ao número de hidrogênios ionizáveis.
O ácido hipofosforoso, H3PO2, utilizado na fabricação de medicamentos, apresenta
fórmula estrutural:
H
O
P
O
H
H
a) Quantos hidrogênios são ionizáveis no ácido hipofosforoso? Justifique sua
resposta.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 28 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
b) Escreva a equação de neutralização desse ácido com o hidróxido de sódio.
RESOLUÇÃO:
a) apenas um (01) hidrogênio ionizável.
b) H3PO2 + NaOH NaH2PO2 + H2O
07. O cloro é um gás irritante e sufocante. Misturado à água, reage produzindo os
ácidos clorídrico e hipocloroso – que age como desinfetante, destruindo ou inativando
os microrganismos.
a) Identifique os reagentes e os produtos desta reação e forneça suas fórmulas
químicas.
b) A água de lavadeira é uma solução aquosa de hipoclorito e o ácido muriático
é uma solução concentrada de ácido clorídrico. Ambos podem ser utilizados
separadamente na limpeza de alguns tipos de piso. Explique a inconveniência, para
a pessoa que faz a limpeza, de utilizar uma mistura destes dois produtos.
RESOLUÇÃO:
a) Cl2(g) + H2O
HCl(aq) + HClO(aq)
b) H+(aq) + ClO–(aq) + 2 Cl–(aq)
Cl2(g) + H2O como na reação há produção
de gás cloro, o inconveniente é que a água de lavadeira é irritante aos olhos,
devido à presença do cloro.
08. (TRANSPETRO - TÉCNICO DE OPERAÇÕES JUNIOR - CESGRANRIO/2012).
O ácido carbônico, de fórmula H2CO3, presente nos refrigerantes, é um ácido
muito fraco e, por essa razão,
(A) a sua constante de ionização é muito baixa.
00000000000
(B) se dissocia nos íons H2 e CO3.
(C) reage apenas com bases fracas.
(D) possui ligações iônicas entre os seus átomos.
(E) possui pH maior do que 7 quando em solução aquosa
RESOLUÇÃO:
Os ácidos fracos reagem com qualquer base. Isto não depende de sua força. Mas,
a constante de ionização é reflexo de sua força. Portanto, sendo um ácido fraco ele
terá baixa constante de ionização.
Resposta: “A”.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 29 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
09. (PETROBRÁS - TÉCNICO(A) QUÍMICO(A) DE PETRÓLEO JÚNIOR CESGRANRIO/2012). A fórmula molecular do anidrido acético, derivado do ácido
etanoico, é dada por
(A) C4H6O3
(B) C4H6O4
(C) C6H4O3
(D) C6H4O4
(E) C6H6O3
RESOLUÇÃO:
O anidrido acético é obtido pela condensação de 2 moléculas do ácido acético.
Para que isto ocorra, deve ocorrer a eliminação de água. Teríamos:
2 C2H4O2 - H2O
C4H6O3
Resposta: “A”.
10. (PETROBRÁS - TÉCNICO DE OPERAÇÃO JÚNIOR- CESGRANRIO/2012). De
acordo com o conceito de Ácido-Base de Arrhenius, a propriedade que
caracteriza uma substância ácida é aquela na qual os compostos que, ao serem
dissolvidos em água,
(A) sofrem dissociação iônica, liberando íons OH−.
(B) sofrem dissociação iônica, liberando íons H+ e OH−, simultaneamente.
(C) sofrem dissociação iônica, liberando CO2 para a atmosfera.
(D) sofrem dissociação iônica, liberando H+.
00000000000
(E) não sofrem dissociação iônica.
RESOLUÇÃO:
De acordo com a teoria de Arrhenius uma substância ácida é aquela que ao ser
dissolvida em água libera como único cátion, por ionização (a banca comete um erro
conceitual, pois, ácidos ionizam e bases e sais dissociam), o grupo H3O+ (simplificado
por H+).
A meu ver a Resposta: mais adequada seria a alternativa E, pois, ácidos não
dissociam. Mas a banca trouxe a D.
Resposta: “D”.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 30 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
11. (DMAE-RS- QUÍMICO- CONSULPLAN/2011). Quantos átomos de hidrogênio
possui a estrutura química do composto “ácido cloroso”?
A) 4
B) 3
C) 2
D) 1
E) 0
RESOLUÇÃO:
A fórmula do ácido cloroso é HClO2. Portanto, apresenta um átomo de hidrogênio.
Resposta: “C”
12. (UNIPAMPA - TÉCNICO DE LABORATÓRIO– CESPE/2013). O ácido acético
pode ser armazenado juntamente com outros ácidos, tal como o ácido nítrico,
não sendo requeridos cuidados especiais para armazenamentos de ácidos.
RESOLUÇÃO:
Os ácidos geralmente são agentes corrosivos, podem ser voláteis e tóxicos. Devem
ser guardados em espaços adequados.
Resposta: “ERRADO”.
13. (MINISTÉRIO DA AGRICULTURA – AUXILIAR DE LABORATÓRIO –
CONSULPLAN/2014). Qual dos seguintes compostos é um ácido?
A) SO2.
B) H2SO4
C) Na2SO4.
00000000000
D) Na2S2O3.
RESOLUÇÃO:
Ácidos, segundo Arrhênius, liberam íons H3O+ quando em solução aquosa.
Portanto, é necessário que a espécie química tenha ao menos átomo de hidrogênio.
Por exclusão, chegamos ao H2SO4. Só uma dica: ácidos começam com H. Portanto,
B.
Resposta: “B”.
14. (UFJF-MG - TÉCNICO DE LABORATÓRIO – 2013 – IFSULDEMINAS) O ácido
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 31 de 32
00000000000 - DEMO
QUÍMICA INMETRO TÉCNICO CARGO 10
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
clorídrico puro (HC ) é um composto que conduz pouca eletricidade, assim
como a água pura (H2O). No entanto, ao dissolvermos esse ácido na água, é
formada uma solução que conduz muito bem a eletricidade, o qual se deve à:
a) dissociação da água em H+ e OH-.
b) ionização do HC , formando H3O+ e C -.
c) transferência de elétrons da água para o HC .
d) transferência de elétrons do HC para a água.
e) reação de neutralização do H+ da água com o C - do HC .
RESOLUÇÃO:
O ácido puro e a água pura são compostos moleculares e, portanto, péssimos
condutores de corrente elétrica. Porém, ao misturá-los, o ácido sofre a reação de
ionização originando íons. A solução iônica formada é boa condutora de corrente
elétrica. HCl + H2O
H+ + Cl-
Resposta: “B”
Hoje tivemos uma aula mais light, praticamente para apresentar o curso e
a didática do professor. Coloquei todo assunto de ácidos. A vídeo-aula da
segunda parte de ácidos será postada na aula 01. Na aula 01 fecharemos todo
estudo das funções, onde teremos mais aspectos relativos aos ácidos, em
reações com hidróxidos e óxidos.
Seja muito bem-vindo ao nosso curso.
Aguardo você para as próximas aulas.
Sempre a seu dispor.
Prof. Wagner Bertolini
00000000000
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 32 de 32
00000000000 - DEMO