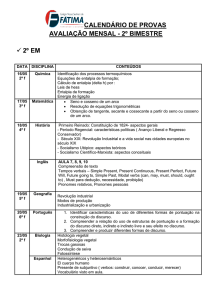
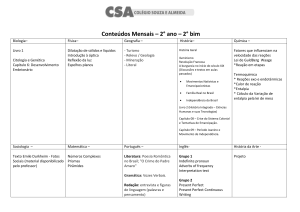
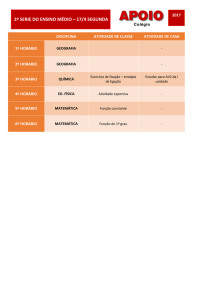
Capitulo 1 - Exercícios de termodinâmica – 1ª Lei
1.15 - A capacidade calorifica do ar é bastante menor que a da água e por isso pequenas
quantidades de calor consegues mudar a temperatura do ar. Esta é uma das razões que explica
que as regiões desérticas são muito quentes durante o dia e geladas durante a noite. A
capacidade calorifica a pressão e temperatura ambiente é de 21 JK-1mol-1. Qual a quantidade de
energia necessária para elevar a temperatura de uma sala de 5,4mx6,55mx4m em 10ºC.
Assumindo que não existem perdas de calor quanto tempo dhemorará subir esses 10º C caso o
calor fosse fornecido a 1,5KW. Assume que 1 W = 1Js-1
1.19 – Quando 229 J de energia são fornecidos como calor a uma pressão constante para 3 moles
de CO2 a temperatura da amostra aumenta 2,06K. Calcular a capacidade calorifica deste gas a
pressão e a volume constante.
1.21 – Suponha que energia interna molar de uma substância ao longo de uma dada gama de
temperatura é dada pela seguinte expressão:
Um (T) = a + bT + cT2
Encontre uma expressão para calcular a capacidade calorifica a uma temperatura T
1.29 –A água é aquecida até ao seu ponto de ebulição sob uma pressão de 1 atm. Quando uma
corrente elétrica de 0,5A a 12V é feita passar através de uma resistência elétrica durante 300 e
promove a evaporação de 0,798 g de água. Calcular a energia interna molar e a variação de
entalpia no ponto de ebulição (T= 373,15K).
‘
1.37 - O etano é queimado nos poços de combustível devido à sua baixa reatividade. Será que
o etano é um bom combustível.
2C2H6 (g) + 702(g) 4 CO2 (g) + H20 (l) ∆fH0 (etano)= - 3120 kJ
(a) Qual a entalpia de combustão do etano?
(b) Qual é a entalpia especifica do etano?
(c) O etano é mais ou menos eficiente que o metano?