FT - Unicamp
CET0300-OF004 - Curso de Especialização
em Meio Ambiente e Desenvolvimento
Sustentável
Microbiologia
Prof ª Dra. Cassiana Maria Reganhan Coneglin
1ª Experiência: Microbiologia da Água
Grupo 5:
Ariane Meschiatti dos Santos Escobar
Juliana Longatto
Ludmila Augusta Bueno Peruchi
Paula Helena Garcia Mellado
Roberta da Cruz Souza
1.
Introdução
As bactérias coliformes habitam normalmente o intestino do ser humano e dos animais, portanto são
indicadores da contaminação de uma amostra de água. Como a maior parte das doenças são transmitidas por
via fecal, os organismos patogênicos, ao serem eliminados pelas fezes, atingem o ambiente aquático, podendo
contaminar as pessoas que se abastecem de forma inadequada dessa água. Portanto, as bactérias coliformes
podem ser usadas como indicadoras dessa contaminação. Uma grande vantagem do uso dessas bactérias como
indicadoras de contaminação fecal é sua presença em grandes quantidades nos esgotos domésticos, já que
cada pessoa elimina bilhões dessas bactérias diariamente (BRASIL, 2006).
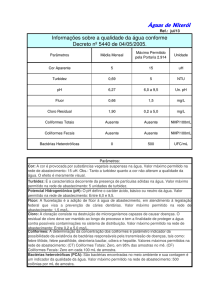
A Portaria 518 de 23/03/2004 do Ministério da Saúde que estabelece os procedimentos e
responsabilidades relativos ao controle e vigilância da qualidade da água para consumo humano e seu padrão
de potabilidade. A Portaria atribui deveres e obrigações para diferentes níveis, mas as secretarias municipais
de saúde que tem o papel de exercer a vigilância da qualidade da água.
Segundo a CETESB, os microrganismos do grupo dos coliformes totais são de bacilos gramnegativos, oxidase negativos, capazes de crescer na presença de sais biliares ou no caldo lauril sulfato e de
fermentar a lactose a 35-37ºC, com produção de acido, gás e aldeído, em 24 horas. Além de serem
encontradas nas fezes, podem ocorrer no meio ambiente, em águas com altos teores de material orgânico, solo
ou vegetação em decomposição. As bactérias do grupo dos coliformes fecais são capazes de fermentar a
lactose a 44–45 ºC em 24 horas, sendo representados principalmente pela Escherichia coli e, também por
algumas bactérias dos gêneros Klebsiella, Enterobacter, Citrobacter. Dentre esses organismos somente a
E.coli é de origem fecal.
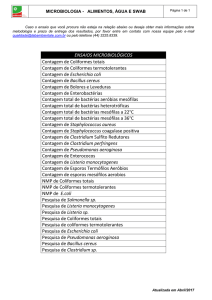
Para a avaliação técnica das condições sanitárias de uma água, utiliza-se vários métodos como
parâmetro para verificar se uma amostra de água está dentro das legislações e própria para consumo humano
A detecção de coliformes totais e fecais nas amostras de água podem ser feitas pelo método da
presença – ausência desses microrganismos após a inoculação das amostras e um caldo lactosado, que é o
teste presuntivo. Se houver mudança de cor púrpura para amarelo, com ou sem produção de gás, incubado a
35ºC em 24 horas, indica presença dessas bactérias, submete-se então as amostras aos testes confirmativos,
para a determinação de coliformes totais e fecais, sendo o caldo verde brilhante para o grupo de coliformes
totais e o meio E.C para o grupo de coliformes fecais (CETESB, 2002).
A determinação de coliformes totais e fecais pela técnica de tubos múltiplos é expressa pelo numero
mais provável (NMP) de coliformes que, por sua vez, representa a quantidade mais provável de coliformes
existentes em 100 mL de água da amostra. O exame de coliformes é empregado paro controle de sistemas de
abastecimentos de água e assim determina a eficiência do tratamento (RICHTER & NETO, 1991).
O método dos tubos múltiplos é realizado em duas etapas: na primeira, a amostra é inoculada em
caldo lauril sulfato de sódio, o qual inibe a microbiota acompanhante, ao mesmo tempo é um meio de
enriquecimento para bactérias do grupo dos coliformes. Bactérias deste grupo causam turvação no meio com
formação de gás, detectado em tubos de Duhran, após 48 horas de incubação a 35 ºC. A segunda etapa é
realizada através da inoculação de alçadas dos caldos lauril positivos em caldos seletivos para coliformes
totais e fecais, sendo o caldo lactosado com verde brilhante para coliformes totais e o EC para Escherichia
coli . Após a incubação para coliformes totais e E.coli, ocorre turvação do caldo com formação de gás,
quando positivos (BETTEGA et al, 2006).
A técnica de membrana filtrante é um método rápido e preciso para isolamento e identificação de
colônias de bactérias do grupo coliformes totais. Esta técnica é recomendada pelo Standart of Methods for the
Examination of Water and Wasterwater, referência internacional em análises em águas. Esse método é feito
com auxílio de bomba a vácuo, o qual filtra-se 100 mL de amostra através de uma membrana filtrante de 47
mm de diâmetro e 0,45 μm de porosidade estéril, utilizando equipamento de filtração, e após a filtração, a
membrana é colocada sobre a superfície da placa contendo o meio M-ENDO Agar LES. A colônia típica de
coliformes é rosa a vermelho escuro e brilho verde metálico superficial.
A detecção de coliformes totais e E.coli em amostras de água pelo teste do substrato cromogênico é
simples e rápido que não requer preparação de meios de cultura.O Colilert é uma formulação em frasconetes
estéreis , contendo sais, fontes de carbono e nitrogênio bem como nutrientes específicos para detecção
simultânea
de coliformes totais e E.coli. A formulação contém o o-nitrofenil-β-D-galactopiranosídeo
(ONPG), para diferenciação dos microrganismos que apresentam as enzimas de fermentação lactose f-Dgalactosidase) e a 4-metilumbeliferil-β-D-glucoronídeo (MUG) para diferenciação de E.coli, que apresenta a
enzima β-glucoronidase. A presença de coliformes totais é determinada pelo desenvolvimento da cor amarela
e a presença de E.coli pela fluorescência sob a luz UV (Silva et al, 2001).
A contagem de bactérias heterotróficas é amplamente utilizada como indicador da qualidade da água
potável, sendo que os microrganismos são detectados por propagação em meios não-seletivos. A contagem de
bactérias heterotróficas, genericamente definidas como microrganismos que requerem carbono orgânico como
fonte de nutrientes, fornece informações sobre a qualidade bacteriológica da água de uma forma ampla. O
teste inclui a detecção de bactérias ou esporos de bactérias, sejam de origem fecal, componentes da flora
natural da água ou resultantes da formação de biofilmes no sistema de distribuição, servindo, portanto, de
indicador auxiliar da qualidade da água (DOMINGUES et al, 2007).
Segundo DOMINGUES et al, as duas metodologias mais utilizadas para contagem de bactérias em
placa são: o método de esgotamento em placa e o método “Pour Plate”. Pela metodologia de “Pour Plate”
verte-se o meio fundido e estabilizado em banho Maria sobre a amostra, o que permite o crescimento
bacteriano no interior do ágar. Para o método do esgotamento, a amostra é depositada na superfície do ágar já
solidificado e, a seguir, uniformemente espalhada com uma alça de Drigalski.
2.
Objetivos
Esta prática teve como objetivo geral a Colimetria e Plaqueamento / Quantificação de bactérias
heterotróficas da água.
3.
Materiais e Métodos
3.1 Vidrarias e materiais
- Placa de Petri
- Pipetas
- Frasco de água de diluição
- Frasco para coleta
- Frasco para incubação
- Alça de inoculação
- Tubos de ensaio
- Proveta
- Cartela com multicavidades
3.2 Equipamentos
- Balança Analítica
- Contador de colônias
- Banho Maria
- Estufa de incubação
- Bico de Bunsen
- Sistema de filtração
- Estufa de esterilização
- Seladora de cartelas
3.3 Reagentes
- Água de diluição
- Ágar PCA (Plate Count Agar) ou NA (Agar Nutriente)
- Caldo P-A
- Caldo lactosado com verde brilhante
- Meio E.C
- Flaconete - Colilert
3.4 Contagem de Bactérias Heterotróficas em placas, pela técnica “Pour Plate”.
Para contagem de número total de bactérias heterotróficas, procedeu-se da seguinte maneira:
- Foi diluída a amostra em água de diluição (salina 0,085%) – 1:10 e 1:100. Não se esquecendo de
utilizar uma pipeta para cada diluição, foram essas realizadas da seguinte maneira: adicionou-se ao frasco que
continha 90 ml de água de diluição, 10 ml da amostra de água analisada, foi obtida assim uma diluição 1:10
ou 10-1.
- Agitou-se o frasco da diluição 1:10, foram retirados 10ml e foram transferidos ao segundo frasco de
diluição que continha 90ml de água de diluição, obteve-se assim uma diluição de 1:100 ou 10-2.
- Marcaram-se as placas e os frascos para diluição de maneira ordenada (10 -1 e 10-2).
- Foram homogeneizados os frascos com as diluições desejadas (10 -1 e 10-2), e obedecendo-se os
cuidados de assepsia, foram transferidos 1,0ml de cada diluição em placas de Petri separadas.
- Verteu-se aproximadamente 10 ml de meio PCA (Plate Count Agar) na placa de Petri, e
movimentou-se delicadamente em forma de oito com a placa fechada sobre a bancada. O meio foi
previamente fundido e mantido a temperatura de 45°C em banho maria.
- Esperou-se o meio solidificar invertendo as placas para evitar a água de condensação na superfície
do Ágar e foram transferidas as placas de Petri para a incubação em estufa bacteriológica a 35°C. Realizou-se
a leitura de contagem bacteriana após 24-48H com o auxílio de um contador de colônias.
3.5 Coliformes Totais e Fecais – Detecção em amostras de água através do teste de PresençaAusência (P/A).
- Antes da inicialização do trabalho realizou-se a assepsia da bancada, usando álcool 70%.
- Dispôs-se sobre a bancada de trabalho o material necessário para a execução do exame.
- Foram identificados os frascos contendo 50 ml de P/A, com os números das amostras.
- Acendeu-se o bico de Bunsen, para manter o ambiente asséptico.
- Homogeneizou-se a amostra, no mínimo 25 vezes, suavemente.
- Dosou-se 100 ml da mesma em proveta estéril e procedeu-se a inoculação, verteu-se
cuidadosamente esse volume da amostra no frasco contendo o caldo P/A, foi tomado o cuidado para que não
ocorresse entrada de ar no tubo de Durham contido no interior do frasco.
- Após a inoculação das amostras, efetuou-se a incubação a 35±0,5°C, durante 24h.
- Após esse período de incubação, efetuou-se a primeira leitura, considerando como resultado
positivo à acidificação do meio (evidenciado pela mudança de sua coloração de púrpura para amarelo), com
ou sem produção de gás. Para os resultados considerados negativos, retornaram-se os frascos à incubadora por
mais 24 horas, efetuando-se após esse período, a leitura final, conforme especificado anteriormente.
- Submeteram-se as culturas com resultados presuntivos aos testes confirmativos, para a
determinação de coliformes totais e para a diferenciação de coliformes fecais.
- Com o auxílio de uma alça de inoculação, devidamente flambada e resfriada, retirou-se um inoculo
da cultura positiva em caldo P/A. Realizou-se uma leve agitação do frasco, para a dispersão das bactérias
conforme recomendado.
- Imediatamente após a abertura contendo as culturas positivas em caldo P/A, flambou-se a boca do
mesmo antes de colher o inóculo, a operação foi repetida antes do fechamento.
- Transferiu-se esse inóculo para um tubo contendo caldo lactosado com verde brilhante e bile a 2% e
incubou-se a 35±0,5°C, durante 24-48 horas o para um tubo contendo o meio E.C e incubou-se a 44,5±0,2°C,
em Banho Maria com agitação, durante 24horas.
- Após os períodos determinados de incubação, foram efetuadas as leituras, considerando-se
resultados positivos para coliformes totais a produção de gás a partir da fermentação da lactose no meio caldo
lactosado com verde brilhante e bile a 2%, coliformes fecais presentes diante da produção de gás no meio
E.C.
3.6 Coliformes Totais e Fecais – Determinação pela técnica de Tubos Múltiplos.
- Para a realização do teste procedeu-se da seguinte maneira:
- Identificou-se a amostra a ser analisada e definiram-se os volumes da mesma a serem inoculados,
em função da procedência.
- Procedeu-se á identificação dos tubos, anotando nestes, os números das amostras, o volume a ser
inoculado e a data.
- Foi homogeneizada a amostra no mínimo 25 vezes, suavemente.
- Diluiu-se a amostra até 10-2, de acordo com a metodologia para a realização da diluição em série,
foram identificados os frascos de diluições, com as respectivas diluições.
- Foi homogeneizado o frasco com a amostra bruta e com o auxílio de uma nova pipeta transferiu-se
1,0ml em cada um dos tubos de caldo lactosado (série de 5 tubos).
- Repetiu-se a operação para as diluições 10-1, 10-2, completando, portanto, o total de 15 tubos, sendo
5 para cada diluições (100, 10-1 e 10-2).
- Após a inoculação de todos os volumes da amostra, incubou-se a 35±0,5°C, durante 24 horas.
- Decorrido esse período de incubação, foi efetuada sua 1° leitura, considerando-se como resultado
positivo a acidificação do meio, com ou sem produção de gás, para resultados negativos, retornou-se o frasco
á incubação por mais 24 horas, efetuando-se após 48 horas a leitura final. Os valores foram registrados,
anotando-se o número de tubos com resultado positivo para cada volume inoculado.
- As culturas com resultado presuntivo, foram submetidas aos testes confirmativos, para a
determinação de coliformes totais e a diferenciação de coliformes fecais, com o auxílio de uma alça de
inoculação devidamente flambada e/ou palito de madeira, previamente esterilizado, retirou-se um inoculo da
cultura positiva em caldo CL e transferiu esse inoculo para um tubo contendo caldo lactosado com verde
brilhante e bile a 2% a 35±0,5°C, durante 24-48 horas e para o meio E.C a 44,5±0,2°C, em banho Maria com
agitação, durante 24 horas.
- Após os períodos determinados de incubação, efetuaram-se as leituras, considerando resultados
positivo para coliformes totais a produção de gás a partir da fermentação da lactose no meio caldo lactosado
com verde brilhante e bile a 2%, coliformes totais estavam presentes se houvessem produção de gás no meio
E.C. Anotaram-se os resultados e calculou-se o NMP a partir dos dados obtidos e de acordo com a tabela
disponibilizada.
3.7 Coliformes Totais – Técnica Membrana Filtrante.
- Foram identificadas as amostras a serem analisadas e foram definidos os volumes da mesma a
serem filtrados (100ml da amostra ou diluições).
- Prestou-se atenção nos materiais dispostos na bancada, pois todos estavam esterilizados, tomandose o cuidado para manter o ambiente asséptico.
- Foi retirado a parte posterior do porta filtro, com as extremidades de uma pinça previamente
flambada e resfriada, colocou-se uma membrana filtrante estéril sobre a parte inferior do porta-filtro.
- Foi acoplado a parte superior do porta-filtro à parte inferior tomando cuidado para não danificar a
membrana.
- Homogeneizou-se a amostra, por agitação manual e distribuíram-se os volumes requeridos da
amostra em proveta estéril.
- Verteu-se um pouco de água de diluição estéril ou a própria amostra e foi ligada a bomba de vácuo
para que a membrana fosse bem fixada ao funil.
- Verteu-se cuidadosamente o volume da amostra a ser examinada no porta-filtro, evitando-se que a
água respingasse sobre as bordas superiores dos mesmos.
- Foi ligada a bomba de vácuo e procedeu-se a filtração.
- Após a filtração, enxugou-se o porta-filtro duas vezes, com volumes de 20-30ml de água de
diluição estéril, evitando assim a retenção de alguma bactéria nas paredes internas do mesmo.
- Desligou-se a fonte de vácuo, ao finalizar a operação, evitando-se a secagem excessiva da
membrana filtrante.
- Foi separada a parte superior do porta-filtro e com uma pinça cujas extremidades foram flambadas
e resfriadas, retirou-se com cuidado a membrana.
- Obedecendo-se aos cuidados de assepsia, foi colocada cuidadosamente a membrana, com a
superfície quadriculada voltada para cima, na superfície do meio de cultura contido na placa de Petri,
devidamente identificada com o número da amostra e o volume filtrado. Ao transferir-se a membrana para a
superfície do meio de cultura, toda a área da membrana ficou completamente aderida ao meio.
- Tampou-se a placa de Petri e incubou-se em posição invertida a 35±0,5°C, durante 24±2 horas.
- Após o período de incubação, foi efetuada a contagem de colônias típicas de coliforme (colônia
vermelho-escuras com brilho verde-metálico, recobrindo toda a superfície da colônia ou parte dela).
3.8 Coliformes Totais – Técnica Cromogênico – Colilert.
- Foi identificada a amostra a ser analisada.
- Adicionou-se o reagente do flaconete ao frasco contendo 100ml de amostra, fechou-se e agitou-se
para total mistura.
- Despejou-se todo o conteúdo do frasco na cartela.
- Foi colocada a cartela na seladora para que esta fosse lacrada.
- Transferiu-se a cartela para a incubadora a 35°C, durante 24 horas.
4
Resultados e discussões
- A contagem de bactérias heterotróficas realizada pelo método “Pour Plate” obteve 73 colônias no
primeiro quadrante, 47 colônias no segundo quadrante, 66 colônias no terceiro quadrante e 50 colônias no
quarto quadrante. Totalizando 236 colônias na placa de petri de concentração 10 -2.
- No teste de Presença/Ausência realizado em frascos obteve-se mudança na coloração de todos os
meios de lilás para alaranjado, o que nos sugere um resultado positivo para a presença de coliformes na
amostra em questão.
- No segundo teste de Presença/Ausência (P/A) para coliformes fecais (CF) e coliformes totais (CT)
pela técnica de Tubos Múltiplos pôde-se observar no meio de concentração 100 que 5 frascos apontaram
resultado positivo para coliformes totais e 5 frascos apontaram positivo para coliformes fecais. No meio de
concentração 10-1, 3 frascos apontaram resultado positivo para coliformes totais e nenhum frasco deu positivo
para coliformes fecais.
Por fim, na concentração 10-2 apenas um frasco apontou resultado positivo para coliformes totais e
nenhum frasco deu positivo para coliformes fecais.
- No experimento utilizando a técnica Colilert foi possível observar pela mudança de cor do meio a
presença de coliformes totais e através do uso de luz UV a presença da bactéria E. coli. O resultado obtido foi:
48 quadrantes grandes e 44 quadrantes pequenos coloridos, o que nos sugere então cerca de 829,7 coliformes
totais. Na utilização da luz UV houve apenas um quadrante que apresentou luminescência apontando a
presença de E. coli.
- O experimento que utilizamos a Técnica da Membrana Filtrante foi inconclusivo devido a
problemas metodológicos.
5
Conclusões
As bactérias do grupo coliformes são comumente utilizadas em testes e medições microbiológicas
com o intuito de confirmar a confiabilidade e qualidade da água e também de alimentos destinados ao
consumo humano.
Atualmente são conhecidos dois tipos de coliformes, sendo, totais e fecais. Os coliformes totais são
integrantes do grupo de bactérias gram-negativas e produzem gás em torno de 35 a 37 ºC, conforme
comprovado mediante os ensaios laboratoriais mencionados. Por sua vez, os coliformes fecais são capazes de
suportarem temperaturas acima de 40 ºC, motivo pelo qual são denominados de termotolerantes. Tais
coliformes contemplam as bactérias gram-negativas E. coli encontrada no trato intestinal de animais de
sangue quente, sobretudo equinos e ruminantes.
Os coliformes podem provocar doenças gastro-intestinais e mesmo toxinfecções alimentares, de
modo que, quanto maior sua quantidade presente, maior será o risco na ingestão, evidenciando assim uma
razão de proporcionalidade direta entre esses fatores.
Sendo assim, as amostras de água avaliadas apontam a contaminação por coliformes totais e fecais,
aspecto que deve ser considerado no momento de emprego de produtos químicos e equipamentos na Estação
de Tratamento de Água (ETA) ou mesmo no tratamento simplificado em zona rural através do correto
dimensionamento de bomba dosadora de hipoclorito de sódio para poços, dentre outros.
6
Referências Bibliográficas
[1] http://www.ibb.unesp.br/departamentos/Educacao/Trabalhos/obichoquemedeu/bacteria_coliformes_fecais.htm
Acesso em 05 de agosto de 2011.
[2] http://www.darwin.futuro.usp.br/site/ecologia/quadroteorico/c_coliformes.htm
Acesso em 05 de agosto de 2011.
BETTEGA, J. M. P. R., Machado, M.R., Presibella M., Baniski, G., Barbosa, C de Almeida. Métodos
analíticos e microbiológicos da água para consumo humano.
Disponível em: http://www.scielo.br/pdf/cagro/v30n5/v30n5a19.pdf. Acesso em: 4 de agosto de 2011.
BRASIL. FUNASA- Fundação Nacional da Saúde. Manual do saneamento. 3 ed. rev. Brasília. 2006.
CETESB - Comapanhia de Tecnologia de Saneamento Ambiental. Análises Microbiológicas da Água.
São Paulo. 2002.
DOMINGUES, V.O., TAVARES, G. D, STUKER, F., MICHELOT, T. M, REETZ, L.G.B.,
BERTONCHELI, C de Mello, HORNER, R. Contagem de bactérias heterotróficas na água para consumo
humano:
Comparação
entre
duas
metodologias.
Disponível
em:
http://w3.ufsm.br/revistasaude/2007/33(1)15-19,%202007.pdf. Acesso em: 8 de agosto de 2011.
PORTARIA Nº 518/GM. Em 25 de março de 2004. Ministério da Saúde. Disponível em:
http://dtr2001.saude.gov.br/sas/PORTARIAS/Port2004/GM/GM-518.htm. Acesso em: 3 de
agosto de 2011.
RICTHER, C.A., NETTO A.J.M. Tratamento de água: tecnologia atualizada. São Paulo. Edgard Blucher.
1991.
SILVA, N., JUNQUEIRA, V.C.A., SILVEIRA, N.F.A. Manual de métodos de análise microbiológica de
alimentos. São Paulo. Livraria Varela. 2001.
Standard Methods for the Examination of Water and Wastewater. 20th edition.1998.