Diferenças entre Tonsilite Recorrente
e Tonsilas Hiperplásicas
De-Yun Wang, Yamei Zhang e Li Shi
Considerações gerais
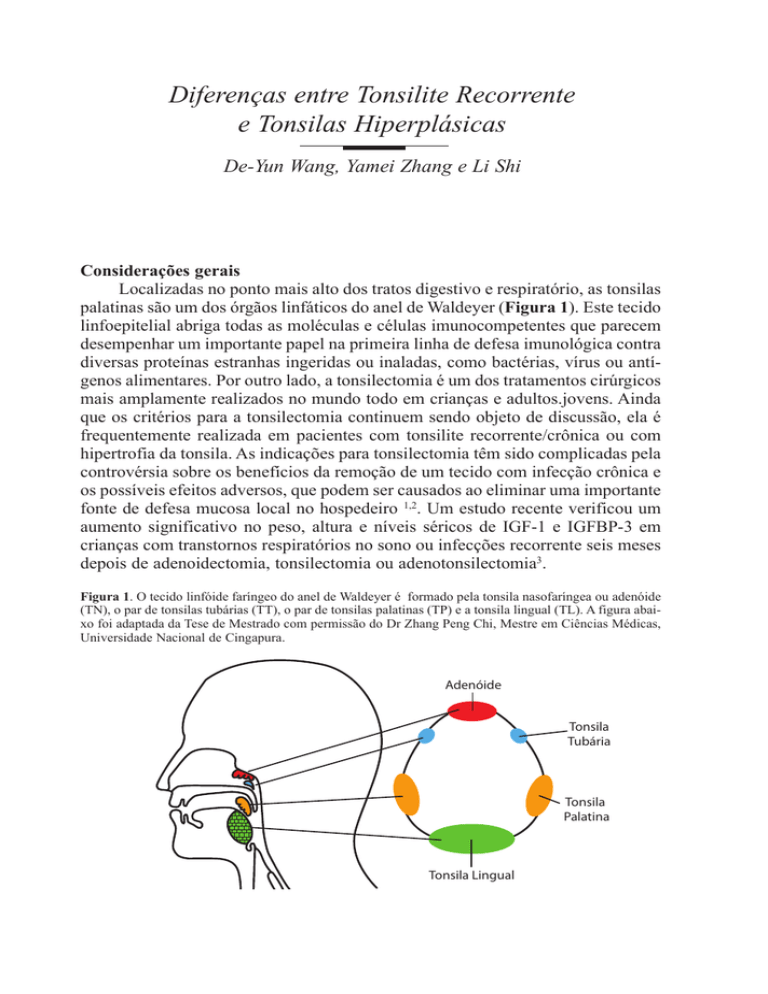
Localizadas no ponto mais alto dos tratos digestivo e respiratório, as tonsilas
palatinas são um dos órgãos linfáticos do anel de Waldeyer (Figura 1). Este tecido
linfoepitelial abriga todas as moléculas e células imunocompetentes que parecem
desempenhar um importante papel na primeira linha de defesa imunológica contra
diversas proteínas estranhas ingeridas ou inaladas, como bactérias, vírus ou antígenos alimentares. Por outro lado, a tonsilectomia é um dos tratamentos cirúrgicos
mais amplamente realizados no mundo todo em crianças e adultos.jovens. Ainda
que os critérios para a tonsilectomia continuem sendo objeto de discussão, ela é
frequentemente realizada em pacientes com tonsilite recorrente/crônica ou com
hipertrofia da tonsila. As indicações para tonsilectomia têm sido complicadas pela
controvérsia sobre os benefícios da remoção de um tecido com infecção crônica e
os possíveis efeitos adversos, que podem ser causados ao eliminar uma importante
fonte de defesa mucosa local no hospedeiro 1,2. Um estudo recente verificou um
aumento significativo no peso, altura e níveis séricos de IGF-1 e IGFBP-3 em
crianças com transtornos respiratórios no sono ou infecções recorrente seis meses
depois de adenoidectomia, tonsilectomia ou adenotonsilectomia3.
Figura 1. O tecido linfóide faríngeo do anel de Waldeyer é formado pela tonsila nasofaríngea ou adenóide
(TN), o par de tonsilas tubárias (TT), o par de tonsilas palatinas (TP) e a tonsila lingual (TL). A figura abaixo foi adaptada da Tese de Mestrado com permissão do Dr Zhang Peng Chi, Mestre em Ciências Médicas,
Universidade Nacional de Cingapura.
Adenóide
Tonsila
Tubária
Tonsila
Palatina
Tonsila Lingual
IX MANUAL DE OTORRINOLARINGOLOGIA PEDIÁTRICA DA IAPO 111
Clinicamente, as indicações usadas para recomendar ou realizar a cirurgia
de tonsilas são:
- tonsilite recorrente ou crônica;
- hipertrofia (hiperplasia).
Há grandes diferenças de opinião com relação a extensão, a gravidade e a
duração de diversas condições que justifiquem a cirurgia. A Academia Americana
de Otolaringologia, seção de Cirurgia de Cabeça e Pescoço, propôs que a tonsilectomia seja realizada para tratar a tonsilite crônica ou recorrente (sete episódios
em 12 meses, cinco episódios por ano durante dois anos, ou três episódios por
ano durante três anos) quando ela ocorre apesar do tratamento clínico, ocorre com
complicações ou está associada com o estado de portador persistente de estreptococos patogênicos4. Além disso, a tonsilectomia tem sido indicada há muitos anos
para tratar a tonsilite aguda ou crônica que resulta em convulsões febris, abscesso
peritonsilar, hipertrofia tonsilar obstruindo a respiração ou deglutição, portadores
do bacilo diftérico e confirmação da doença por biópsia de tecido5. Se as alterações da função normal das imunoglobulinas aparecerem quando a tonsila está
doente, e a imunoexclusão e a imunorregulação estiverem disfuncionais, a tonsila
não serve adequadamente como a primeira linha de defesa. Como sugerido por
alguns estudos, a tonsila pode ser prejudicial para o organismo, como no caso de
autoimunidade associada a tonsilite focal1.
Contudo, há controvérsias com relação ao equilíbrio entre os benefícios
de extrair um tecido cronicamente infectado e os possíveis efeitos adversos,
que podem ser causados pela eliminação de uma fonte importante de defesa
mucosa local no hospedeiro.Tem sido sugerido que o médico que retira o órgão
precisa ter uma compreensão do potencial imunológico das tonsilas, para que a
decisão tomada tenha como objetivo claro a manutenção do máximo de saúde
para o paciente.
Histologia e a suposta função imunológica das tonsilas
A tonsila palatina tem uma arquitetura linfóide característica, que inclui um
epitélio reticular ao longo das criptas, uma região folicular e centros germinativos
primários e secundários, cobertos por zonas do manto, e regiões extrafoliculares
(Figura 2). Apresenta uma arquitetura singular, similar à dos linfonodos (tipos de
células, desenvolvimento de centros germinativos quando há exposição a antígenos) e tem criptas profundas, parcialmente ramificadas, o que aumenta muito sua
área superficial e aprisiona materiais ambientais6,7. As células imunocompetentes
que estão localizadas nestas várias regiões da tonsila foram bem descritas por
Bernstein et al1. O antígeno penetra na cripta, sendo captado pelas células do epitélio reticular. Nesta região, as células apresentadoras de antígeno são células de
Langerhans, macrófagos e células M (microfold). Estas células transportam então
o antígeno para as células T na zona extrafolicular. Além disso, a apresentação de
antígeno para as células da zona do manto pode estimular as células de memória
com IgD e IgM de superfície para mudar para clones mais maduros de células B
que possuem IgA e IgG. Finalmente, as células dendríticas específicas no centro
germinativo podem ser responsáveis pela apresentação de antígeno para as células
B nesta área.
112
IX MANUAL DE OTORRINOLARINGOLOGIA PEDIÁTRICA DA IAPO
Figura 2. O folículo da tonsila palatina contém uma zona do manto e um centro germinativo. (GC: Centro
germinativo; MZ: Zona do manto; IF Área Interfolicular).
As células T derivadas do timo ocupam caracteristicamente as zonas extrafoliculares, mas as células T “helper-inducer”também estão presentes nos centros
germinativos8. As células B estão presentes primariamente no centro germinativo
e na zona do manto, mas são encontradas também no epitélio reticular. A porcentagem média de células T e B nas tonsilas palatinas é 42% e 52%, respectivamente.
Em comparação com o sangue periférico, 67% dos linfócitos são células T e 14%
são células B. As células CD4+Leu8+ representam células suppressor-inducer,
enquanto que as células CD4+Leu8- representam células helper-inducer9. A
maioria das células encontradas na tonsila palatina são células helper-inducer, e
as células T suppressor-inducer são mais abundantes no sangue periférico.
Foi verificado que as células que secretam Ig ativamente, ou plasmócitos,
não representam mais do que 2% do total de células na tonsila palatina e nas tonsilas nasofaríngeas10, A IgG parece ser a imunoglobulina a predominante. A proporção de IgG, IgA, e IgM, entretanto, é diferente entre os diversos estudos. Um estudo sugeriu que a tonsila palatina tem características de um sistema imunológico
mucoso, uma vez que a secreção de IgA nas tonsilas palatinas é significativamente
maior que no linfonodo11. Tem sido sugerido que as tonsilas e/ou adenóides sejam
a fonte de células B com imunoglobulina de superfície específica, direcionada
contra um microorganismo, e que não está presente na orelha média ou na mucosa
nasal. Assim, uma célula B específica originária do tecido linfóide da tonsila ou
adenóide pode migrar para um local adjacente na mucosa respiratória superior1.
A patogênese e os mecanismos de base responsáveis pelo desenvolvimento das tonsilas hipertróficas (hiperplásicas) ou tonsilite crônica
O nosso entendimento limitado da patogênese e dos mecanismos de base,
responsáveis pelo desenvolvimento de tonsilas hipertróficas (hiperplásicas) ou
IX MANUAL DE OTORRINOLARINGOLOGIA PEDIÁTRICA DA IAPO 113
tonsilite crônica é a causa da incerteza nas nossas decisões relacionadas à
tonsilectomia. Sabe-se que diferentes modificações morfológicas e imunológicas
ocorrem na tonsila anormal, mas o papel que desempenham na patogênese destas
condições ainda é incerto12. Há necessidade de mais informações sobre a estrutura
e a função normal e patológica deste tecido linfóide, para podermos saber em que
circunstâncias clínicas a tonsilectomia pode ser realizada.
1. Áreas e número de folículos na tonsilite recorrente e na hipertrofia da tonsila
Para esclarecer a etiologia da tonsilite recorrente e da hipertrofia tonsilar é
importante determinar se existe diferença na arquitetura microanatômica entre
estas duas condições. Usando o método de contagem de pontos, Surjan et al.
estimaram o tamanho do centro germinativo e concluíram que os centros germinativos estavam aumentados nas tonsilas hipertróficas em comparação com os de
pacientes com tonsilite recorrente13. Gorfien et al. usaram a análise de imagem
para medir o tamanho do centro germinativo e verificaram que há um aumento
significativo na área do centro germinativo em tonsilas apresentando hipertrofia
quando comparadas com controles normais14. Contudo, estas pesquisas foram
restritas ao centro germinativo, e não pesquisaram as alterações de toda a área do
folículo. Poucos estudos encontrados na literatura avaliaram o tamanho da área
do centro germinativo em folículos secundários. Brandtzaeg et al. estimaram o
tamanho do centro germinativo usando um método de contagem de pontos em
um grupo de amostras de tonsilas normais obtidas por biópsia, e verificaram que
os centros germinativos eram um pouco maiores nos indivíduos com idades entre
dois e 25 anos idade do que nos mais velhos (30 a 81 anos de idade) 15. Esta diferença, entretanto, não foi estatisticamente significativa.
Usando um método de análise de imagem, pudemos comparar a diferença
histológica entre a área e o número de folículos nas tonsilas de pacientes com
hipertrofia tonsilar e tonsilite recorrente 16. Neste estudo, tecidos frescos de tonsilas foram obtidos de pacientes com hipertrofia tonsilar (n=16) e tonsilite recorrente (n=15) e foram colocados em líquido de Bouin durante 48 horas. Os tecidos
foram incluídos em parafina e obtidos 60 cortes (6µm de espessura) de diferentes
partes da tonsila, cobrindo a parte periférica e central. Foram colocados três cortes em cada lâmina e apenas um deles foi selecionado de forma aleatória para ser
avaliado, usando um algoritmo gerador de números aleatórios.
Cada corte foi examinado usando um microscópio Olympus BX50, com
aumento 40×. As imagens foram adquiridas com uma câmera de vídeo colorida
JVC KY-F50 e feito o snapping em um computador Dell Triniton. Por seleção
manual, foram medidos a área de cada folículo e o número de folículos em cada
corte usando o software Olympus Micro Image 2.0 (Figura 3). A medida da
área e os números de folículos foi feita às cegas com relação à categoria clínica
do paciente nos dois grupos do estudo. Todos os determinantes de mensuração
foram previamente escolhidos por um processo de seleção aleatória, usando um
algoritmo gerador de números aleatórios. Para cada grupo, a medida foi feita em
205 folículos. Os resultados mostraram que a área média do folículo nas tonsilas
hipertróficas (0,23±0,02mm2) foi significativamente maior do que no grupo tonsilite (0,15±0,02mm2) (p<0,01). Contudo, não há diferença significativa no número
114
IX MANUAL DE OTORRINOLARINGOLOGIA PEDIÁTRICA DA IAPO
médio de folículos entre estes dois grupos. Os resultados do nosso estudo indicam
que a hipertrofia tonsilar é histologicamente caracterizada por um aumento dos
folículos, quando comparado com a tonsilite crônica, indicando uma condição
hiperplásica das células linfóides no centro germinativos 16. Isto pode explicar
ainda a diferença na etiologia e/ou no mecanismo imunológico de defesa basal
destas duas condições.
Figura 3. Imagem digitalizada de folículos sob aumento 40x.
O contorno em preto indica as áreas medidas.
2. Subconjuntos de linfócitos
Os subconjuntos de linfócitos nas tonsilas e uma população de linfócitos T
imaturos ou inativados têm sido estudados em tonsilas com inflamação crônica.
Os resultados mostraram que os linfócitos T purificados, de tonsilas, são CD3+
e são compostos por uma maioria de linfócitos CD4+ 17,18. Estes dados estão em
concordância com a hipótese de que os linfócitos T das tonsilas contém linfócitos
T ativados 19. Por outro lado, o processo de diferenciação das células B das tonsilas e seu suposto papel na imunidade secretória do trato respiratório são uma das
funções mais importantes das tonsilas. Foi demonstrado que os linfócitos B e as
células ativadas com marcadores positivos estavam maiores nas tonsilas hipertróficas e em crianças 20 Assim, torna-se importante o estudo da população e da
distribuição de linfócitos B e T nas tonsilas para se obter um entendimento melhor
dos papéis que desempenham, sob diferentes condições patológicas.
Usando citometria de fluxo, Lopez-Gonzalez et al. 21 mediram os subconjuntos de linfócitos em suspensões de células de tonsilas com patologia infecciosa e
obstrutiva. Este estudo demonstrou um aumento significativo de células T (CD3+
e TCR Alfa+ Beta+) em tonsilas com patologia infecciosa em comparação com
as hipertróficas. Em outro estudo, Olofsson et al. (1998) encontraram diferenças
entre tonsilite recorrente e hipertrofia tonsilar hipertrófica quando as populações
de leucócitos estavam limitadas ao epitélio superficial, mas a composição celular
de áreas interfoliculares e foliculares era similar22.
Em um estudo piloto, fizemos a pesquisa quantitativa da população de
IX MANUAL DE OTORRINOLARINGOLOGIA PEDIÁTRICA DA IAPO 115
células T e B e de seus subconjuntos. O material foi obtido de sete pacientes com
hipertrofia tonsilar (n=4) ou infecção recorrente/crônica (n=3), que estavam com a
tonsilectomia marcada. Como controle, foi usado o tecido tonsilar obtido durante
a uvulopalatofaringoplastia (UPFP) de um paciente sem histórico clínico de tonsilite. Um painel de subconjuntos de células T e B, marcadores de proliferação
celular e ativação (CD45, CD3, CD20, CD14, CD4, CD8, CD25, CD69, CD71,
CD38 e receptores superficiais de IgG) foram analisados por citometria de fluxo.
Nossos resultados mostraram que parece não haver uma diferença importante
entre tonsilas com hipertrofia e as com infecção recorrente/crônica em termos de
expressão destes receptores celulares superficiais (Tabela 1).
Tabela 1. Resultados das células imunocompententes em tonsilas de oito pacientes com inflamação aguda,
tonsilas hipertróficas, e inflamação crônica (dados apresentados como porcentagem mediana).
Tonsila hipertrófica
N=4
Tonsilite crônica
N=3
Sem infecção/hipertrofia*
N=1
CD45+
93,9
88.6
91,9
CD14+
1,4
0,71
1,82
CD3+
47,6
55,9
57,9
CD4+
CD25+
CD69+
CD71+
CD38+
RO/RA
37,5
4,0
22,5
1,3
29.3
1,85
40,5
3,1
24,3
1,92
31,9
2,59
44,1
2,17
27,9
0,75
18.8
5,18
CD8+
CD25+
CD69+
CD71+
CD38+
RO/RA
9.7
0,22
3,3
0,3
6,2
0,67
13,6
0,25
8.0
0,2
7,4
0,39
8.7
0,07
3,51
0,02
1,7
0,62
CD20+
CD25+
CD69+
CD71+
CD38+
IgG+
56,2
0,7
19.3
18.8
40,2
28
47
1,1
16
12,3
27,2
25,3
50,9
0,09
3,02
3,9
10,9
20,6
*Tecido tonsilar obtido durante uvulopalatofaringoplastia (UPFP) de pacientes sem histórico clínico de
tonsilite
3. Perfil de citocinas
A tonsila palatina é um local importante de ativação, diferenciação e
mudança de isotipo de células T e células B induzidas por bactérias e vírus. O
desenvolvimento de imunidade específica induz uma série de reações moleculares e celulares complicadas, como captação, processamento e apresentação de
antígeno, interações de células T e B, geração de anticorpos, ativação de complemento, fagocitose, apoptose e citotoxicidade celular. Todos estes eventos são
controlados por uma comunicação complexa entre as células do sistema imuno-
116
IX MANUAL DE OTORRINOLARINGOLOGIA PEDIÁTRICA DA IAPO
lógico quando há a liberação polarizada de citocinas mediada por receptor. Como
o processo inflamatório, as respostas imunológicas requerem várias redes de citocinas. Assim, a determinação do perfil de citocinas é importante para esclarecer o
mecanismo imunológico de defesa, bem como o processo inflamatório na tonsila.
Até agora, há um número limitado de estudos descrevendo o perfil de citocinas em tonsilite e hipertrofia da tonsila. Usando a imunohistoquímica e ELISA,
alguns estudos verificaram que há um teor maior de IL-2, IL-6, IFN-gama, IL-10
e IL-1beta em tonsilite crônica do que na hipertrofia da tonsila, mas houve controvérsias entre estes relatos com relação a IL-4 23-26. Em um outro estudo, TNF-alfa
mRNA foi detectado por RT-PCR, mas não foi encontrada nenhuma diferença
entre a tonsilite crônica e a hipertrofia da tonsila 27. As IL-4, IL-5, IL-6 e IFN-r
mRNA não foram detectadas, contudo, tanto na tonsilite crônica, como na hipertrofia da tonsila.
Recentemente realizamos um estudo para investigar o perfil de citocinas em
tecido tonsilar de pacientes com tonsilite recorrente (n=7) e hipertrofia de tonsila
(n=6) 28. Usando coloração imunohistoquímica, IL-4, IL-6 e IFN-γ mostraram
frequências significativamente mais elevadas de contagem de células positivas na
tonsilite recorrente do que na hipertrofia da tonsila. Contudo, não foi encontrada
nenhuma diferença entre os grupos com relação a IL-2, IL-8, IL-10 e IL-13. A
distribuição predominante de células que sintetizam citocinas foi localizada na
área extrafolicular, próximo às criptas, e no epitélio reticular. Nas tonsilas, a IL-4
é a principal citocina, sendo expressa em quase todos os compartimentos do tecido
tonsilar. No folículo, a IL-4 foi mais expressa na zona do manto do que no centro
germinativo. O IFN-gama estava presente principalmente na área extrafolicular e
a IL-2 foi encontrada tanto na área extrafolicular como em alguns centros germinativos. A IL-8 foi encontrada na mesma proporção nos dois grupos. A localização estava concentrada no epitélio superficial e epitélio reticular das criptas. As
células expressando IL-6 e IL-10 estavam disseminadas pela área extrafolicular.
No mesmo estudo28 a expressão de mRNA por (RT-PCR) de IL-2, IL-4, IL-6,
IL-10, IL-13, IFN-γ foi detectável em todos os tipos de células (células CD4+,
CD8+ e CD19+) dos grupos de tonsilite recorrente e hipertrofia da tonsila. O IL-8
mRNA, contudo, não foi detectado em todas as amostras. Não houve diferença
significativa no teor de expressão de IL-2, IL-4, IL-6, IL-10, IFN-gama em células
CD4+, CD8+ e CD19+ entre tonsilite recorrente e hipertrofia da tonsila (Figura
4). O teor da expressão de IL-13 mRNA nas células B da tonsila é significativamente mais elevado (p<0,05) na tonsilite recorrente do que na hipertrofia da
tonsila. Além disso, o teor de expressão de IL-13 mRNA não mostra uma diferença significativa entre os dois grupos em termos das células CD4+ e CD8+. O
nosso estudo demonstra que a tonsila humana é um órgão imunológico ativo, que
contem uma ampla gama de células produtoras de citocinas. Seguindo os nossos
dados, muitas citocinas são detectáveis em tonsilite recorrente e hipertrofia da
tonsila, e não há um padrão de diferenciação do perfil de citocina Th1 e Th2 entre
estas duas doenças das tonsilas clinicamente definidas 28.
IX MANUAL DE OTORRINOLARINGOLOGIA PEDIÁTRICA DA IAPO 117
Figura 4. A expressão de mRNA da citocina em células CD4+, CD8+ e CD19+ de tonsilite recorrente e
hipertrofia da tonsila
Conclusão
A tonsila palatina humana é um órgão imunológico ativo que contem uma
ampla variedade de células produtoras de citocinas. A hipertrofia da tonsila é histologicamente caracterizada por um aumento dos folículos em comparação com
a tonsilite crônica, indicando uma condição de hiperplasia das células linfóides
nos centros germinativos. De acordo com os nossos dados, não há um padrão que
permita a diferenciação do perfil de citocina Th1 e Th2 entre estes dois distúrbios.
Este estudo sugere que a tonsilite recorrente e a hipertrofia da tonsila envolvem
um mecanismo imunopatológico complexo, com a participação sobreposta tanto
da resposta imunológica Th1 como da Th2. O papel e os mecanismos de base da
regulação de citocinas pelas células T e B na tonsilite recorrente e a hipertrofia da
tonsila ainda precisam ser elucidados.
Referências bibliográficas
1. Bernstein JM, Yamanaka N, Nadal D. Immunobiology of the tonsils and
adenoids. In: Ogra P, Lamm ME, McGhee JR, Mestecky J, Strober W
and Bienenstock J (Eds). Handbook of mucosal Immunology. San Diego,
Academic Press, Inc. 1994.
2. Faramarzi A, Kadivar MR, Heydari ST, Tavasoli M. Assessment of the consensus about tonsillectomy and/or adenoidectomy among pediatricians and
otolaryngologists. Int J Pediatr Otorhinolaryngol. 2010 Feb;74(2):133-6.
118
IX MANUAL DE OTORRINOLARINGOLOGIA PEDIÁTRICA DA IAPO
3. Kiris M, Muderris T, Celebi S, Cankaya H, Bercin S. Changes in serum
IGF-1 and IGFBP-3 levels and growth in children following adenoidectomy,
tonsillectomy or adenotonsillectomy. Int J Pediatr Otorhinolaryngol. 2010
May;74(5):528-31.
4. Mui S, Rasgon BM, Hilsinger Jr, RL. Efficacy of tonsillectomy for recurrent
throat infection in adults. Laryngoscope. 1998; 108: 1325-1328.
5. Kornblut AD. A traditional approach to surgery of the tonsils and adenoids.
Otolaryngol Clin North Am 1987; 20: 349-363.
6. Brandtzaeg P. Research in gastrointestinal immunology-state of the art. Scand
J Gastroenterol 1985; 20 (Suppl 114): 137-156.
7. Mestecky J, Abraham R, Ogra PL. Common mucosal immune system and
strategies for the development of vaccines effective at the mucosal surfaces.
In: Ogra P, Lamm ME, McGhee JR, Mestecky J, Strober W and Bienenstock
J (Eds). Handbook of mucosal Immunology. San Diego, Academic Press, Inc.
1994.
8. Yamanaka N, Sambe S, Harabuchi Y and Kataura A. Immunological study of
tonsil. Distribution of T cell subsets. Acta Otolaryngol (Stockh) 1983; 96: 509516.
9. Lanier L, Engelman EG, Gatenby P, Babcock GF, Warner NL, Herzenberg
LA. Correlation of functional properties of human lymphoid cell subsets and
surface marker phenotypes using multiparameter analysis and flow cytometry.
Immunol Rev 1983; 74: 143-160.
10.Nadal D, Albini B, Schlapfer E, Bernstein JM Ogra PL. Role of Epstein-Barr
virus and interleukin-6 in the development of lymphomas of human origin in
SCID mice engrafted with human tonsillar mononuclear cells. J Gen Virol
1992; 73: 113-121.
11. Woloschak G, Liarakos C Tomasi T. Identification of the major immunoglobulin heavy chain poly A RNA in murine lymphoid tissue. Mol Immunol 1986;
23: 645-653.
12. Ohta N, Fukase S, Aoyagi M, Koike V, Fukase Y, Sendo F. Neutrophil activity
of tonsillar cells from patients with tonsillitis. Acta Otolaryngol (Stockh) 1994
(Suppl); 511: 214-217.
13.Surjan L, Jr., Brandtzaeg P, Berdal P. (1978). Immunoglobulin systems of
human tonsils. II. Patients with chronic tonsillitis or tonsillar hyperplasia:
quantification of Ig-producing cells, tonsillar morphometry and serum Ig concentrations. Clin Exp Immunol. 31: 382-390
14. Gorfien JL, Hard R, Noble B, Brodsky L. (1999). Quantitative study of germinal center area in normal and diseased tonsils using image analysis. Ann Otol
Rhinol Laryngol. 108: 398-402
15.Brandtzaeg P, Surjan L, Jr., Berdal P. (1978) Immunoglobulin systems
of human tonsils. I. Control subjects of various ages: quantification of
Ig-producing cells, tonsillar morphometry and serum Ig concentrations. Clin
Exp Immunol. 31: 367-381.
IX MANUAL DE OTORRINOLARINGOLOGIA PEDIÁTRICA DA IAPO 119
16.Zhang PC, Pang YT, Loh KS, Wang DY. Comparison of histology between
recurrent tonsillitis and tonsillar hypertrophy. Clin Otolaryngol 2003; 28: 235239.Plum J, Van Cauwenberge P, De Smedt M. Phenotyping of mononuclear
cells from tonsils and corresponding biopsies using a cytofluorimeter. Acta
Otolaryngol (Stockh) 1986; 101: 129-134.
17. Plum J, Van Cauwenberge P, De Smedt M. Human tonsillar T lymphocytes: An
immature or activated T-lymphocyte population. Clin Immunol Immunopathol
1986; 39: 14-23.
18.Plum J, Van Cauwenberge P, De Smedt M. Analysis of activation markers on
tonsillar T lymphocytes. Otolaryngol (Stockh) 1988; 454 (Suppl): 113-117.
19.Plum J, Van Cauwenberge P, De Smedt M. Analysis of activation markers on
tonsillar T lymphocytes. Otolaryngol (Stockh) 1988; 454 (Suppl): 113-117.
20.Bussi M, Carlevato MT, Panizzut B, Omede P, Cortesina. Are recurrent and
chronic tonsillitis different entities? An immunological study with specific
markers of inflammatory stages. Acta Otolaryngol (Stockh) 1996 (Suppl) 523:
112-114.
21.Lopez-Gonzalez MA, Sanchez B, Mata F, Delgado F. Tonsillar lymphocyte
subsets in recurrent acute tonsillitis and tonsillar hypertropgy. Int J Pediatr
Otorhinolaryngol 1998; 43: 33-39.
22.Olofsson K, Hellstrom S, Hammarstrom M-L. The surface epithium of recurrent infected palatine tonsils is rich in Tcells. Clin Exp Immunol 1998; 111:
36-47.
23. Gallo O. De Carli M. Gallina E. Toccafondi G. Romagnani S. Del Prete G. The
production of immunoregulatory cytokines is localized to the extra follicular
area of human tonsils. Acta Oto-Laryngologica. 116(3):477-85, 1996 May
(IHC).
24. Agren K. Andersson U. Nordlander B. Nord CE. Linde A. Ernberg I. Andersson
J. Acta Upregulated local cytokine production in recurrent tonsillitis compared with tonsillar hypertrophy. Oto-Laryngologica. 115(5):689-96, 1995 Sep.
(IHC).
25.Andersson J. Andersson U. Characterization of cytokine production in infectious mononucleosis studied at a single-cell level in tonsil and peripheral
blood. Clinical & Experimental Immunology. 92(1):7-13, 1993 Apr (IHC).
26. Kerakawauchi H. Kurono Y. Mogi G. Immune responses against Streptococcus
pyogenes in human palatine tonsils, Laryngoscope. 107(5):634-9, 1997 May
(E).
27.Saichiro Tanaka, ShiroNakagawa, Mitsuru Furukawa. Detection of cytokine
expression in human palatine tonsils. Acta Oto-Laryngologica. Suppl 523:7879, 1996 (RT).
28. Zhang PC. Histology and Immune Response of human palatine tonsil in
recurrent tonsillitis and tonsillar hypertrophy. Thesis for the degree of Master
of Sciences, National University of Singapore, 2001.