1
SISTEMA MUSCULAR I
SUMÁRIO
HISTOLOGIA MUSCULAR
1 – Músculo estriado e não estriado
2 – Organização do músculo estriado esquelético: epimísio, perimísio e endomísio
3 – Fibra muscular esquelética em microscopia
•
características gerais: sarcolema, sarcoplasma, retículo sarcoplasmático, sarcossomas
•
miofibrilas
•
miofilamentos: actina e miosina
•
sarcómeros
•
bandas A, I, H e Z
•
túbulos transversos (sistema T) e tríade muscular
4 – O mecanismo de contracção. O papel dos iões cálcio e das moléculas de ATP
5 – Contracção isométrica e isotónica
6 – Fibras musculares tipo I e tipo II.
7 - A forma dos músculos.
8 - Inserção muscular. Tendão, Aponevrose e Fáscia.
Bibliografia:
1
- Williams PL, Warwick R. Gray’s Anatomy. 38th
Edition. Edinburgh: Churchill Livingstone; 1995. p. 737 - 788.
2 - Junqueira LC, Carneiro J. Histologia Básica. 10ª Edição. Rio de Janeiro: Guanabara Koogan; 2004. p. 185-205.
3 - Kierszenbaum AL. Histologia e Biologia Celular. Uma Introdução à Patologia. Rio de Janeiro: Elsevier; 2004. p. 189-211.
4 – Murray RK, Granner DK, Mayes PA, Rodwell VW. Harper`s Illustrated Biochemistry. 36th. New York: Lange Medical Books/Mc Graw Hill; 2003.
p. 556-579.
5 – Geeves MA, Holmes KC. Structural Mechanism of Muscle Contraction. Annual Review of Biochemistry. 1999: 68: 687-728.
SISTEMA MUSCULAR I
I – INTRODUÇÃO
Anatomo-Histo-Fisiologia I
2008-2009
Cristina Teixeira
2
Se as células fossem apenas sacos de citoplasma teriam uma forma esférica, no entanto, há muitas células que não
assumem esta forma porque possuem um esqueleto interno proteico, o citoesqueleto. Além disso, porque alguns
elementos do citoesqueleto têm a capacidade de alterar o seu comprimento, a célula pode alterar a sua forma e esta
capacidade permite à célula desempenhar determinadas funções, nomeadamente a fagocitose.
A alteração da forma da célula é consequência das alterações numa variedade de sistemas proteicos do citoesqueleto. Algumas proteínas filamentosas, como por exemplo a tubulina, alteram o seu comprimento pela adição e
subtração de unidades ao filamento proteico através de um processo controlado de polimerização e despolimerização.
Outros sistemas proteicos, actualmente referidos como motores moleculares, podem alterar o seu comprimento de uma
forma muito rápida utilizando energia sob a forma de ATP, destes sistemas proteicos, o predominante é o conjunto actinamiosina.
Nas células musculares, os filamentos de actina e miosina são tão abundantes que preenchem praticamente todo o
interior da célula. Estas proteínas filamentosas das células musculares apresentam-se alinhadas numa determinada
direcção, por isso, as interacções ao nível molecular levam ao encurtamento de toda a célula, a contracção. Sendo os
músculos conjuntos de células musculares com esta capacidade de encurtamento, entende-se que cada músculo é uma
máquina que transforma a energia química em trabalho mecânico, cujas forças resultantes movimentam os membros,
expandem os pulmões, bombeiam o sangue. No organismo humano, o tecido muscular corresponde entre 40 a 50% da
1
massa corporal .
II - HISTOLOGIA MUSCULAR
1
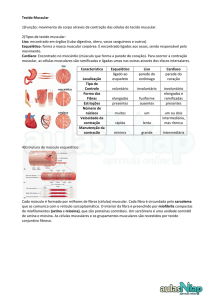
O tecido muscular é constituído por células alongadas, as células musculares, fibras musculares ou miócitos , com
uma grande quantidade de filamentos proteicos no seu citoplasma. A origem destas células é mesodérmica e a sua
1, 2
diferenciação ocorre pela síntese de proteínas filamentosas, concomitante ao alongamento celular
.
As fibras musculares são células de tal forma diferenciadas que os seus componentes adquirem nomenclatura especial.
Assim, a membrana plasmática designa-se sarcolema, o citoplasma designa-se sarcoplasma, o retículo endoplasmático liso
designa-se retículo sarcoplasmático, as mitocôndrias designam-se sarcossomas
1, 2
.
A aparência microscópica e a funcionalidade do tecido muscular é variável, o que permite dividir o tecido muscular em
diferentes grupos. Os miócitos podem apresentar ou não estriação transversal, no primeiro caso o tecido muscular designa-se
1, 2, 3
estriado, no segundo caso designa-se não estriado ou liso
.
O tecido muscular estriado pode estar organizado em grandes grupos de fibras musculares muito longas, constituindo os
músculos, inseridos nos elementos do esqueleto. Funcionalmente, os músculos são responsáveis pela mobilização dos
elementos esqueléticos onde estão inseridos, por conseguinte responsáveis pelo movimento do corpo, esta forma de tecido
muscular designa-se tecido muscular estriado esquelético. O tecido muscular estriado pode estar organizado numa rede de
miócitos ramificados interligados de modo a funcionarem como uma unidade. Porque esta forma de tecido muscular só é
encontrado no coração, designa-se tecido muscular estriado cardíaco
1, 2, 3
.
O tecido muscular liso é constituído por fibras musculares fusiformes, sem estriação transversal, normalmente
localizadas nas paredes das estruturas tubulares e vísceras ocas do organismo. Funcionalmente são responsáveis por alterar o
1, 2, 3
diâmetro do lúmen tubular, sem que haja controlo consciente desta actividade
.
III - O MÙSCULO ESTRIADO ESQUELÉTICO
1 – Organização do Músculo
Anatomo-Histo-Fisiologia I
2008-2009
Cristina Teixeira
3
Num músculo, as fibras musculares estão organizadas em grupos de feixes de fibras musculares, sendo o conjunto de
feixes envolvido por uma membrana externa de tecido conjuntivo, o epimísio. Do epimísio partem septos muito finos de tecido
conjuntivo que separam, entre si, os feixe de fibras musculares, estes septos constituem o perimísio. Cada fibra muscular, por
sua vez, é envolvida por uma camada muito fina de tecido conjuntivo, com predominância de fibras reticulares, formando o
endomísio que é tecido conjuntivo que preenche os espaços intercelulares
1, 2, 3
.
O tecido conjuntivo mantém as fibras musculares unidas e, por seu intermédio, a força da contracção do músculo é
transmitida aos tendões e aos ossos. Além disso, os vasos sanguíneos penetram no músculo através dos septos de tecido
2
conjuntivo e formam uma exuberante rede de capilares entre as fibras musculares .
2 – Aspectos Citológicos da Fibra Muscular Estriada Esquelética
Cada célula do músculo esquelético, designada fibra muscular estriada esquelética, é uma célula muito longa,
cilíndrica e multinucleada, com um diâmetro que varia entre 10 a 100 micrómetros e um comprimento que varia entre alguns
milímetros e vários centímetros. Os vários núcleos, localizados perifericamente, ocupam uma fina orla de sarcoplasma na
1
vizinhança do sarcolema .
A característica ultra-estrutural dominante da fibra muscular estriada esquelética é a presença, no sarcoplasma, de
proteínas filamentosas, organizadas em estruturas cilíndricas, cada cilindro com cerca de 1 a 2 micrómetros de diâmetro
2
percorrendo logitudinalmente a célula . Cada um destes feixes constitui a miofibrila
1, 2
. Ao longo da miofibrila é visível a
estriação transversal, de elevado significado funcional e que reflecte a organização das proteínas filamentosas em unidades que
1, 2
se repetem ao longo da miofibrila, os sarcómeros
, cada um deles com 2,2 micrómetros de comprimento na fibra muscular
1
relaxada .
Apesar das miofibrilas serem a característica dominante em microscopia electrónica, a fibra muscular contém organelos
essenciais para a função celular, nomeadamente mitocôndrias e retículo endoplasmático liso ou retículo sarcoplasmático. A
membrana plasmática ou sarcolema, apresenta inúmeras invaginações tubulares para o interior da célula, que penetram no
sarcoplasma entre miofibrilas, segundo o plano transverso, envolvendo-as. Cada uma destas invaginações do sarcolema é
designada túbulo transverso ou túbulo T do sarcolema, constituindo no seu conjunto, o sistema tubular ou sistema T do
sarcolema. O retículo sarcoplasmático da fibra muscular é exuberante e tem como função armazenar iões cálcio. Consiste de
grandes cisternas interligadas por um plexo de canais. De cada lado do túbulo T do sarcolema há uma cisterna de retículo
sarcoplasmático, este conjunto constitui a tríade muscular, um conjunto de três elementos (um túbulo T do sarcolema e duas
cisternas de retículo sarcoplasmático)
1, 2
.
Utilizando microscopia de polarização as estrias transversais são resultantes de uma alternância de bandas claras e
bandas escuras, ao longo de cada miofibrila. As bandas escuras, também designadas bandas anisotrópicas ou bandas A
resultam de uma alteração do estado de polarização da luz incidente, por outro lado, as bandas mais claras, também
designadas bandas isotrópicas ou bandas I, resultam da não alteração do feixe de luz polarizada
1, 2
. Cada banda clara ou
banda I é transversalmente dividida em duas semi-bandas por uma linha muito escura a linha Z, banda Z ou disco Z, que
aparece de forma repetitiva ao longo da miofibrila separando entre si sarcómeros vizinhos
1, 2
.
Com microscopia electrónica cada sarcómero aparece constituído por dois tipos de filamentos proteicos: os filamentos
espessos de miosina, com cerca de 15 nanómetros de diâmetro e os filamentos finos, de actina, com cerca de 9 nanómetros
1
de diâmetro .
A banda I é formada unicamente por filamentos de actina. A linha Z representa a zona de inserção e união de filamentos
de actina de dois sarcómeros consecutivos. A banda A é constituída por filamentos de miosina. Num e noutro extremo da banda
A, os filamentos de miosina estão intercalados com filamentos de actina. Na fibra muscular relaxada, os filamentos de actina
1, 2
não penetram no centro da banda A, portanto, no centro há apenas filamentos de miosina, correspondendo à banda H
. No
1
centro da banda H, os filamentos de miosina estão ligados por material colocado transversalmente, constituindo a linha M .
Cada sarcómero é a distância entre duaslinhas Z consecutivas. No centro do sarcómero está a banda A com a banda H
no seu centro e em cada extremidade do sarcómero está uma semi-banda I (metade da banda I)
Anatomo-Histo-Fisiologia I
2008-2009
1, 2
.
Cristina Teixeira
4
1.3 – Os Filamentos de Actina e de Miosina
4
A miosina corresponde a 55% da proteína do músculo . Cada filamento de miosina é constituído por várias unidades, as
2
moléculas de miosina . Cada molécula de miosina apresenta uma haste filamentosa e uma dupla estrutura globular, num dos
extremos da haste que constitui a cabeça da molécula de miosina
2, 4
. Constitucionalmente, a molécula de miosina é um
hexâmero formado por um par de cadeias pesadas e dois pares de cadeias leves. O par de cadeias pesadas é constituído por
duas cadeias polipeptídicas enroladas em dupla hélice que divergem numa das extremidades e, nesta extremidade, cada
cadeia polipeptídica apresenta uma estrutura globular. Cada par de cadeias leves coloca-se junto de uma das estruturas
1, 4
globulares da dupla hélice
.
Quando a molécula de miosina é degradada com tripsina (enzima proteolítica) aparecem dois fragmentos proteicos, a
meromiosina leve, constituída pela maior parte da haste e a meromiosina pesada, constituída pelas duas porções globulares
e uma pequena porção da haste
1, 2, 4
. A porção globular da meromiosina pesada (subfragmento S1) tem actividade ATPásica e
uma grande afinidade química para os filamentos de actina. A porção filamentosa da meromiosina pesada (subfragmento S2) é
uma ligação não extensível entre a cabeça da molécula de miosina e a haste, mas com pontos flexíveis em cada extremo,
permitindo que a cabeça da molécula rode, alterando a sua configuração
1, 4, 5
.
As moléculas de miosina estão dispostas nos filamentos espessos, de tal forma, que as hastes ficam em feixe, paralelas
2
umas às outras e as cabeças ficam voltadas para fora do feixe . No centro do filamento espesso de miosina não há estruturas
globulares, estas aparecem apenas nos extremos do filamento de miosina, precisamente nos locais onde os filamentos de
1
miosina ficam intercalados com os filamentos de actina .
Cada filamento de actina é uma estrutura filamentosa, actina F, formada por duas cadeias polipeptídicas, entrelaçadas,
cada uma delas, constituída por monómeros de actina globular (actina G). No sulco entre as duas cadeias polipeptídicas,
encontra-se uma outra proteína filamentosa, a tropomiosina, constituída por duas cadeias polipeptídicas enroladas em hélice.
Ao longo da molécula de tropomiosina, aparecem de forma regularmente espaçada os complexos de troponina. Cada um
destes complexos é constituído por três subunidades proteicas, uma delas com grande afinidade para o ião cálcio (troponina C),
outra que se liga à tropomiosina (troponina T) e, ainda outra, que impede a interacção actina-miosina (troponina I)
2, 3, 4
.
1.4 – Outras Proteínas Associadas às Miofibrilas
Para além dos filamentos de miosina e actina, há uma série de proteínas associadas às miofibrilas, responsáveis pela
integridade estrutural das miofibrilas. Os discos Z e as linhas M que aparecem ao longo das miofibrilas são, essencialmente,
locais onde aparecem proteínas diversas que permitem a inserção dos filamentos de actina e a conexão de filamentos de
miosina, respectivamente
1, 3
.
A desmina é uma outra proteína que liga diferentes miofibrilas, permitindo o perfeito alinhamento entre sarómeros de
miofibrilas diferentes
1, 3
.
A distrofina é uma proteína confinada à periferia da fibra muscular, situada próximo da face interna do sarcolema. Está
ligada por uma das extremidades a grandes complexos glicoproteicos que atravessam o sarcolema e que estão ligados a
proteínas da matriz extracelular. A extremidade oposta da distrofina está ligada a filamentos de actina F. Desta forma, a
distrofina parece contribuir para transmitir força mecânica ao sarcolema, permite a ancoragem do citoesqueleto ao sarcolema e
à matriz extracelular
1, 3, 4
.
Aplicação de conhecimentos: A mutação do gene que codifica a distrofina causa deterioração estrutural e funcional
que caracteriza as distrofias musculares, nomeadamente a distrofia muscular de Duchenne
1, 2, 3, 4
. Estas patologias
3
caracterizam-se por fraqueza muscular e atrofia .
3 – O Mecanismo de Contracção da Fibra Muscular Estriada Esquelética
Anatomo-Histo-Fisiologia I
2008-2009
Cristina Teixeira
5
O sarcómero em repouso (músculo relaxado) consiste de filamentos de miosina e filamentos de actina que se sobrepõem
parcialmente. A contracção é o encurtamento do sarcómero, aproximando linhas Z contíguas. Este processo não se deve ao
encurtamento dos filamentos de actina e/ou miosina, mas sim a um aumento da sobreposição entre filamentos de actina e
miosina
1, 2
.
A contracção da fibra muscular depende da formação de pontes de miosina que ciclicamente interagem com os
filamentos de actina, obrigando ao seu deslizamento e durante este processo ocorre hidrólise de ATP
1, 5
. As pontes de miosina
destacam-se para fora do filamento de miosina, em cada extremidade desse filamento, precisamente nos locais onde há
1
sobreposição de filamentos de actina e miosina . A ponte de miosina, corresponde à meromiosina pesada e pode ser clivada em
dois subfragmentos S1 com estrutura globular e S2 com estrutura filamentosa. É uma máquina molecular com unidades
funcionais em comunicação: no subfragmento S1 está o local de ligação à actina e o local de ligação e hidrólise do ATP, o
fragmento S2 é a porção filmentosa, o braço da molécula de miosina que funciona como alavanca que amplifica as pequenas
5
alterações ocorridas no fragmento S1 em grandes alterações que permitem o arrastamento do filamento de actina .
A teoria para a contracção muscular considera a ligação do subfragmento S1 ao filamento de actina e a sua actividade
ATPásica como factores fulcrais. No entanto, pressupõe ainda que a ponte de miosina liga-se ao filamento de actina com uma
determinada configuração que é subitamente alterada mediante um movimento giratório responsável por empurrar o filamento
5
de actina .
3.1 - Etapas ou Fases do Mecanismo de Contracção
No músculo em repouso (fase de relaxamento), os complexos de troponina situados ao longo da molécula de
tropomiosina inibem a interacção actina-miosina porque os locais da actina F com afinidade para miosina estão bloqueados,
inacessíveis. Esta inibição é concretizada través das subunidades Tp I dos complexos troponina, as quais provavelmente
arrastam a tropomiosina, colocando-a sobre os locais de actina F que apresentam grande afinidade para o subfragmento S1 da
4
molécula de miosina, tornando estes locais inacessíveis .
Na fibra muscular em repouso, o fragmento S1 da molécula de miosina liga-se à molécula de ATP e, porque tem
actividade ATPásica, o ATP é hidrolisado em ADP e fosfato inosrgânico (Pi) que permanecem ligados ao fragmento S1.
4
Constitui-se o complexo miosina-ADP-Pi, altamente energético .
Os neurónios motores são células nervosas que conduzem estímulos sob a forma de potenciais de acção às fibras
musculares esqueléticas, levando à despolarização do sarcolema. Através do sistema de túbulos transversais do sarcolema a
onda de despolarização difunde-se para o interior da fibra muscular. Devido à proximidade entre túbulos T do sarcolema e as
cisternas do retículo sarcoplasmático (tríade), a onda de despolarização atinge a membrana do retículo sarcoplasmático o que
leva à abertura de canais para o ião cálcio localizados nesta membrana. O ião cálcio, extremamente concentrado nas cisternas
do retículo sarcoplasmático, difunde-se para o sarcoplasma
2, 4
.
Os iões cálcio têm uma grande afinidade para a subunidade TpC do complexo troponina. A ligação dos iões cálcio a
estes complexos altera todo o complexo troponina, alterando a sua ligação à tropomiosina. Desta forma a tropomiosina move-se
do local habitual, desbloqueando os locais da actina F com grande afinidade para a miosina. Assim, em presença de iões cálcio
no sarcoplasma torna-se possível a ligação da subunidade S1 da molécula de miosina ao filamento de actina
2, 4
.
Quando os locais da actina F com afinidade para a miosina ficam acessíveis, os fragmentos S1 da molécula de miosina,
4
sob a forma de complexos miosina-ADP-Pi, ligam-se ao filamento de actina constituindo o complexo actina-miosina – ADP-Pi .
A formação deste complexo promove a libertação dos produtos de hidrólise do ATP, primeiro o Pi e de seguida o ADP. A
libertação destes produtos é acompanhada de uma alteração da posição da porção globular (subfragmento S1) em relação à
porção filamentosa (subfragmento S2). Ocorre um movimento de rotação do subfragmento S1, arrastando o filamento de actina
ao qual está ligado em direcção ao centro do sarcómero, por uma distância que pode atingir 10 nanómetros
1, 4
.
A ligação do subfragmento S1 da molécula de miosina a uma nova molécula de ATP faz baixar a afinidade da miosina à
actina, a actina é libertada. Um novo ciclo começa quando a molécula de ATP é hidrolisada no fragmento S1 da molécula de
Aplicação de conhecimentos: A ligação de uma nova molécula de ATP ao subfragmento S1 da molécula de miosina é
fundamental para que a actina seja libertada e ocorra relaxamento. Se o nível de ATP intracelular baixar drasticamente,
Anatomo-Histo-Fisiologia I
2008-2009
Cristina Teixeira
por exemplo em caso de morte celular, o fragmento S1 da molécula de miosina permanece fortemente ligado ao
filamento de actina, situação que explica o estado de rigidez muscular, rigor mortis, observado no cadáver
1, 4, 5
.
6
miosina, forma-se o complexo miosina-ADP-Pi que se liga ao filamento de actina
1, 4
. Todo o ciclo se repete vezes sucessivas,
2
enquanto houver iões cálcio no sarcoplasma e, portanto, os locais de actina F com afinidade para a miosina estão acessíveis .
Os eventos químicos e mecânicos que caracterizam o processo de contracção muscular causam deslizamentos dos
filamentos de actina em direcção ao centro do sarcómero, aumentando gradualmente a sobreposição entre filamentos de actina
e miosina. O resultado é o encurtamento das bandas I e H, com
1, 2
encurtando os sarcómero
consequente
aproximação
de
discos
Z
consecutivos,
2
. Porque os sarcómeros encurtam toda a fibra muscular encurta .
Quando termina a despolarização do sarcolema promovida pelos neurónios motores, a membrana do retículo
sarcoplasmático, por transporte activo, retira os iões cálcio do sarcoplasma, armazenado-os no interior das cisternas. A
2
ausência de iões cálcio no sarcoplasma interrompe a actividade contráctil .
IV - TENDÕES, APONEVROSES E FÁSCIAS
Tendões são parte integrante do músculo, são formados por feixes compactos de fibras de colagénio paralelas
entre si, que permitem a inserção do músculo à estrutura óssea. Têm forma de corda ou tira com secção redonda ou oval. São
estruturas muito resistentes à tensão. Os tendões têm pouco número de capilares. Tecido conjuntivo areolar penetra entre os
feixes de fibras para providenciar aporte sanguíneo e nervoso.
Aponevroses são constituídos por várias camadas de fascículos largos de fibras de colagénio colocadas
paralelamente entre si, na mesma camada, mas com diferentes direcções entre camadas. As aponevroses estão associadas à
inserção muscular, não são mais que tendões muito largos.
Fáscias são camadas de tecido conjuntivo que cobrem as superfícies musculares separando os diferentes
músculos entre si. Células adiposas podem acumular-se em alguns pontos das fáscias, principalmente nas regiões superficiais
entre a pele e os músculos. Sob a derme encontra-se a fáscia superficial que a separa dos músculos subjacentes.
Bibliografia:
1
- Williams PL, Warwick R. Gray’s Anatomy. 38th
Edition. Edinburgh: Churchill Livingstone; 1995. p. 737 - 788.
2 - Junqueira LC, Carneiro J. Histologia Básica. 10ª Edição. Rio de Janeiro: Guanabara Koogan; 2004. p. 185-205.
3 - Kierszenbaum AL. Histologia e Biologia Celular. Uma Introdução à Patologia. Rio de Janeiro: Elsevier; 2004. p. 189-211.
4 – Murray RK, Granner DK, Mayes PA, Rodwell VW. Harper`s Illustrated Biochemistry. 36th. New York: Lange Medical Books/Mc Graw Hill; 2003.
p. 556-579.
5 – Geeves MA, Holmes KC. Structural Mechanism of Muscle Contraction. Annual Review of Biochemistry. 1999: 68: 687-728.
Anatomo-Histo-Fisiologia I
2008-2009
Cristina Teixeira