FISIOLOGIA DO SISTEMA RESPIRATÓRIO
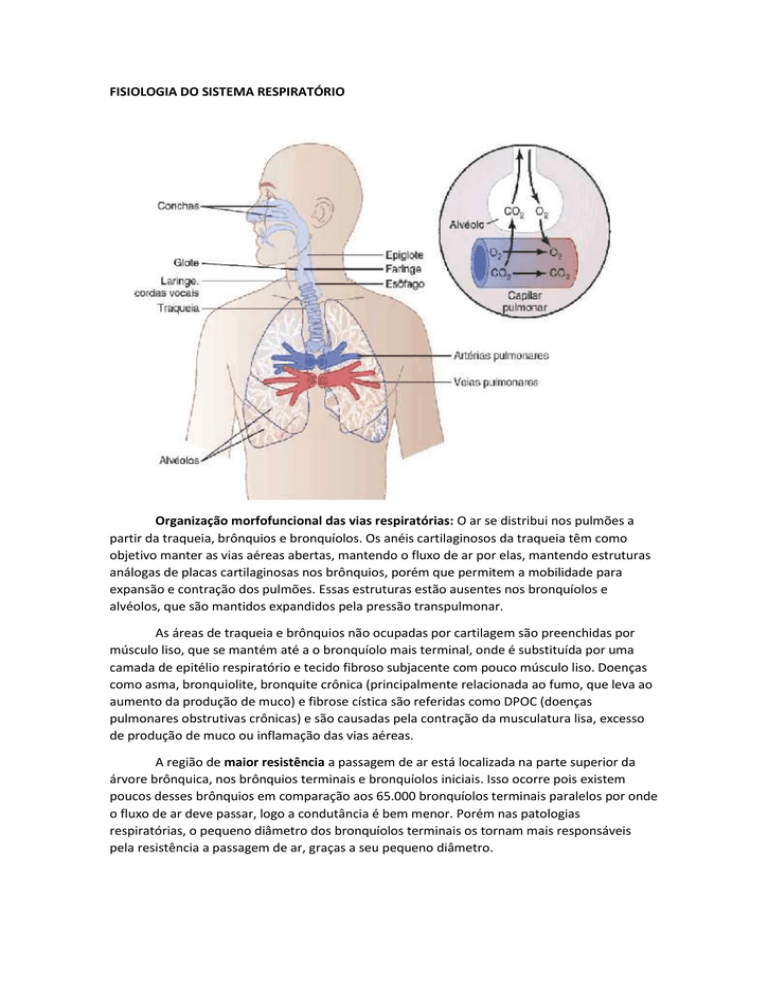
Organização morfofuncional das vias respiratórias: O ar se distribui nos pulmões a
partir da traqueia, brônquios e bronquíolos. Os anéis cartilaginosos da traqueia têm como
objetivo manter as vias aéreas abertas, mantendo o fluxo de ar por elas, mantendo estruturas
análogas de placas cartilaginosas nos brônquios, porém que permitem a mobilidade para
expansão e contração dos pulmões. Essas estruturas estão ausentes nos bronquíolos e
alvéolos, que são mantidos expandidos pela pressão transpulmonar.
As áreas de traqueia e brônquios não ocupadas por cartilagem são preenchidas por
músculo liso, que se mantém até a o bronquíolo mais terminal, onde é substituída por uma
camada de epitélio respiratório e tecido fibroso subjacente com pouco músculo liso. Doenças
como asma, bronquiolite, bronquite crônica (principalmente relacionada ao fumo, que leva ao
aumento da produção de muco) e fibrose cística são referidas como DPOC (doenças
pulmonares obstrutivas crônicas) e são causadas pela contração da musculatura lisa, excesso
de produção de muco ou inflamação das vias aéreas.
A região de maior resistência a passagem de ar está localizada na parte superior da
árvore brônquica, nos brônquios terminais e bronquíolos iniciais. Isso ocorre pois existem
poucos desses brônquios em comparação aos 65.000 bronquíolos terminais paralelos por onde
o fluxo de ar deve passar, logo a condutância é bem menor. Porém nas patologias
respiratórias, o pequeno diâmetro dos bronquíolos terminais os tornam mais responsáveis
pela resistência a passagem de ar, graças a seu pequeno diâmetro.
A árvore brônquica é exposta a NE e epinefrina liberadas pela medula adrenal, que
atuam nessa região sobre receptores betadrenérgicos, causando a dilatação da árvore
brônquica. Poucas fibras parassimpáticas penetram no parênquima pulmonar, sendo
responsáveis pela constrição leve a moderada dos bronquíolos. Porém, em doenças
musculares autoimunes (como miastenia gravis e asma) que provoquem a contração dessa
musculatura, a estimulação parassimpática pode levar a oclusão dos bronquíolos, sendo
utilizado, nesses casos, antagonistas de acetilcolina (como a atropina) para o tratamento.
Esses nervos parassimpáticos também são ativos por reflexos originados nos pulmões que
começas com a irritação do epitélio respiratório por gases nocivos, poeira, fumaça de cigarro e
microêmbolos nas artérias pulmonares.
Reações alérgicas também estimulam a liberação de histamina e substância de reação
lenta a anafilaxia pelos mastócitos dos tecidos pulmonares. Elas podem ser provocadas por
doenças como a asma ou pelas outras substâncias irritantes que causam respostas reflexas no
parassimpático.
O epitélio respiratório recobre toda a região das vias aéreas, do nariz aos brônquios.
Suas células caliciformes são as responsáveis pela produção de muco, que aprisiona pequenas
partículas presentes no ar. Os cílios desse epitélio batem de 10 a 20x na direção da faringe,
levando o muco para o esôfago, onde ele é deglutido ou eliminado pela tosse.
Os brônquios e a traqueia são sensíveis a irritações, especialmente na laringe e na
carina (onde a traqueia se divide nos brônquios). Os impulsos aferentes são levados
principalmente pelo nervo vago até o centro respiratório bulbar, que inicia a inspiração rápida
de uma grande quantidade de ar, que é aprisionado no pulmão pelo fechamento da epiglote e
cordas vocais, seguida da forte contração dos músculos abdominais e intercostais internos,
que leva ao aumento da pressão intra-pulmonar. A abertura repentina da epiglote e das cordas
vocais faz o ar dos pulmões deslocar-se violentamente em direção ao exterior (a força da
contração dos pulmões colapsa tanto a árvore brônquica quanto a traqueia). O reflexo do
espirro é muito semelhante ao da tosse, exceto pelo fato de que o nervo facial é o que conduz
o estímulo aferente para o bulbo e que a úvula se deprime, permitindo a passagem de grande
quantidade de ar pelas vias nasais.
As vias nasais possuem uma função de condicionamento do ar – são responsáveis por
filtrar, umidificar e equilibrar a temperatura do ar. O ar inalado se eleva por até 0,5 grau
Celsius acima da temperatura corporal e a saturação total com vapor d’água se eleva de 2% a
3%. A filtração do ar ocorre principalmente para partículas com tamanhos superiores a 6
micrômetros. Quase nenhuma das partículas do da fumaça de cigarro, com 0,3 micrômetros,
são precipitadas até atingirem os alvéolos, sendo que até 1/3 delas realmente se precipita pelo
processo de difusão, sendo removidas pelos macrófagos alveolares ou carreadas pelo sistema
linfático. O excesso dessas partículas pode levar ao crescimento de tecido fibroso no septo
alveolar, levando a debilidade permanente.
O interstício pulmonar é geralmente muito pequeno, podendo até não ser discernido
na MO. Porém, em condições patológicas, ele se alarga devido ao influxo de células
inflamatórias e fluido de edema, o que pode interferir nas trocas gasosas. Os fibroblastos estão
presentes em grande quantidade, secretando elastina e colágeno, importantes na morfologia e
fisiologia desse orgão. A cartilagem é um tecido resistente e flexível que suporta as vias aéreas
condutoras e 80% da traqueia, desaparecendo ao nível dos bronquíolos. Além da cartilagem, o
epitélio respiratório repousa sobre músculatura lisa que podem se contrair ou dilatar de
acordo com os estímulos mecânicas, químicos ou irritativos. As células de Kultschitzky são
células neuroendócrinas encontradas em toda a extensão da árvore traqueobrônquica e
secretam aminas biogênicas, como serotonina e dopamina.
O pulmão possui uma circulação dupla, realizada pela veia pulmonar, que carrega o
sangue oxigenado para o átrio esquerdo (que são capazes de controlar o débito ventricular
esquerdo mesmo com o variável fluxo arterial pulmonar devido a sua camada de músculo liso,
que realiza a variação ativa da resistência ao fluxo), e as artérias brônquicas, geralmente em
número de 3, que dividem-se juntamente com a árvore brônquica e nutrem brônquios,
bronquíolos, vasos, nervos, linfonodos e a maior parte da pleura visceral. As veias brônquicas
também contribuem para a drenagem do pulmão. Na fibrose cística, as artérias brônquicas,
que geralmente recebem apenas 1 a 2% do DC chegam a receber de 10 a 20%. A erosão do
tecido inflamado para esses vasos, secundariamente a infecção bacteriana, provoca a
hemoptise (expectoração com sangue).
As funções de vocalização e fonação também são dependentes das vias aéreas (pregas
vocais).
MECÂNICA VENTILATÓRIA
(1 cmH2O = 0,735 mmHg)
A expansão e contração dos pulmões dá-se principalmente por movimento
diafragmáticos que aumentam ou diminuem a pressão intra-torácica e por elevação e
depressão das costelas, promovendo o deslocamento ântero-posterior da caixa torácica. A
respiração passiva é feita quase inteiramente pela contração do diafragma estimulada pelo
nervo frênico (nervo espinhal – não se relaciona ao SNA). Na contração do diafragma, o
assoalho dos pulmões é puxado para baixo (estão conectados por tecido conjuntivo fibroso
saindo da pleura parietal) e, no seu relaxamento, a retração elástica dos pulmões, parede do
tórax e das estruturas do abdômen comprimem os pulmões e expelem o ar. Durante a
respiração vigorosa, a contração dos músculos abdominais ainda empurra o conteúdo do
abdômen sobre o diafragma, expelindo o ar com mais força.
O movimento de “braço de bomba” realizado pelos músculos do dorso e tórax
também são responsáveis por um aumento de até 20% da caixa torácica na direção anterior.
Os intercostais externos, esternocleidomastoideo, serrátil anterior e escalenos são músculos
que elevam as costelas, sendo responsáveis, portanto, pela inspiração, enquanto os
intercostais internos e o reto abdominal, que deprimem as costelas (e, no caso do reto,
também projetam o conteúdo abdominal sobre o diafragma), auxiliam na expiração.
O pulmão funciona como uma estrutura elástica, que colapsa toda vez que não existe
uma força para mantê-lo inflado, expelindo todo o ar no seu interior. Ele não tem conexão
com a parede da caixa torácica, exceto onde ele encontra-se suspenso no hilo a partir do
mediastino. O pulmão flutua na cavidade do tórax, cercado por uma camada de líquido pleural
que impede seu atrito com a parede, o que poderia levar a inflamações. A sucção constante do
excesso do líquido pleural pelos vasos linfáticos cria uma tração entre a superfície visceral e
parietal da pleura, o que mantém os pulmões numa conformação fixa, porém livres para
deslizarem sobre o líquido. A pressão pleural é uma pressão negativa (pressão que exercida
por forças num sentido convergente) causada pela sucção do líquido pleural, que é de -5
cmH2O em repouso, ou seja, a quantidade de pressão necessária para manter os pulmões
abertos em repouso. Durante a inspiração normal, o aumento do volume pulmonar exige uma
diminuição dessa pressão negativa, que atinge -7,5 cmH2O quando o pulmão aumenta em
0,5L.
Lesões traumáticas perfurantes na região da pleura que levam a formação de um meio
de continuidade com o ar atmosférico caracterizam um quadro de pneumotórax – a entrada
de ar na região da pleura diminui a pressão negativa exercida pela sucção dos vasos linfáticos,
tornando mais difícil a expansão do pulmão e, consequentemente, aumentando a pressão
intra-pulmonar, o que diminui o fluxo de ar para o interior dos alvéolos.
A pressão alveolar é a pressão do ar existente dentro dos alvéolos. Durante o repouso
em que não existe nenhum fluxo de ar, a pressão da traqueia e de toda a árvore brônquica é
de 0 cmH20 (= 1 atm, que é a pressão atmosférica). Para existir fluxo, a pressão deve diminuir
um pouco em relação a da atmosfera (-1 cmH2O já é o suficiente para um fluxo de 0,5L de ar
no tempo de 2s de uma respiração normal). Durante a expiração, ocorre o oposto. A diferença
entre a pressão alveolar e pleural é a pressão transpulmonar.
A complacência pulmonar é o grau de extensão dos pulmões por cada unidade de
aumento da pressão transpulmonar (se tempo suficiente for dado para atingir o equilíbrio). A
complacência total dos pulmões de um adulto normal é de 200 mL/ 1 cmH2O (ou seja, a cada
elevação de 1 cmH2O na pressão transpulmonar, os pulmões se enchem de 200 mL de ar no
período de 10 a 20 segundos). O diagrama das curvas de complacência inspiratória e
expiratória indicam a variação do volume pulmonar em função da mudança da pressão
transpulmonar.
As características desse diagrama são determinadas pelas forças elásticas dos pulmões,
que se dividem em força elástica do tecido pulmonar propriamente dito e forças elásticas
causadas pela tensão superficial do fluido presente na face interna dos alvéolos. As primeiras
são determinadas pelas fibras de elastina e colágeno presentes no parênquima pulmonar, que
já se encontram contraídas nos pulmões em repouso, contraindo ainda mais na inspiração. As
forças elásticas causadas pela tensão superficial são mais complexas, porém basta comparar o
diagrama do pulmão cheio com ar e com solução salina para perceber que a interface do
líquido alveolar com o ar é um requisito importante para manter a boa complacência dos
pulmões (correspondem a um terço das forças elásticas que tendem a provocar o colapso dos
pulmões).
A tensão superficial da água consiste na propriedade dessas moléculas de
organizarem-se em uma fina camada contrátil quando em contato com o meio aéreo, tendo
como resultado geral a produção de uma força elástica de contração. O surfactante é o agente
ativo da superfície da água (ou seja, tem a capacidade de reduzir a tensão superficial da água),
no caso dos alvéolos é uma mistura de vários fosfolipídios (dipalmitoilfosfatidilcolina), íons
cálcio e apoproteínas surfactantes, que não se dissolvem uniformemente no líquido alveolar,
formando uma nova superfície sobre a membrana de água com tensão superficial cerca de ½ a
1/12 vezes menor que a tensão superficial da água. Ele é secretado pelas células alveolares
tipo II, que compõe 10% da superfície alveolar e também são responsáveis pela renovação do
tecido alveolar. O raio do alvéolo também é importante na tensão superficial da água (Pressão
= 2 x TSA / Raio do alvéolo), sendo inversamente proporcional a ela.
A caixa torácica tem suas próprias características elásticas e viscosas, de forma que,
mesmo sem a presença dos pulmões, seria necessário esforço muscular para expandi-la. A
complacência do sistema pulmão-tórax é quase a metade da complacência dos pulmões
isolados (110 mL de ar/ 1 cmH2O) numa respiração de repouso. Além disso, quando os
pulmões estão muito inflados ou comprimidos, as limitações do tórax reduzem essa
complacência para até 1/5 do valor da complacência dos pulmões isoladamente. O trabalho
necessário para realizar a inspiração divide-se em três frações – o trabalho para superar as
forças elásticas do pulmão e tórax (complacência); o trabalho necessário para sobrepujar a
resistência aérea ao movimento de ar para os pulmões; o trabalho necessário para superar a
viscosidade pulmonar e torácica.
O registro das mudanças no volume pulmonar é realizado por um aparelho
denominado espirômetro. Os volumes pulmonares dividem-se em 4 tipos:
o volume corrente – volume de ar inspirado ou expirado, em cada respiração normal
(cerda de 500 mL no adulto);
o volume de reserva inspiratório – volume extra de ar que pode ser inspirado, além do
volume corrente, quando a pessoa inspira com força total (cerca de 3000 mL);
o volume de reserva expiratório – é o máximo volum de ar que pode ser expirado na
expiração forçada, após a expiração corrente (cerca de 1100 mL);
o volume residual – volume de ar que fica nos pulmões após expiração forçada (cerca
de 1200mL).
As capacidades pulmonares são combinações entre dois ou mais volumes:
a capacidade inspiratória – volume corrente + volume de reserva inspiratório,
quantidade total de ar que pode ser inspirado partindo do nível corrente (cerca de 3500 mL);
a capacidade residual funcional – volume de reserva expiratório + volume residual , é a
quantidade de ar que permanece nos pulmões após uma respiração normal (cerca de 2300
mL)
a capacidade vital – volumes de reserva inspiratório e expiratório + volume corrente, é
a quantidade máxima de ar que pode ser expelida dos pulmões após a inspiração da
quantidade máxima de ar (cerca de 4600 mL).
a capacidade pulmonar total – capacidade vital + volume residual, volume máximo que
os pulmões podem se expandir (cerca de 5800 mL).
Essas capacidades podem variar, sendo geralmente de 20%-25% menores nas
mulheres, e maiores em pessoas atléticas e com massas corporais maiores. Para facilitar o
estudo, algumas siglas foram criadas para facilitar as expressões algébricas:
CV = Vc + VRE + VRI
CV = CI + VRE
CPT = CV + VR
CPT = CI + CRF
A capacidade residual funcional, que é o volume de ar que permanece nos pulmões a
cada expiração normal, é importante para a função pulmonar, podendo variar em alguns tipos
de patologia. Para medir essa capacidade, o espirômetro é utilizado de maneira indireta,
através de uma mistura do ar em seu interior com gás hélio, em concentração conhecida.
O produto do volume corrente pela frequência respiratória por minuto corresponde a
quantidade total de ar que é levado para o interior das vias respiratórias a cada minuto. O
volume corrente normal é de 0,5L e a frequência de 12 respirações por minuto, portanto, a
ventilação-minuto é, em média, 6L/min. Em casos extremos, a frequência respiratória pode ir
até 40-50 ventilações por minuto, enquanto o volume corrente pode se tornar tão grande
quanto a capacidade vital, cerca de 4600 mL, gerando uma ventilação-minuto de 200L/min,
porém a maioria das pessoas não consegue sustentar esse ritmo por mais de 1 minuto.
A velocidade/intensidade com que o ar novo alcança os bronquíolos respiratórios,
sacos e ductos respiratórios é chamada de ventilação alveolar. O ar do espaço morto é aquele
que não atinge o nível dos bronquíolos respiratórios, situando-se no nariz, faringe e traqueia.
Ele dificulta a remoção de gases expiratórios dos pulmões. Ele pode ser medido através de um
método simples, onde o indivíduo inspira oxigênio puro, preenchendo o espaço morto com
esse gás e, logo em seguida, expira em um medidor de nitrogênio de registro rápido.
Inicialmente, enquanto o volume do espaço morto estiver sendo captado, a concentração do
nitrogênio será baixa. Porém, quando o ar alveolar começa a chegar ao medidor, essa
concentração aumenta até atingir um pico, quando todo o ar do espaço morto já foi eliminado.
No adulto, o espaço morto tem 150 mL de ar, aumentando com a idade.
A intensidade da ventilação alveolar é o volume total de ar novo que entra nos
alvéolos e áreas adjacentes de troca respiratória a cada minuto. É igual ao produto da
frequência respiratória pela diferença do volume corrente e do volume do espaço morto: VA =
Freq x (VC – VM) (logo, ele é = 12 x (500 – 150) = 4200 L/min no adulto). É um dos fatores
determinantes nas trocas gasosas.
CIRCULAÇÃO PULMONAR, EDEMA PULMONAR E LÍQUIDO PLEURAL
O pulmão possui dupla circulação, a circulação de alta pressão e baixo fluxo, que supre
a traqueia e árvore brônquica, incluindo bronquíolos terminais, o interstício pulmonar,
vasculatura e nervos com sangue sistêmico das artérias brônquicas (ramos da aorta torácica) e
a circulação de baixo pressão e fluxo elevado que leva sangue venoso de todas as regiões do
corpo para os capilares alveolares pela artéria pulmonar. A veia pulmonar drena esses leitos
para o ventrículo esquerdo, onde ele será redistribuído pela aorta para o resto do corpo.
A artéria pulmonar tem uma espessura bem pequena (seu diâmetro, portanto, é
aumentado) e possui ramos muito curtos e distensíveis, o que confere a ela e seus ramos uma
grande complacência, permitindo que ela acomode o volume sistólico do VD. As veias
pulmonares também são curtas. As artérias brônquicas são responsáveis por 1 a 2% do DC,
que irrigam o interstício pulmonar e os grandes e pequenos brônquios. Ela é drenada pelas
veias pulmonares e, portanto, entra no átrio esquerdo diretamente, o que leva ao DC ser de 1
a 2% maior no lado esquerdo do coração.
Os vasos linfáticos estão presentes em todo o tecido de suporte pulmonar e drenam
principalmente para o ducto linfático torácico direito. Partículas que chegam aos alvéolos são
parcialmente removidas por esses canais (poeira, fumaça de cigarro), assim como as proteínas
plasmáticas que escapam da circulação pulmonar, ajudando a prevenir um edema pulmonar.
Durante a sístole, a pressão na artéria pulmonar é essencialmente igual a do VD.
Entretanto, após o fechamento da valva pulmonar, a pressão cai vertiginosamente no
ventrículo e cai mais lentamente na artéria pulmonar, conforme o sangue flui pelos capilares
pulmonares. A pressão arterial pulmonar sistólica é de 25mmHg (igual a pressão do VD na
sístole), e a diastólica de 8mmHg logo após a sístole (maior que a do ventrículo, que é de
1mmHg), logo a pressão arterial pulmonar média é de 15mmHg. A pressão no átrio esquerdo e
nas principais veias pulmonares é de cerca de 2mmHg, podendo variar de 1 a 5mmHg.
O pulmão possui um volume sanguíneo de 450 mL (9% do DC normal), sendo que
70mL localizam-se em capilares pulmonares, enquanto o restante divide-se igualmente entre
artérias e veias pulmonares. Esse valor pode variar da metade até o dobro, em condições
fisiológicas ou patológicas (ex: soprar o ar com força ao tocar trompete aumenta a pressão
dento dos pulmões, podendo lançar até 250 mL do sangue pulmonar na circulação sistêmica).
Patologias cardíacas envolvendo a insuficiência do lado esquerdo do coração ou resistência ao
fluxo sanguíneo na válvula mitral podem levar ao acúmulo de sangue nos pulmões e aumento
exacerbado da pressão nos vasos pulmonares. O sangue pulmonar pode ser desviado para a
circulação sistêmica também em casos de hemorragias.
O fluxo sanguíneo nos pulmões é essencialmente igual ao DC, e ele se redistribui
através de mecanismos de vasoconstrição/dilatação para as regiões com maior quantidade de
ar oxigenado, ou seja, quando um a concentração de O2 no interior dos alvéolos cai abaixo do
normal, os vasos sanguíneos adjacentes se contraem (ao contrário da circulação sistêmica !),
dado a atividade de uma substância vasoconstritora secretada pelo epitélio respiratório,
aumentando em até 5x a RVP, permitindo que o sangue flua para alvéolos que possuem maior
pressão parcial de O2. Esse efeito ainda leva em conta a pressão hidrostática atuando sobre o
sangue do indivíduo numa posição ortostática, que tem uma diferença de acordo com a altura
em que o vaso se localiza. O pulmão, do ápice à base, tem 30 cm de altura (ocasionando uma
diferença de 23mmHg entre esses dois pontos), sendo que a pressão na região acima do
coração é 15mmHg menor do que a dos vasos ao nível desse orgão, e na região abaixo é de
8mmHg maior.
Para facilitar o entendimento, dividiu-se o pulmão em 3 principais zonas: Zona 1 –
ausência de fluxo sanguíneo durante todo o ciclo cardíaco => ocorre pois a pressão capilar
alveolar nessa área nunca se eleva acima da pressão do ar alveolar; Zona 2 – fluxo sanguíneo
intermitente => ocorre somente durante a pressão sistólica pulmonar, que supera a pressão
do ar alveolar, porém na diastólica ela continua inferior; Zona 3 – fluxo contínuo => ocorre pois
a pressão nos capilares alveolares é sempre maior que a do ar alveolar. Essas zonas levam em
conta também o aumento da pressão do ar nos alvéolos pulmonares, que se forem superiores
a do capilar, interrompem o fluxo.
Normalmente os pulmões só têm zonas de fluxo 2, nos ápices, e 3, nas áreas inferiores,
no indivíduo em pé. Ex: a pressão no ápice do pulmão é 15mmHg inferior a pressão à nível do
coração, ou seja, é de 10mmHg (25mmHg da pressão da artéria pulmonar – 15mmHg), sendo
superior a pressão do ar alveolar sobre o intersticio (0 cmH2O na ausência de fluxo). Porém,
conforme o fluxo passa e a sístole acaba, a pressão na artéria pulmonar cai, restando apenas o
efeito da pressão hidrostática. Inicia-se a diástole, que exerce uma pressão de 8mmHg incapaz
de vencer a pressão hidrostática de 15mmHg no ápice do pulmão, criando um fluxo
intermitente. Aproximadamente 10cm acima do coração, o componente da pressão
hidrostática já é o suficiente para vencer a pressão alveolar sobre o interstício, ou seja, a
pressão é constantemente maior do que a alveolar, criando apenas zonas 3. Quando a pessoa
está em decúbito, todos os alvéolos tornam-se zona 3.
A zona 1 ocorre sob condições anormais, como quando a pessoa respira contra
pressão de ar positiva, de modo que a pressão alveolar seja 10mmHg maior do que a normal, o
que causa a formação de zonas 1 no ápice do pulmão, ou quando a pessoa, em posição ereta,
possui baixa pressão arterial pulmonar sistólica (pode ser ocasionado por uma hemorragia).
Durante o exercício físico, o fluxo na região superior dos pulmões pode aumentar de 7
a 8 vezes, enquanto nas inferiores aumenta apenas de 2 a 3 vezes. Isso está ligado ao aumento
das pressões vasculares pulmonares, que transformam zonas 2 em zonas 3. O aumento de
número de capilares abertos, distensão de todos os capilares e aumento da velocidade do
fluxo por cada capilar e, por último, aumento da pressão arterial são estratégias utilizadas pelo
corpo para comportar o aumento do volume sanguíneo para os pulmões sem uma variação
intensa de pressão arterial pulmonar. Esses mecanismos conservam a energia do lado direito
do coração e impedem o aumento da pressão capilar pulmonar, impedindo o desenvolvimento
de edema pulmonar.
A pressão atrial esquerda de um indivíduo saudável quasenunca se elevados 6mmHg,
mesmo durante o exercício vigoroso. Com problemas no lado esquerdo do coração, o sangue
passa a se acumular no AE, elevando sua pressão normal (de 1 a 5 mmHg) para até 4050mmHg. Elevações acima de 7 a 8 mmHg na pressão atrial esquerda levam a elevações iguais
na pressão arterial pulmonar, resultando em sobrecarga para o lado direito do coração. A
pressão atrial esquerda acima dos 30 mmHg, existe uma grande chance de desenvolver edema
pulmonar.
DINÂMICA CAPILAR PULMONAR
A dinâmica dos capilares pulmonares não se diferencia em relação à dos capilares
sistêmicos, apenas ocorre em condições especiais: a pressão capilar pulmonar é baixa, a
pressão intersticial no pulão é mais negativa, os capilares pulmonares são mais permeáveis a
proteínas, o que causa uma pressão coloidosmótica maior no líquido intersticial e a parede dos
alvéolos é frágil, podendo se romper por qualquer pressão positiva superior a pressão dos
alvéolos sobre o interstício (0 mmHg).
Como as forças direcionadas para fora são ligeiramente maiores que as direcionadas
para dentro, existe uma pressão de filtração média que causa um leve fluxo de líquidos dos
capilares pulmonares para os espaços intersticiais, que é bombeado de volta para a circulação
pelo sistema linfático. Por isso, a leve pressão negativa exercida por esses capilares
pulmonares pelos vasos linfáticos no interstício pulmonares são importantes para remover o
excesso de líquido no espaço intersticial, mantendo os alvéolos secos (exceto pela fina camada
de líquido na sua face interna). O líquido no interstício comunica-se com a cavidade pleural
através da pleura visceral, levando para ele as proteínas teciduais, que lhe conferem sua
viscosidade. Esse líquido é succionado por vasos linfáticos numa pressão de -7mmHg,
superando a pressão de colapsação dos pulnões de -4mmHg, o que leva ao tracionamento dos
pulmões contra a pleura parietal.
O edema pulmonar consiste num funcionamento defeituoso do sistema linfático ou de
um aumento da filtração de líquido dos capilares pulmonares, o que leva ao aumento da
pressão do líquido intersticial pulmonar, que passa da faixa negativa para positiva, causando o
enchimento dos espaços intertisciais pulmonares e alvéolos com líquido. As suas causas mais
comuns são insuficiência cardíaca esquerda ou doença da válvula mitral, que levam a grandes
elevações na pressão venosa pulmonar ou lesão das membranas dos capilares pulmonares,
causada por infecções ou inalação de gases tóxicos. Esse fluido pode também se acumular no
espaço interpleural, causando um derrame pleural.
PRINCÍPIOS FÍSICOS DAS TROCAS GASOSAS
A etapa seguinte a ventilação dos alvéolos é a difusão gasosa do oxigênio partindo
dessas estruturas para as veias pulmonares e do gás carbônico no sentido oposto, porém o ar
atmosférico contém, além desses, várias outras moléculas em quantidades significativas, como
o nitrogênio e o gás carbônico. A difusão efetiva de gases numa câmara gasosa ocorre no
sentido de maior concentração desse gás para o de menor concentração. A pressão parcial de
um desses gases é causada pelo impacto das moléculas livres de cada um deles contra a
parede dos alvéolos, logo ela é proporcional a concentração das moléculas de gás, e a própria
difusão do gás depende fortemente da pressão que ele exerce sobre o sistema.
O ar é composto, aproximadamente, de 78% de nitrogênio e 21% de oxigênio (e 1%
por argônio, gás carbônico e outros gases). A pressão total (soma das pressões parciais) dessa
mistura é de 760 mmHg ao nível do mar, logo PO2 = 160 mmHg e PN2 = 600mmHg,
aproximadamente. Mesmo dissolvidos na água ou em tecidos corporais, os gases exercem
pressão pois movem-se aleatoriamente (chocando-se contra membranas plasmáticas, por
exemplo), e essa pressão não depende apenas da sua concentração, mas também do seu
coeficiente de solubilidade, que aumenta conforme os gases se atraem pelo solvente (dessa
forma, elas são dissolvidas sem gerar excesso de pressão parcial na solução). Isso pode ser
notado pela lei de Henry:
Onde a concentração é volume do gás/volume da solução, e os coeficientes são:
Por essa tabela, percebe-se que o dióxido de carbono é muito mais solúvel que o
oxigênio, o que reduz consideravelmente sua pressão parcial. Essa mesma pressão parcial
tende a forçar as moléculas gasosas do ar alveolar para a solução no sangue dos capilares
alveolares (dependendo da sua pressão parcial no sangue, elas também podem retornar para
o alvéolo, gerando o ar residual). Logo, no caso do O2, cuja pressão parcial é maior no alvéolo
e menor nos capilares pulmonares, a direção da difusão é no sentido alvéolo-sangue, sendo o
contrário para o CO2.
Além da diferença de pressão, fatores como a solubilidade do gás, área do corte
transversal do líquido, distância pela qual o gás precisa se difundir, peso molecular do gás e
temperatura do líquido afetam na difusão. Essas variáveis são expressas na fórmula D =
PxAxS / d x PM^1/2, onde A é a área de secção transversal do líquido, S é a sua solubilidade
(quanto maior a afinidade do gás pelo solvente, mais fácil é a difusão), d é a distância de
difusão e 1/PM^1/2 é inversamente proporcional a velocidade do gás, que facilita a difusão.
Percebe –se que as únicas características do gás que interferem na difusão são S e PM, sendo a
razão S/PM^1/2 denominada coeficiente de difusão do gás (indica qual gás tem maior
capacidade de difundir-se sobre uma mesma pressão parcial).
Quando os gases não umidificados são inalados, a água armazenada nas paredes das
vias aéreas se evapora e umidifica o ar. Isso resulta da baixa pressão parcial de água (pH2O) na
mistura de ar, criando um fluxo das paredes em direção a essa mistura. A temperatura
corporal normal, essa pressão parcial é de 47 mmHg, variando proporcionalmente ao aumento
da temperatura. Esse vapor d’água dilui os demais gases, reduzindo suas pressões parciais.
O ar alveolar não possui a mesma composição do ar atmosférico, uma vez que esse ar
é apenas parcialmente substituído pelo ar atmosférico a cada respiração, sendo umidificado
antes de atingir os alvéolos e que o oxigênio e o gás carbônico estão em constante difusão:
Sabe-se que a capacidade funcional residual média dos pulmões é de cerca de 2300
mL. Entretanto, apenas 350 mL de ar chegam a aos alvéolos a cada inspiração normal, sendo
essa mesma quantidade expirada. Esse valor é muito baixo, sendo necessárias várias
respirações para renovar o ar alveolar. Essa lenta renovação do ar tem uma função de evitar
mudanças repentinas nas concentrações gasosas no sangue, variações súbitas de oxigenação e
acúmulo de CO2 nos tecidos e do pH tecidual com a interrupção temporária da respiração.
A concentração de oxigênio no ar alveolar e também sua pressão parcial são
controladas pela intensidade da absorção do gás pelo sangue e pela intensidade da entrada
do oxigênio nos pulmões pela ventilação. Numa intensidade ventilatória normal de 4,2 L/min,
se consome 250 mL/min de O2, sendo sua pressão parcial normal de 104 mmHg. Para manter
essa mesma pressão sobre um consumo 4 vezes maior de oxigênio (1000 mL/min), como num
exercício moderado, a intensidade ventilatória também tem que aumentar por volta de 4
vezes. Porém, independente do aumento da ventilação, a pO2 nunca se eleva acima de 149
mmHg caso a pessoa esteja respirando ar atmosférico normal a pressão do nível do mar, uma
vez que essa é a pressão parcial máxima do gás umidificado para essa pressão.
Esse mesmo raciocínio aplica-se à pCO2 no ar alveolar, que é propocional à velocidade
de excreção de CO2 e inversamente proporcional à ventilação alveolar (quanto maior a
excreçao de CO2 do sangue para o ar alveolar, maior sua concentração, logo maior pressão
parcial e, da mesma forma, quanto mais rápido esse for removido, menor a sua concentração,
diminuido pCO2).
O ar expirado é uma combinação do ar do espaço morto(maior pO2), que é eliminado
inicialmente, com o ar alveolar (maior pCO2):
A membrana respiratória é uma camada muito fina que separa os capilares
pulmonares dos alvéolos (de 0,2 a 0,6 micrômetros). A área superficial total da membrana
respiratória é de aproxiamadamente 70m² e cada capilar tem um diâmetro de 5 micrômetros,
o que significa que as hemácias precisam se espremer para passar por eles, implicando
também numa distância de difusão bem pequena para as trocas gasosas nessa região. A
difusão dos gases pela membrana respiratória depende de todos os mesmo fatores já citados
(diferença de pressão, A, S, PM^1/2 e d).A espessura da membrana pode ser alterada por
edema de pulmão ou por fibrose pulmonar, enquanto outras patologias, como o enfisema
pulmonar, levam a coalescência dos alvéolos pulmonares, diminuindo a área da superfície de
contato com os capilares (variações ligeiras na área de superfície pode levar a um sério
comprometimento das trocas gasosas).
Os fatores citados acima que influenciam na difusão são quantificados na capacidade
de difusão de oxigênio, que é a medida do fluxo de O2 que passa do ar alveolar para o sangue
sob a diferença de pressão de 1 mmHg. No homem jovem mediano, esse valor é de 21
mL/min/mmHg, ou seja, a diferença de pressão média do oxigênio durante a respiração
normal é de 11 mmHg (11 x 21 = 230mL/min, que é próximo de 250, valor do consumo normal
de O2). Esse valor aumenta durante o exercício para até 65mL/min/mmHg pela abertura dos
capilares pulmonares e dilatação dos já abertos, além do aumento da proporção ventilaçãoperfusão. Embora não tenha sido calculada, admite-se que a capacidade de difusão de CO2 é
proporcional a seu coeficiente de difusão, sendo portanto 20x maior que a do O2 ->
450mL/min/mmHg no repouso.
Os dois fatores determinantes da pCO2 e pO2 nos alvéolos são: (1) a intensidade de
transferência do O2 e CO2 através da membrana respiratória e (2) a intensidade da ventilação
alveolar. Algumas áreas dos pulmões podem ser muito bem ventiladas, porém não receberem
quase nenhum fluxo sanguíneo, enquanto outras podem ter um fluxo excelente, porém quase
nenhuma ventilação, criando uma dificuldade na respiração ainda que o fluxo sanguíneo
pulmonar e a ventilação sejam totais. Um conceito é utilizado para compreender as relações
desse balanceamento, a proporção de ventilação-perfusão.
Quando Va/Q é zero, ou seja, não há nenhuma ventilação alveolar, o ar nos alvéolos
entre em equilíbrio com as pressões de O2 e CO2 do sangue venoso que retorna aos pulmões
vindo da circulação sistêmica (pO2 = 40mmHg e pCO2 = 45mmHg). Quando Va/Q é infinito, ou
seja, não há fluxo de sangue, a ausência da perfusão impede a troca de gases, fazendo com
que o ar alveolar mantenha-se sobre as mesmas condições do ar inspirado umidificado ( pO2 =
149 mmHg e pCO2 = 0). Com Va/Q normal, tanto a perfusão quanto a ventilação ocorrem de
formas ideais, garantindo uma troca efetiva de gases e tornando a p02 alveolar = 104 mmHg
(entre 149 do ar inspirado e 40 da circulação venosa) e pCO2 = 40 mmHg (entre 0 do ar
inspirado e 45 da circulação venosa). O diagrama de Va/Q indica as pressões parciais de O2 e
CO2 no ar alveolar, sob condições atmosféricas ao nível do mar e pressões normais no sangue
venoso, para todos os valores da proporção:
Quando a proporção de ventilação-perfusão for alta, não ocorre a troca de oxigênio do
ar com o sangue, fazendo com que a ventilação seja “desperdiçada”. A ventilação do ar do
espaço morto também é desperdiçada. A soma dessas duas ventilações desperdiçadas forma o
espaço morto fisiológico, que é calculado pela equação de Bohr:
Onde VDfis é o espaço morto fisiológico, VT é o volume total, PaCO2 é a pressão
parcial do dióxido de carbono no sangue arterial e PeCO2 é a pressão parcial média do dióxido
de carbono em todo o ar expirado. Quando o espaço morto fisiológico é muito grande, o
trabalho da ventilação gera um menor rendimento.
Quando Va/Q está abaixo do normal, ocorre ventilação inadequada para oxigenar
completamente o sangue que flui pelos capilares alveolares, fazendo com que determinada
fração de sangue que passa pelos capilares pulmonares continue não-oxigenada, formando o
sangue derivado. O montante do sangue derivado por minuto é denominado derivação
fisiológica, sendo medida por:
Onde Qps é a derivação fisiológica por minuto, Qt é o DC por minuto, CiO2 é a
concentração de oxigênio no sangue arterial em condições ideais, CaO2 é a concentração de
oxigênio no sangue arterial e CvO2 é a concentração de O2 no sangue venoso.
Quando a derivação fisiológica é alta, a quantidade de sangue não-oxigenado na
circulação sistêmica aumenta.
Na pessoa normal, em posição ereta, o fluxo sanguíneo e a ventilação são
consideravelmente menores na parte superior do pulmão, entretanto sendo o fluxo de sangue
bem menor do que a ventilação (sofre maior efeito da pressão hidrostática). Na parte superior
do pulmão, Va/Q é 2,5 vezes maior que o ideal, o que causa um moderado espaço morto
fisiológico nessa região, enquanto a parte inferior, esse valor é 0,6 vezes menor que o ideal, o
que causa uma pequena derivação fisiológica. O exercício físico aumente a perfusão
principalmente da região superior dos pulmões, fazendo com que ocorre bem menos espaço
morto fisiológico e aumentando a efetividade das trocas gasosas.
Principalmente em fumantes, várias DPOC desenvolvidas provocam o aprisionamento
do ar alveolar, ou enfisema, que tem como consequência a destruição da parede alveolar,
reduzindo tanto a ventilação pelo bloqueio dos brônquios quanto a troca de gases nos alvéolos
afetados pelo enfisema, o que aumenta tanto o espaço morto fisiológico quanto a derivação
fisiológica.
TRANSPORTE DE GASES NO SANGUE E NOS LÍQUIDOS TECIDUAIS
Após realizar as trocas gasosas nos capilares pulmonares, o sangue entra na veia
pulmonar com uma pO2 em torno de 104mmHg (em equilíbrio com a pO2 do ar alveolar),
correspondendo a 98% do sangue arterial, enquanto os outros 2% vêm da aorta pela
circulação brônquica e irrigam as regiões profundas do pulmão, retornando para a circulação
com uma pO2 de cerca de 40 mmHg (igual à do sangue venoso sistêmico após a captação de
O2 pelos tecidos) a partir das veias pulmonares (fluxo de derivação), o que reduz sua pO2 para
95 mmHg ao chegar no átrio esquerdo.
A diferença entre a pO2 no sangue saído do coração esquerdo e do líquido intersticial
(aproximadamente pO2 = 40mmHg) faz com que o gás se difunda rapidamente para o líquido,
entrando em equilíbrio com sua pressão e chegando às veias com uma pressão de O2 em
equilíbrio com a pressão do líquido intersticial, ou seja, em torno de 40 mmHg. Entretanto, o
aumento do fluxo sanguíneo para um determinado tecido pode elevar sua pO2, uma vez que
ocorre um aporte maior de O2, enquanto a intensa atividade metabólica tende a diminuir essa
pressão parcial pela atividade metabólica.
A pO2 intra-celular naturalmente encontra-se menor do que a dos capilares
periféricos, uma vez que esse gás é constantemente utilizado no metabolismo celular,
variando desde 5 até 40 mmHg, tendo por média 23 mmHg. Em compensação, os subprodutos
do metabolismo formam várias moléculas de CO2, elevando a pCO2 intra-celular, o que leva a
difusão desse gás para os capilares teciduais e transporte para os pulmões. A grande diferença
entre a difusão do CO2 e do O2 é que CO2 tem afinidade muito maior pela água, se difundindo
20x mais rápido que o O2, necessitando, portanto de diferenças de pressões bem menores
para causar sua difusão (a pCO2 intra-celular é de 46 mmHg, enquanto a do líquido intersticial
é de 45, que é igual a pressão de CO2 nas veias da circulação sistêmica que chega aos alvéolos,
onde a pCO2 do ar alveolar de 40mmHg entra em equilíbrio com a do sangue venoso,
tornando 40mmHg a pCO2 arterial sistêmica).
Ao contrário da pO2, o efeito do aumento do fluxo sanguíneo para os tecidos reduz a
pCO2 intersticial (para um valor de 41 mmHg, aproximado à pressão do sangue arterial),
enquanto o aumento da atividade metabólica eleva a pCO2 intra-celular dada a formação de
subprodutos metabólicos e, consequentemente, também eleva pCO2 no interstício.
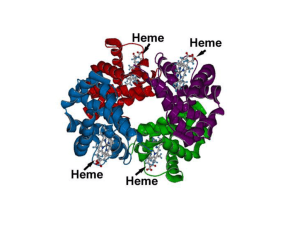
Cerca de 97% do oxigênio transportado pelo sangue o faz associado a molécula de
hemoglobina nas hemácias, enquanto 3% apenas são transportados em estado dissolvido na
água do plasma e células sanguíneas. O oxigênio se combina frouxamente e de maneira
reversível com a porção heme da hemoglobina. Quando pO2 é alta, o oxigênio se liga a
hemoglobina, e no caso contrário se desprende dela. A saturação de oxigênio no sangue
arterial sistêmico (pO2 = 95 mmHg) é, em média, 97%, enquanto no venoso é de 75% (pO2 =
40 mmHg). A quantidade de oxigênio liberada para os tecidos varia de acordo com as
necessidades fisiológicas. Em condições normais, são liberados em torno de 4,4mL de oxigênio
para cada 100mL de sangue que passa através dos capilares, e em caso de exercício físico, esse
valor aumenta para até 15 mL. Além disso, em corredores de maratona bem treinados, o
débito cardíaco pode se elevar de seis a sete vezes, aumentando ainda mais essa taxa.
A hemoglobina atua como reguladora da pO2 nos tecidos, uma vez que para a
liberação dos 5 mL de oxigênio necessários para o metabolismo basal, deve haver uma queda
de pO2 para 40mmHg, portanto esse é o teto da pO2 no líquido intersticial que permite a
liberação das quantidades mínimas de oxigênio requeridas (valores acima desse levam a
liberação de menor volume de O2 pelas hemácias, o que é observado no diagrama de
dissociação oxigênio hemoglobina) quando essa pressão entrar em equilíbrio com a do sangue
arterial (pO2 = 95 mmHg). Por outro lado, a partir desse valor, a liberação de oxigênio pela
hemoglobina em função da diminuição da pO2 no interstício é bastante elevada (95mmHg ->
40 mmHg liberam 5 mL e de 40 mmHg para 15 mmHg liberam 10mL => queda abrupta no
diagrama de dissociação), permitindo que a quantidade extra de oxigênio no sangue obtida
durante o exercício físico seja liberada para os tecidos (o aumento do metabolismo tecidual
diminui a pO2 intersticial).
Mesmo com variações de pressão atmosférica, a hemoglobina mantém a pO2 tecidual
constante. A pO2 normal nos alvéolos é cerca de 104 mmHg, porém essa pO2 pode diminuir
em locais de altitude elevada e em voo para até metade desse valor ou aumentar em
profundezas marítimas ou em câmaras pressurizadas por até dez vezes sem alterar demais a
pO2 tecidual.
Com a redução da pO2 alveolar de 104 mmHg para apenas 60 mmHg, a saturação de
oxigênio na hemoglobina cai para 89% - inferior ao valor de 97% da pO2 comum – e, para
compensar essa menor saturação, a pressão parcial do oxigênio nos tecidos deve diminuir para
manter a mesma diferença de pressão que permite o fluxo de 5mL de O2/ 100 mL de sangue.
Esse valor corresponde a uma pO2 intersticial de 35 mmHg, ou seja, apenas 5 mmHg abaixo da
pressão normal. No caso do aumento da pO2 alveolar para pressões muito maiores, a
saturação atinge o pico de 100% e o oxigênio adicional continua a ser difundido para os
tecidos, fazendo com que a pO2 do sangue capilar caia para valores de poucos mmHg acima da
normal, que é de 40 mmHg.
Alguns fatores desviam a curva de dissociação do oxigênio-hemoglobina, como o
aumento da concentração de íons hidrogênio (pH), de CO2, da temperatura corporal e do 2,3bifosfoglicerato (composto presente no sangue que aumenta sua concentração em condições
de hipóxia por perfusão deficiente). Todos esses fatores desviam a curva de dissociação para a
direita, ou seja, diminuem a saturação da hemoglobina para uma dada faixa de pO2,
incentivando, portanto, a liberação de oxigênio do sangue para os tecidos (e também ao
contrário, caso a concentração dos fatores citados diminua). A maioria desses fatores está
aumentado durante o exercício físico – o metabolismo das fibras musculares produz maior
quantidade de CO2 e outros ácidos que se dissociam, liberando H+ e a temperatura é
aumentada em função da hiperatividade da cadeia respiratória – explicando a maior liberação
de O2 para os tecidos nessas condições.
Esse é o efeito Bohr, que pode ser explicado pela difusão do dióxido de carbono dos
tecidos para o sangue, aumentando a pCO2 no sangue e a concentração da H2CO3 e íons H+
no sangue. Esse efeito desloca a curva de dissociação para direita e para baixo, forçando a
liberação de oxigênio pela hemoglobina para os tecidos. Nos pulmões, o dióxido de carbono se
difunde para o ar alveolar, diminuindo a concentração de H+ e a pCO2 do sangue, o que
desloca a curva para a esquerda e para cima, favorecendo a saturação da hemoglobina numa
dada pO2 (aumenta sua afinidade pelo oxigênio).
O principal fator limitante das reações intracelulares não é o oxigênio, uma vez que
dado o sistema de enzimas da célula todas já ocorrem em sua velocidade normal com uma
pO2 acima de 1 mmHg. O principal fator limitante dessas reações é o substrato energético
ADP, que possui uma relação de proporcionalidade com o consumo de oxigênio pelas células,
ou seja, a utilização do oxigênio é controlada pela intensidade ou velocidade com que o ATP é
convertido em ADP. Outros fatores limitantes são a distância entre os capilares e os tecidos
(pode ser aumentada em situações patológicas) e a intensidade do fluxo sanguíneo.
O monóxido de carbono desloca o oxigênio da hemoglobina por se ligar ao mesmo
sítio do grupo heme em que ele se ligaria, porém com uma afinidade 250x maior. Isso pode ser
evidenciado na curva de dissociação monóxido de carbono – hemoglobina, onde a saturação
das hemácias já atinge 97% com uma pCO alveolar de 0,4 mmHg, o que só ocorreria com pO2
alveolar de 104 mmHg. Ou seja, isso significa que para uma pressão 250 vezes menor, as
moléculas de CO já competem por igual com as moléculas de O2, podendo ocupar até metade
da hemoglobina do sangue. E ainda que o conteúdo de O2 do sangue esteja reduzido, a pO2
pode estar normal, impedindo o mecanismo de aumento de frequência respiratória em
resposta a falta de oxigênio (geralmente ocorrendo pela pO2 baixa). O tratamento envolve a
administração de O2 puro e com CO2 a 5% para estimular o centro respiratório.
O CO2 é difundido pelas células dos tecidos até os capilares sanguíneos e, ao atingir o
sangue, é transportado de três principais formas -> (1) dissolvido no sangue (cerca de 0,3 mL/
100 mL de sangue; 7% do total); (2) na forma do íon bicarbonato, originado pela dissociação do
ácido carbônico, um produto da reação de água e dióxido de carbono catalisado pela enzima
anidrase carbônica, presente nas hemácias, e difundido do citoplasma das hemácias para o
plasma sanguíneo por um antiporte de bicarbonato-íons cloreto, enquanto o H+ é tamponado
pela hemoglobina (esse mecanismo é responsável pelo transporte de 70% do CO2); (3)
transporte pela carbaminoemoglobina, uma associação fraca e reversível do CO2 com a
hemoglobina e que demora mais tempo para acontecer do que a reação da anidrase
carbônica, e, além da hemoglobina, CO2 pode se associar a outras proteínas plasmáticas
(responsável por 23% do transporte de CO2).
O ácido carbônico formado reduz o pH do sangue, sendo essa redução controlada pela
Hb. Sob condições normais, o sangue venoso tem um pH ligeiramente menor que o arterial
(pHven = 7,37 e pHart= 7,41). Em exercício intenso, essa variação pode ser de até 0,5.
A curva de dissociação do dióxido de carbono mostra a dependência do dióxido de
carbono sanguíneo total em função da pCO2 no sangue. Vale a pena lembrar que a pCO2
durante o repouso varia entre 40 mmHg no sangue arterial e 45 mmHg no sangue venoso,
representando uma variação na faixa de concentração de dióxido de carbono de apenas 4
volumes percentuais (mL de dióxido de carbono dissolvido/ 100 mL de sangue, ou seja, apenas
4 mL de CO2 são transportados para o ar alveolar a cada 100 mL de sangue passando pelos
capilares pulmonares), embora existam cerca de 50 mL de CO2 dissolvido para cada 100 mL de
sangue (essa concentração varia de 48 mL/100mL ao passar pelos pulmões e 52mL/100mL na
passagem pelos tecidos).
Da mesma forma que o aumento da concentração de CO2 no sangue desloca o
oxigênio da hemoglobina, a associação do oxigênio a hemoglobina também desloca o CO2 do
sangue. O efeito Haldane é explicado pelo aumento da acidez da hemoglobina quando ela se
associa ao O2 nos pulmões, o que faz com que ela perca sua afinidade pelo dióxido de
carbono, impedindo a formação de CO2Hgb e também libere maior quantidade de íons H+,
deslocando o equilíbrio da reação da anidrase carbônica no sentido de formar CO2 e água à
partir dos íons bicarbonato.
CONTROLE DO CENTRO RESPIRATÓRIO:
O centro respiratório é composto de vários grupos de neurônios localizados
bilateralmente no bulbo e na ponte. É dividido em três grandes grupos de neurônios: (1) um
grupo dorsal respiratório, localizado na região dorsal do bulbo, responsável principalmente
pela inspiração, (2) um grupo ventral respiratório, localizado na região ventrolateral do bulbo,
responsável tanto pela expiração quanto pela inspiração, dependendo dos neurônios que são
estimulados e (3) o centro pneumotáxico, localizado dorsalmente na região superior da ponte,
e que ajuda a controlar tanto a freqüência quanto o padrão da respiração.
O grupo dorsal respiratório de neurônios desempenha um papel fundamental no
controle da respiração. Ele se estende ao longo da maior parte do comprimento do bulbo.
Todos ou quase todos os seus neurônios estão localizados no núcleo do tracto solitário,
embora neurônios adicionais da substância reticular adjacente ao bulbo provavelmente
também desempenhem papéis importantes no controle respiratório.
O núcleo do tracto solitário também é uma terminação sensorial dos nervos vago e
glossofaríngeo, que transmitem sinais sensoriais dos quimioceptores, dos baroceptores e de
vários tipos diferentes de receptores pulmonares para o centro respiratório. O ritmo básico da
respiração é gerado principalmente no grupo dorsal respiratório de neurônios. Mesmo quando
todas as terminações nervosas periféricas que entram no bulbo são seccionadas e o tronco
encefálico também é seccionado acima e abaixo do bulbo, este grupo de neurônios ainda
emite, repetitivamente, potenciais de ação inspiratórios.
A causa básica dessas descargas repetitivas, porém, ainda é desconhecida. O sinal
inspiratório ocorre “em rampa”, iniciando-se muito fraco e aumentando progressivamente por
cerca de dois segundos. Em seguida, cessa abruptamente por cerca de três segundos e permite
a retração elástica da caixa torácica e dos pulmões causando a expiração. O centro
pneumotáxico limita a duração da inspiração e aumenta a freqüência respiratória.
O grupo ventral de neurônios permanece quase totalmente inativo durante a
respiração normal em repouso. Quando há necessidade de altos níveis de ventilação
pulmonar, essa área opera mais ou menos como um mecanismo multiplicador. Dessa forma, o
grupo ventral é essencialmente importante na respiração forçada. Os receptores de
estiramento localizados nas paredes dos brônquios e bronquíolos, que transmitem os sinais
através dos nervos vagos para o grupo respiratório dorsal quando os pulmões ficam muito
distendidos ativam uma resposta de feedback adequada que desliga a rampa inspiratória
através do chamado reflexo de insuflação de Hering-Breuer.
O último objetivo da respiração é manter as concentrações adequadas de oxigênio,
dióxido de carbono e íons hidrogênio nos tecidos. Portanto, é importante que a atividade
respiratória seja altamente responsiva às variações de cada um desses elementos. O excesso
de dióxido de carbono ou de íons hidrogênio causa aumento na intensidade dos sinais
inspiratórios e expiratórios para os músculos da respiração. O oxigênio atua quase totalmente
nos quimioceptores periféricos localizados nos corpos carotídeos e aórticos, e estes
transmitem sinais adequados para o centro respiratório através do nervo de Hering.
A área quimiossensitiva do centro respiratório é muito sensível às mudanças da
pressão parcial de dióxido de carbono na circulação ou à concentração de íons hidrogênio. Os
neurônios da área sensitiva são principalmente sensíveis aos íons hidrogênio. Entretanto, este
íon tem dificuldade em atravessar as barreiras hemoencefálica e hemoliquórica, ao contrário
do dióxido de carbono. Embora o dióxido de carbono tenha pouco efeito direto na estimulação
dos neurônios da área quimiossensitiva, ele exerce um potente efeito indireto. Este efeito é
resultado da reação do dióxido de carbono com a água dos tecidos para formar ácido
carbônico.
Este, por sua vez, se dissocia em íons hidrogênio e íons bicarbonato; os íons hidrogênio
têm potente efeito estimulador direto. Quando uma pessoa respira ar com muito pouco
oxigênio, isto, obviamente, diminui a pressão parcial de oxigênio sanguínea e excita os
quimioceptores carotídeos e aórticos, desse modo aumentando a respiração. Entretanto, esse
efeito é muito menor do que se espera, porque o aumento da respiração remove o dióxido de
carbono dos pulmões e conseqüentemente diminui a pressão parcial de dióxido de carbono e
a concentração de íons hidrogênio do sangue.
Estas duas alterações deprimem intensamente o centro respiratório, como foi
discutido anteriormente, de modo que o efeito final dos quimioceptores em aumentar a
respiração em resposta à diminuição da pressão parcial de oxigênio é totalmente
contrabalançado. A causa mais predominante de depressão respiratória e parada respiratória
seja talvez a dosagem excessiva de anestésicos e narcóticos.
O pentabarbital sódico e a morfina deprimem intensamente o centro respiratório.
Outros anestésicos como o halotano são mais comumente utilizados por não apresentarem
estas características de forma tão acentuada.
Uma anormalidade da respiração chamada de respiração periódica ocorre em
diferentes enfermidades. A pessoa respira profundamente por um pequeno intervalo de
tempo e depois respira fracamente ou não respira durante um intervalo, e este ciclo se repete
continuadamente. O tipo mais comum de respiração periódica é a respiração de CheyneStokes, caracterizada por aumento e diminuição lenta da respiração que se repetem
aproximadamente a cada 40 a 60 segundos.