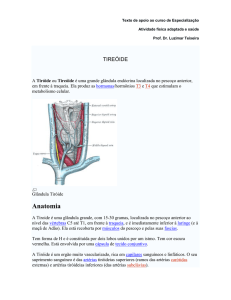
ANEXO I
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
1
1.
DENOMINAÇÃO DO MEDICAMENTO
Thyrogen 0,9 mg, pó para solução injectável.
2.
COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Cada frasco de Thyrogen contém um valor nominal de 0,9 mg de tirotropina alfa. Após reconstituição,
cada frasco de Thyrogen contém 0,9 mg de tirotropina alfa em 1,0 ml.
Para excipientes, ver 6.1.
3.
FORMA FARMACÊUTICA
Pó para solução injectável.
Pó liofilisado, branco a esbranquiçado.
4.
INFORMAÇÕES CLÍNICAS
4.1
Indicações
O Thyrogen (tirotropina alfa) está indicado na determinação da tiroglobulina (Tg) sérica, com ou sem
associação a cintigrafia corporal com radio-iodo, com o objectivo de detectar tecido tiroideu residual e
persistência ou recidiva de carcinoma diferenciado da tiróide em doentes submetidos a tiroidectomia e
mantidos sob terapêutica de supressão hormonal da tiróide (THST).
Doentes com carcinoma diferenciado da tiróide de baixo risco, com níveis não detectáveis de Tg sérica
quando medicados com THST e sem aumento dos níveis de Tg após estimulação pela rhTSH podem
ser seguidos efectuando o doseamento dos níveis de Tg após estimulação pela rhTSH.
O Thyrogen (tirotropina alfa) está indicado na estimulação pré-terapêutica em doentes de baixo risco
(ver secção 5.1), após-tiroidectomia e em manutenção da terapêutica de supressão hormonal (THST),
para a ablação de restos da tiróide em associação com 100 mCi (3,7 GBq) de iodo radioactivo (131I).
4.2
Posologia e modo de administração
O regime de dose recomendada é de duas doses de 0,9 mg de tirotropina alfa administradas, por
injecção intramuscular, em intervalos de 24 horas.
A terapia deverá ser supervisionado por médicos com experiência em carcinoma da tiróide.
Após reconstituição com água para injectáveis, deverá ser administrado 1,0 ml de solução (0,9 mg de
tirotropina alfa) por injecção intramuscular na nádega. Para instruções sobre a manipulação, ver
secção 6.6.
Para efectuar cintigrafias corporais ou ablação, a administração de rádio-iodo deverá ser feita 24 horas
após a última injecção de Thyrogen. As imagens deverão ser obtidas 48 a 72 horas após a
administração de rádio-iodo.
Para a determinação da tiroglobulina (Tg) sérica, a amostra de soro deverá ser colhida 72 horas após a
última injecção de Thyrogen.
Devido a uma insuficiência de dados sobre a utilização de Thyrogen em crianças, este produto só
deverá ser administrado a crianças em circunstâncias excepcionais.
A utilização de Thyrogen em doentes com insuficiência hepática não requer cuidados especiais.
2
Em doentes com insuficiência renal significativa, a actividade de radioiodo deve ser cuidadosamente
seleccionada pelo especialista de medicina nuclear.
A utilização de Thyrogen na determinação da Tg, no seguimento de doentes com carcinoma
diferenciado da tiróide após tiroidectomia, deve estar em conformidade com as directrizes oficiais.
4.3
Contra-indicações
•
•
Hipersensibilidade à hormona bovina ou humana de estimulação da tiróide ou a qualquer um
dos excipientes.
Gravidez.
4.4
Advertências e precauções especiais de utilização
O Thyrogen não deve ser administrado por via endovenosa.
O Thyrogen assegura uma maior sensibilidade na detecção de tecido tiroideu residual e de persistência
ou recidiva de carcinoma diferenciado da tiróide, quando utilizado como uma alternativa à suspensão
da terapêutica hormonal na combinação da determinação da Tg com a cintigrafia corporal com radioiodo. Com Thyrogen podem ocorrer resultados falsamente negativos. Se persistir uma suspeita elevada
de existência de doença metastática, deve considerar-se a hipótese de recolher nova amostra para
determinação da Tg e de efectuar nova cintigrafia corporal.
A presença de anticorpos contra a Tg (Tg Ab) surge em 18-40% dos doentes com carcinoma
diferenciado da tiróide podendo causar o aparecimento de resultados falsamente negativos nas
determinações da Tg sérica. Portanto, é necessário efectuar os doseamentos dos TgAb e da Tg.
Efeito sobre o crescimento e/ou tamanho tumoral:
Nos doentes com carcinoma da tiróide, os vários casos de estimulação de crescimento tumoral,
detectado durante a suspensão da terapêutica de supressão hormonal da tiróide para proceder a exames
de diagnóstico, foram atribuídos à manutenção prolongada de níveis elevados da hormona
estimuladora da tiróide (TSH).
Existe a possibilidade teórica de que o Thyrogen, tal como a suspensão da hormona tiroideia, possa
induzir um crescimento tumoral.
Nos ensaios clínicos com tirotropina alfa, produzindo um aumento de curta duração nos níveis séricos
de TSH, não foi referido qualquer caso de crescimento tumoral.
Devido à elevação dos níveis de TSH após a administração de Thyrogen - em casos com carcinoma
metastático da tiróide, especialmente quando localizado em espaços confinados, tais como o cérebro,
medula espinal e órbita, ou com infiltração no pescoço - podem surgir edema ou hemorragia focal no
local onde se encontram estas metástases. Isto pode resultar num aumento do tamanho do tumor e
conduzir a sintomas agudos, que dependem da sua localização anatómica. Têm, por ex., ocorrido casos
de hemiplegia, hemiparesia e perda de visão em doentes com metástases no SNC. Recomenda-se que
se considere o pré-tratamento com corticóides nos casos em que a expansão local do tumor possa
comprometer estruturas anatómicas vitais.
4.5
Interacções medicamentosas e outras
Não foram efectuados estudos formais de interacção entre Thyrogen e outros medicamentos. Nos
ensaios clínicos, não foram observadas interacções entre Thyrogen e a terapêutica com as hormonas da
tiróide - triiodotironina (T3) e tiroxina (T4) - quando administrados simultaneamente.
A utilização de Thyrogen permite a realização de cintigrafias corporais com rádio-iodo em
eutiroidismo, mantendo a terapêutica de supressão hormonal da tiróide. Dados sobre a cinética do
rádio-iodo indicam que a sua eliminação é aproximadamente 50% superior em eutiroidismo
comparativamente ao hipotiroidismo. A função renal está reduzida, em hipotiroidismo, resultando
numa maior retenção de rádio-iodo no organismo aquando da obtenção de imagens. Este factor deve
ser considerado quando se selecciona a actividade do rádio-iodo a utilizar na cintigrafia corporal,
3
apesar de apenas ter sido testada uma actividade de 3,7 GBq de 131I no ensaio de estimulação préterapêutica.
4.6
Gravidez e aleitamento
Não foram efectuados estudos de reprodução animal utilizando Thyrogen.
Não se sabe se o Thyrogen pode causar lesões fetais quando administrado a uma mulher grávida ou se
o Thyrogen pode afectar a capacidade reprodutiva.
Devido à consequente exposição do feto a uma elevada dose de matéria radioactiva, o Thyrogen está
contra-indicado na gravidez. As doentes não devem amamentar.
4.7
Efeitos sobre a capacidade de conduzir e utilizar máquinas
Não se conhece qualquer efeito.
4.8
Efeitos secundários
Foram referidos os seguintes efeitos secundários, relacionados com o a administração de Thyrogen,
com ocorrência mais frequente (≥ 0,1%), em três ensaios clínicos prospectivos (N=442):
Classes de sistemas de
Incidência nos doentes
Reacção adversa ao fármaco
órgãos
Doenças gastrointestinais Muito frequente (> 10%)
Náuseas
Frequente (>1% - ≤ 10%)
Vómitos
Perturbações gerais e
Frequente (>1% - ≤ 10%)
Fadiga
alterações no local de
Pouco frequente (>0,1% - ≤ 1%) Astenia, dores nas costas,
administração
sintomas gripais, febre, arrepios
Doenças do sistema
Frequente (>1% - ≤ 10%)
Tonturas, cefaleias
nervoso
Pouco frequente (>0,1% - ≤ 1%) Parestesia
Afecções dos tecidos
Pouco frequente (>0,1% - ≤ 1%) Exantema cutâneo, urticária
cutâneos e subcutâneos
Vasculopatias
Pouco frequente (>0,1% - ≤ 1%) Sensação de calor
Foi referida a seguinte lista de efeitos secundários, relacionados com a administração de Thyrogen,
em relatos recolhidos após a sua introdução no mercado:
4
Classes de sistemas de
órgãos
Cardiopatias
Doenças gastrointestinais
Perturbações gerais e
alterações no local de
administração
Exames complementares
de diagnóstico
Afecções músculoesqueléticas e dos tecidos
conjuntivos
Neoplasias benignas,
malignas e não
especificadas (incl.
quistos e pólipos)
Doenças do sistema
nervoso
Doenças respiratórias,
toráxicas e do mediastino
Afecções dos tecidos
cutâneos e subcutâneos
Vasculopatias
Incidência nos doentes
Reacção adversa ao fármaco
Muito rara (>0,001% - ≤ 0,01%)
Rara (>0,01% - ≤ 0,1%)
Muito rara (>0,001% - ≤ 0,01%)
Muito rara (>0,001% - ≤ 0,01%)
Palpitações
Náuseas, vómitos, diarreia
Astenia, fadiga, dores,
sintomas gripais, febre,
arrepios
Diminuição da TSH
Muito rara (>0,001% - ≤ 0,01%)
Artralgia, mialgias
Muito rara (>0,001% - ≤ 0,01%)
Dores metastáticas, inchaço
da neoplasia
Rara (>0,01% - ≤ 0,1%)
Muito rara (>0,001% - ≤ 0,01%)
Muito rara (>0,001% - ≤ 0,01%)
Tonturas, cefaleias
Tremores
Dispneia
Muito rara (>0,001% - ≤ 0,01%)
Hiperhidrose, prurido,
exantema cutâneo, urticária
Rubor
Muito rara (>0,001% - ≤ 0,01%)
Foram, muito raramente, referidas manifestações de efeitos secundários relacionados com a via de
administração, incluindo desconforto, dor, prurido, exantema cutâneo e urticária no local de injecção
intramuscular.
Foram observados casos muito raros de hipertiroidismo ou de fibrilhação auricular ao administrar
0,9 mg de Thyrogen a doentes com presença parcial ou total da glândula tiróide.
As manifestações de hipersensibilidade foram relatadas com pouca frequência em enquadramentos
clínicos e após a introdução no mercado. Estas reacções consistiram em urticária, exantema cutâneo,
prurido, rubores e sinais e sintomas respiratórios. Em ensaios clínicos envolvendo 442 doentes,
nenhum doente desenvolveu anticorpos contra a tirotropina alfa quer após utilização única quer após
utilização repetida e limitada (27 doentes) do medicamento. Não se pode excluir a hipótese de
ocorrência de anticorpos que possam interferir com a determinação da TSH endógena.
4.9
Sobredosagem
Um doente idoso recebeu 0,9 mg de Thyrogen em 4 dias sucessivos a que se seguiram fibrilhação
auricular e enfarte do miocárdio fatal 2 dias mais tarde. Um doente que recebeu uma dose
intramuscular única de 3,6 mg e outro doente que recebeu uma dose endovenosa única de 0,3 mg
sofreram os seguintes efeitos indesejáveis: náuseas acentuadas, vómitos, diarreia e diaforese.
O tratamento sugerido em caso de sobredosagem é o restabelecimento do equilíbrio de fluidos,
podendo considerar-se a administração de um antiemético.
5
PROPRIEDADES FARMACOLÓGICAS
5.1
Propriedades farmacodinâmicas
Grupo farmacoterapêutico: Testes da função da tiróide.
Código ATC para a tirotropina alfa: V04CJ01
5
A tirotropina alfa (hormona estimuladora da tiróide humana recombinante) é uma glicoproteína
heterodimérica produzida pela tecnologia do ADN recombinante. É constituída por duas subunidades
ligadas de forma não covalente. Os cADN’s codificam uma subunidade alfa de 92 resíduos de
aminoácidos contendo dois locais de glicosilação amina e uma subunidade beta de 118 resíduos
contendo um local de glicosilação amina. Possui propriedades bioquímicas comparáveis à hormona
estimuladora da tiróide (TSH) humana endógena. A associação da tirotropina alfa com os receptores
da TSH nas células epiteliais da tiróide estimula a captação de iodo e a sua organificação, bem como a
síntese e libertação de tiroglobulina, triiodotironina (T3) e tiroxina (T4).
Em doentes com carcinoma diferenciado da tiróide, é efectuada uma tiroidectomia quase total ou
mesmo total. Para um diagnóstico eficaz dos resíduos da tiróide ou de carcinoma da tiróide, através da
produção de imagens por radioiodo ou do doseamento da tiroglobulina, e para a terapêutica dos
resíduos da tiróide com radioiodo, é necessário um nível sérico de TSH elevado para estimular a
captação de radioiodo e/ou a libertação de tiroglobulina. A abordagem padrão para atingir níveis de
TSH elevados tem sido retirar os doentes da terapêutica de supressão hormonal da tiróide (THST), o
que geralmente faz com que os doentes tenham os sinais e os sintomas próprios do hipotiroidismo.
Com a utilização de Thyrogen, a estimulação de TSH necessária à captação de radioiodo e à libertação
de tiroglobulina é atingida quando os doentes são mantidos em estado de eutiroidismo com a THST,
evitando assim a morbilidade associada ao hipotiroidismo.
Uso diagnóstico
A eficácia e segurança do Thyrogen para utilização na determinação da tiroglobulina sérica juntamente
com a cintigrafia corporal com rádio-iodo, para o diagnóstico de tecido tiroideu residual e de
persistência ou recidiva de carcinoma diferenciado da tiróide, foi demonstrada em dois estudos. Num
dos estudos foram examinados dois regimes: 0,9 mg por via intramuscular com intervalo de 24 horas
entre as duas doses (0,9 mg x 2) e 0,9 mg por via intramuscular com intervalos de 72 horas entre as
três doses (0,9 mg x 3). Ambos os regimes de dosagem foram eficazes, não sendo diferentes em
termos estatísticos da suspensão da terapêutica hormonal, na estimulação da captação de rádio-iodo
para a produção de imagens de diagnóstico. Ambos os regimes de dosagem melhoraram a
sensibilidade, precisão e valor preditivo negativo da determinação da tiroglobulina estimulada por
Thyrogen, isoladamente ou em combinação com a cintigrafia corporal com rádio-iodo, quando
comparados com as análises efectuadas enquanto os doentes permaneciam na terapêutica de supressão
hormonal da tiróide.
Em ensaios clínicos, em doentes tiroidectomizados, para avaliação da detecção de tecido tiroideu
residual e de persistência ou recidiva de carcinoma diferenciado da tiróide utilizando um método de
doseamento da tiroglobulina com um nível inferior de detecção de 0,5 ng/ml, os níveis de
tiroglobulina estimulados por Thyrogen foram de 3 ng/ml, 2 ng/ml e 1 ng/ml, correspondendo aos
níveis de tiroglobulina após suspensão da terapêutica de supressão hormonal da tiróide de 10 ng/ml, 5
ng/ml e 2 ng/ml, respectivamente. Nestes estudos descobriu-se, também, que a determinação da
tiroglobulina com Thyrogen era mais sensível do que as determinações da tiroglobulina mantendo a
THST. Especificamente, num estudo de Fase III em que estiveram envolvidos 164 doentes, a taxa de
detecção de tecido de origem tiroideia após doseamento da tiroglobulina com Thyrogen situou-se entre
73-87%, ao passo que, o doseamento da tiroglobulina com THST situou-se entre 42-62%
relativamente aos mesmos valores limite e padrões de referência.
A doença metastática foi confirmada através de cintigrafia corporal após tratamento com radio-iodo ou
por biópsia dos gânglios linfáticos em 35 doentes. Os níveis de tiroglobulina estimulados por
Thyrogen foram superiores a 2 ng/ml nos 35 doentes, enquanto que a tiroglobulina com THST foi
superior a 2 ng/ml em 79% destes doentes.
Estimulação pré-terapêutica
Num estudo comparativo envolvendo 60 doentes de baixo risco, as taxas de ablação bem sucedida dos
resíduos da tiróide, utilizando 100 mCi de radioiodo em doentes com carcinoma da tiróide
tiroidectomizados, foram comparáveis entre os doentes tratados após suspensão da THST e os doentes
tratados após a administração de Thyrogen. Os doentes estudados eram adultos (>18 anos de idade),
com diagnóstico recente de carcinoma diferenciado da tiróide - papilar ou folicular, incluindo a
6
variante papilar-folicular, caracterizada principalmente (54 em 60)como T1-T2, NO-N1, MO
(classificação TNM). O êxito da ablação dos resíduos da tiróide foi avaliado por imagiologia com
radioiodo e por análise da tiroglobulina sérica 8 meses após o tratamento. Os 28 doentes (100%)
tratados após suspensão da THST e os 32 doentes (100%) tratados após a administração de Thyrogen
não apresentaram qualquer captação visível de radioiodo no leito da tiróide ou, se visível, a captação
no leito da tiróide foi <0,1% da dose de radioiodo administrada. O êxito da ablação dos resíduos da
tiróide foi também avaliado, apenas em doentes que não apresentavam anticorpos de interferência antiTg, pela comprovação do nível de Tg sérica <2 ng/ml após estimulação com Thyrogen, oito meses
após a ablação. Utilizando-se este critério de Tg, 18/21 doentes (86%) e 23/24 doentes (96%) tiveram
uma ablação bem sucedida dos resíduos da tiróide nos grupos de suspensão da THST e de tratamento
com Thyrogen, respectivamente. Existem evidências na literatura de uma menor eficácia com a
administração de Thyrogen em comparação com a suspensão da THST ao utilizar-se 30 mCi. Por
conseguinte, a eficácia de Thyrogen com doses de 131I <100 mCi não está estabelecida.
A qualidade de vida ficou significativamente reduzida após suspensão da terapêutica de supressão
hormonal da tiróide, mas manteve-se inalterada após qualquer um dos regimes de dosagem com
Thyrogen, em ambas as indicações.
5.2
Propriedades farmacocinéticas
A farmacocinética do Thyrogen foi estudada em doentes com carcinoma diferenciado da tiróide após
uma única injecção intramuscular de 0,9 mg. Após injecção, o nível do pico médio (Cmax) obtido foi de
116 ± 38 mU/l e ocorreu aproximadamente 13 ± 8 horas após administração. A semi-vida de
eliminação foi de 22 ± 9 horas. Pensa-se que a via principal de eliminação da tirotropina alfa é renal e,
em menor grau, hepática.
5.3
Dados de segurança pré-clínica
Os dados pré-clínicos de utilização de Thyrogen são limitados mas não revelam riscos especiais para o
ser humano.
6.
INFORMAÇÕES FARMACÊUTICAS
6.1
Lista de excipientes
Manitol
Fosfato de sódio monobásico, monohidrato
Fosfato de sódio dibásico, heptahidrato
Cloreto de sódio
6.2
Incompatibilidades
Na ausência de estudos de compatibilidade, o Thyrogen não deve ser administrado como uma mistura
com outros medicamentos na mesma injecção.
6.3
Prazo de validade
Frascos para injectáveis não abertos
3 anos.
Prazo de validade após reconstituição
Recomenda-se que a solução de Thyrogen seja injectada no período de tempo de três horas.
6.4
Precauções especiais de conservação
Guardar entre 2°C e 8°C (no frigorífico).
7
Manter o frasco dentro da embalagem exterior.
A solução reconstituída pode ser armazenada por um período máximo de 24 horas a uma temperatura
entre 2°C e 8°C ao abrigo da luz e evitando a contaminação microbiana.
6.5
Natureza e conteúdo do recipiente
O Thyrogen é fornecido em frascos de vidro transparente de Tipo I de 5 ml. O fecho é constituído por
um tampão de butilo siliconizado com uma tampa removível inviolável. Cada frasco de Thyrogen
contém 1,1 mg de tirotropina alfa. Após reconstituição com 1,2 ml de água para injectáveis, retira-se
1,0 ml de solução (equivalente a 0,9 mg de Thyrogen) e administra-se ao doente.
Para proporcionar um volume suficiente para permitir dispensar correctamente o produto, cada frasco
de Thyrogen é formulado de modo a conter um excesso de 0,2 ml.
Cada frasco de Thyrogen é destinado a uma única utilização.
Tipo da embalagem: um e dois frascos de Thyrogen por embalagem.
6.6
Instruções para utilização e manipulação
O pó para solução injectável tem de ser reconstituído com água para injectáveis. Só é necessário um
frasco de Thyrogen para cada injecção.
Utilizar a técnica asséptica
Adicionar 1,2 ml de água para injectáveis ao pó de Thyrogen no frasco. Mexer o conteúdo do frasco
fazendo movimentos circulares suaves com a mão até que todo o material se encontre dissolvido. Não
agitar a solução. Quando o pó estiver dissolvido, o volume total no frasco é de 1,2 ml. O pH da
solução de Thyrogen é de aproximadamente 7.0.
Inspeccionar visualmente a solução de Thyrogen no frasco para verificar se contém partículas
estranhas e se existe coloração. A solução de Thyrogen deve ser transparente e incolor. Não utilizar
frascos que contenham partículas estranhas ou que se apresentem turvos ou com coloração.
Retirar 1,0 ml de solução de Thyrogen do frasco. Isto equivale a 0,9 mg de tirotropina alfa a injectar.
O Thyrogen não contém conservantes. Eliminar imediatamente qualquer solução não utilizada.
A solução de Thyrogen deve ser injectada no prazo de três horas. No entanto a solução de Thyrogen
manter-se-á quimicamente estável durante um máximo de 24 horas, se for guardada no frigorífico
(entre 2°C e 8°C). É importante estar ciente de que a segurança microbiológica depende das condições
assépticas durante a preparação da solução.
7.
TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
Genzyme Europe B.V., Gooimeer 10, 1411 DD Naarden, Países Baixos.
8.
NÚMEROS DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
EU/1/99/122/001
EU/1/99/122/002
8
9.
DATA DA PRIMEIRA AUTORIZAÇÃO/RENOVAÇÃO DA AUTORIZAÇÃO
9 Março 2000
10.
DATA DA REVISÃO DO TEXTO
9
ANEXO II
A.
FABRICANTE DA SUBSTÂNCIA ACTIVA DE ORIGEM
BIOLÓGICA E TITULAR DA AUTORIZAÇÃO DE
FABRICO RESPONSÁVEL PELA LIBERTAÇÃO DO LOTE
B.
CONDIÇÕES DA AUTORIZAÇÃO DE INTRODUÇÃO NO
MERCADO
10
A.
FABRICANTE DA SUBSTÂNCIA ACTIVA DE ORIGEM BIOLÓGICA E TITULAR
DA AUTORIZAÇÃO DE FABRICO RESPONSÁVEL PELA LIBERTAÇÃO DO LOTE
Nome e endereço do fabricante da substância activa de origem biológica
Genzyme Corp.
51 New York Avenue
Framingham, MA 01701-9322
USA
Nome e endereço do fabricante responsável pela libertação do lote
Genzyme Ltd.
37 Hollands Road
Haverhill
Suffolk CB9 8PU
Reino Unido
B.
CONDIÇÕES DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
•
CONDIÇÕES OU RESTRIÇÕES RELATIVAS AO FORNECIMENTO E À
UTILIZAÇÃO IMPOSTAS AO TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO
MERCADO
Medicamento de receita médica restrita (ver anexo I: resumo das características do medicamento,
4.2.).
•
OUTRAS CONDIÇÕES
O titular desta autorização de introdução no mercado deve informar a Comissão Europeia sobre os
planos de comercialização do medicamento autorizados pela presente decisão.
11
ANEXO III
ROTULAGEM E FOLHETO INFORMATIVO
12
A. ROTULAGEM
13
INDICAÇÕES A INCLUIR NA EMBALAGEM EXTERIOR OU, CASO ESTA NÃO EXISTA,
NO ACONDICIONAMENTO PRIMÁRIO
{EMBALAGEM EXTERIOR (EMBALAGEM DE 1 FRASCO)}
1.
DENOMINAÇÃO DO MEDICAMENTO
THYROGEN 0,9 mg
Pó para solução injectável
Tirotropina alfa
2.
DESCRIÇÃO DO(S) PRINCÍPIO(S) ACTIVO(S)
Cada frasco contém 0,9 mg de tirotropina alfa.
3.
LISTA DOS EXCIPIENTES
Excipientes:
Manitol
Fosfato de sódio monobásico, monohidrato
Fosfato de sódio dibásico, heptahidrato
Cloreto de sódio
4.
FORMA FARMACÊUTICA E CONTEÚDO
1 frasco contendo 1,1 mg de pó para preparação de solução injectável (equivalente a 0,9 mg/ml de
solução reconstituída).
5.
MODO E VIA(S) DE ADMINISTRAÇÃO
Apenas para injecção intramuscular.
6.
ADVERTÊNCIA ESPECIAL DE QUE O MEDICAMENTO DEVE SER MANTIDO
FORA DO ALCANCE E DA VISTA DAS CRIANÇAS
Manter fora do alcance e da vista das crianças.
7.
OUTRAS ADVERTÊNCIAS ESPECIAIS, SE NECESSÁRIO
8.
PRAZO DE VALIDADE
EXP. {mês/ano}
14
9.
CONDIÇÕES ESPECIAIS DE CONSERVAÇÃO
Guardar entre 2°C e 8°C (no frigorífico).
Manter o frasco dentro da embalagem exterior.
10.
CUIDADOS ESPECIAIS QUANTO À ELIMINAÇÃO DO MEDICAMENTO NÃO
UTILIZADO OU DOS RESÍDUOS PROVENIENTES DESSE MEDICAMENTO, SE
FOR CASO DISSO
Destina-se a ser utilizado apenas uma vez.
Qualquer solução não utilizada deve ser eliminada de forma apropriada.
11.
NOME E ENDEREÇO DO TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO
MERCADO
Genzyme Europe B.V.
Gooimeer 10
1411 DD Naarden
Países Baixos
12.
NÚMERO(S) DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
EU/1/99/122/001
13.
NÚMERO DO LOTE DE FABRICO
Lote {número}
14.
CLASSIFICAÇÃO GERAL RELATIVA AO FORNECIMENTO
Medicamento sujeito a receita médica.
15.
INSTRUÇÕES DE UTILIZAÇÃO
Administração no período de 3 horas após a reconstituição.
Ler o folheto informativo antes de utilizar o medicamento.
15
INDICAÇÕES A INCLUIR NA EMBALAGEM EXTERIOR OU, CASO ESTA NÃO EXISTA,
NO ACONDICIONAMENTO PRIMÁRIO
{EMBALAGEM EXTERIOR (EMBALAGEM DE 2 FRASCOS)
1.
DENOMINAÇÃO DO MEDICAMENTO
THYROGEN 0,9 mg
Pó para solução injectável
Tirotropina alfa
2.
DESCRIÇÃO DO(S) PRINCÍPIO(S) ACTIVO(S)
Cada frasco contém 0,9 mg de tirotropina alfa.
3.
LISTA DOS EXCIPIENTES
Excipientes:
Manitol
Fosfato de sódio monobásico, monohidrato
Fosfato de sódio dibásico, heptahidrato
Cloreto de sódio
4.
FORMA FARMACÊUTICA E CONTEÚDO
2 frascos contendo cada um 1,1 mg de pó para preparação de solução injectável (equivalente a
0,9 mg/ml de solução reconstituída)
5.
MODO E VIA(S) DE ADMINISTRAÇÃO
Apenas para injecção intramuscular.
6.
ADVERTÊNCIA ESPECIAL DE QUE O MEDICAMENTO DEVE SER MANTIDO
FORA DO ALCANCE E DA VISTA DAS CRIANÇAS
Manter fora do alcance e da vista das crianças.
7.
OUTRAS ADVERTÊNCIAS ESPECIAIS, SE NECESSÁRIO
8.
PRAZO DE VALIDADE
EXP. {mês/ano}
16
9.
CONDIÇÕES ESPECIAIS DE CONSERVAÇÃO
Guardar entre 2°C e 8°C (no frigorífico).
Manter o frasco dentro da embalagem exterior.
10.
CUIDADOS ESPECIAIS QUANTO À ELIMINAÇÃO DO MEDICAMENTO NÃO
UTILIZADO OU DOS RESÍDUOS PROVENIENTES DESSE MEDICAMENTO, SE
FOR CASO DISSO
Destina-se a ser utilizado apenas uma vez.
Qualquer solução não utilizada deve ser eliminada de forma apropriada.
11.
NOME E ENDEREÇO DO TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO
MERCADO
Genzyme Europe B.V.
Gooimeer 10
1411 DD Naarden
Países Baixos
12.
NÚMERO(S) DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
EU/1/99/122/002
13.
NÚMERO DO LOTE DE FABRICO
Lote {número}
14.
CLASSIFICAÇÃO GERAL RELATIVA AO FORNECIMENTO
Medicamento sujeito a receita médica.
15.
INSTRUÇÕES DE UTILIZAÇÃO
Administração no período de 3 horas após a reconstituição.
Ler o folheto informativo antes de utilizar o medicamento.
17
INDICAÇÕES MÍNIMAS A INCLUIR EM PEQUENAS UNIDADES DE
ACONDICIONAMENTO PRIMÁRIO
{ RÓTULO }
1.
DENOMINAÇÃO DO MEDICAMENTO E VIA(S) DE ADMINISTRAÇÃO
THYROGEN 0,9 mg
Pó para solução injectável
Tirotropina alfa
2.
MODO DE ADMINISTRAÇÃO
Apenas para injecção intramuscular.
3.
PRAZO DE VALIDADE
EXP.{mês/ano}
4.
NÚMERO DO LOTE
Lote {número}
5.
CONTEÚDO EM TERMOS DE PESO, VOLUME OU UNIDADE
Guardar entre 2°C e 8°C
Genzyme Europe B.V. - NL
18
B. FOLHETO INFORMATIVO
19
FOLHETO INFORMATIVO
Leia atentamente este folheto antes de utilizar o medicamento.
Conserve este folheto. Pode ter necessidade de o ler novamente.
Caso tenha dúvidas, consulte o seu médico ou farmacêutico.
Neste folheto:
1. O que é o Thyrogen e para que é utilizado
2. Antes de utilizar o Thyrogen
3. Como utilizar o Thyrogen
4. Efeitos secundários possíveis
5. Conservação do Thyrogen
6. Outras informações
Thyrogen 0,9 mg, pó para solução injectável.
Tirotropina alfa
Cada frasco contém 0,9 mg de tirotropina alfa.
A substância activa no Thyrogen é a tirotropina alfa.
Os outros ingredientes são:
Manitol
Fosfato de sódio monobásico, monohidrato
Fosfato de sódio dibásico, heptahidrato
Cloreto de sódio
Titular da autorização de introdução no mercado:
Genzyme Europe B.V., Gooimeer 10, 1411 DD Naarden, Países Baixos.
Titular da autorização de fabrico:
Genzyme Ltd., 37 Hollands Road, Haverhill, Suffolk CB9 8PU, Reino Unido
Tamanho da embalagem: um e dois frascos de Thyrogen por embalagem.
1.
O QUE É O THYROGEN E PARA QUE É UTILIZADO
O Thyrogen é um pó para preparação de solução injectável de cor branca a esbranquiçada
A tirotropina alfa é uma hormona de estimulação da tiróide humana produzida pela tecnologia do
ADN recombinante.
A tirotropina alfa estimula o tecido da tiróide a fazer a captação de iodo e a produzir tiroglobulina (Tg)
e hormonas da tiróide (triiodotironina (T3) e tiroxina (T4)).
O Thyrogen (tirotropina alfa) destina-se à utilização na determinação de tiroglobulina (Tg) sérica em
associação ou não com a cintigrafia corporal com rádio-iodo. Estes exames de diagnóstico são
utilizados para detectar certos tipos de carcinoma da tiróide em doentes após remoção da glândula da
tiróide e que mantêm uma terapêutica com hormonas tiroideias.
Doentes com carcinoma diferenciado da tiróide de baixo risco com níveis não detectáveis de Tg
durante a terapêutica com hormona da tiróide e sem aumento dos níveis de Tg, após estimulação com
tirotropina alfa, podem ser seguidos utilizando tirotropina alfa para a determinação dos níveis de Tg .
Para eliminação (ablação) do tecido da tiróide residual que permaneceu após a remoção cirúrgica da
glândula tiroideia em doentes de baixo risco, deverá utilizar-se o Thyrogen (tirotropina alfa) em
associação com o tratamento com radioiodo e mantendo a terapêutica com hormonas tiroideias.
20
O tratamento deve ser vigiado por um médico especializado em carcinoma da tiróide.
2.
ANTES DE UTILIZAR O THYROGEN
Não utilize o Thyrogen
Deverá informar o seu médico se alguma vez teve uma reacção alérgica (por exemplo, “erupção
cutânea” ou comichão) à hormona estimuladora da tiróide (TSH) humana ou bovina, ou a quaisquer
outros ingredientes antes de começar a tomar este medicamento.
Efeito sobre o crescimento de tumoral
O seu médico decidirá se pertence a um grupo específico de doentes para os quais deve se considerar a
hipótese de um tratamento prévio com corticosteróides (por exemplo, doentes com metástases
intracerebrais ou na medula espinal). Se tiver alguma preocupação, contacte imediatamente o seu
médico.
Gravidez
Não utilizar Thyrogen durante a gravidez. Se estiver grávida, consulte o seu médico.
Aleitamento
Não utilizar Thyrogen enquanto estiver a amamentar. Só deve começar a amamentar quando o seu
médico aconselhar.
Utilizar o Thyrogen com outros medicamentos:
Não há conhecimento de interacção com as hormonas da tiróide da terapêutica recomendada.
O seu médico de medicina nuclear determinará qual a dose exacta de rádio-iodo que deve ser utilizada
para a cintigrafia corporal ou para ablação, tendo em consideração o facto de estar a manter uma
terapêutica com hormonas da tiróide.
3.
COMO UTILIZAR THYROGEN
O pó do Thyrogen deve ser dissolvido em água para injectáveis.
Só é necessário um frasco de Thyrogen para cada injecção. A injecção deve ser administrada por via
intramuscular.
O seu médico, enfermeiro ou farmacêutico preparará a injecção. Para instruções, ver 6.
Qual a dose de Thyrogen recomendada?
A dose recomendada de Thyrogen é de duas doses de 0,9 mg de tirotropina alfa administrada com um
intervalo de 24 horas. O seu médico ou enfermeiro injectará 1,0 ml de solução de Thyrogen (0,9 mg de
tirotropina alfa).
O Thyrogen deve ser administrado apenas no músculo da nádega. A solução de Thyrogen nunca deve
ser injectada numa veia.
O pediatra do seu filho decidirá se o Thyrogen pode ser administrado ao seu filho.
Não misture o Thyrogen com outros medicamentos na mesma injecção.
Mesmo que sofra de insuficiência hepática, poderá receber Thyrogen.
Se tiver diminuição da função renal, o seu médico decidirá a quantidade de rádio-iodo a ser
administrada.
21
Quando for submetido/a a cintigrafia corporal com radioiodo ou a ablação, o seu médico administrará
o radioiodo 24 horas após a última injecção de Thyrogen. A produção da imagem de diagnóstico
deverá ser efectuada 48 a 72 horas após a administração de radioiodo (72 a 96 horas após a última
injecção de Thyrogen), enquanto que a produção da imagem pós-terapêutica poderá ser adiada por uns
dias para permitir que a actividade de fundo decline.
Para a determinação da tiroglobulina (Tg) sérica, o seu médico ou enfermeiro fará a colheita de uma
amostra de soro 72 horas após a última injecção de Thyrogen.
4.
EFEITOS SECUNDÁRIOS POSSÍVEIS
Como todos os medicamentos, o Thyrogen poderá causar efeitos secundários.
Num número limitado de casos, os doentes referiram efeitos secundários relacionados com o local da
injecção, incluindo vermelhidão, desconforto, comichão, dor local ou ardor e erupção cutânea com
comichão.
Foram referidos os seguintes efeitos secundários em ocasiões raras: náuseas, cefaleias, vómitos,
diarreia, tonturas.
Os seguintes efeitos secundários foram referidos em ocasiões muito raras: fraqueza, fadiga, parestesia
(sensação de picada ou formigueiro), dor (incluindo dor no local das metástases - carcinoma
secundário), inchaço do tumor, dores musculares ou nas articulações, arrepios, febre, rubor quente,
palpitações, tremores, sudação e sintomas gripais.
Foram referidas reacções ligeiras sugestivas de hipersensibilidade (reacções alérgicas) em muito
poucos casos. Estas reacções podem consistir em urticária, prurido (comichão), dificuldade em
respirar e “erupção” cutânea.
Se sentir quaisquer efeitos secundários não referidos neste folheto, informe o seu médico ou
farmacêutico.
5.
CONSERVAÇÃO DO THYROGEN
Manter fora do alcance e da vista das crianças.
Guardar entre 2°C e 8°C (no frigorífico).
Manter o frasco dentro da embalagem exterior, a fim de o proteger da luz.
Não utilizar depois de terminado o prazo de validade indicado no rótulo.
22
6.
OUTRAS INFORMAÇÕES
Para quaisquer informações sobre este medicamento, queira contactar o representante local do titular
da autorização de introdução no mercado.
België/Belgique/Belgien/
Luxembourg/Luxemburg
Genzyme Belgium nv/sa (Belgique/Belgien),
Tél/Tel: + 32 2 714 17 11
Česká Republika/Slovenská Republika
Genzyme CEE GmbH organizační složka
(Česká Republika),
Tel: +420 2 667 282 08
Danmark/Norge/Sverige/Suomi/Finland
Genzyme AS, (Danmark/Tanska),
Tlf/Puh./Sími: + 45 32712600
Deutschland
Genzyme GmbH, Tel: +49 610236740
Ísland
VISTOR hf., Tel: +354 535 7000
Ελλάδα/Κύπρος
Jasonpharm ΑΕ (Ελλάδα),
Τηλ: +30 210 7522600
Polska/Eesti/Latvija/Lietuva
Genzyme Polska Sp. z o. o.
(Poola/Polija/Lenkija),
Tel: + 48 22 516 24 30
España
Genzyme, S.L., Tel: +34 91 6591670
Portugal
Genzyme Portugal
Taguspark
Edifício Ciência II, 2º Sala 2D
2740-120 Porto Salvo
Tel: +351 21 422 0100
France
Genzyme S.A.S, Tél: +33 1 825 800 211
Slovenija
Genzyme CEE GmbH Predstavništvo za
Hrvatsku (Hrvaška), Tel: +385 91 5077 928
Italia/Malta
Genzyme Srl (Italia), Tel: +39 059 349811
United Kingdom/Ireland
Genzyme Therapeutics (United Kingdom),
Tel: +44 1865 405200
Magyarország
Genzyme CEE GmbH Képviselet,
Tel: +36 1 309 6689
Nederland
Genzyme Europe BV, Tel: +31 35 6991200
Österreich
Genzyme Austria GmbH,
Tel: + 43 1 774 65 38
Este folheto foi revisto pela última vez em
-------------------------------------------------------------------------------------------------------------------------A informação que se segue destina-se apenas aos médicos e aos profissionais dos cuidados de saúde:
Utilizar a técnica asséptica
Adicionar 1,2 ml de água para injectáveis ao Thyrogen em pó existente no frasco. Mexer suavemente
o conteúdo do frasco, com movimentos circulares da mão, até todo o material se encontrar dissolvido.
Não agitar a solução. Depois do pó estar dissolvido, o volume total do frasco é de 1,2 ml. O pH da
solução de Thyrogen é aproximadamente 7.0.
23
Inspeccionar visualmente a solução de Thyrogen no frasco para verificar se contém partículas
estranhas e se existe coloração. A solução de Thyrogen deve ser uma solução transparente e incolor.
Não utilizar frascos com partículas estranhas, que estejam turvos ou que apresentem coloração.
Retirar 1,0 ml da solução de Thyrogen do frasco do produto. Isto equivale a 0,9 mg de tirotropina alfa
a ser injectado.
O Thyrogen não contém conservantes. Eliminar, imediatamente, qualquer solução não utilizada.
Após reconstituição, a solução deve ser injectada num prazo de três horas, no entanto a solução de
Thyrogen manter-se-á quimicamente estável durante 24 horas (se for guardada entre 2°C e 8°C
protegida da luz). É importante salientar que a segurança microbiológica depende das condições de
assepsia durante a preparação da solução.
24