Proteinas:
Intro:
São as macromoleculas mais versateis nos sistemas vivos e realizam funções cruciais em todos
os processos biológicos. Funcionam como catalisadores, transportadores e armazenam outras
moleculas como O2, fornecem suporte mecânico e protecção imunitaria, geram movimento,
transmitem impulsos nervosos e controlam o crescimento e diferenciação.
São polimeros lineares de amino acidos, que se enrolam (fold) espontaneamente em
estruturais 3dimensionais determinadas pela sequencia de aas. A sua função está
directamente relacionada com esta estrutura 3D. Contém uma vasta gama de grupos
funcionais, que incluem alcoois (-OH), tióis, ácidos carboxilicos (-COOH), carboxamidas, etc. A
maioria destes é quimicamente reactiva. Quando combinados em várias sequências, esta gama
de grupos funcionais contribui para o espectro funcional das proteinas. As suas propriedades
reactivas são essenciais para a função enzimatica, p.e.
Algumas proteinas sao rigidas, enquanto outras apresentam uma flexibilidade consuderável.
Unidades rigidas podem agir como elementos estruturais no clitosqueleto ou no tecido
conjuntivo. Proteinas flexiveis podem agir como “alavancas” ou “molas”, essenciais para a
uniao entre proteinas e outras unidades complexas, e para a transmissão de info. Entre a
propria celula e as demais celulas
A estrutura das proteinas pode ser descrita em 4 niveis. A estrutura primária é a sequencia de
aa. A est. Secundária refere-se à conformação adoptada por regioes locais das cadeias
polipeptidicas. A est. Terciária descreve o enrolamento (folding) total da cadeia polipeptidica.
A est. Quaternaria refere-se à associação especifica de multiplas cadeias polipeptidicas para
formarar complexos de multisubunidades.
- As Proteinas sao construidas a partir dum repertório de 20 aa: Cada aa consiste num átomo
de carbono tetraédrico central ligado a um grupo amina, a um grupo carboxílico (ácido), uma
cadeia lateral distintiva e um átomo de H. As cadeias laterais variam no tamanho, forma e na
presença de grupos funcionais.
- Est. Primária: AA formam lig. Peptidicas para formar polimeros: A ligação estabelece-se
entre o grupo carboxilico de um aa e o grupo amina do próximo. Esta ligação é resistente à
hidrólise, pelo que as proteinas sao bastante estaveis cineticamente. A ligação C-N tem
carácter de dupla ligação. Cada lig. Peptidica tem um dador de pontes de H (geralmente um
atomo mt electronegativo; o grupo NH do grupo amida) e um aceitador de pontes/ligação de H
(o grupo CO do grupo carboxilo). A lig. Peptidica não tem carga, p que permite às proteinas
estruturas globulares “empacotadas”.
- Est. Secundária: As cadeias polipeptidicas adoptam a forma de estructuras como a Alpha
Hélice e a Folha Beta
- Est Terciária; Proteinas soluveis em água dobram-se em estructuras compactas com núcleos
nao polares: a estrutura compacta e assimetrica dos polipéptidos individuais constitui a est.
Terciária.
- Est Quaternária : Proteinas constituidas por mais de uma cadeia polipeptidica apresentam
estrutura quaternaria. Cada cadeia individual chama-se “subunidade”. Geralmente, as
subunidades encontram-se ligadas por lig. Nao covalentes (pontes de H, lig hidrofóbicas, forças
de Van der Waals, interações electrosestáticas, por ex)
- A seq de aa determina a estrutura 3dimensional , e como tal, todas as outras propriedades
da proteína.
Hemoglobina (Hb)
Intro: Na corrente sanguinea, os GV transportam O2 dos pulmões para os tecidos, onde este é
necessário. A Hb, uma proteina com 4 subunidades e com um pigmento que liga O2, o Heme,
que dá a cor vermelha ao sangue, transporta O2 e liberta-o nos músculos, onde este é
armazenado na Mioglobina (Mb), que fornece uma reserva de O2 disponível quando
necessária.
Durante a evolução, os vertebrados desenvolveram dois mecanismos essenciais que permitem
o fornecimento adequado de O2 às células: um sistema circulatório bastante complexo e
abrangente, e o uso de proteinas de transporte e armazenamento de O2, Hb e Mb,
respectivamente. Estas 2 proteinas apresentam estruturas que permitem a ligação de O2
praticamente identicas. No entanto, Hb é mais eficiente neste função, podendo usar até 90%
do seu potencial no transporte de O2 (a Mb apenas consegue usar 7% da sua capacidade
potencial). Esta diferença reside no facto de que a Mb existe como uma única cadeia
polipeptidica, enquanto que a Hb é constituida por 4 cadeias, 2 cadeias alfa e duas cadeias
beta (2 dímeros Alfa-Beta)«’, que ligam O2 cooperativamente, ou seja, a lig de O2 numa cadeia
aumenta a capacidade de lig no resto da molécula. Este mecanismo tb funciona na libertação
de O2, que ocorre ao nivel dos tecidos.
- Mb e Hb ligam Oxigénio nos átomos de Ferro no grupo Heme: O grupo Heme é constituido
por uma parte orgânica, protoporfirina IX (contém 4 anéis pirrole) e uma parte inorgânica: o
átomo de Fe, em posição central, no estado Fe2+ (ião, reduzido). Este ião encontra-se
coordenado com a cadeia lateral de um resíduo de Histidina (Hys), histidina proximal. Devido à
transferência parcial de e-s do ferro para o O2 (oxidação do ião Fe2+ em Fe3+), o ião para o
plano hémico durante a ligação do O2.
- Hb liga o O2 cooperativamente: The curva de lig de O2 da Mb releva um equilibrio simples
no processo de lig. A curva de saturação de O2 da Hb é uma sigmóide, o que indica que a lig é
cooperativa: a lig de O2 num local dentro do tetrâmero afecta as afinidades da lig de O2 nos
outros locais. A ligação e a libertação cooperativa de O2 aumentam signficantemente a
eficácia do transporte de O2. A estrututa quaternaria da Hb muda como consequência da lig
de O2. Os dois dimeros alfa beta rodam aproximadamente 15 graus na transição de desoxiHb
para oxiHb (T para R). Os GV contém 2,3-BPG em concentrações aproximadamente iguais às da
Hb. O 2,3-BPG liga-se fortemente à desoxiHb (mas nao ao estado R), estabilizando a forma T e
diminuindo a afinidade de O2 da Hb. O 2,3-BPG não se liga tão fortemente à Hb fetal, pelo que
esta consegue ligar O2 mais eficazmente do que a Hb adulta. Esta diferença permite a
transferência de O2 entre sangue materno e fetal.
- Iões H+ e CO2 promovem a libertação de O2: As propriedades de lig de O2 da Hb são
afectadas pelo pH e pela presença de CO2, um fenómeno consecido como o efeito de Bohr. Ao
aumentar a [H+], ou seja, diminuir o pH, diminui a afinidade de O2 da Hb, devido à protonaçãp
das terminações amina de certos resíduos de histidina. Os residuos protonizados ajudam a
estabilizar a forma T. O aumento da [CO2] diminui a afinidade de O2 da Hb por 2 processos: o
C02 é convertido em ácido carbónico, que diminui a afinidade de O2 por diminuir o pH dentro
do GV; o C02 junta-se aos grupos terminais amina da Hb para formar carbamato, que
estabilizam a desoxiHb por interacções iónicas. Como os ioes H+ e o CO2 são produzidos
durante o metabolismo celular, o efeito de Bohr ajuda a libertar O2 onde este é mais
necessário.
Enzimas
Intro: São catalisadores bioquimicos. A catálise ocorre num local particular da enzima, o local
activo. Quase todas as enzimas são proteinas, embora haja moleculas de RNA com poder
enzimático. As enzimas são catalisadores eficazes devido à sua especificidade e da capacidade
de se ligarem a uma vasta gama de moléculas. Através de forças intermoleculares, as enzimas
juntam os substractos numa orientação optima.
- São Catalisadores poderosos e altamente especificos: Conseguem melhorar as taxas de
reacção em factores de 10^6 ou mais. Muitas enzimas necessitam de cofactores para a
actividade, que podem ser iões metálicos ou moléculas orgânicas vitamínicas denominadas
coenzimas.
- A energia livre é a função termodinâmica mais util para determinir se uma reacção pode
ocorrer. Uma reacção pode ocorrer espontaneamente se a variação de energia livre for
negativa. As enzimas não alteram o equilibrio da reacção, diminuem a energia livre de
iniciação necessária para que uma reacção ocorra.
- As enzimas aceleram as reacções ao facilitar a formação do estado de transição: as enzimas
funcionam como catalisadores ao diminuirem a energia livre de activação de uma reacçao.
Aceleram as reacções ao criarem caminhos alternativos à reacção, em que o estado de
transição tem menor energia livre, e é formado mais rapidamente do que numa reacção nao
catalisada. O primeiro passo na catalização é a formação do complexo ES. A especificidade da
ligação ES depende de ligações de H e da forma do local activo, que rejeita moléculas que nao
tenham uma forma suficientemente complementar (teoria da chave fechadura). O
reconhecimento dos susbtractos pelas enzimas é normalmente acompanhado por alterações
conformacionais no local activo, que facilitam a formação do estado de transição (teoria do
encaixe induzido).
- As propriedades cinéticas de muitas enzimas são descritas pelo modelo de Michaelis
Menten. Vmax é a taxa de reacção quando a enzima está completamente saturada com
substracto e Km (constante de Michaelis) é a concentração do substracto para o qual a taxa de
reacção corresponde a metade do máx. O número de turnover é o numero de moleculas de
substracto convertidas em moleculas de produto por unidade de tempo num unico local
catalítico quando a enzima está saturada. As enzimas alostéricas são enzimas cuja actividade
catalítica pode ser regulada. Não podem ser medidas pela cinética de MM, têm multiplos
locais activos, que apresentam cooperatividade.
- As enzimas podem ser inibidas por moleculas especificas: Na inibição irreversivel, o inibidor
encontra-se covalentemente ligado à enzima, pelo que a sua dissociação é muito lenta
(inibidores covalentes ajudam a localizar o local activo da enzima). A inibição reversível é
caracterizada por um equilibro entre a enzima e o inibidor. Um inibidor competitivo compete
com o substracto pela ligação ao local activo. Aumenta a Km. A inibiçaõ competitiva pode ser
superada pelo aumento da concentração do substracto. Na inibição incompetitiva, o inibidor
combina-se apenas com o complexo ES. Na inibição nao-competitiva, o inibidor diminui o
numero de turnover, A intensidade da inibição depende da concentração do inibidor e da sua
afinidade para a E e/ou para ES. Interpretado como uma ligação à proteína que condiciona a
plasticidade do local activo. Este efeito não se ‘desfaz’ por aumento da [S]! Provoca a
diminuição da Vmax.
Regulação de Enzimas
Intro: A actividade das enzimas tem de ser regulada para que estas actuam na altura e no local
correctos. A regulação é feita através de 5 processos essenciais:
- Controlo alostérico – proteinas alostericas conteem locais regulatorios distintos e multiplos
locais funcionais. A ligação de pequenas moleculas sinal nos locais regulatorios é um meio de
controlar a actividade destas proteinas. Alem disso, as proteinas alostericas apresentam
cooperatividade (actividade num local funcional afecta a actividade nos outros locais)
- Múltiplas formas da enzima: Isoenzimas são enzimas homologas que catalizam a mesma
reacçao mas apresentam pequenas diferenças estruturais e nos valores de Vmax e Km e nas
propriedades regulatórias.
- Modificação Covalente Reversível: As propriedades cataliticas de muitas enzimas sao
alteradas pela ligação covalente de um grupo, geralmente um grupo fosforilo. ATP é o dador
de Pi nestas reacções, que sao catalizadas por proteinas cinases. A remoção do Pi por hidrólise
é catalizada por proteinas fosfatases.
- Activação Proteolítica: As enzimas controladas por alguns destes mecanismos regulatorios
transitam entre estados de activação e inactivação. Uma estrateia regulatoria diferente é
usada para converter irreversivelmente uma enzima inactiva numa activa. Muitas enzimas sao
activadas pela hidrolise de algumas ligações peptidicas.
- Controlo da Quantidade de Enzima presente: A actividade enzimatica pode ser regulada pelo
ajuste da quantidade de enzima presente. Isto ocorre, por exemplo, ao nivel da transcrição.
- Algumas enzimas são inibidas pelo produto final de uma cadeia de enzimas (feedback)
- A modificação covalente é um meio de regular a actividade enzimatica: A fosforilação é o
meio mais comum de modificação covalente reversivel.
-Muitas enzimas são activadas por clivagem proteolitica especifica: A activação de uma enzima
por clivagem proteolitica de uma ou mais lig. Peptidicas é um mecanismo de controlo em
muitos processos.
Metabolismo
- Todas as celulas transformam energia, que é extraida do seu ambiente e é utilizada para
converter moleculas simples em componentes celulares.
- O metabolismo celular é constituido por muitas reacções intercaladas: Pode ser dividido em
2 categorias: reacçoes catabolicas (extracção de energia atraves da degradação de moleculas)
e reacções anabolicas ( biossintese, com gasto de energia).
- ATP é a moeda da energia Livre nos sistemas biológicos: A energia derivada do catabolismo é
convertida em adenosina trifosfato. A sua hidrólise é exergonica (ocorre de forma espontanea)
e a energia libertada pode ser utilizada para potenciar processos celulares, como transporte
activo e biossintese.
- A Oxidação de combustiveis de carbono (ex glicose) é uma importante fonte de energia
celular: A formação de ATP é associada à Oxidação de combustiveis de carbono, directamente
ou através da formação de gradientes ionicos. Os organismos fotossinteticos conseguem usar
a luz para gerar tais gradientes. A extracção de energia dos nutrientes em organismos aerobios
ocorre em 3 fases: grandes moleculas sao quebradas em moleculas mais simples, como aa,
açucares e acidos gordos; estas pequenas moleculas são degradadas em unidades simples que
têm papeis especificos no metabolismo. Uma delas é a unidade acetil do acetil CoA, um
transpostador de grupos acil activos; cíclio de Krebs e fosforilação oxidativa, em que o ATP é
gerado a partir do fluxo de e-s para o O2 , o ultimo aceitador de e-s.
- O metabolismo é caracterizado por vias recorrentes. Transportadores activos como o ATP,
NADH e acetil CoA transferem grupos activados em vários caminhos metabolicos. O
metabolismo é regulado de varias maneiras. A quantidade de algumas enzimas criticas é
controlada pela regulaçao da taxa de sintese e degradação.
Glicólise e Gluconeogénese
A glicólise é um conjunto de reacções que converte glucose em piruvato. As 10 reacções da
glicolise ocorrem no citoplasma. A glucose é convertida em frutose 1,6- difosfato por uma
fosforilação (hexocinase; glucose 6 fosfato) , uma isomerização (frutose 6 fosfato) e uma
segunda fosforilação (fosfofrutocinase) . Duas moleculas de ATP sao consumidas por mol. de
glucose nestas reacçoes. Depois, a frutose 16 bifosfato é clivada pela aldolase em
dihidroxiacetona fosfato e gliceraldeido 3 fosfato, q sao interconvertiveis. Numa terceira
etapa, é gerado ATP. O gliceraldeido 3 fosfato é oxidadado e fosforilado para formar 1,3 BPG,
que transfere um grupo Pi para o ADP, formando.se ATP e 3 fosfoglicerato. Uma troca de Pi e
uma desidratação formam fosfoenolpiruvato (contem potencial de transferencia de Pi). A
fosfoenolpiruvato é convertido em piruvato (piruvato cinase), ocorrendo fosforilação de ADP e
formação de mais uma molecula de ATP.
O aceitador de e-s na oxidação do gliceraldeido 3 fosfato é o NAD+, que tem de ser regenerado
para que a glicólise continue. Nos organimso aeróbios, o NADH formado na glicólise transfere
os seus e-s para o O2 na cadeia transportadora de e-s, regenerando-se NAD+. Em condiçoes de
anaerobiose, o NAD+ é regenerado pela redução do piruvato em lactato (fermentação lactica)
ou em etanol (f. Alcoólica).
- A via glicolitica tem um papel duplo: degradação de glucose para gerar ATP e forncecimento
de materiais para a sintese de componentes celulares. A taxa de conversão de glucose em
piruvato é regulada consoante estas duas necessidades da célula. Apenas três reacções da
glicólise sao irreversíveis: as catalizadas pela Hexocinase, fosfofrutocinase e piruvato cinase. A
fosfofrutocinase é inibida por valores altos de ATP, e é activada pelo AMP e pela frutose 2,6
bifosfato. No fígado, esta molécula sinaliza a abundância de glucose. Logo, a PFK está activa
quando é necessário energia ou “blocos de construção” para a biossintese. Hexocinase é
inibida pela glucose 6 fosfato, que se acumula quando a PFK está inactiva. O ATP e a alanina
inibem alostericamente a piruvato cinase, que é activada pela acumulação de frutose 1,6
bifosfato. Logo, a piruvato cinase está activa em casos de déficite energético e acumulação de
intermediários da glicolise.
- A glucose pode ser sintetizada a partir de precursos que não os hidratos de carbono, como o
lactato, aa e glicerol, processo denominado de gluconeogénese. Este processo necessita de 4
novas reacções para compensar a irreversibilidade das 3 principais reacções na glicolise. Em
duas dessas reacções, o piruvato é carboxilado na mitocondria em oxaloacetato, que é
posteriormente descarboxilado e fosforilado em fosfoenolpiruvato. Estas reacções sao
catalizadas pelas enzimas piruvato carboxilase e fosfoenolpiruvato carboxicinase. As outros 2
reacções são a hidrolise da frutose 1,6 bifosfato e da glucose-6-fosfato, que sao catalizadas por
fosfatases especificas. A maior parte dos materias usados pelo figado para a gluconeogenese
são o lactato e a alanina, produzidos a partir do piruvato nos musculos esqueleticos. A
formação de lactato durante a actividade fisica intensa contribui para o inicio da
gluconeogense no figado.
- A gluconeogenese e a glicolise sao reguladas reciprocamente, de modo a que os dois
processos nao ocorram simultaneamente. A fosfofrutocinase a a frutose 1,6- bifosfatase são
pontos de controlo chave. A Frutose 2,6 bifosfato é uma molecula intracelular sinalizadora
presente em niveis maiores quando a glucose é abundante, e activa a glicolise e inibe a
gluconeogenese ao regular as 2 enzimas anteriores. A piruvato cinase a a piruvato carboxilase
sao reguladas por outros efectores para que as duas nao se encontram maximamente activas
ao mm tempo.
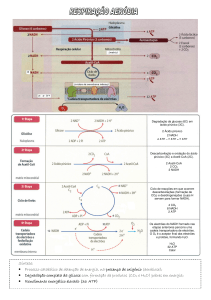
O Ciclo do Ácido Cítrico (aka Ciclo de Krebs ou ainda TCA: Tricarboxylic acid cycle):
Intro: Do metabolismo da glucose em piruvato na glicólise apenas se obtém uma pequena
fracção do ATP disponível na molécula de glucose. A maior parte do ATP gerado no
metabolismo provém do processamento aeróbio da glucose, que começa com a sua completa
oxidação, com libertação de CO2. O ciclo do ácido cítrico é o caminho final comum para a
oxidação de moléculas “combustíveis”: hidratos de carbono, ácidos gordos e amino-ácidos. A
maioria destas moléculas é integrada no ciclo sob a forma de Acetil Coenzima A. Sobre
condições anaeróbias, o piruvato sofre descarboxilação oxidativa para formr Acetil CoA. Nos
eucariontes, as reacções do ciclo de Krebs ocorrem na matriz mitocondrial (dentro da
membrana interna mitocondrial). Moléculas combustíveis são compostos de carbono passíveis
de ser oxidados, perdendo electrões. O ciclo do ácido cítrico inclui uma série de reacções
redox que resultam na oxidação de um grupo acetil e na formação de 2 moleculas de CO2.
Esta oxidação gera electrões com alta energia que serão utilizados para potenciar a síntese de
ATP. A função do ciclo de Krebs é “coleccionar” electroes com alta energia de moleculas
combustiveis.
Padrão do Ciclo do ácido cítrico: o oxaloacetato (composto com 4 átomos de C) reage com
uma unidade actil (com 2 C) para formar o ácido tricarboxílico (6 C), que liberta 2 moléculas de
CO2 em 2 descarboxilações oxidativas sucessivas, que libertam electrões de alta energia
(fomração de 2 moléculas de NADH). Resta um composto com 4 C, que é processado de modo
a ser regenerado o oxaloacetato, que inicia outro ciclo (igual, duh). 2 átomos de C entram no
ciclo sob a forma de um grupo acetil, e 2 atomos de C saem do ciclo sob a forma de CO2.
Durante este ciclo, os electrões removidos do acetil CoA são utilizados para formar NADH e
FADH2. 3 iões híbridos sao transferidos para 3 moléculas de Dinucleótido de Nicotinamida
Adenina (NAD+) e um par de átomos de H é transferido para uma molécula de Dinucleótido de
Flavina Adenina (FAD). Da oxidação dos transportadores de electrões (NADH e FADH2) durante
a fosforilação oxidativa resultam 9 moléculas de ATP . Os electroes libertados durante este
processo movem-se ao longo de uma série de proteinas membranares (cadeia transportadora
de e-s) para gerar um gradiente de protões ao longo da membrana. Estes protões movem-se
então para a ATP sintetase para gerar ATP a partir de ADP e fosfato inorgânico.
- A Piruvato Desidrogenase é o Elo de Ligação entre a Glicólise e o ciclo de Krebs: este elo
corresponde à descarboxilação oxidativa do piruvato para se formar Acetil CoA.
- Durante o ciclo são oxidadas unidades com 2 átomos de C: o ciclo começa com a formação
de citrato (6 C) a partir de oxaloacetato e acetil CoA, sendo o citrato isomerado em isocitrato.
Da descarboxilação oxidativa (catalisada pela isocitrato desidrogenase) deste intermediário
resulta α-cetoglutarato (5 C), que sofre descarboxilação oxidativa, (catalisada pela αcetoglutarato desidrogenase) formando-se Sucinil CoA (4 C). A ligação tioester do sucinil CoA é
clivada por ortofosfato, para formar sucinato e GTP. O Sucinato é oxidado em fumarato (4 C),
que é hidratado para formar malato (4 C), que é oxidado para regenerar o oxaloacetato.
- Regulação do ciclo do ácido cítrico: Este ciclo apenas opera em condições de aerobiose
porque requer NAD+ e FAD. A formação irreversível de Acetil CoA a partir do piruvato é um
ponto regulatório importante para a entrada do piruvato no ciclo. A actividade da Piruvato
Desidrogenase é controlada por Fosforilação Reversível, sendo inibida pela fosforilação. Os
aceitadores de e-s (NAD+ e FAD) são regenerados quando o NADH e o FADH2 transferem os es para a cadeia tranpostadora, com a produção concomitante de ATP. Assim, a taxa do ciclo de
Krebs depende da necessidade de ATP. Altas quantidades de ATP inibem a acção das enzimas
que catalisam as descarboxilações oxidativas.
Fosforilação Oxidativa (FO):
Intro: É o processo pelo qual se forma ATP como resultado da transferência de e-s de NADH e
de FADH2 para o O2 por uma série de transportadores de e-s. Toma lugar no membrana
interna da mitocondria, e é a maior fonte de ATP em organismos aeróbios.
O NADH e o FADH2 formados durante a glicólise, a oxidação de ácidos gordos e no ciclo do
ácido cítrico são moléculas ricas em energia por conterem (cada uma) um par de e-s com alto
potencial de transferência. Quando estes e-s são utilizados para reduzir o oxigénio molecular a
água na FO, uma grande quantidade de energia é libertada, podendo ser utilizada para gerar
ATP. O fluxo dos e-s através dos complexos proteicos localizados na membrana interna
mitocondrial causa o bombeamento de protões (H+) para fora da matriz mitocondrial. A
distribuição desigual de protões resultante gera um gradiente e um potencial eléctrico
transmembranar que causa o movimento de protões. É sintetizado ATP quando os protões
voltam a entrar na matriz mitocondrial através de um complexo enzimático (ATP Sintetase).
A cadeia respiratória é constituida por três canais/bombas (em inglês “pumps”) de protões
activadas pelo fluxo de e-s: NADH Desidrogenase /NADH – Ubiquinona – oxidoredutase
(complexo I; são transportados 4 H+ por cada 2 e-s que fluem do NADH), Ubiquinonacitocromo c oxidoredutase (complexo III) e Citocromo Oxidase (complexo IV; são
transportados 2 H+, por cada 2 e-s que fluem a partir do citocromo) (o complexo II é a
succinato desidrogenase ou succinato-coenzima Q oxidoredutase; é onde o FADH2 cede os
seus e-s). Estes complexos transmembranares contêm múltiplos centros de oxidação-redução,
incluindo quinonas, flavinas, grupos heme dos citocromos e iões Cobre. A fase final da FO é
realizada pela ATP Sintetase, que é activada pelo fluxo de protões de volta para a matriz
mitocondrial.
- A Fosforilação Oxidativa Depende da Transferência de Electrões: O fluxo os e-s através de 3
complexos transmembranares orientados assimetricamente resulta no bombeamente de
protões para fora da matriz mitocondrial e na geração de um potencial membranar. O ATP é
sintetizado quando os protoes fluem de volta para a matriz mit. Através de um canal num
complexo ATP Sintetase (tb conhecido como F0F1-ATPase),
- A Cadeira Respiratória Consiste em 4 Complexos: Três bombas de protões e um ego de
ligação ao ciclo do Ácido Cítrico: Os electrões do NADH são transferidos para o grupo
prostético do complexo I, NADH-Q Oxidoredutase (o Q corresponde à Ubiquinona). Os e-s
emergem na QH2 , a forma reduzida da Ubiquinona. A enzima Succinato Desidrogenase (do
ciclo de Krebs) é um componente do Complexo II, Succinato-Q Redutase, que doa e-s do
FADH2 à Q, para formar QH2. Este transportador hidrofóbico altamente móvel transfere os
seus e-s para o complexo III, Q-Citocromo c Oxidoredutase, que reduz a citocromo c (proteína
membranar periférica hidrossolúvel), que é tb um transportador de e-s móvel, transportandoos para o complexo IV, Citocromo c Oxidase. Um ião de ferro de um grupo heme deste
complexo e um ião de cobre transferem e-s para o aceitador final de electroes, o O2, para
formar H2O.
- A síntese de ATP é Potenciada por um gradiente de Protões: O fluxo de e-s através dos
complexos I, III e IV leva ao deslocamento de protões da matriz para o lado citoplasmático da
membrana interna mitocondrial. O fluxo de protões de volta para a matriz através da ATP
Sintetase activa a síntese de ATP. Este complexo enzimático é um motor molecualr constituido
por 2 unidades operacionais: um componente rotativo e um componente estacionário. A
rotaçao da subunidade gama (procurem o símbolo no google) induz mudanças estruturais na
subunidade β, resultando na síntese e libertação de ATP da enzima. O influxo de protões
fornece a força necessária à rotação.
O fluxo de e-s nos complexos I, III e IV gera um gradiente suficiente para sintetizar,
respectivamente, uma, meia e uma moléculas de ATP. Logo, são formadas 2,5 moléculas de
ATP por cada molecula de NADH oxidada na matriz mitocondrial, enquanto que por cada
molécula de FADH2 oxidada se formam apenas 1,5 moléculas de ATP, uma vez que os e-s
entram na cadeia em QH2, após o primeiro local de bombeamento de protões.
- Os Shuttles permitem o movimento ao longo das Membranas Mitocondriais: Os e-s do
NADH citoplasmático são transferidos para a mitocondria pelo shuttle glicerol fosfato para
formar FADH2 a partir de FAD, ou pelo shuttle malato-aspartato para formar NADH
mitocondrial. A entrada de ADP na matriz mitocondrial está relacionada com a saída de ATP
pela ATP-ADP Translocase, um transportador activado por potencial membranar.
- A Regulação da FO é controlada principalmente pelas necessidades de ATP: O NADH e o
FADH2 apenas são oxidados se o ADP for simultaneamente fosforilado a ATP. Esta forma de
regulação chama-se controlo respiratório. Existem proteínas desacopladoras, como o DNP, que
desacoplam o transporte de electroes e a sintese de ATP para gerar calor. Os desacopladores
dissipam o gradiente de protões ao transportar protões através da membrana interna
mitocondrial.
Metabolismo dos Ácidos gordos (AG):
Intro: Um ácido gordo contém uma longa cadeia hidrocarbonada e um grupo terminal
carboxilato. Têm quatro importantes papéis fisiológicos:
1- São moléculas combustível. São armazenados na forma de triacilglicerol (ou gordura
neutra ou ainda triglicerídeo), que são ésteres de AG com glicerol, sem carga eléctrica.
Os AG mobilizados de triacilgliceróis são oxidados para preencher as necessidades
energéticas da célula ou do organismo. Durante o repouso ou exercício moderado
(passear um Chihuahua) os AG são a nossa fonte primária de energia.
2- Os AG são constintuintes de fosfolípidos e glicolípidos. Estas moléculas anfipáticas são
componentes das membranas biológicas.
3- Modificadores hidrofóbicos das protéinas: Muitas protéinas são modificadas por uma
ligação covalente ao AG, o que as sinaliza para locais membranares.
4- Os derivados dos AG têm a função de hormonas e mensageiros intracelulares.
Síntese e Degradação de AG: estes dois processos consistem em quatro etapas que são
contrárias entre si. A degradação é um processo oxidativo que converte um AG num conjunto
de unidades acetil (na forma de acetil CoA) activadas, para que possam ser processadas no
ciclo do ácido cítrico. Um AG activado é oxidado para introduzir uma dupla ligação, que é
hidratada (+ H2O) para introduzir um grupo hidroxilo (OH). A molécula é agora um álcool, que é
convertido numa cetona por oxidação. Finalmente, o AG é clivado pela coenzima A para
resultar Acetil CoA e uma cadeia de AG com 2 átomos de carbono a menos. Se o AG tiver um
numero par de atomos de C e for saturado (só ligações simples entre C’s) o processo é
repetido até que o AG seja completamente convertido em unidades acetil CoA.
A Síntese de AG começa com unidades individuais que serão juntadas. Neste caso, grupos acil
(acil=AG) activados e uma unidade de malonilo, que se condensa com a unidade acetil para
formar um fragmento com 4 atomos de C. Para produzir a cadeia hidrocarbonada, o grupo
carbonilo (CHO, em que o H está ligado ao C por uma lig simples e o O está ligado ao C por uma
ligação dupla) é reduzido a um grupo metileno em 3 passos: uma redução, uma desidratação e
uma segunda redução (o exacto oposto da degradação). O produto desta redução é o butiril
CoA. Outro grupo malonilo activado condensa-se com a unidade butiril e o processo é repetido
até que se forme um AG com 16 carbonos.
Degradação: Grupo acil activado – Oxidação, Hidratação, Oxidação, clivagem Grupo acil
activado (com menos 2 carbonos) e grupo acetil activado
Síntese: grupo acil activado e grupo malonilo activado – Condensação, redução, desidratação,
redução Grupo acil activado ( com mais 2 carbonos)
- Os Triglicerídeos são fontes de energia altamente concentradas: Os AG são armazenados no
tecido adiposo sob a forma de triglicerídeos.
Os lípidos da dieta são digeridos por lipases pancreáticas
Os lípidos da dieta são transportados em Quilomicrons.
-A Utilização de AG como combustível requer 3 etapas de processamento: Os triacilgliceróis
podem ser mobilizados pela acção hidrolítica de lipases que então sob controlo hormonal. A
epinefrina e a glucagna estimulam a degradação de triglicerídeos ao activarem a lipase. Já a
insulina inibe a lipólise. Os AG são activados e convertidos em acetil CoA, transportados ao
longo da membrana interna mitocondrial pela carnitina, e degradaod na matriz mitocondrial,
por uma sequência recorrente de 4 reacções: oxidação pelo FAD, hidratação, oxidação pelo
NAD+ e tiólise pelo Coenzima A. O FADH2 e o NADH formados na oxidação transferem os seus
electros para o Oxigénio através da cadeia respiratória e o acetilCoA formado na tiólise
condensa-se com o oxaloacetato para entrar no ciclo do ácido cítrico. Os mamíferos são
incapazes de converter AG em glucose porque não possuem um processo para produção de
Oxaloacetato, piruvato ou outros intermediários gluconeogénicos do acetil CoA.
Os triglicerídeos são hidrolizados por lipases estimuladas por hormonas.
Os AG são ligados ao Coenzima A antes de serem Oxidados.
A carnitina transporta AG de cadeia longa activados para a matriz mitocondrial.
Acetil CoA, NADH e FADH2 são gerados em cada etapada da oxidação do AG (Ox, Hid, Ox).
A oxidação completa do palmitato resulta em 106 moléculas de ATP.
-AG insaturados e com número impar de átomos de carbono requerem etapas adicionais
para a degradação: O propionil CoA derivado de cadeias com numero impar de átomos de
carbono requer uma enzima dependente da vitamina B12 para ser convertido em Sucinil CoA
Uma isomerase e uma redutase são necessárias para a oxidação de AG insaturados.
AG com numero impar de C resultam em propionil CoA.
A vitamina B12 contem um átomo de cobalto e um anel de Corrina.
A metilmalonilo CoA Mutase cataliza um rearranjo para formar Sucinil CoA.
AG também são oxidados em peroxissomas.
Corpos cetónicos são formados a partir do Acetil CoA quando a degradação de gorduras
predomina.
Os corpos cetónicos representam um combustível importante em alguns tecidos.
Os animais não têm a capacidade de obter Glucose a partir de AG (O acetil CoA não pode ser
convertido em piruvato).
- Os AG são degradados e sintetizados por diferentes processos: A síntese ocorre no
citoplasma enquanto que a degradação ocorre pincipalmente na matriz mitocondrial. Os
intermediários na síntese de AG estão ligados covalentemente a grupos sulfidrilo de uma
protéina transportadora de Acil (ACP: Acyl carrier protein), enquanto que os intermediários da
degradação estão covalentemente ligados ao grupo sulfidril do Coenzima A. As enzimas da
síntese encontram-se ligadas num único polipéptido chamado sintase de AG, enquanto que na
degradação as enzimas não parecem estar associadas. A cadeia de AG em crescimento é
elongada pela adição sequencial de unidades com 2 C derivados do acetil CoA. O dador
activado destas unidades na etapa de elongação é a ACP do malonilo. A reacção de elongação
é activada pela libertação de CO2. O redutor na síntese é o NADPH, e os oxidantes na
degradação são o NAD+ e o FAD. A elongação feita pelo complexo sintase pára na formação de
palmitato (16 C). A restante elongação é feita por outras enzimas.
A síntese começa com a carboxilação do acetil CoA em malonil CoA. Esta reacção dependente
do ATP é catalizada pela acetil CoA carboxilase (enzima biotina).O Acetil ACP forma-se a partir
de acetil CoA e a malonil ACP forma-se a partir de malonil CoA. Estas duas ACP condensam-se
para formar acetoacetilACP, uma reacção activada pela libertação de CO2 da unidade malonilo
activada. Segue-se uma redução, uma desidratação e uma segunda redução. A butiril ACP
formada por este processo está preparada para uma segunda elongação, que começa com a
adição de uma unidade com dois atomos de C do malonil ACP. Sete elongações resultam em
palmitoil ACP, que é hidrolizado a palmitato. O NADPH necessário à sintese é gerado a partir
da transferência de equivalentes redutores da mitocondria pelo shuttle malato-piruvato e pela
via da pentose fosfato.
A formação de malonil CoA é um passo importante na síntese de AG.
A síntese de palmitato requer 8 moléculas de acetil CoA, 14 moléculas de NADPH e 7
moléculas de ATP. Várias fontes fornecem NADPH para a sintese.
Inibidores da Sintase de AG podem ser drogas úteis, já que a sobreexpressão deste complexo é
característica de alguns cancros.
- A acetil CoA carboxilase desempenha um papel fundamental no controlo do metabolismo
de AG: A síntese e degradação de AG são reciprocamente regulados para que ambos não
ocorram simultaneamente. A acetil CoA carboxilase (sítio de controlo essencial) é fosforilada e
inactivada pela cinase dependente do AMP. A fosforilação é revertida por uma proteina
fosfatase. O citrato, que sinaliza a abundãncia de componentes para lípidos (building blocks,
legos) e energia reverte parcialmente a inibição imposta pela fosforilação.
A acetil CoA Carboxilase é regulada por condições celulares. É inibida pela fosforilação, pelo
nível de citrato e por hormonas (glucagina, epinefrina, insulina. A insulina estimula a síntese ao
activar a carboxilase, enquanto que a epinefrina e a glucagina têm o efeito oposto). Quando
há excesso de AG, os acil CoA’s não entram na matriz mitocondrial porque o malonil CoA inibe
a carnitina aciltransferase I.
- A insaturação e elongação de AG são obtidas por sistemas enzimáticos acessórios: Os AG
são elongados e dessaturados por sistemas enzimáticos na membrana do retículo
endoplasmático. A dessaturação requer NADH e O2 e é realizada por um complexo que
consiste numa flavoproteina, um citocromo e uma protéina férrica sem heme. Os mamíferos
não possuem as enzimas que introduzem duplas ligações distais ao nono carbono, e portanto
necessitam de linoleato linolenato nas suas dietas.
Enzimas ligadas à membrana geram AG insaturados.
Hormonas Eicosanóides são derivadas de AG poli-insaturados.
O araquidonato (arachidonate), percursor essencial da prostaglandina e outras moléculas
sinalizadoras, é um derivato do linoleato. Este AG poli-insaturado (20:4) é o percursos de várias
classes de moleculas sinalizadoras (prostaglandinas, prostaciclinas, tromboxanas, leucotrienes)
que actuam como mensageiros e hormonas locais. Chamam-se eicosanóides porque contêm
20 atomos de C. A aspirina (acetilsalicilato), uma droga anti-inflamatória e antitrombótica,
bloqueia irreversivelmente a síntese destes eicosanóides.
Biossintese de Lipidos e Esteróides Membranares
Intro: O colesterol é transportado no sangue por lipoproteinas de baixa densidade (low density
lipoproteins, LDL) e é recebido pelas células através do receptor LDL na superfície celular. O
transporte e a recepção de colesterol ilustra um mecanismo recorrente para a entrada de
metabolitos e moléculas sinalizadoras nas células. O receptor LDL está ausente em pessoas
com hipercolesterolemia familiar, doença genética. A ausência do receptor está associada a
níveis elevados de colesterol no sangue e de depósitos de colesterol nos vasos sanguíneos,
facto que está associado a ataques cardíacos. O colesterol tem um papel próprio no
desenvolvimento de aterosclerose em pessoas sem defeitos genéticos.
- O Fosfatidato é um intermediário comum na síntese de fosfolípidos e triacilgliceróis: O
fosfatidato é formado por sucessivas acilações do glicerol-3-fosfato pelo acil CoA. A hidrólise
do seu grupo fosforil, sguida da acilação resulta num triacilglicerol. O CDP- Diacilglicerol, o
intermediário activado na sisntese de vários fosfolipidos, é formado a partir de fosfatidato e
CTP. A unidade fosfatidil activada é então transferida para o grupo hidroxilo de um álcool polar
(ex: inositol) para formar um fosfolípido (ex: fosfatidilinositol). Nos mamíferos, a
fosfatidiletanolamina é formada pelo CDP-etanalamina e pelo diacilglicerol. A
fosfatiletanolamina é metilada pela S-adenosilmetionina para formar fosfatidilcolina. Este
fosfogliceridio pode tb ser sintetizado por uma via que utiliza a colina da dieta. CDP-colina é o
intermediário activado nesta via.
Os esfingolípidos são sintetizados a partir da ceraminda, que é formada a partir da acilação da
esfingosina.
- O Colesterol é sintetizado a partir do Acetil CoA em três etapas:
O colesterol é um componente esteróide das membranas celulares animais que modula a sua
fluidez e é o precursor de hormonas esteróides tais como a progesterona, a testosterona, o
estradiol e o cortisol. Todos os 27 átomos de C do colesterol derivam do acetil CoA num
processo sintético com 3 etapas:
1- Síntese de isopentenil pirofosfato, uma unidade isoprene activada que é o principal
componente (building block) do colesterol (ocorre no citoplasma) ;
2- Condensação de 6 moléculas de isopentenil pirofosfato para formar esqualeno
(ocorre no Reticulo Endoplasmatico);
3- O esqualeno cicliza e o produto tetraciclico é subsequentemente convertido em
colesterol (RE).
A síntese de Mevalonato, que é activado na forma de isopentenil pirofosfato, inicia a síntese
do colesterol. O mevalonato é obtido a partir do 3-hidroxi-3-metilglutaril CoA (derivado do
Acetil CoA e do acetoacetil CoA), e posteriormente convertido em isopentenil pirofosfato (5 C),
que se condensa com o seu isómero, dimetilalilo pirofosfato (5 C) para formar geranil
pirofosfato (10 C). A adição de uma segunda molécula de isopentenil pirofosfato resulta em
farnesil pirofosfato ( 15 C), que se condensa com ela propria, formando esqualeno ( 30 C), que
se cicliza em lanosterol ( 30 C) que é modificado, obtendo-se o colesterol.
- A Regulação Complexa da Biossíntese do colesterol ocorre em vários locais: No fígado, a
sintese do colesterol é regulado por mudanças na quantidade e actividade da 3-hidroxil-3metilglutaril CoA reductase, cuja actividade é regulada por fosforilação.
Os triacilgliceróis exportados pelo intestino são transportados por quilomicrons e hidrolizados
por lipases. O colesterol e outros lípidos em excesso, necessários para o fígado, são exportados
na forma de VLDL (Very low density lipoproteins – lipoproteinas de muita baixa dencedáde).
Após entregar o seu conteudo de triacilgliceróis ao tecido adiposo, entre outros tecidos
periféricos, a VLDL é convertida em IDL (intermediate-density lipoprotein) e depois em LDL
(low density lipoprotein). IDL e LDLD transportam ésteres de colesterol, principalmente o
colesteril linoleato.O fígado recebe LDL através de endocitose mediada por receptor. O
receptor de LDL liga-a e medeia a sua entrada na célula.
A apoliproteina B, uma proteina de grandes dimensoes, é um componente estrutural essencial
de quilomicrons, VLDL e LDL. HDL (High density Lipoproteins) transportam colesterol dos
tecidos periféricos para o fígado.
As lipoproteinas transportam colesterol e triacilgliceróis pelo Organismo.
- Derivados do Colesterol incluem Sais Biliares e Hormonas esteróides:
Sais Biliares: são derivados polares do colesterol. São detergentes eficientes porque contém
regiões polares e regiões apolares. São sintetizados no fígado, armazenados na vesícula biliar e
libertados no intestino delgado. São o constintuinte principal da bílis e solubilizam os lipidos da
dieta. A solubilização aumenta a área superficial efectiva dos lípidos com 2 consequências:
1)maior área de acção das lipases, 2) os lípidos são absorvidos mais prontamente pelo
intestino. Exs: glicocolato (glicocholate), taurocolato (taurocholate). Facilitam a digestão dos
lipidos.
Hormonas Esteróides: O colesterol é o precursos de 5 classes de hormonas esteróides:
progesteronas, glucocorticóides, mineralocorticóides, androgénios (testosterona) e
estrogénios. Estas hormonas são moleculas sinalizadoras poderosas que regulam várias
funções do organismo. A progesterona prepara o útero para a implantação do ovo e é
essencial para a manutenção da gravidez. Os androgénios são responsáveis pelo
desenvolvimento dos caracteres sexuais secundários masculinos, enquanto que os estrogénios
são responsáveis para o desenvolvimento dos caracteres sexuais secundários femininos. Os
glucocortinóides (ex: cortisol) promovem a gluconeogénese e a formação de glicogénio,
aumentam a degradação de gorduras e proteinas e inibem a resposta inflamatória. Os
mineralocorticóides (ex: aldosterona) actuam nos tubos distais do rim para aumentam a
reabsorção de iões Na+ e a excreção de K+ e H+, levando a uma aumento do volume e da
pressao sanguinea. As hormonas esteróides ligam-se a moléculas receptoras, activando-as,
moleculas essas que servem como factores de transcrição, que regulam a expressão de um
gene.
A Pregnenolona, um precursor para muitos outros esteróides, é formado a partir do colesterol
pela clivagem da sua cadeia lateral.
A progesterona, os androgénios, os estrogénios e os corticoesteróides são sintetizados a partir
da Pregnenolona.
A vitamina D obtem-se do colesterol, através da separação dos seus anéis pela luz.